


 ,
LUO Ying,
YANG Yang,
LI Yu-ke,
XIA Hui,
CHEN Zhi-hao,
TAN Xiao-dan,
PENG Zhe,
LI Miao-miao,
YANG Jun-qing
,
LUO Ying,
YANG Yang,
LI Yu-ke,
XIA Hui,
CHEN Zhi-hao,
TAN Xiao-dan,
PENG Zhe,
LI Miao-miao,
YANG Jun-qing

近年来,大量证据支持“胎儿编程”学说,即母亲孕期宫内感染、营养缺乏及激素水平改变等异常因素,均会干扰胎儿编程过程,严重时会导致胎儿发育的异常、缺陷或成为其出生后潜在致病因素[1-2]。例如,在孕期给予大鼠脂多糖(lipopolysaccharide,LPS)腹腔注射建立孕期炎症模型中, 子代肾组织DNA甲基化水平增加,伴肾损伤及肾素血管紧张素系统(renin angiotensin system,RAS)激活,从而诱发高血压[3-4]。证据显示,先天免疫系统在胎儿大脑发育中非常重要,孕妇感染可导致胎儿脑白质细胞死亡和髓鞘形成缺陷[5-6]。胎盘炎症与早产儿脑损伤密切相关,且胎盘炎症程度越重,早产儿脑损伤发生风险越高[7]。但是,相关的动物实验研究的直接证据较少,最新研究表明,SD大鼠孕期LPS刺激,可导致胎鼠脑水肿和凋亡,以及新生14 d子鼠室周区脱髓鞘和白质损伤[8]。而孕期炎症子代大鼠皮层及海马神经元是否发生改变、行为功能是否异常,少见报道。另一方面,孕期炎症对子代大鼠神经系统影响的机制至今尚不清楚,需要深入研究。
大量研究证明,神经系统疾病由缺血、缺氧、钙超载、兴奋性氨基酸、氧化应激、炎症因子等多种因素引起[9]。炎症因子引起神经元损伤、凋亡的观点已被学者广泛认可。多项流行病学研究显示,以环氧化酶2(cyclooxygenase 2,COX-2)为经典作用靶点的非甾体抗炎药,能够明显降低老年人发生神经系统疾病的危险性[10]。新近动物实验研究表明,COX-2下游产物前列腺素E2(prostaglandin E2,PGE2)能通过受体调节小胶质细胞活化,调节大脑的炎症反应程度,对神经元功能和存活起决定性作用,提示COX-2途径有可能作为神经系统疾病干预的潜在新靶点[11]。因此,本实验建立孕期炎症模型,观察孕期LPS刺激对子代大鼠行为学、皮层及海马形态的影响,并从COX-2及其下游通路初步探讨其机制。
1 材料与方法 1.1 实验动物SPF级SD♀鼠,6~8周龄,体质量220~250 g,由重庆医科大学动物实验中心提供,动物生产许可证编号:SCXK(渝2012-0001)。子代SD大鼠,由孕鼠繁殖。
1.2 试剂LPS购自美国Sigma公司;前列腺素D2(prostglandin D2,PGD2)、PGE2、前列腺素I2(prostglandin I2,PGI2)、肿瘤坏死因子α(tumor necrosis factor α,TNF-α)、白介素6(interleukin-6,IL-6)和白介素1β(interleukin-1β,IL-1β) ELISA试剂盒,均购自上海源叶公司;COX-2抗体,购自英国Abcam公司;羊抗兔HRP标记二抗,购自武汉三鹰。
1.3 仪器Morris水迷宫系统(北京众实迪创科技发展有限责任公司);YLS-1B型多功能大鼠自发活动记录仪(山东省医学科学院设备站);BH-2光学显微镜(Olympus公司);全自动酶标仪(Spectra MaxM2公司)。
1.4 方法 1.4.1 动物分组及实验设计8只孕鼠随机分为生理盐水(normal saline,NS)[8]组和LPS组,每组4只。LPS组孕鼠在孕期d 11、14、18腹腔注射LPS,每次300 μg·kg-1;NS组孕鼠腹腔注射同容积的生理盐水。一日3次观察孕鼠情况,至其生产。出生的子鼠中,每组随机选取30只新生子鼠并编号,分别记录它们出生d 3、10、20、30的体质量,在d 30时每组随机选取9只♂鼠进行行为学测试之后,其中每组3只进行脑组织病理学检查,每组6只进行ELISA检测和Western blot实验。
1.4.2 Morris水迷宫测试子鼠出生后d 30,采用Morris水迷宫测定大鼠空间学习记忆能力,实验前让子代♂大鼠熟悉环境15 min。整个测试程序分为2个阶段:(1)定向航行阶段:将大鼠头朝向水迷宫的池壁放入水中。记录大鼠第1次登上平台的时间。大鼠连续训练4 d,每天每只大鼠训练4次,每次训练间隔15~20 min。(2)空间记忆检测阶段:d 5进行测试,将大鼠从最后一次训练的位置放入水中,将平台撤除,记录大鼠穿越平台次数,并记录大鼠运动轨迹。
1.4.3 旷场实验实验于周围环境安静、可见度为5 m的暗室中进行,实验装置为内部黑漆覆盖,长、宽、高为100 cm×100 cm×50 cm的木箱,底面均分为25个方格(每个20 cm×20 cm),子代大鼠被放置于中央方格,记录其5 min内活动情况。①垂直运动(rearing):两前爪腾空或攀附墙壁的活动记录得分。②水平运动(horizontal movement):穿行的方格数记录得分,穿行方格的定义为,大鼠4只脚都进入同一格子中。③理毛次数(grooming):每只大鼠前爪整理毛发的次数。④排泄次数(excretion):每只大鼠排泄的次数。
1.4.4 自主活动测试将各组的子代大鼠放入多功能大鼠自主活动记录仪中, 记录时室内保持安静,适应实验环境5 min后, 测定大鼠各组自主活动次数, 记录时间为5 min。
1.4.5 脑组织病理学检查进行Morris水迷宫测试之后,d 2每组随机选取3只大鼠称体质量,1%戊巴比妥钠(50 mg·kg-1)腹腔注射麻醉后,暴露胸腔,先注入PBS冲洗,然后用注入4%多聚甲醛在体灌流固定。将脑组织放入4%多聚甲醛4 ℃固定2 d。取出脑组织,石蜡包埋后进行冠状切片,厚度约5 μm。对石蜡切片进行HE染色。显微镜光镜下观察子代大鼠海马和皮层神经元的形态结构变化,并进行死亡神经细胞计数的定量分析。
1.4.6 ELISA法测定大鼠海马和皮层中PGD2、PGE2、PGI2、TNF-α、IL-6和IL-1β的含量除进行脑组织病理学检查的大鼠外,每组剩下6只大鼠全部用1%戊巴比妥钠(50 mg·kg-1)腹腔注射麻醉后,断头取脑,冰面分离皮层和海马,-80 ℃保存。取-80 ℃保存的海马和皮层组织(每组6只),称重后,按照重量体积比(W/V)1 :9,加入生理盐水,于冰面进行匀浆,制备组织匀浆液,4 ℃、3 000×g离心30 min,收集上清液。从冰箱取出用于分离游离型和结合型酶标记物的浓缩洗涤液[10],水浴加热时结晶溶解,用蒸馏水按1 :20稀释,配制成所需浓度的稀释洗涤液。取出检测所需微孔板,室温条件下平衡20 min。根据ELISA试剂盒说明书操作,所用试剂均在临用前新鲜配制,设置标准孔及样品孔,参照ELISA测试盒说明书操作。在反应终止后15 min内,采用酶标仪在450 nm波长处测试各孔OD值,并根据标准曲线计算样品浓度。
1.4.7 Western blot测定大鼠海马和皮层中COX-2蛋白表达取-80 ℃保存的海马、皮层组织,提取各组总蛋白。SDS-PAGE电泳、转膜,5%胎牛血清封闭4 h。加入相应的一抗COX-2、β-actin(1 :1 000),4 ℃孵育过夜。回收一抗,TBST洗膜,5 min×4次,滴加HRP标记的二抗(1 :2 000),于摇床上室温孵育2 h。TBST洗膜,5 min×4次,然后用成像分析系统成像并检测。每组实验重复3次。
1.5 统计学处理所有实验数据均采用x±s表示,用SPSS 17.0进行统计学分析,组间比较用Dunnett’s t分析。
2 结果 2.1 孕期炎症子代大鼠体质量监测如Fig 1所示,体质量监测从子鼠出生后3 d起至30 d, 两组子鼠体质量均随着天数的延长而增加, 相比于NS组,LPS组差异无统计学意义。
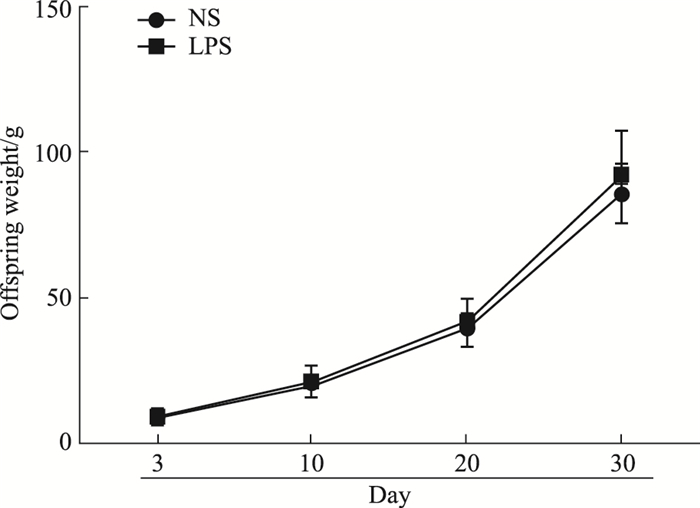
|
| Fig 1 Weight change in offsprings(x±s, n = 30) |
Morris水迷宫实验结果显示,LPS组子代大鼠d 5逃避潜伏期明显长于NS组(P<0.05)。与NS组相比,d 5 LPS组子代大鼠穿越平台次数明显减少(P<0.05)。与NS组比较,LPS组子代大鼠运动轨迹明显延长。旷场实验主要测试动物在新异环境中的自主行为和对新环境的探索力。与NS组相比,LPS组的水平运动明显减少(P<0.05),而垂直运动、理毛次数和排泄次数差异无显著性。自主活动测试的结果显示,与NS组相比,LPS组的自发活动明显减少(P<0.05)。见Fig 2。
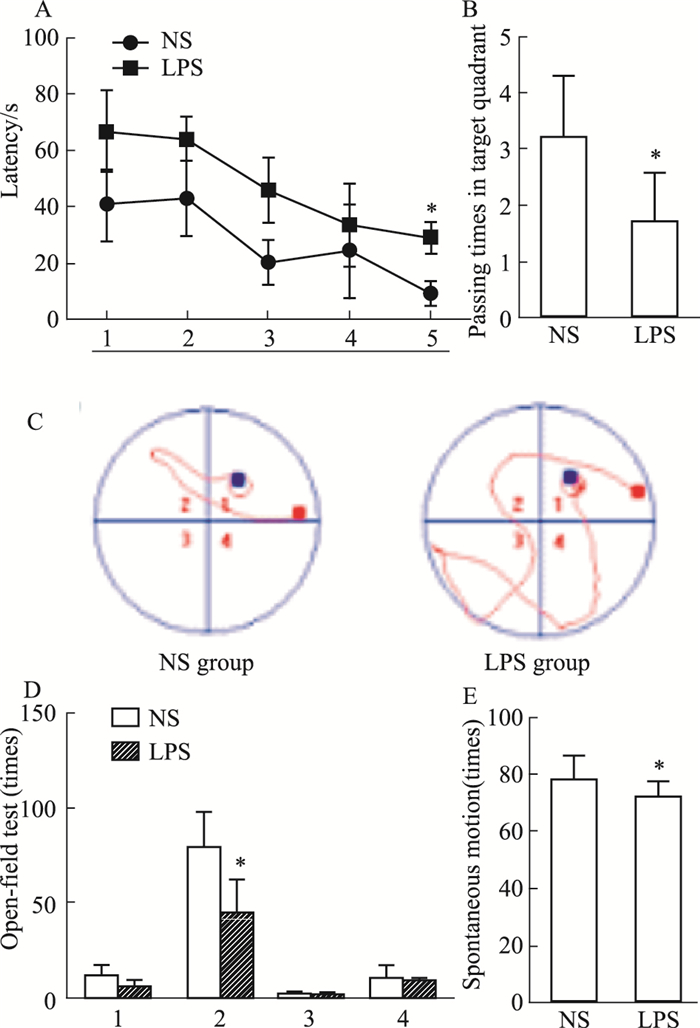
|
| Fig 2 Behavioral changes in offspring rats exposed to LPS during pregnancy(x±s, n = 9) A:Comparison of the mean escape latencies to find the hidden platform on days 1-5; B:Comparison of the mean in the number of crosses in the MWM on days 5; C:Comparison of each group to find the trajectory of the hidden platform; D:Open field behavior of postnatal day (P)30 rats over 5 min that received LPS or saline on pregnancy(1: Rearing; 2: Horizontal movemet; 3: Grooming; 4: Excretion); E:Spontaneous locomotor activity of P30 rats over 5 min that received LPS or saline on pregnancy. *P < 0.05 vs NS group. |
在中枢神经系统中,海马是与学习、记忆功能密切相关的重要脑区,也是应激反应和神经损伤的主要部位。如Fig 3所示,NS组子代大鼠海马区神经细胞层次清晰,结构完整,排列整齐,未见明显核固缩;LPS组子代大鼠海马CA1区神经元细胞丢失和(或)核固缩多于NS组(P<0.05)。与海马特点相似,孕期LPS炎症组大鼠皮层神经元细胞核明显深染、固缩(P<0.01)。
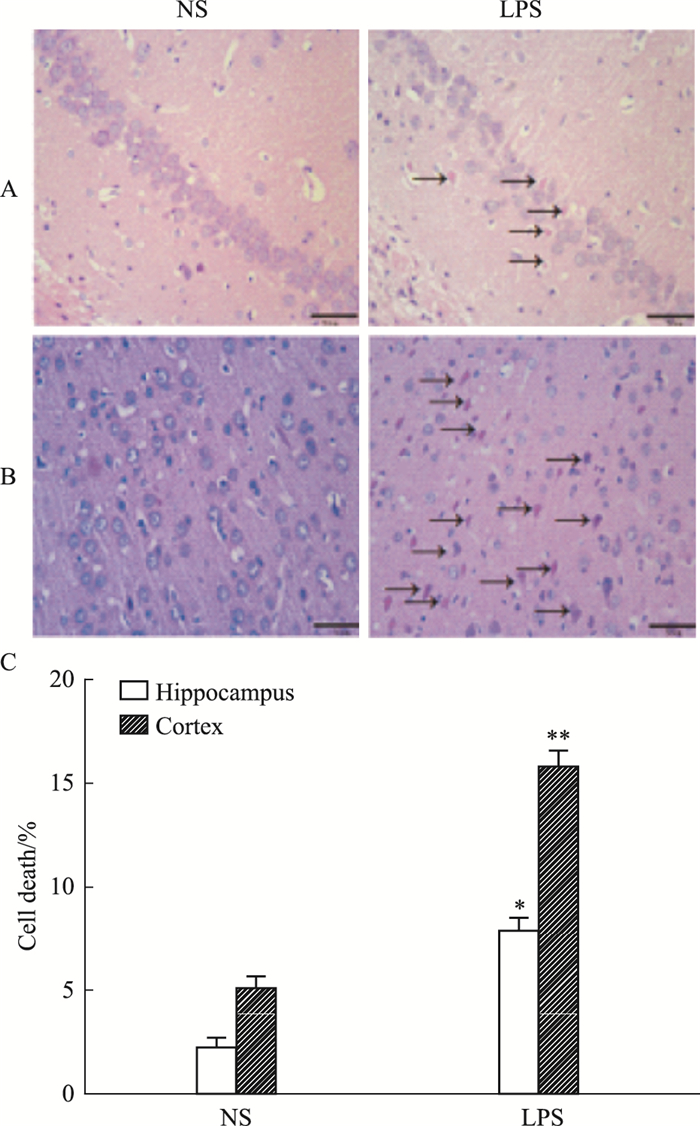
|
| Fig 3 Effect of inflammation during pregnancy on hippocampus and cortex in offspring rats(HE×400) A:Hippocampus; B:Cortex; Arrow points:neuronal karyopyknosis. C:Quantitative analysis of neuronal counts in NS and LPS groups(x±s, n=3). *P < 0.05, **P < 0.01 vs NS group. |
在中枢神经系统疾病的发展过程中,COX-2蛋白表达变化与神经系统病变密切相关,而前列腺素(prostaglandins,PGs),如PGD2、PGE2、PGI2是由COX-2催化花生四烯酸(arachidonic acid,AA)代谢产生。如Fig 4所示,相比于NS组,LPS组大鼠海马和皮层中PGE2、PGD2和PGI2明显升高(P<0.01,P<0.05)。TNF-α、IL-6和IL-1β是常见的促炎细胞因子,通常在炎症发生部位存在高浓度的聚集。如Fig 4所示,与NS组相比,LPS组大鼠海马和皮层中的TNF-α、IL-6和IL-1β在子代大鼠海马中的含量明显升高(P<0.01, P<0.05)。
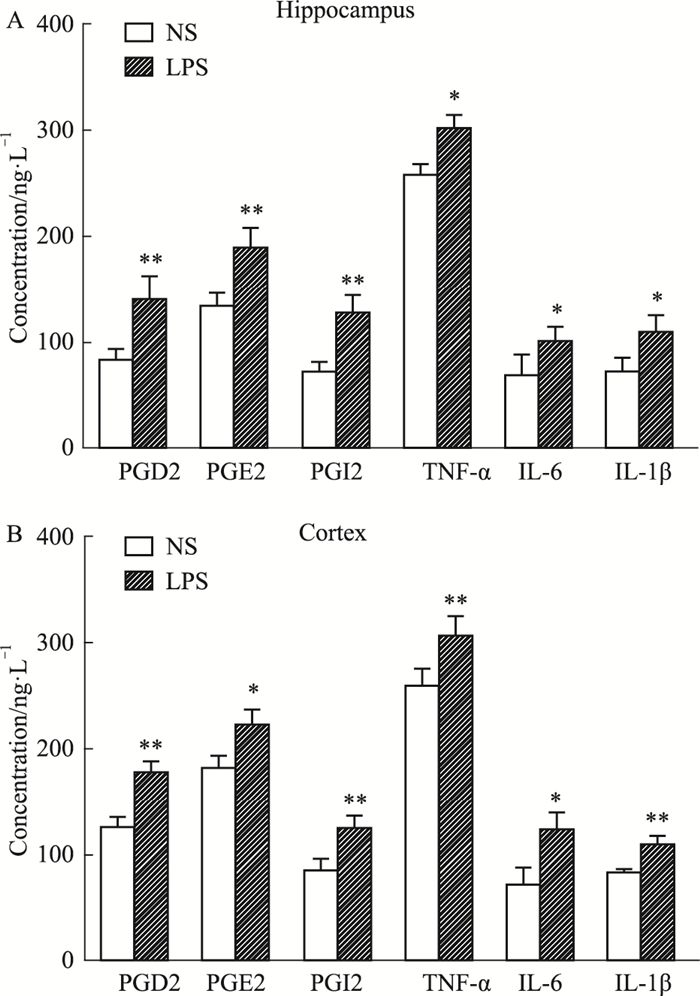
|
| Fig 4 Changes of PGD2, PGE2, PGI2, TNF-α, IL-6 and IL-1β contents in rat hippocampus(A) and cortex(B)(x±s, n = 6) *P < 0.05, **P < 0.01 vs NS group |
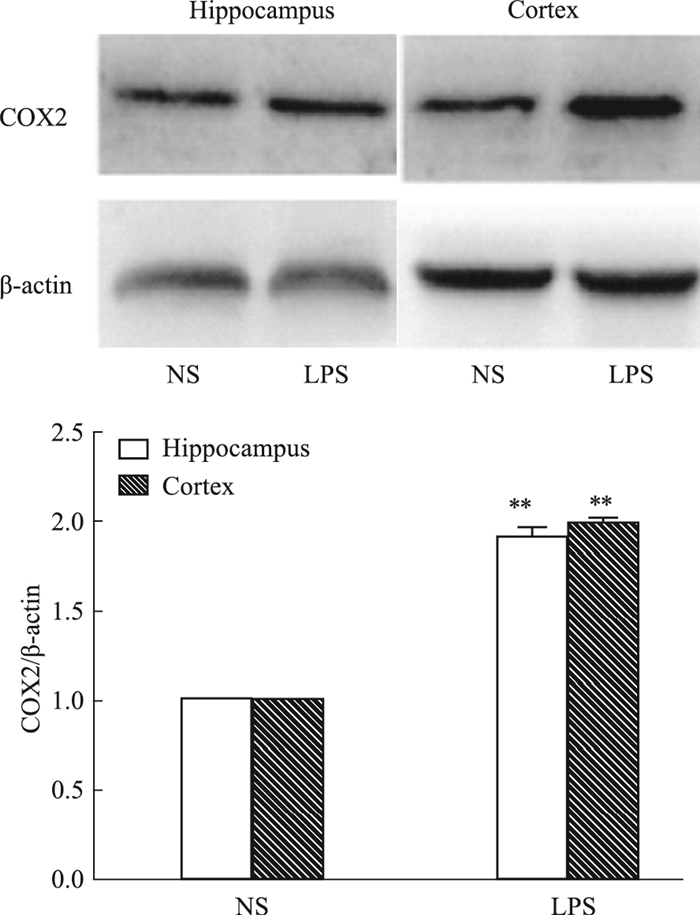
Fig 5的Western blot结果显示,与NS组相比,LPS组大鼠海马及皮层COX-2蛋白表达均明显升高(P<0.01)。
|
| Fig 5 Expression of COX-2 in hippocampus and cortex of rats detected by Western blot(x±s, n = 3) **P < 0.01 vs NS group |
神经系统是机体最复杂的系统之一,是胚胎发育过程中不可或缺的一个环节。研究表明,许多神经系统疾病的发生与妊娠期胎儿在子宫内生长的环境密切相关[1]。流行病学研究提示,产前感染会增加神经系统疾病的发病率[8],原因可能是感染引起母体宿主中促炎细胞因子的升高,导致胚胎中的一些炎症因子如TNF-α和IL-1β水平发生改变。另外,孕期感染可引起子代大鼠脑中活化的小胶质细胞和星形胶质细胞增多,激活的胶质细胞产生许多炎性因子,可导致氧化应激反应增强[12]。
细胞膜磷脂在磷脂酶A2的作用下生成AA,AA在COX-2作用下生成大量PGs,如PGD2、PGE2、PGI2,介导炎症的发生。炎症在许多神经系统疾病的发病机制中起着关键性的作用。研究表明,COX-2在正常脑组织中含量低,但在炎症状态的脑组织中占有重要地位[13]。COX-2在一些脑疾病中均有高表达,如全脑缺血[14]和阿尔茨海默病(Alzheimer’s dis-ease,AD)[15]等。目前,并无相关研究证实COX-2表达与孕期炎症致子代脑损伤的发病机制相关。
本研究观察孕期子代大鼠出生后,空间学习记忆、旷场实验、自主活动、脑组织病理学、COX-2及下游PGs的表达、炎性因子水平等指标的改变。结果显示,孕期炎症子代大鼠学习记忆功能明显受损;水平运动和自发活动次数明显减少;海马和皮层的神经细胞核深染、固缩明显;COX-2蛋白表达明显增加;COX-2催化产物前列腺素PGD2、PGI2和PGE2, 以及炎性细胞因子TNF-α、IL-6和IL-1β含量明显增加。提示母体孕期炎症暴露,炎性细胞因子如TNF-α、IL-6和IL-1β可能会通过胎盘屏障、血脑屏障,导致子代大鼠处于炎症状态,进而引起COX-2激活;激活的COX-2诱导AA生成大量PGs,如PGD2、PGE2和PGI2,这些PGs持续升高,引起诱导型一氧化氮合酶(inducible nitric oxide synthase,iONS)释放大量具有神经毒性的自由基,如一氧化氮(nitric oxide,NO),最终导致孕期炎症子代大鼠脑损伤的发生。因此,COX-2及下游PGs与孕期炎症子代脑损伤的发生、发展密切相关。但是,具体的分子机制及因果关系需要采用进一步实验研究加以明确。
综上所述,孕期炎症刺激可导致子代大鼠行为学异常、皮层及海马神经元损伤,其机制可能与COX-2及下游PGs产生有关。
| [1] |
Gluckman P D, Hanson M A, Cooper C, Thornburg K L. Effect of in utero and early-life conditions on adult health and disease[J]. N Engl J Med, 2008, 359(1): 61-73. doi:10.1056/NEJMra0708473 |
| [2] |
Teng J, Chang T, Reyes C, et al. Placental weight and neurologic outcome in the infant:a review[J]. J Matern Fetal Neonatal Med, 2012, 25(10): 2082-7. doi:10.3109/14767058.2012.671871 |
| [3] |
Kundakovic M, Gudsnuk K, Herbstman J B, et al. DNA methylation of BDNF as a biomarker of early-life adversity[J]. Proc Natl Acad Sci USA, 2015, 112(22): 6807-13. doi:10.1073/pnas.1408355111 |
| [4] |
赵钐妤, 刘雅, 李晓辉. 孕期LPS刺激对子代6周龄大鼠血管结构的影响[J]. 中国药理学通报, 2017, 33(5): 662-7. Zhao S S, Liu Y, Li X H. Effect of maternal lipopolysaccharides exposure during pregnancy on vascular structure in neonatal offspring rats[J]. Chin Pharmacol Bull, 2017, 33(5): 662-7. doi:10.3969/j.issn.1001-1978.2017.05.015 |
| [5] |
Hagberg H, Gressens P, Mallard C. Inflammation during fetal and neonatal life:implications for neurologic and neuropsychiatric disease in children and adults[J]. Ann Neurol, 2012, 71(4): 444-57. doi:10.1002/ana.v71.4 |
| [6] |
Van S J, Schang A L, Sigaut S, et al. Brain damage of the preterm infant:new insights into the role of inflammation[J]. Biochem Soc Trans, 2014, 42(2): 557. doi:10.1042/BST20130284 |
| [7] |
张强, 卢红艳, 王金秀, 等. 胎盘炎症及胎儿炎症反应综合征与早产儿脑损伤的关系研究[J]. 中国当代儿科杂志, 2015, 17(3): 217-21. Zhang Q, Lu H Y, Wang J X, et al. Relationship between placental inflammation and fetal inflammatory response syndrome and brain injury in preterm infants[J]. Chin J Contemp Pediatr, 2015, 17(3): 217-21. |
| [8] |
Jin S J, Liu Y, Deng S H, et al. Neuroprotective effects of activated protein C on intrauterine inflammation-induced neonatal white matter injury are associated with the downregulation of fibrinogen-like protein 2/fibroleukin prothrombinase and the inhibition of pro-inflammatory cytokine[J]. Int J Mol Med, 2015, 35(5): 1199-212. doi:10.3892/ijmm.2015.2136 |
| [9] |
Oztanir M N, Ciftci O, Cetin A, et al. Hesperidin attenuates oxidative and neuronal damage caused by global cerebral ischemia/reperfusion in a C57BL/J6 mouse model[J]. Neurol Sci, 2014, 35(9): 1393-9. doi:10.1007/s10072-014-1725-5 |
| [10] |
Wyss-Coray T, Rogers J. Inflammation in Alzheimer disease—a brief review of the basic science and clinical literature[J]. Cold Spring Harb Perspect Med, 2012, 2(1): a006346. |
| [11] |
Legler D F, Bruckner M, Uetzvon Allmen E, et al. Prostaglandin E2 at new glance:novel insights in functional diversity offer therapeutic chances[J]. Int J Biochem Cell Biol, 2010, 42(2): 198-201. doi:10.1016/j.biocel.2009.09.015 |
| [12] |
郝丽云, 李晓辉.孕期炎症刺激对子代大鼠认知能力的影响极其初步机制研究[M].第三军医大学, 2011. Hao L Y, Li X H. Prenatal exposure to lipopolysaccharide results in cognitive deficits in age-increasing offspring rats[J]. Neuroscience, 2010,166(3): 763-70. |
| [13] |
Miller S B. Prostaglandins in health and disease:an overview[J]. Semin Arthritis Rheum, 2006, 36(1): 37-49. |
| [14] |
Candelario J E, Fiebich B L. Cyclooxygenase inhibition in ischemic brain injury[J]. Curr Pharm Des, 2008, 14(14): 1401-18. doi:10.2174/138161208784480216 |
| [15] |
Wang P, Guan P P, Wang T, et al. Aggravation of Alzheimer's disease due to the COX-2-mediated reciprocal regulation of IL-1β and Aβ between glial and neuron cells[J]. Aging Cell, 2014, 13(4): 605-15. doi:10.1111/acel.12209 |