

2. 湖北科技学院 糖尿病心脑血管病变湖北省重点实验室,湖北 咸宁 437100
2. Hubei Province Key Lab on Cardiovascular, Cerebrovascular, and Metabolic Disorders, Hubei University of Science and Technology, Xianning Hubei 437100, China
随着人口老年化、城市化进展加快、人们生活条件的改善,糖尿病(diabetes mellitus,DM)呈快速增长和低龄化的趋势,目前全球患病人数已达4.25亿,预计2045年可达6.29亿,我国糖尿病患者人数众多,给家庭和社会带来极大负担[1-2]。糖尿病对全身大、小血管危害较大,50%~80% DM患者死亡的主要原因为心血管并发症[3]。然而,DM是如何引起心血管损伤的,目前尚不清楚。有研究发现,高脂毒性在DM早期就对心肌产生不良影响,并且脂毒性的危害远远高于糖毒性[4],DM患者将过度摄取的脂肪酸积聚在心脏,引起心肌细胞结构和功能发生改变,导致心肌细胞凋亡,引起脂毒性心肌病[5]。目前,许多学者围绕脂毒性对心肌损伤及其机制进行研究,发现脂代谢调控与线粒体通路调控二者之间存在一定联系[6]。有文献指出[7],DM患者的高脂血症增加心肌细胞线粒体损伤,并增加细胞活性氧(reactive oxygen species,ROS)水平,最终使心肌细胞出现凋亡,但线粒体凋亡通路是否介导了高脂诱导的心肌细胞损伤,国内外尚未见报道。基于此,本实验通过观察高脂对H9c2心肌细胞增殖、线粒体膜电位、ROS水平、线粒体凋亡信号通路相关蛋白表达的影响,探讨高脂所致H9c2心肌细胞的损伤或凋亡与线粒体通路之间的相关性。
1 材料与方法 1.1 材料 1.1.1 细胞系H9c2大鼠心肌细胞,购于上海通派生物有限公司。
1.1.2 试剂高糖DMEM培养基(美国Hyclone公司);胎牛血清、MTT(美国Gibco公司);棕榈酸(palmitic acid,PA),购自美国Sigma公司;DAPI染液(武汉谷歌生物有限公司);细胞ROS试剂盒、ECL试剂盒(美国Thermo Scientific公司);线粒体膜电位试剂盒(上海碧云天生物技术公司);Annexin V FITC-PI细胞凋亡试剂盒(南京建成生物工程研究所);抗Bcl-2、Bax、Cyt-C、Cleaved casepase-3抗体(美国Cell Signaling Technology公司);β-actin抗体(美国Santa Cruz公司)。
1.1.3 仪器超净工作台(苏州安泰公司);CO2细胞培养箱(德国Heraeus公司);HVE-50高压灭菌器(日本Hirayama公司);倒置荧光显微镜(日本Olympus公司);酶标仪(美国Bio-Tek公司);自动发光凝胶成像系统(英国SYNGENE公司);垂直式电泳仪(美国Bio-Rad公司)。
1.2 方法 1.2.1 PA的配制精密称取PA粉末25.642 mg倒入EP管中,然后加入1 mL无水乙醇,将EP管进行超声震荡至完全溶解后,使用滤膜过滤,制备PA母液浓度为100 mmol·L-1。使用前,37 ℃水浴锅将PA储存液完全溶解至无沉淀物,使用时,将PA按不同浓度与0.5% BSA的DMEM培养基混合。
1.2.2 细胞培养H9c2心肌细胞培养于高糖DMEM培养基(含10%胎牛血清和双抗)中,在37 ℃、5% CO2培养箱中培养至70%~80%融合时,用含0.25% EDTA胰酶消化细胞,传代培养,取对数生长期的细胞进行实验。
1.2.3 实验分组① PA浓度梯度:分为对照组、PA(0.1、0.2、0.4 mmol·L-1)组;②PA时间梯度:分为对照组、PA作用不同时间(12、24、36、48 h)组;③为了评估线粒体凋亡通路在脂毒性心肌损伤中的作用,按PA浓度梯度分组,刺激时间为24 h。
1.3 检测指标 1.3.1 MTT法检测H9c2心肌细胞增殖率在相应的板中接种H9c2心肌细胞悬液(细胞2×107~2×108·L-1,每孔100 μL),每组设置6个复孔。在37 ℃、5% CO2细胞培养箱中培养过夜,按照实验设计,加入不同浓度含PA的培养基,继续培养;实验结束后,弃去孔内上清液,每孔加入20 μL MTT溶液(5 g·L-1),培养4 h后弃培养液,加入DMSO;在570 nm处检测各孔OD值,按照以下公式计算细胞增殖率,细胞增殖率 = 实验组OD值/正常对照组OD值×100%。
1.3.2 细胞ROS的检测向24孔板每孔接种500 μL H9c2心肌细胞悬液过夜,不同浓度含PA的高糖DMEM培养基处理细胞,继续培养24 h,弃去孔内培养基,用不含胎牛血清的DMEM清洗2遍,按1 :500的比例用不含胎牛血清的DMEM配制ROS试剂盒试剂,每孔加入500 μL配制好的试剂,细胞培养箱中培养20 min,弃去孔内培养基,用1×PBS清洗2遍,向每孔滴加1滴DAPI染液,避光室温静置10 min,1×PBS清洗2遍后,收集细胞爬片,用抗荧光淬灭封片剂封片。在倒置荧光显微镜20倍镜下观察,拍照。
1.3.3 检测细胞凋亡24孔板每孔接种500 μL H9c2心肌细胞悬液过夜,不同浓度含PA的高糖DMEM培养基处理细胞,继续培养24 h,弃去孔内培养基,用PBS洗涤细胞3次,每次5 min。4%多聚甲醛固定10 min,用PBS洗涤细胞3次,每次5 min。每孔加入400 μL Annexin V-FITC结合液,再向每孔加入5 μL Annexin V-FITC和10 μL PI,放入细胞培养箱等待10 min。用PBS洗涤细胞3次,每次5 min,封片后,用共聚焦荧光显微镜检测凋亡细胞。
1.3.4 线粒体膜电位的检测向24孔板每孔接种500 μL H9c2心肌细胞悬液过夜,不同浓度含PA的高糖DMEM培养基处理细胞,继续培养24 h,弃去孔内培养基,用PBS洗涤细胞2次,每次5 min。加入500 μL培养液,再加入500 μL JC-1染色工作液,37 ℃孵育20 min。孵育后,弃上清,用JC-1(1×)洗2次,加入2 mL培养液,用共聚焦荧光显微镜检测膜电位。
1.3.5 蛋白免疫印迹检测实验结束后,用PBS清洗并裂解刮净细胞,收集到离心管中,离心,取上清液,BCA法蛋白定量后。进行SDS-PAGE凝胶电泳,并转膜,用5%脱脂牛奶封闭1 h,线粒体通路相关蛋白及凋亡相关蛋白的一抗4 ℃孵育过夜,二抗37 ℃孵育1 h,用ECL显影液处理,经凝胶成像仪检测Cyt-C、Cleaved casepase-3、Bax、Bcl-2的表达水平。
1.4 统计学方法采用SPSS 17.0软件进行统计学分析,结果以x±s表示,使用GraphPad Prism5作图,组间比较采用单因素方差分析,两组比较采用t检验。
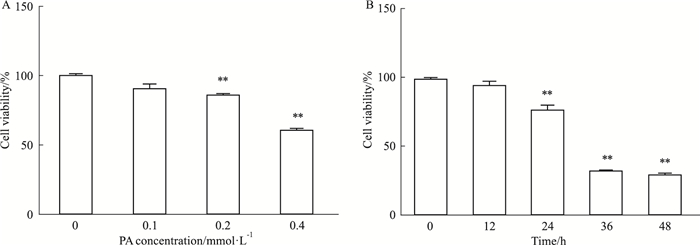
2 结果 2.1 高脂刺激对H9c2心肌细胞增殖率的影响Fig 1A结果显示,与正常对照组相比,不同浓度PA(0.1、0.2、0.4 mmol·L-1)刺激H9c2心肌细胞24 h时,细胞增殖率分别为97.99%、78.41%和57.72%。与正常组比较,PA 0.2、0.4 mmol·L-1组细胞增殖率均明显下降(P<0.01)。Fig 1B结果表明,0.2 mmol·L-1 PA刺激H9c2心肌细胞0、12、24、36、48 h时,高脂所致的心肌细胞增殖率为94.24%、85.76%、72.24%、50.72%,与正常组相比,呈现浓度依赖性下降趋势。PA 0.2 mmol·L-1刺激心肌细胞36、48 h时,细胞增殖率出现50%以上的下降(P<0.01),而36 h与48 h组之间差异无显著性(P>0.05)。
|
| Fig 1 Influence of PA on cell viability in H9c2 cells(x±s, n = 6) A:Cell viability was significantly suppressed when PA concentration increased to 0.4 mmol·L-1; B:Cell viability was significantly suppressed when incubated time exceeded 36 h and 48 h in 0.2 mmol·L-1 PA. **P < 0.01 vs control (0 mmol·L-1 PA). |
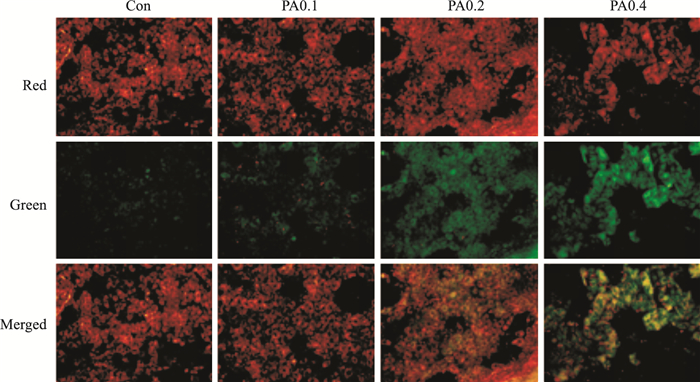
如Fig 2所示,与正常对照组比较,红色荧光随PA的浓度增大而减弱,而绿色荧光增强。在PA为0.4 mmol·L-1时,细胞数目明显减少,形态出现明显不规则现象,红光变弱,而绿光变亮。由于线粒体在膜电位较高时,JC-1聚集在线粒体基质内,形成红色荧光;在线粒体膜电位较低时,JC-1不能聚集在线粒体的基质内,产生绿色荧光。结果表明,随着PA的浓度逐渐增加,线粒体膜电位逐渐降低,并且细胞出现凋亡现象。
|
| Fig 2 Influence of PA-induced H9c2 cardiomyocyte mitochondrial membrane potential(×20) |
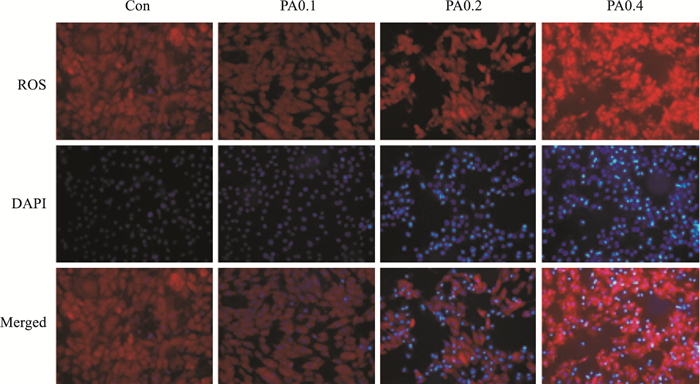
如Fig 3所示,与正常对照组比较,PA浓度为0.2 mmol·L-1时,细胞中ROS水平有所增加,当PA浓度为0.4 mmol·L-1时,细胞数量急剧减少,细胞质与细胞核均发生不同程度的改变,如细胞肿大、细胞核质浓缩、细胞内容物外溢等现象。
|
| Fig 3 Influence of PA-induced H9c2 cardiomyocyte oxidative damage(×20) |
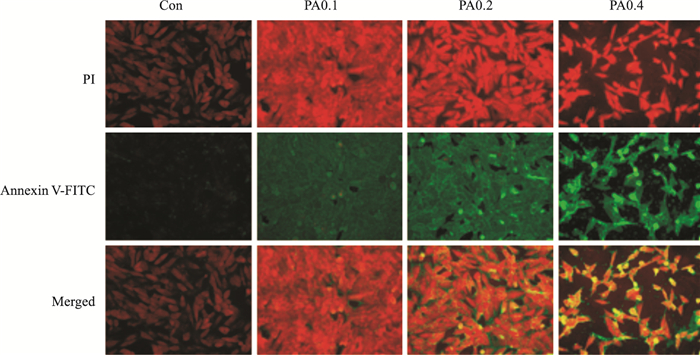
Fig 4结果表明,与正常对照组相比,PA浓度为0.1 mmol·L-1时AnnexinV-FITC标记的绿色荧光明显增强,PI标记的红色荧光在PA浓度为0.2 mmol·L-1时开始增强,细胞质与细胞核均发生轻微形态学改变。在PA浓度为0.4 mmol·L-1时细胞数目明显减少,出现细胞凋亡相关形态学改变。
|
| Fig 4 Influence of PA-induced H9c2 cardiomyocyte apoptosis(×20) |
如Fig 5所示,与正常对照组相比,PA 0.4 mmol·L-1组Cyt-C和Cleaved casepase-3蛋白表达水平明显增高(P<0.05),而PA 0.1、0.2 mmol·L-1组与正常对照组比较,差异无显著性(P>0.05)。在PA刺激24 h的情况下,Bcl-2表达持续降低,PA 0.4 mmol·L-1组Bcl-2表达明显低于正常对照组(P<0.05),而Bax持续升高,在PA 0.4 mmol·L-1时明显高于正常对照组(P<0.05)。Bcl-2、Bax在PA 0.1、0.2 mmol·L-1时与正常组之间差异无显著性(P>0.05)。
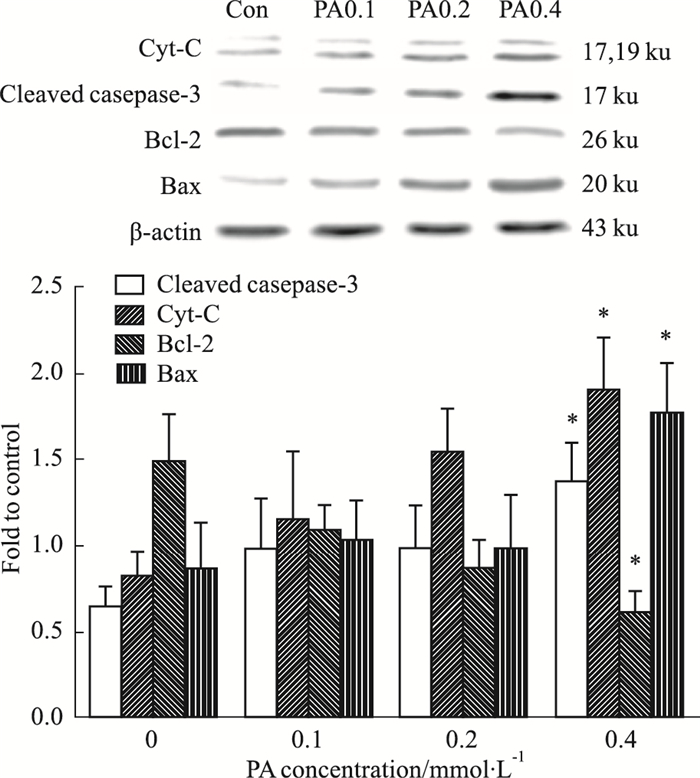
|
| Fig 5 Influence of palmitic acid concentration on expression ofCyt-C, Cleaved casepase-3, Bax and Bcl-2 in H9c2 cells(x±s, n = 3) *P < 0.05 vs control (0 mmol·L-1 PA) |
心肌病在临床上分为原发性与继发性,脂毒性心肌病属于继发性心肌病,由于心脏中脂质大量积聚,机体对脂肪酸的摄取和利用远大于心肌细胞实际的氧化代谢需要,使心肌细胞内脂质大量蓄积[8],而蓄积的脂质又对心肌产生毒性,造成心肌细胞损伤,从而导致心肌细胞脂代谢产物和介质堆积。增加的脂肪酸也可以引起线粒体ROS产生过量,并且不能及时有效地清除,引起细胞氧化应激损伤和ATP生成减少,导致脂毒性心肌损伤[9]。因此,脂肪酸代谢紊乱是引起心肌细胞凋亡和功能障碍的重要原因之一。本研究结果显示,H9c2心肌细胞在持续高脂环境刺激下,细胞存活率随时间和浓度的增加逐渐下降,在PA浓度为0.4 mmol·L-1时,时间为24 h时极为明显。PA 0.2 mmol·L-1时ROS明显增强,细胞形态出现异常,而PA 0.4 mmol·L-1时细胞数量减少,细胞凋亡增加。说明高浓度脂肪酸可使心肌细胞发生氧化应激损伤,导致细胞的形态和数目发生改变,最终导致心肌细胞出现凋亡,影响心脏的正常功能。本研究结果与文献报道一致。
脂肪酸参与心肌病的病理过程相当复杂,心肌细胞脂代谢紊乱,引起细胞器如线粒体、内质网功能异常,线粒体凋亡通路作为细胞凋亡的内源途径,是近年来研究热点之一[10]。线粒体膜通透性转化孔(mitochondrial permeability transition pore, MPTP)在维持线粒体和细胞物质信息交换方面起着重要作用,它通过节律性开放来保持膜内外的离子梯度和电势差,从而调控细胞凋亡。凋亡刺激因素可以使MPTP由周期性开放变为持续性开放,致使线粒体膜电位下降或消失、呼吸链功能破坏、形成细胞色素C(cytochrome C,Cyt-C)大分子通道,激活caspase-9介导的细胞凋亡[11]。此外,刺激因素也可通过降低线粒体的膜电位、改变线粒体膜磷脂等损伤线粒体[12]。本研究显示,高脂刺激H9c2心肌细胞24 h后,与正常组相比,JC-1绿色荧光增强,红色荧光减弱,表明高脂导致线粒体膜电位下降,线粒体膜的完整性破坏,细胞出现早期凋亡,如细胞数目减少,失去正常形态,表现出细胞凋亡相关的形态学改变,而且免疫印迹结果显示线粒体凋亡蛋白Cyt-C、Cleaved caspase-3表达明显增加,进一步说明细胞发生凋亡。因此,高脂刺激H9c2心肌细胞能引起线粒体膜电位下降、相关凋亡蛋白表达升高,从而促进细胞损伤或凋亡。
Bcl-2家族中存在促凋亡因子(Bax)和抗凋亡因子(Bcl-2),它们具有调控细胞凋亡的作用。Bcl-2大多位于线粒体外膜上,调节线粒体外膜通透性,具有抑制凋亡的作用。当Bcl-2表达下降时,线粒体通透性增加,外膜孔径变大,变大的线粒体孔径导致线粒体中Cyt-C的释放以及凋亡诱导因子增加。Bax是与Bcl-2共沉淀的X蛋白质,Bax/Bcl-2比值增加,细胞出现凋亡[13]。本研究结果显示,H9c2心肌细胞在高脂作用24 h后,Bax在PA 0.4 mmol·L-1时表达明显升高,而Bcl-2降低,表明高脂刺激H9c2心肌细胞通过增加线粒体膜通透性来引起细胞凋亡。
综上所述,高脂刺激H9c2心肌细胞能够抑制细胞增殖,引起H9c2心肌细胞ROS水平的增加,线粒体膜电位的降低,最终诱发线粒体凋亡蛋白的表达。提示线粒体凋亡通路在高脂诱导H9c2心肌细胞损伤中起重要的调控作用,进而为理解脂毒性心肌损伤的形成机制提供了新的线索。然而,线粒体通路调控脂毒性心肌病的病理机制,以及是否还存在其他信号通路调控糖尿病心肌病线粒体凋亡通路,仍需进一步阐明。
| [1] |
International Diabetes Federation. IDF Diabetes ATLAS (8th edition)[M].Belgium: International Diabetes Federation, Brussels, 2017.
|
| [2] |
Wang L, Gao P, Zhang M, et al. Prevalence and ethnic pattern of diabetes and prediabetes in China in 2013[J]. JAMA, 2017, 317: 2515-23. doi:10.1001/jama.2017.7596 |
| [3] |
Wang Z V, Hill J A. Diabetic cardiomyopathy:catabolism driving metabolism[J]. Circulation, 2015, 131(9): 771-3. doi:10.1161/CIRCULATIONAHA.115.015357 |
| [4] |
陈丹, 吴基良, 李晶. 内质网应激信号通路在高脂诱导的心肌细胞损伤中的作用[J]. 中国药理学通报, 2017, 33(7): 966-71. Chen D, Wu J L, Li J. Role of endoplasmic reticulum stress in high fatty acid induced injury in cardiomyocytes[J]. Chin Pharmacol Bull, 2017, 33(7): 966-71. doi:10.3969/j.issn.1001-1978.2017.07.016 |
| [5] |
Katunga L A, Gudimella P, Efird J T, et al. Obesity in a model of gpx4 haploinsufficiency uncovers a causal role for lipid-derived aldehydes in human metabolic disease and cardiomyopathy[J]. Mol Metab, 2015, 4(6): 493-506. doi:10.1016/j.molmet.2015.04.001 |
| [6] |
俞牧雨, 米日阿依·阿里木江, 刘威, 等. 小檗碱通过抑制脂肪酸摄取降低小鼠原代肝细胞脂质沉积[J]. 中国药理学通报, 2018, 34(3): 337-42. Yu M Y, Miriayi A J, Liu W, et al. Berberine ameliorates lipid accumulation of mouse primary hepatocytes by decreasing fatty acids uptake[J]. Chin Pharmacol Bull, 2018, 34(3): 337-42. doi:10.3969/j.issn.1001-1978.2018.03.009 |
| [7] |
Carpentier A C. Abnormal myocardial dietary fatty acid metabolism and diabetic cardiomyopathy[J]. Can J Cardiol, 2018, 34(5): 605-14. doi:10.1016/j.cjca.2017.12.029 |
| [8] |
Li Q, Yu Q, Na R, et al. Omega3 polyunsaturated fatty acids prevent murine dilated cardiomyopathy by reducing oxidative stress and cardiomyocyte apoptosis[J]. Exp Ther Med, 2017, 14(6): 6152-8. |
| [9] |
Liu H, Peng H, Chen S, et al. S1PR2 antagonist protects endothelial cells against high glucose-induced mitochondrial apoptosis through the Akt/GSK-3β signaling pathway[J]. Biochem Biophys Res Commun, 2017, 490(3): 1119-24. doi:10.1016/j.bbrc.2017.06.189 |
| [10] |
Chen X, Bian M, Zhang C, et al. Dihydroartemisinin inhibits ER stress-mediated mitochondrial pathway to attenuate hepatocyte lipoapoptosis via blocking the activation of the PI3K/Akt pathway[J]. Biomed Pharmacother, 2018, 97: 975-84. doi:10.1016/j.biopha.2017.11.010 |
| [11] |
Fan X Y, Liu Y J, Chen K, et al. Organic arsenicals target thioredoxin reductase followed by oxidative stress and mitochondrial dysfunction resulting in apoptosis[J]. Eur J Med Chem, 2018, 143: 1090-102. doi:10.1016/j.ejmech.2017.05.022 |
| [12] |
Sun X, Mao Y, Dai P, et al. Mitochondrial dysfunction is involved in the aggravation of periodontitis by diabetes[J]. J Clin Periodontol, 2017, 44: 463-71. doi:10.1111/jcpe.2017.44.issue-5 |
| [13] |
Iurlaro R, Muñoz-Pinedo C. Cell death induced by endoplasmic reticulum stress[J]. FEBS J, 2016, 283(14): 2640-52. doi:10.1111/febs.13598 |

