

2. 中国人民解放军总医院第五医学中心中药研究所,北京 100039;
3. 北京中医药大学药学院,北京 100029;
4. 成都中医药大学药学院,四川 成都 611137
柏兆方(1982-),男,博士,助理研究员,研究方向:临床中药学,通讯作者,E-mail:baizf2008@126.com
 ,
XU Guang1,2,
GAO Yuan2,3,
WANG Zhi-lei2,4,
FU Shu-bin1,2,
LIU Hui-min2,
XIAO xiao-he2,
ZHAO Hai-ping1
,
XU Guang1,2,
GAO Yuan2,3,
WANG Zhi-lei2,4,
FU Shu-bin1,2,
LIU Hui-min2,
XIAO xiao-he2,
ZHAO Hai-ping1
 ,
BAI Zhao-fang2
,
BAI Zhao-fang2

2. Department of China Military Institute of Chinese Materia, the Fifth Medical Centre, Chinese PLA (People's Liberation Army) General Hospital, Beijing 100039, China;
3. School of Pharmacy, Beijing University of Traditional Chinese Medicine, Beijing 100029, China;
4. School of Pharmacy, Chengdu University of Traditional Chinese Medicine, Chengdu 611137, China
炎症小体是存在于胞质内,参与免疫应答的一类多聚蛋白复合物,可调控机体清除病原体和损伤细胞, 在先天免疫应答中发挥重要作用。炎症小体由炎症小体感受器(如NLRs)、接头蛋白(apoptosis-associated speck-like protein, ASC)、半胱天冬蛋白酶的前体(pro-caspase-1)组成,且介导细胞焦亡和IL-1β、IL-18等细胞因子的分泌[1]。研究发现,多种疾病的发生与NOD样受体蛋白3(NOD-like receptor 3, NLRP3)、NOD样受体家族半胱天冬酶激活募集结构域4(NOD-like receptor containing a caspase activating and recruitment domain 4,NLRC4)、黑色素瘤缺乏因子2(absent in melanoma 2, AIM2)炎症小体的过度激活密切相关[2]。其中,NLRP3炎症小体能被ATP、Nigericin等多种内源性或外源性因素激活[3];AIM2炎症小体通过感应病原微生物或者宿主细胞的双链DNA(ds DNA)募集ASC产生,诱导炎症小体组装[4];而NLRC4炎症小体则被沙门菌、嗜肺军团菌、铜绿假单胞菌等细菌中的鞭毛蛋白激活[5]。三种炎症小体都可导致IL-1β、IL-18等促炎因子活化和分泌,激活过度则导致疾病的发生。
补骨脂为豆科植物补骨脂(Psoralea corylifolia L.)的干燥成熟果实,具有补肾壮阳、温脾止泻、纳气平喘的功效[6],相关制剂主要用于治疗关节炎、骨质疏松等疾病[7]。研究发现,类风湿性关节炎与NLRP3炎症小体的异常激活密切相关。类风湿性关节炎属于常见的一类自身免疫性疾病,但随着机体免疫系统的紊乱,滑膜组织中的固有免疫细胞和适应性免疫细胞及分泌的炎性因子,使得炎症持续存在,可引起关节软骨和骨组织的破坏,最终导致关节畸形及功能丧失[8]。补骨脂的主要活性成分有香豆素、黄酮、单萜酚类化合物等,香豆素成分包括补骨脂素、异补骨脂素、补骨脂定、8-甲氧基补骨脂素、8-羟基补骨脂素等,黄酮类成分包括补骨脂异黄酮(结构式见Fig 1)等[9]。补骨脂作为传统骨科常用药,可用于治疗类风湿性关节炎,但补骨脂抗炎的具体成分及其作用机制尚不清楚。本文拟探讨补骨脂成分是否能通过调控炎症小体活性,减轻免疫炎症反应,为炎症小体相关疾病治疗提供依据。
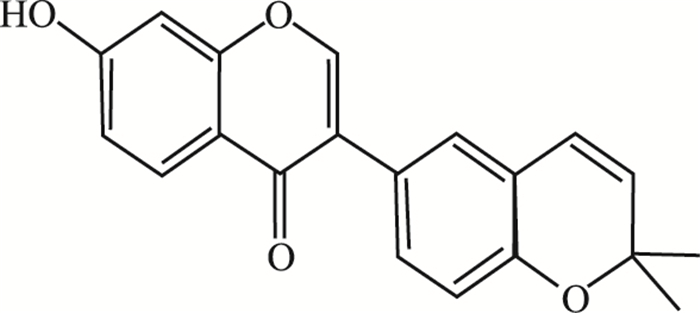
|
| 图 1 Structure of corylin |
补骨脂素(psoralen,批号:17110104)、异补骨脂素(angelicin,批号:18033005)、补骨脂异黄酮(corylin,批号:17092503)、补骨脂定(psoralidin,批号:16042601)、8-甲氧基补骨脂素(8-methoxypsoralen,批号:161019)、8-羟基补骨脂素(xanthotol,批号:160904),均购自成都普菲德生物技术有限公司,纯度>98%。
1.2 试剂DMEM培养基、胎牛血清(美国HyClone公司);Opti-MEM无血清培养基(美国Gibco公司);三磷酸腺苷(ATP)、尼日利亚菌素(Nigericin)、脂多糖(Lipopolysaccharide, LPS)、沙门氏菌(Salmonella)、Poly(deoxyadenylic-deoxythymidylic), (Poly(dA:dT))、二甲基亚砜(DMSO)(美国Sigma Aldrich公司);NLRP3、ASC、caspase-1 p20、pro-caspase-1、mature IL-1β、pro-IL-1β、Tubulin、GAPDH抗体(美国Cell Signaling Technology公司);CCK-8试剂盒(美国MedChemExpress公司,产品编号:HYK03013000T);Caspase-GloⓇ 1 Inflammasome Assay测定试剂盒(美国Promega公司,产品编号:G9952);TNF-α ELISA检测试剂盒(北京达科为生物技术有限公司,产品编号:122720)。
1.3 仪器二氧化碳培养箱(美国Thermo Scientific公司);酶标仪(美国Promega公司);低温高速离心机(美国Sigma公司);电泳槽、转印槽、凝胶电泳分析系统(美国Bio-Rad公司)。
2 方法 2.1 细胞培养小鼠骨髓来源巨噬细胞系(immortal bone marrow-derived macrophages,iBMDM)、人正常肝细胞(L02)、人肝星形细胞(LX-2),均购自中国科学院上海细胞所。培养于含10%胎牛血清、1%双抗的DMEM培养基中,5% CO2、37 ℃恒温培养,细胞生长至80%~90%丰度时, 传代或用于实验。细胞接种于12孔、24孔或96孔培养板中, 备用。
2.2 CCK-8细胞毒性实验取培养至80%~90%丰度的iBMDM和L02细胞, 于96孔板中接种细胞悬液(每孔100 μL), 密度2.5×108·L-1。iBMDM和L02细胞分为正常组、0.1% DMSO组、不同浓度的补骨脂异黄酮组(0.625、1.25、2.5、5、10、20、30、40、50、60、70、80、90、100、110、120 μmol·L-1), 培养24 h后,每孔加入CCK-8溶液10 μL,结合试剂盒说明书及预实验结果,培养箱内培养15 min后, 450 nm处测定吸光度值。
2.3 细胞刺激方式iBMDM细胞中评价炎症小体活性:取培养至80%~90%丰度的iBMDM细胞,于24孔板中接种细胞悬液(每孔500 μL), 细胞密度为8.5×108·L-1,置于培养箱中预培养12~16 h, 50 μg·L-1 LPS预处理h后, 加入含各单体化合物的opti-MEM无血清培养基处理1 h,而后ATP(5 mmol·L-1)、Nigericin(20 μmol·L-1)刺激1 h;沙门氏菌刺激4 h、转染Poly(dA:dT)(2 mg·L-1)刺激6 h, 按文献方法,处理细胞上清和细胞裂解液[10]。
iBMDM、LX-2细胞中评价NF-κB活性:取培养至80%~90%丰度的iBMDM和LX-2细胞,于24孔板中接种细胞悬液(每孔500 μL), 细胞密度为6.5×108·L-1, 培养板置于培养箱中预培养12~16 h, 加入含不同浓度的补骨脂异黄酮(6.25、12.5、25 μmol·L-1)处理1 h,而后加入50 μg·L-1 LPS刺激4 h后, 分别收取细胞上清和细胞裂解液。
2.4 Western blot检测细胞NLRP3、ASC、caspase-1、pro-caspase-1,pro-IL-1β蛋白水平细胞上清蛋白样品采用12%的SDS-聚丙烯酰胺凝胶电泳, 细胞裂解液样品采用10%的SDS-聚丙烯酰胺凝胶电泳。转膜后, 5%脱脂奶室温封闭1 h, 不同一抗(1:1 000)溶液4 ℃孵育过夜, 洗膜3次后, 孵育相应二抗(1:5 000) 1 h,洗膜3次后,显影观察条带变化。
2.5 ELISA法测定iBMDM细胞上清液中TNF-α含量收集iBMDM细胞培养上清液。室温4 000 r·min-1离心5 min,取上清。ELISA法测定上清TNF-α含量,操作步骤按说明书进行。
2.6 Caspase-1活性测定按照Caspase-GloⓇ 1 Inflammasome Assay测定试剂盒说明书进行操作。先室温平衡Caspase-GloⓇ 1缓冲液、Z-WEHD荧光素底物及MG-132抑制剂,然后在10 mL Z-WEHD-氨基荧光素底物中,加入60 μL MG-132(120 μmol·L-1)抑制剂充分涡旋至彻底混合,再加入Caspase-GloⓇ 1缓冲液,充分涡旋,形成终浓度为60 μmol·L-1的荧光检测混合物,待用。96孔板中加入细胞上清样本,每孔再加入已配制待用的荧光检测混合物,细胞培养板振荡器振荡1 min, 室温避光平衡,使样品与荧光底物充分结合,1 h后经酶标仪检测分析caspase-1荧光值。
2.7 统计学方法所有实验均独立重复3次,数据以x±s表示,采用SPSS 21.0进行统计学分析,计量资料使用Kolmogorov-Smirnov及Shapiro-Wilk法验证是否符合正态分布,符合正态分布的多组均数比较采用单因素方差分析(One way ANOVA),组间比较采用最小显著差(LSD)法。
3 结果 3.1 筛选鉴定补骨脂化学成分对NLRP3炎症小体活性的影响通过文献调研补骨脂化学成分,筛选6种补骨脂单体化合物:补骨脂素、异补骨脂素、补骨脂定、8-甲氧基补骨脂素、8-羟基补骨脂素、补骨脂异黄酮,评价其在20 μmol·L-1浓度下对LPS联合ATP诱导的NLRP3炎症小体活性的作用。caspase-1活性检测结果显示,在细胞培养上清中,补骨脂异黄酮中caspase-1产生明显降低,表明补骨脂异黄酮可抑制ATP诱导的NLRP3炎症小体活性(Fig 2)。
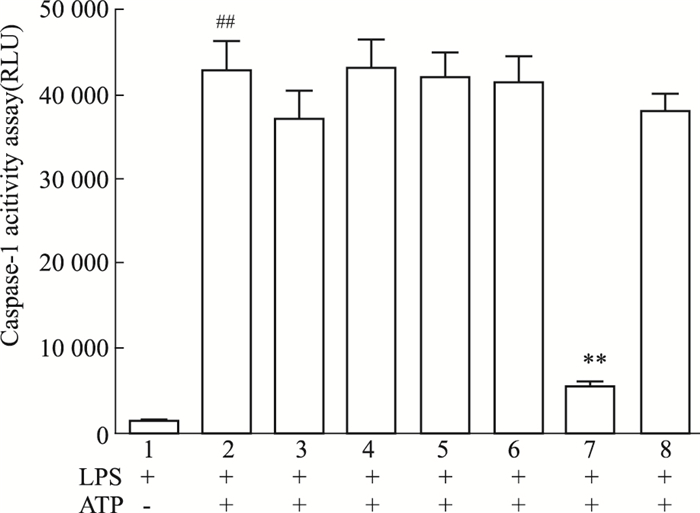
|
| Fig 2 Caspase-1 p20 activity of six isolated compounds from Psoralea corylifolia L (x±s, n=3) 1:Control; 2:Model; 3:Psoralen; 4:B-methoxypsoralan; 5:Xanthotol; 6:Angelicin; 7:Corylin; 8:Psoralidin. The inflammasome activities of six isolated compounds from Psoralea corylifolia L. were tested by Caspase-GloⓇ 1 Inflammasome Assay. RLU: recombinant luciferase, proportional to caspase-1 activity. ##P < 0.01 vs control group; **P < 0.01 vs model group. |
利用CCK-8实验,检测补骨脂异黄酮对iBMDM和L02细胞的毒性。与对照组相比,随着补骨脂异黄酮给药浓度增加,iBMDM和L02细胞存活率呈梯度降低。在iBMDM中,补骨脂异黄酮的半数抑制浓度(IC50)为108 μmol·L-1,最大无毒剂量是28 μmol·L-1;在L02细胞中,IC50为123 μmol·L-1,最大无毒剂量是23.8 μmol·L-1。本研究中使用的补骨脂异黄酮最高浓度为20 μmol·L-1,该浓度范围内无细胞毒性(Fig 3)。
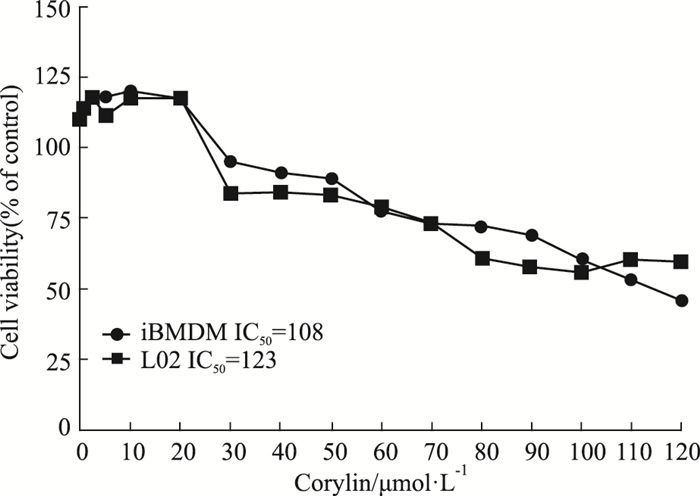
|
| Fig 3 Cell viability of corylin in iBMDM and L02 cells (x±s, n=3) |
为进一步明确补骨脂异黄酮对NLRP3炎症小体的影响,本研究首先评估补骨脂异黄酮对LPS联合ATP诱导的NLRP3炎症小体活性抑制作用是否具有量效关系。细胞培养上清的caspase-1活性检测结果显示,补骨脂异黄酮呈浓度依赖性抑制caspase-1活性(Fig 4A)。Western blot检测结果显示,补骨脂异黄酮呈浓度依赖性抑制caspase-1 p20的产生和mature IL-1β p17分泌,但是对细胞裂解液中NLRP3、ASC、pro-caspase-1和pro-IL-1β等炎症小体组成蛋白表达无影响(Fig 4B)。同样,补骨脂异黄酮也浓度依赖性抑制LPS联合Nigericin诱导的NLRP3炎症小体活化以及后续关键蛋白caspase-1 p20产生和mature IL-1β p17的分泌(Fig 4C、4D)。上述结果表明,补骨脂异黄酮可抑制ATP和Nigericin诱导NLRP3炎症小体活化,抑制mature IL-1β介导的免疫炎症反应。
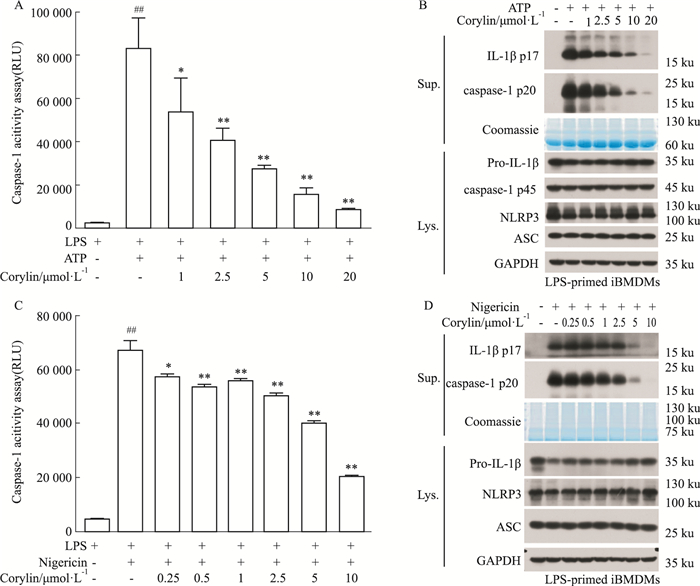
|
| Fig 4 Effect on ATP, nigericin-induced NLRP3 inflammasome activation inhibited by corylin (x±s, n=3) A: LPS-primed iBMDMs treated with various doses of corylin, and then stimulated with ATP. The activity of caspase-1 in culture supernatants (Sup.) was analyzed by Caspase-GloⓇ 1 Inflammasome Assay. B: Western blot was used to analyze the expression levels of IL-1β p17, caspase-1 p20 in Sup., pro-IL1β, pro-caspase-1, NLRP3, ASC in cell lysates (Lys.). C: LPS-primed iBMDMs stimulated with nigericin after treated with corylin. The activity of caspase-1 in Sup. was analyzed by Caspase-GloⓇ 1 Inflammasome Assay. D: Western blot was used to analyze the expression levels of IL-1β p17, caspase-1 p20 in Sup., pro-IL1β, pro-caspase-1, NLRP3, ASC in Lys. Coomassie blue staining was provided as the loading control for the Sup. GAPDH was provided as the loading control for the Lys.(B, D). ##P < 0.01 vs control group; *P < 0.05, **P < 0.01 vs model group. |
为明确补骨脂异黄酮对NLRP3炎症小体的抑制作用是否具有特异性,本研究分别利用LPS联合沙门氏菌和Poly(dA:dT),构建NLRC4和AIM2炎症小体活化模型。如Fig 5所示,在LPS联合沙门氏菌诱导的NLRC4炎症小体活化模型中,补骨脂异黄酮可抑制pro-caspase-1剪切活化,降低caspase-1 p20的产生,表明补骨脂异黄酮能抑制NLRC4炎症小体的活化。在LPS联合dsDNA类似物Poly(dA:dT)诱导的AIM2炎症小体活化模型中,补骨脂异黄酮能够降低细胞培养上清中pro-caspase-1剪切活化,降低caspase-1 p20的产生,表明补骨脂异黄酮亦能抑制AIM2炎症小体活性。而在NLRC4和AIM2炎症小体活化模型中,补骨脂异黄酮对细胞裂解液中的NLRP3、ASC、pro-caspase-1及pro-IL-1β等蛋白表达均无明显影响。
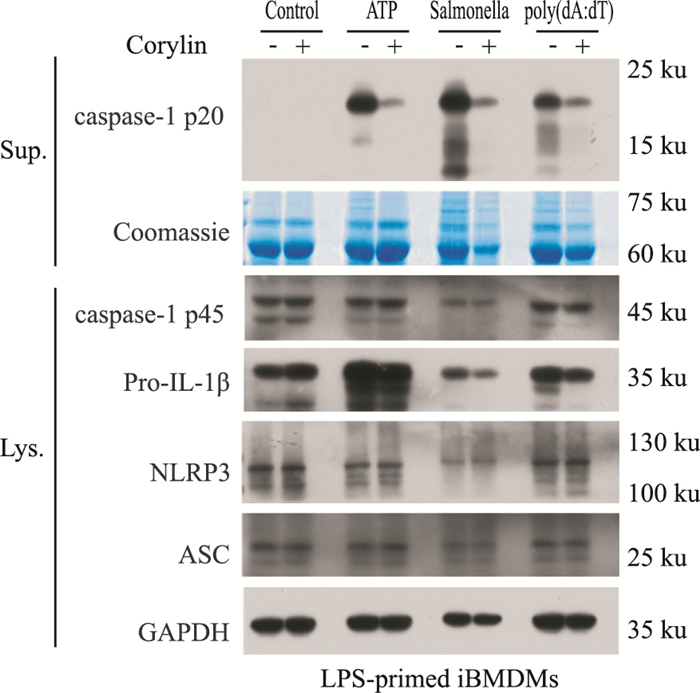
|
| Fig 5 NLRC4, AIM2 inflammasome activation inhibited by corylin Western blot analysis of caspase-1 p20 in Sup., pro-IL-1β, pro-caspase-1, NLRP3, ASC in Lys. of LPS-primed iBMDMs treated with corylin (10 μmol·L-1) and then stimulated with ATP, Salmonella, Poly(dA:dT). |
为进一步探索补骨脂异黄酮对炎症小体抑制作用的机制,本研究在iBMDM和LX-2细胞中,评价补骨脂异黄酮是否影响NF-κB信号通路介导的炎症小体组成蛋白表达。NF-κB信号通路是NLRP3、NLRC4及AIM2炎症小体激活的第一信号,通过Toll样受体4(Toll like receptor 4,TLR4)等受体,活化NF-κB信号通路,诱导NLRP3、pro-IL-β、pro-IL-18蛋白表达[11]。Western blot结果显示(Fig 6),补骨脂异黄酮对LPS诱导的NLRP3和pro-IL-1β的表达无明显影响,同时对pro-caspase-1表达也无影响。ELISA结果进一步提示,补骨脂异黄酮也不影响LPS诱导TNF-α的表达分泌。上述结果表明,补骨脂异黄酮对NF-κB信号介导的炎症小体组成蛋白的表达无影响。
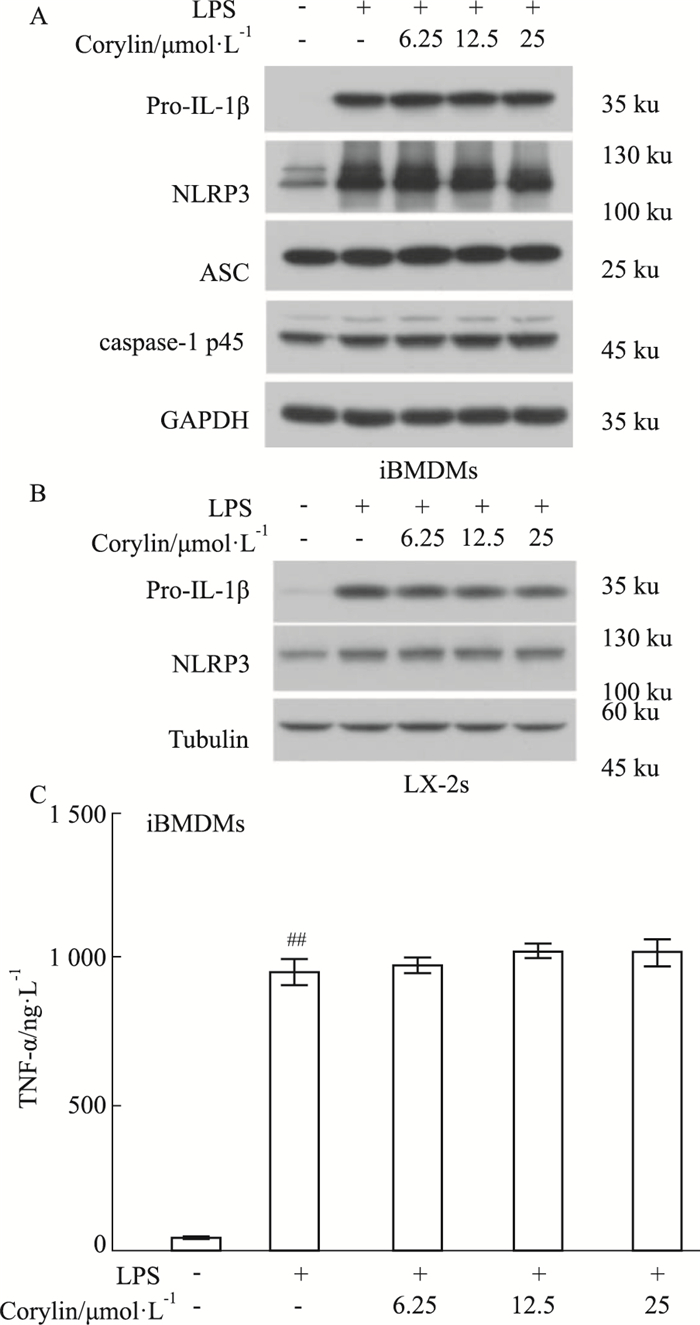
|
| Fig 6 NF-κB signaling pathway not inhibited by corylin (x±s, n=3) A: iBMDMs were treated with various doses of corylin and then stimulated with LPS. Western blot was used to analyze the protein expressions of pro-IL-1β, NLRP3, pro-caspase-1, ASC in Lys. B: LX-2s were treated with different concentrations of corylin and then incubated with LPS. Western blot was used to analyze the protein expressions of pro-IL-1β, NLRP3, pro-caspase-1, ASC in Lys. GAPDH and tubulin were provided as the loading control for the Lys.(A, B). C: The secretion of TNF-α was measured in the Sup. of iBMDMs by ELISA. ##P < 0.01 vs control group. |
本研究为探讨补骨脂异黄酮与NLRP3炎症小体相互作用的性质,研究补骨脂异黄酮对NLRP3炎症小体的抑制效应是否具有可逆性。LPS预处理的iBMDM细胞,补骨脂异黄酮预孵育0.5 h和1 h,撤去未结合的药物,再给予ATP刺激,结果显示,补骨脂异黄酮仍能抑制ATP诱导iBMDM细胞中caspase-1 p20的产生,且与撤药时间呈相关性,即给予ATP之前,撤去未结合药物的时间越长,caspase-1 p20的产生越低(Fig 7A),表明补骨脂异黄酮对NLRP3炎症小体抑制作用具有不可逆性。Western blot结果显示,补骨脂异黄酮对细胞裂解液中NLRP3、ASC、pro-caspase-1及pro-IL-1β蛋白表达均无明显影响(Fig 7B)。
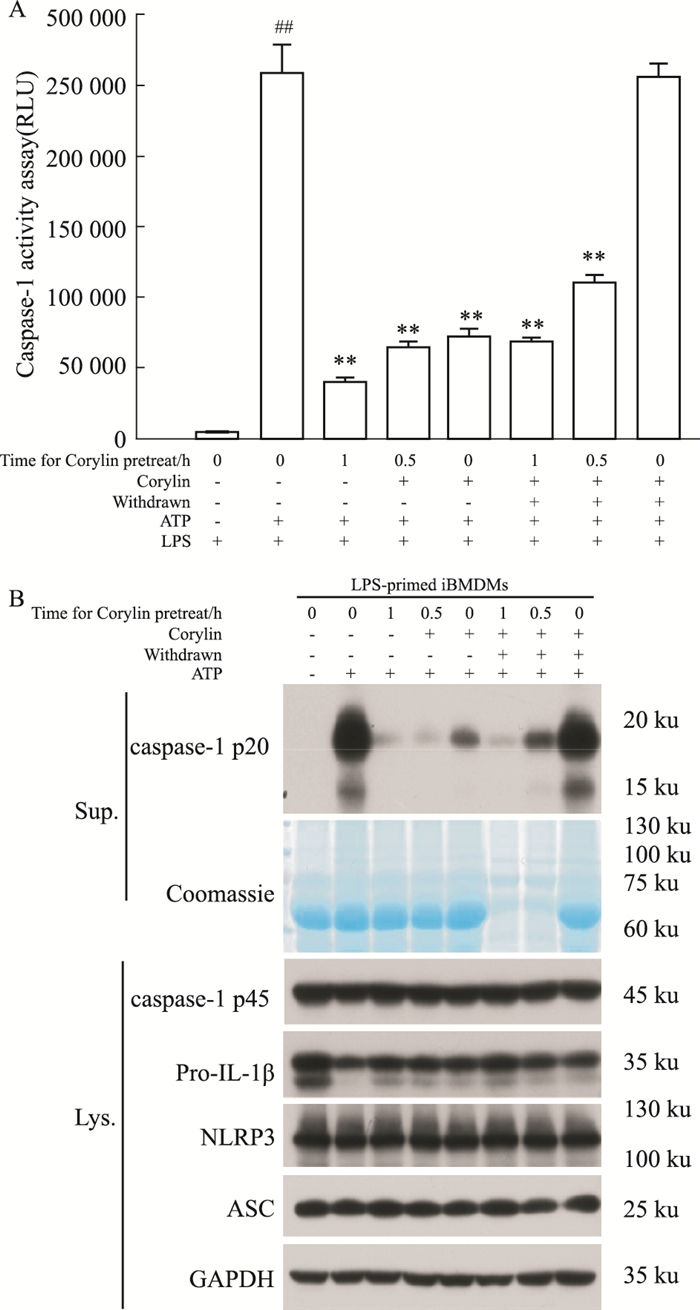
|
| Fig 7 Activation of NLRP3 inflammasome irreversibly inhibited by corylin (x±s, n=3) A: LPS-primed iBMDMs treated with corylin for 0.5 h, 1 h and washed three time, then stimulated with ATP for 0.5 h, 1 h. Caspase-GloⓇ 1 Inflammasome Assay was used to analyze the activity of caspase-1 in Sup. ##P < 0.01 vs control group; **P < 0.01 vs model group. B: The protein expressions of caspase-1 p20, pro-caspase-1, pro-IL-1β, NLRP3, ASC were analyzed by Western blot. Coomassie blue staining was provided as the loading control for the Sup. GAPDH was provided as the loading control for the cell Lys. |
炎症小体作为固有免疫的重要部分,可有效识别病原微生物和机体产生的损伤分子,诱发免疫炎症反应。NLRP3炎症小体可识别尼日利亚菌素、二氧化硅、ATP、尿酸钠结晶等,AIM2炎症小体能够被病原微生物或者宿主细胞的dsDNA激活,NLRC4炎症小体可识别沙门菌中细菌鞭毛蛋白[12]。三种炎症小体一旦组装激活,导致pro-caspase-1剪切活化,产生caspase-1 p20,caspase-1 p20进一步剪切pro-IL-1β和pro-IL-18,使其分别形成成熟的IL-1β和IL-18,导致系列免疫炎症反应和细胞焦亡,引起损伤。近年研究表明,类风湿性关节炎与NLRP3炎症小体异常调控密切相关[10],补骨脂作为传统骨科用药,可用于治疗类风湿性关节炎这一自身免疫性疾病。因此,本实验探讨补骨脂中单体化合物能否通过调控炎症小体,减轻免疫炎症反应,为类风湿关节炎的诊断和治疗提供依据。实验结果表明,补骨脂中补骨脂异黄酮可有效抑制ATP、Nigericin诱导的NLRP3炎症小体活性,抑制caspase-1 p20的产生及mature IL-1β p17分泌,此外还能抑制NLRC4、AIM2炎症小体活性,表明补骨脂异黄酮对炎症小体活性的抑制作用具有广谱性。这对解释补骨脂治疗类风湿性关节炎这一自身免疫炎症性疾病具有重要意义,同时为治疗炎症小体活化相关疾病的药物研发提供新思路和新方法,也为其他炎症疾病的治疗和防控提供借鉴。
炎症小体活化需要两条信号通路协同完成[13]。第一信号首先TLR4受体与LPS等配体结合,诱导NF-κB信号通路活化,上调NLRP3、pro-IL-1β、pro-IL-18等NLRP3炎症小体组成蛋白的表达。第二信号是活化信号,在ATP、Nigericin等损伤相关分子模式(damage associated molecular patterns, DAMPs)和病原相关分子模式(pathogen-associated molecular patterns,PAMPs)作用下,NLRP3与ASC、pro-caspase-1形成多聚化复合体,诱导pro-caspase-1自我剪切活化,一方面诱导细胞焦亡,另一方面活化的caspase-1使pro-IL-1β、pro-IL-18剪切为活化的IL-1β、IL-18,并释放到胞外,参与众多炎症反应。本实验结果表明,补骨脂异黄酮不通过调控NF-κB信号通路抑制NLRP3炎症小体活性, 而是通过第二条信号通路阻断caspase-1 p20的产生,抑制caspase-1 p20对pro-IL-1β的剪切,从而抑制NLRP3炎症小体活性。结合其对NLRC4和AIM2炎症小体均具有抑制作用,且3种炎症小体均需要活化caspase-1介导免疫炎症反应,因此,本实验认为,补骨脂异黄酮通过调控pro-caspase-1的自我剪切发挥作用。
本研究尚未评价补骨脂异黄酮在小鼠骨髓来源的原代巨噬细胞和NLRP3炎症小体相关动物模型中的作用,同时尚未考虑补骨脂异黄酮在机体的生物转化度,若转化成其他代谢产物,是否能同样调控炎症小体,有待进一步探讨。
炎症小体的异常活化导致多种免疫炎症性疾病的发生和发展。近年来,如MCC950[14]、灯盏花乙素[15]等均通过抑制NLRP3炎症小体活化,发挥抗炎作用。因此,开发可调控炎症小体的小分子化合物,对于防治炎症小体相关疾病具有重要意义。
( 致谢:本实验在中国人民解放军总医院第五医学中心中药研究所分子生物学实验室完成,感谢各位老师和同学给予的帮助。)
| [1] |
Lamkanfi M, Dixit V M. Mechanisms and functions of inflammasomes[J]. Cell, 2014, 5(157): 1013-22. |
| [2] |
Mangan M S J, Olhava E J, Roush W R, et al. Targeting the NLRP3 inflammasome in inflammatory diseases[J]. Nat Rev Drug Discov, 2018, 17(9): 588-606. |
| [3] |
Liston A, Masters S L. Homeostasis-altering molecular processes as mechanisms of inflammasome activation[J]. Nat Rev Immunol, 2017, 17(3): 208-14. doi:10.1038/nri.2016.151 |
| [4] |
Hornung V, Ablasser A, Charrel-Dennis M. AIM2 recognizes cytosolic dsDNA and forms a caspase-1 activating inflammasome with ASC[J]. Nature, 2009, 458(7237): 514-8. doi:10.1038/nature07725 |
| [5] |
旷星星.梅毒螺旋体鞭毛蛋白经激活NLRC4炎症小体诱导人巨噬细胞表达IL-1β和IL-18[D].衡阳: 南华大学, 2017. Kuang X X. Treponema pallidum flagellins induces IL-1β and IL-18 production in macrophages via the activation of NLRC4 inflammasome.[D].Hengyang: University of South China, 2017. |
| [6] |
国家药典委员会.中华人民共和国药典(2015年版.一部)[S].北京: 中国医药科技出版社, 2015: 187. Chinese Pharmacopoeia Commission. Chinese Pharmacopoeia.2015, VolumeⅠ[S].Beijing: Chinese Medicine Science and Technology Press, 2015: 187. |
| [7] |
梁建军, 徐亚莉, 田树喜, 等. 补骨脂研究现状及前景[J]. 河北中医, 2013, 35(12): 1904-6. Liang J J, Xu Y L, Tian S X, et al. Current research and prospects of Psoralea corylifolia L[J]. Hebei J TCM, 2013, 35(12): 1904-6. |
| [8] |
施剑峰, 沈波. NLRP3炎性小体在类风湿关节炎中的研究进展[J]. 医学研究杂志, 2017, 4(46): 11-3. Shi J F, Sheng B. Research progress of NLRP3 inflammasome in rheumatoid arthritis[J]. J Med Res, 2017, 4(46): 11-3. |
| [9] |
邱蓉丽, 李璘, 乐巍. 补骨脂的化学成分与药理作用研究进展[J]. 中药材, 2010, 33(10): 1656-9. Qiu R L, Li L, Le W. Chemical composition and pharmacological effect research advances of P. corylifolia L[J]. J Chin Med Mater, 2010, 33(10): 1656-9. |
| [10] |
Song N, Liu Z S, Xue W, et al. NLRP3 phosphorylation is an essential priming event for inflammasome activation[J]. Mol Cell, 2017, 68(1): 185-97. doi:10.1016/j.molcel.2017.08.017 |
| [11] |
刘雯, 郭徐强, 孙洋. NLRP3炎症小体调控机制研究进展[J]. 药学学报, 2016, 51(10): 1505-12. Liu W, Guo X Q, Sun Y. Advances in mechanisms for NLRP3 inflammasomes regulation[J]. Acta Pharm Sin, 2016, 51(10): 1505-12. |
| [12] |
Zhao Y, Yang J, Shi J, et al. The NLRC4 inflammasome receptors for bacterial flagellin and type III secretion apparatus[J]. Nature, 2011, 477(7366): 596-600. doi:10.1038/nature10510 |
| [13] |
Yang C S, Shin D M, Jo E K. The role of NLR-related protein 3 inflammasome in host defense and inflammatory diseases[J]. Int Neurourol J, 2012, 16(1): 2-12. doi:10.5213/inj.2012.16.1.2 |
| [14] |
Coll R C, Robertson A A B, Chae J J, et al. A small-molecule inhibitor of the NLRP3 inflammasome for the treatment of inflammatory diseases[J]. Nat Med, 2015, 21(3): 248-55. doi:10.1038/nm.3806 |
| [15] |
景艳芸, 李陈广, 颜亮. 灯盏花乙素对J774A.1巨噬细胞中ATP诱导的炎症小体活化和细胞焦亡的影响[J]. 中国药理学通报, 2019, 34(2): 174-80. Jing Y Y, Li C G, Yan L. Influences of scutellarin on ATP-inflammasome activation and pyroptosis in J774A.1 macrophages[J]. Chin Pharmacol Bull, 2019, 34(2): 174-80. |