

2. 南昌大学 基础医学院生理学教研室,江西 南昌 330006
2. Dept of Physiology, School of Basic Medicine, Nanchang University, Nanchang 330006, China
糖尿病(diabetes mellitus,DM)是一组代谢性临床综合征,随着社会的发展和人们生活水平的提高,糖尿病的患病率逐年升高。在发达国家,糖尿病患病率已达3%~7%,成为仅次于癌症、艾滋病、心脑血管病之后第4位需要优先考虑的疾病,已成为世界第5位死亡主因[1-4]。我国糖尿病人群的构成,以2型糖尿病为主,占糖尿病人群的90%以上,严重影响着人民健康和社会发展[1, 3, 5-6]。2型糖尿病最主要的症状是高血糖,高血糖是引发糖尿病并发症的主要原因,据估计,全球6个人里面就有1个人处于患糖尿病并发症的危险中[1-6]。
葡萄糖激酶(glucokinase,GK)是己糖激酶家族中的一员,分子质量为52 ku,由448个氨基酸残基构成[5, 7]。肝脏GK参与葡萄糖磷酸化,加速糖原合成及葡萄糖代谢。GK是糖代谢途径中的关键酶,特异性地存在于胰腺β细胞和肝细胞,可促进胰岛素分泌和葡萄糖代谢,参与糖代谢的各条途径[5, 7-8]。肝脏中的GK是糖酵解过程中第一步的限速酶,催化葡萄糖磷酸化生成6-磷酸葡萄糖,后者在胰岛素作用下,经过糖原合成途径合成肝糖原储存起来。因此,肝脏中的GK的主要作用是促进糖酵解,加速糖原合成和抑制糖异生,调节肝细胞对葡萄糖的摄取与利用,从而有效控制体内血糖平衡[5, 8]。
非编码RNA(noncoding RNA, ncRNA)是一类不编码蛋白质,但具有生物学调控功能的RNA分子,同时与一些重要疾病的病理生理过程相关[3, 9-10]。长度大于200个碱基(200 nt)为长链非编码RNA (long noncoding RNA, lncRNA)。本项目前期用SOLiD高通量测序,并通过生物信息学预测和分子生物学验证,确定大鼠肝脏存在lncRNA uc.48 + (http://genome.ucsc.edu/cgi-bin/hgc?hgsid=427967671_gIIKDUiyguaFXCbRBiWSM7gFOgqn&c=chr2&o=20462844&t=20463142&g=ct_Ultra_7128&i=%28null%29+uc.48)[9], 并发现糖尿病模型大鼠肝脏lncRNAuc.48 +表达较对照组明显增加,提示肝脏的lncRNAuc.48 +与糖尿病的病理变化有关。本实验应用2型糖尿病模型大鼠,观察lncRNAuc.48 +小干扰RNA对2型糖尿病模型大鼠血糖的影响及可能机制。
1 材料与方法 1.1 实验动物及分组Sprague-Dawley(SD)♂大鼠,40只,清洁级,体质量200 g左右,购于南昌大学医学部实验动物中心,动物使用许可证号:SYXK(赣)2015-0001。大鼠分笼饲养,每笼饲养7只,温度20~25 ℃,相对湿度40%~70%,昼夜明暗交替12 h/12 h, 自由饮水。适应1周后,禁食不禁水12 h,剪尾采血测血糖。将大鼠随机分成对照组(Control)和模型组,对照组始终喂养普通饲料(由南昌大学医学院实验动物科学部提供),模型组喂养高糖高脂饲料(基础饲料66.5%、蔗糖20%、猪油10%、胆固醇2.5%、胆酸钠1%,加水做成条状,放在恒温鼓风干燥箱中80 ℃干烤3 h)。第5周末(即模型组喂高糖高脂饲料4周后),所有大鼠禁食不禁水12 h测血糖。模型组大鼠空腹腹腔注射链脲佐菌素(streptozotocin, STZ)30 mg·kg-1(临用前将STZ溶解于4 ℃冰箱预冷的pH为4.2的0.1 mol·L-1柠檬酸钠-柠檬酸缓冲液中,配制成2.5 g·L-1的STZ溶液)。第6周末,空腹血糖小于7.8 mmol·L-1的大鼠再注射STZ 30 mg·kg-1一次,第7周末,测空腹血糖大于7.8 mmol·L-1为成模标准。
lncRNAuc.48 +小干扰RNA(siRNA)序列由Invitrogen公司提供,靶序列为5′-GGCACTACTACTTGCAGAA-3′;阴性对照scrambled siRNA (NC siRNA)购自Invitrogen公司。在体转染试剂由EntransterTM公司提供。根据EntransterTM在体转染说明书,实验第10周末,对糖尿病造模成功的大鼠进行lncRNAuc.48 +siRNA在体小干扰实验。成模后的大鼠再随机分成:糖尿病模型+生理盐水对照组、糖尿病模型+lncRNAuc.48 +siRNA处理组、糖尿病模型+NC siRNA处理组。糖尿病模型小干扰RNA处理组的大鼠分别通过尾静脉注射lncRNAuc.48 +小干扰RNA或scrambled siRNA。对照组和糖尿病模型组均尾静脉注射相同体积生理盐水。1周后,取各组大鼠标本检测相关指标。
1.2 试剂GK抗体(Abcam公司);p-Akt1与Akt1抗体,购自以色列Alomone Labs,Jerusalem公司;肝/肌糖原试剂盒(南京建成生物工程研究所);β-actin一抗、羊抗鼠二抗、羊抗兔二抗(中杉金桥);GK及β-actin引物(南京金斯瑞生物科技有限公司);BCA蛋白定量试剂盒(凯基生物)。
1.3 仪器罗康全活力型血糖仪(德国罗氏公司);ABI7500实时定量PCR仪(美国ABI公司);凝胶成像仪(Bio-Rad公司)。
1.4 血糖的测定分别于第1、5、10、11周末,用血糖仪测量各组大鼠空腹血糖(禁食12 h,自由饮水)和餐后血糖,每次测量由相同人员操作,其他条件保持一致。剪尾采血方法:首先用酒精棉球擦拭大鼠尾端,然后用消毒剪刀剪去尾尖2 mm左右,将血直接滴在已准备好的血糖试纸上测量。采血结束后,对大鼠尾端伤口行碘伏消毒。
1.5 肝糖原含量测定取各组大鼠肝脏,用DEPC处理过的PBS清洗,具体操作按试剂盒说明书进行,用全自动生化仪测定。最后根据公式计算肝脏组织糖原含量:糖原含量(mg/g组织)=(测定管OD值-标准管OD值)×标准管含量×样本测试前稀释倍数×样本测试过程中稀释倍数÷1.11。
1.6 实时定量PCR(qPCR)检测肝脏GK mRNA表达使用TRIzol总RNA提取试剂盒(北京天根生物公司)从肝脏中提取总RNA。使用RevertAidTM First Strand cDNA Synthesis Kit(美国Fermentas公司),按照说明书合成cDNA。使用Primer Express 3.0软件(Applied Biosystems)设计引物,引物序列如下:GK上游引物: 5′-GGCTTCACCTTCTCCTTCCC-3′,下游引物: 5′-CACATTGGCGGTCTTCATAG-3′,产物223 bp;β-actin上游引物: 5′-TAAAGACCTCTATGCCAACACAGT-3′,下游引物:5′-CACGATGGAGGGGCCGGACTCATC-3′,产物240 bp;uc.48 +上游引物:5′-GCAAACTGGATGAGGAT-3′,下游引物:5′-GTAGTGCCACAAGGAGA-3′。使用SYBR® Green Master Mix ABIPRISM®7500序列检测系统(Applied Biosystems)进行定量PCR。热循环参数为95 ℃,持续30 s,然后在95 ℃下进行40个循环的放大5 s,60 ℃放置30 s。通过熔解曲线确定扩增特异性,并使用ABI7500 PCR仪器内的软件分析处理结果。
1.7 蛋白印迹检测肝脏GK、p-Akt1与Akt1的含量将肝脏置于匀浆器中,加入蛋白提取液(RIPA)和PMSF,于冰上进行匀浆,提取总蛋白,按照BCA试剂盒说明书检测蛋白浓度。获取的蛋白按照20 μg对应的体积加样,进行聚丙烯酰胺凝胶电泳,转膜。常温下5%的脱脂牛奶(脱脂奶粉+TBST液)封闭2 h,分别加入一抗4 ℃孵育过夜。次日洗膜后, 膜放于二抗中孵育2 h后,用TBST洗膜3次,每次10 min。凝胶成像系统显影液曝光。以β-actin为内参,凝胶成像系统进行条带灰度值扫描,用Image-Pro Plus图像分析系统观察分析综合光密度。以各组β-actin条带的综合光密度值标化其相应组目的蛋白相对表达量。
1.8 数据处理应用SPSS 17.0统计软件对实验数据进行统计分析,各实验组结果以x±s表示,两组之间比较用t检验,多组比较采用方差分析F检验,组间比较用LSD法。
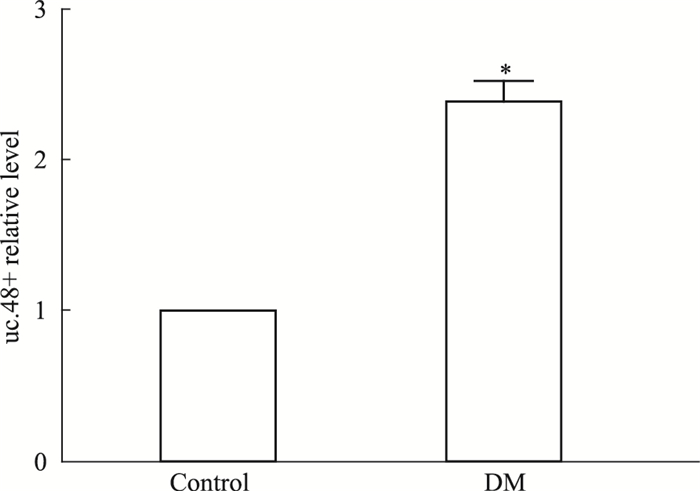
2 结果 2.1 糖尿病模型大鼠肝脏uc.48 +的表达Fig 1的实时定量PCR检测显示,糖尿病模型(DM)大鼠肝脏uc.48 +的表达水平较对照组明显增加(P<0.05)。
|
| Fig 1 Expression of lncRNA uc.48 + in type 2 diabetic rats (x±s, n=7) *P < 0.05 vs control group |
Tab 1结果显示,实验开始时(1周末),正常组大鼠与糖尿病模型组大鼠空腹血糖(fasting blood glucose,FBG)和餐后血糖(postprandial blood glucose,PBG)差异无统计学意义(P>0.05);到第10周末,注射STZ后,糖尿病模型组大鼠与正常对照组大鼠相比,餐后血糖和空腹血糖均升高(P<0.01)。Tab 2结果显示,第11周末,与DM组相比,DM+uc.48 +siRNA处理组空腹血糖和餐后血糖均有所降低(P<0.05)。DM组与DM+NC siRNA组相比,差异无统计学意义。
| Control(n=7) | DM(n=9) | ||||
| FBG | PBG | FBG | PBG | ||
| 1 week | 4.84±0.21 | 5.89±0.73 | 5.36±0.63 | 6.60±0.50 | |
| 10 weeks | 4.93±0.35 | 6.14±0.67 | 16.13±6.50** | 22.60±8.52** | |
| **P < 0.01 vs control group | |||||
| FBG | PBG | |||||
| Control | 4.90±0.21 | 5.95±0.54 | ||||
| DM | 23.37±3.78** | 27.73±3.80** | ||||
| DM+ uc.48+siRNA | 10.70±6.00# | 15.70±7.70# | ||||
| DM+NC siRNA | 23.16±2.85** | 28.02±3.75** | ||||
| **P < 0.01 vs control group; #P < 0.05 vs DM group | ||||||
各组大鼠肝糖原检测结果显示(Tab 3),DM组与对照组相比,肝糖原明显下降(P<0.01),DM+uc.48 +siRNA组与DM组相比,肝糖原明显升高(P<0.05)。DM组与DM+NC siRNA组相比差异无统计学意义。
| Glycogen/mg·g-1 | |
| Control | 43.79±1.32 |
| DM | 3.72±0.87** |
| DM+uc.48+siRNA | 12.71±0.67# |
| DM+NC siRNA | 3.70±0.77** |
| **P < 0.01 vs control group; #P < 0.05 vs DM group | |
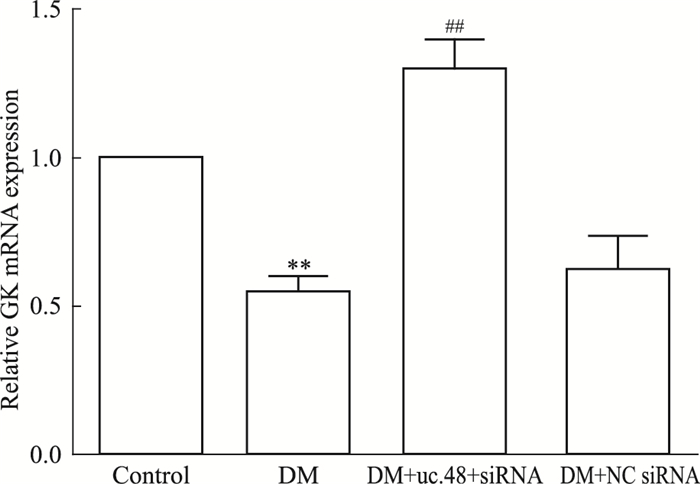
如Fig 2所示,与正常对照组相比,糖尿病模型组肝脏中GK mRNA的表达明显降低(P<0.01);uc.48 +小干扰RNA处理组与糖尿病模型组相比,肝脏中GK mRNA的表达明显升高(P<0.01)。DM组与DM+NC siRNA组相比差异无统计学意义。
|
| Fig 2 Expression of GK mRNA in liver of each group (x±s, n=7) **P < 0.01 vs control group; ##P < 0.01 vs DM group |
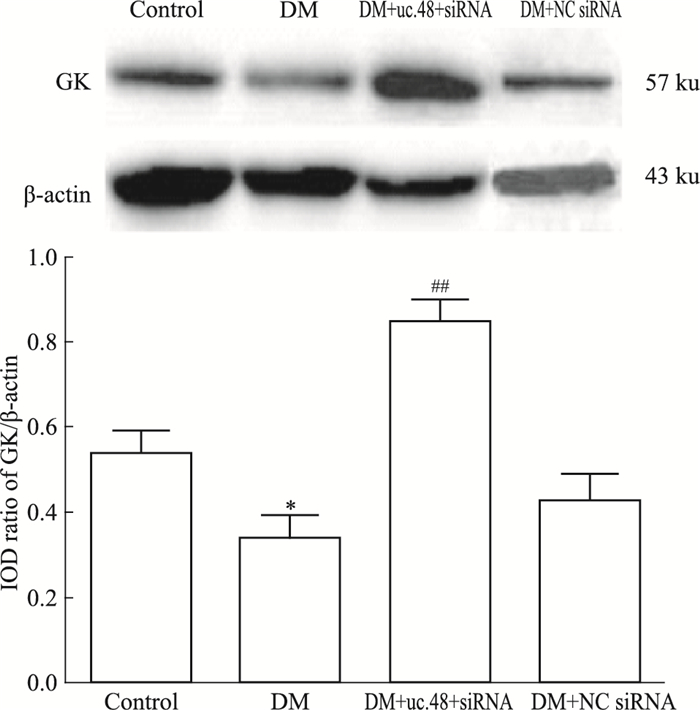
如Fig 3所示,与正常对照组相比,糖尿病模型组肝脏中GK的表达明显降低(P<0.05);uc.48 +小干扰RNA处理组与糖尿病模型组相比,肝脏中GK的表达明显升高(P<0.01)。DM组与DM+ NC siRNA组相比差异无统计学意义。
|
| Fig 3 Expression of GK protein in liver of each group (x±s, n=7) *P < 0.05 vs control group; ##P < 0.01 vs DM group |
Fig 4结果显示,各组间Akt1蛋白含量差异无显著性。与正常对照组相比,糖尿病模型组肝脏中p-Akt1的表达明显降低(P<0.01);uc.48 +小干扰RNA处理组与糖尿病模型组相比,肝脏中p-Akt1的表达明显升高(P<0.01)。DM组与DM+NC siRNA组相比差异无统计学意义。

|
| Fig 4 Expression of Akt1 and p-Akt1 protein in liver of each group (x±s, n=7) **P < 0.01 vs control group; ##P < 0.01 vs DM group |
糖尿病是以高血糖、高血脂为特征的代谢紊乱综合征[2, 4]。本实验应用高糖高脂饲料喂养联合小剂量STZ注射,诱导建立类似2型糖尿病大鼠模型,模型组大鼠检测餐后血糖、空腹血糖均较对照组明显增高,达到了糖尿病的诊断标准,说明2型糖尿病建模成功。人类基因组lncRNAs有481种超保守元件,其特征为长度大于200 bp,且在不同物种之间具有超级保守性[11]。uc.48+是lncRNA[9]。本研究观察到2型糖尿病模型大鼠肝脏的lncRNA uc.48 +表达增加,提示uc.48 +与2型糖尿病有关。实验观察到糖尿病模型大鼠用uc.48 +小干扰RNA处理后,餐后血糖、空腹血糖较模型大鼠降低,表明uc.48 +小干扰RNA可降低糖尿病模型大鼠升高的血糖。
本实验中,糖尿病模型大鼠肝糖原检测显示,糖尿病模型组大鼠肝糖原较对照组明显降低,糖尿病模型大鼠加uc.48 +小干扰RNA处理后,肝糖原的合成较糖尿病模型组大鼠增多,提示uc.48 +小干扰RNA可通过促进葡萄糖代谢途径,降低血糖。研究表明,普通糖尿病患者及糖尿病动物模型体内GK活性明显降低,它可能对糖尿病的发生、发展产生重要影响[8],而增加GK活性可促进葡萄糖的磷酸化,促进糖原合成和胰岛素释放,从而改善糖耐量异常,提高胰岛细胞功能,改善糖尿病症状[5, 7-8]。实验中还观察到糖尿病模型组肝脏GK mRNA和蛋白表达较对照组明显减少,经uc.48 +小干扰RNA干预后,肝脏GK mRNA与蛋白表达较糖尿病模型组明显增加。血糖增高时,GK可使肝糖原合成增加,抑制肝脏糖异生,以维持血糖稳态[5, 7-8]。
Akt是丝氨酸/苏氨酸蛋白激酶,可引起Ser/Thr磷酸化,参与肝脏组织的分化、生长,可调节胰岛素介导的糖代谢[12]。激活的Akt可促进肝细胞GK mRNA的表达[13]。本研究糖尿病模型大鼠实验结果表明,激活Akt可增强肝脏GK的表达。研究结果提示,uc.48 +小干扰RNA处理后,可增加Akt磷酸化激活,促进GK的表达增加、肝糖原合成,进而降低糖尿病模型大鼠升高的餐后血糖和空腹血糖。
总之,本研究发现uc.48 +小干扰RNA可降低2型糖尿病模型大鼠升高的血糖、增加肝糖原合成,其机制涉及增加GK的表达。
| [1] |
Li L, Sheng X, Zhao S H, et al. Nanoparticle-encapsulated emodin decreases diabetic neuropathic pain probably via a mechanism involving P2X3 receptor in the dorsal root ganglia[J]. Purinergic Signal, 2017, 13(4): 559-68. doi:10.1007/s11302-017-9583-2 |
| [2] |
Malecki M T. Type 2 diabetes mellitus and its complications: from the molecular biology to the clinical practice[J]. Rev Diabet Stud, 2004, 1(1): 5-8. doi:10.1900/RDS.2004.1.5 |
| [3] |
Peng H Y, Zou L F, Xie J Y, et al. lncRNA NONRATT021972 siRNA decreases diabetic neuropathic pain mediated by the P2X3 receptor in dorsal root ganglia[J]. Mol Neurobiol, 2017, 54(1): 511-23. doi:10.1007/s12035-015-9632-1 |
| [4] |
Whiting D R, Guariguata L, Weil C, et al. IDF diabetes atlas: global estimates of the prevalence of diabetes for 2011 and 2030[J]. Diabetes Res Clin Pract, 2011, 94(3): 311-21. doi:10.1016/j.diabres.2011.10.029 |
| [5] |
Song M M, Zou L F, Peng L C, et al. LncRNA NONRATT021972 siRNA normalized the dysfunction of hepatic glucokinase through AKT signaling in T2DM rats[J]. Endocr Res, 2017, 42(3): 180-90. |
| [6] |
左龙泉, 王欢, 汪应红, 等. 糖尿病高糖高脂对四氯化碳诱导的大鼠肝纤维化的作用研究[J]. 中国药理学通报, 2018, 34(4): 479-84. Zuo L Q, Wang H, Wang Y H, et al. Effect of diabetes on CCl4-induced rats liver fibrosis[J]. Chin Pharmacol Bull, 2018, 34(4): 479-84. doi:10.3969/j.issn.1001-1978.2018.04.009 |
| [7] |
Iynedjian P B. Molecular physiology of mammalian glucokinase[J]. Cell Mol Life Sci, 2009, 66(1): 27-42. doi:10.1007/s00018-008-8322-9 |
| [8] |
Haeusler R A, Camastra S, Astiarraga B, et al. Decreased expression of hepatic glucokinase in type 2 diabetes[J]. Mol Metab, 2015, 4(3): 222-6. doi:10.1016/j.molmet.2014.12.007 |
| [9] |
Wang S Y, Xu H, Zou L F, et al. LncRNA uc.48 + is involved in diabetic neuropathic pain mediated by the P2X3 receptor in the dorsal root ganglia[J]. Purinergic Signal, 2016, 12(1): 139-48. doi:10.1007/s11302-015-9488-x |
| [10] |
樊波, 徐昌水, 梁尚栋. 长非编码RNA与人类疾病调控机制的研究进展[J]. 中国药理学通报, 2013, 29(12): 1629-33. Fan B, Xu C S, Liang S D. Research development of long noncoding RNA related to the regulation mechenisms of human diseases[J]. Chin Pharmacol Bull, 2013, 29(12): 1629-33. doi:10.3969/j.issn.1001-1978.2013.12.001 |
| [11] |
Bejerano G, Pheasant M, Makunin I, et al. Ultraconserved elements in the human genome[J]. Science, 2004, 304(5657): 1321-5. |
| [12] |
Cho H, Thorvaldsen J, Chu Q, et al. Akt1/PKBalpha is required for normal growth but dispensable for maintenance of glucose homeostasis in mice[J]. J Biol Chem, 2001, 276(42): 38349-52. doi:10.1074/jbc.C100462200 |
| [13] |
Iynedjian P B, Roth R A, Fleischmann M, et al. Activation of protein kinase B/cAkt in hepatocytes is sufficient for the induction of expression of the gene encoding glucokinase[J]. Biochem J, 2000, 351(3): 621-7. doi:10.1042/bj3510621 |

