

2. 第四军医大学唐都医院心血管内科,陕西 西安 710032
2. Dept of Cardiology, Tangdu Hospital, Fourth Military Medical University, Xi′an 710032, China
药用植物绞股蓝具有多种药理学作用,由于其毒性小被国家允许用于保健食品,成为研究开发的热点[1]。绞股蓝发挥药理学作用的主要成分包括皂苷类、黄酮类、多糖类、氨基酸、维生素、微量元素等[2],其中皂苷类为其主要的药理学成分。已有研究报道,纯化的绞股蓝皂苷具有很好的抗氧化作用[3]。酒精性损伤的一个重要机制就是诱导活性氧(reactive oxygen species,ROS)产生氧化应激。ROS是一大类含氧自由基及其产物的总称,机体产生的ROS超出了抗氧化防御体系承受范围就产生了氧化应激,导致组织结构的氧化损伤,最终引起功能障碍和异常,诱导ROS产生是很多有毒有害物质的重要损伤机制。肝脏是代谢酒精的重要器官,也是酒精损伤的主要靶器官。前期已有研究发现,绞股蓝皂苷片可以改善临床脂肪肝患者肝脏功能[4],但绞股蓝皂苷对急性酒精肝脏氧化损伤是否有保护作用,以及其作用机制仍不清楚。因此,本研究采用小鼠急性酒精肝损伤模型,观察绞股蓝皂苷对小鼠酒精肝损伤的保护效果,并试图从氧化损伤角度探讨其作用的分子机制。
1 材料与方法 1.1 材料 1.1.1 实验动物SPF级♂8周龄BALB/c小鼠50只,体质量23~25 g,由第四军医大学实验动物中心提供,动物合格证号:SYXK(陕)2014-001。
1.1.2 药物与试剂绞股蓝总皂苷(98%)购自陕西中鑫生物有限公司;酒精(99.7%)购自天津市富宇精细化工有限公司;丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)、还原型谷胱甘肽(glutathione,GSH)试剂盒,均购自碧云天生物研究所;核因子E2相关因子2(nuclear factor erythroid-2-related factor 2,Nrf2)抗体(ab137550)、抗p65兔单抗(ab32536)、抗谷氨酸半胱氨酸连接酶调节亚基(glutamate-cysteine ligase regulatory subunit,GCLM)兔单抗(ab124827)、抗血红素加氧酶-1(heme oxygenase-1, HO-1)兔单抗(ab68477)、抗Lamin B兔单抗(ab133741),均购自Abcam公司;抗谷氨酸半胱氨酸连接酶催化亚基(glutamate-cysteine ligase catalytic subunit,GCLC)兔多抗(BS2926)、抗Tubulin兔多抗(BS1699),均购自Bioworld公司;核-浆提取试剂盒、辣根过氧化物酶标记的二抗、化学发光液,均购自Thermo公司。
1.1.3 仪器高速冷冻离心机(Eppendorf公司);酶标仪(TECAN公司);蛋白电泳仪、转膜仪、凝胶成像系统(Bio-Rad公司)。
1.2 方法 1.2.1 动物分组、模型制备及给药处理将实验动物随机分为5组,分别为对照组、酒精肝损伤模型组、绞股蓝皂苷低、中、高剂量组。每日上午绞股蓝皂苷组分别灌胃给予50、100、200 mg·kg-1绞股蓝皂苷,连续4 d后,从d 5开始,除了上午给予绞股蓝皂苷外,每日下午模型组和各绞股蓝皂苷保护组给予50%酒精灌胃,剂量为12.67 mL·kg-1,相当于酒精的剂量为5 g·kg-1,连续灌胃3 d,共灌胃酒精3 d。至最后一次灌胃4 h后处死实验动物,取动物全血和肝脏组织进行后续相应指标检测。
1.2.2 谷丙转氨酶(alanine transaminase,ALT)、谷草转氨酶(aspartate transaminase,AST)、总胆固醇(total cholesterol,TC)和甘油三酯(triglyceride,TG)的检测处死实验动物,取外周血分离血清,采用全自动生化分析仪检测ALT、AST、TC和TG的水平。
1.2.3 实时荧光定量PCR法检测肿瘤坏死因子α(tumor necrosis factor α,TNF-α)和白介素6(interleukin 6,IL-6)mRNA水平采用TRIzol方法提取肝组织总RNA,常规定量后反转录得到cDNA,进行定量PCR检测TNF-α和IL-6。PCR反应条件:95 ℃ 10 min,(95 ℃ 30 s、60 ℃ 30 s、72 ℃ 30 s)×45个循环。以β-actin为参照,进行mRNA的相对定量分析。2-△△Ct表示目的基因相对于内参基因的表达量。引物序列见Tab 1。
| Gene | Forward | Reverse |
| TNF-α | 5'-AGCCACACCCACAACCTTAG-3' | 5'-TTTCACCCACAGGGAGTAGG-3' |
| IL-6 | 5'-TAAGGCTGCTTTTGCCACTT-3' | 5'-AAGACCCTGCTGGAACAAGA-3' |
| β-actin | 5'-CCTGTATGCCTCTGGTCGTA-3' | 5 '-CCATCTCTTGCTCGAAGTCT-3 ' |
取肝组织,用生理盐水制成10%的肝组织匀浆,蛋白定量后,按照试剂盒说明书进行相关指标检测。
1.2.5 Western blot检测抗氧化相关通路及蛋白肝组织总蛋白和核蛋白分别采用碧云天试剂盒和Thermo核-浆提取试剂盒,按照说明书进行分离提取,BCA法进行蛋白定量。常规聚丙烯酰胺凝胶蛋白电泳,转膜,室温5%牛奶封闭2 h后,加入相应一抗4 ℃摇床过夜。次日TBST充分洗膜后,加入相应的辣根过氧化物标记的二抗,室温孵育2 h后,TBST充分洗膜后,滴加化学发光液发光、拍照并采用Quantity One软件进行量化分析。
1.2.6 统计学分析实验数据采用SPSS 25.0软件进行方差分析,应用LSD检验进行组间的两两比较。
2 结果 2.1 绞股蓝皂苷对酒精性肝损伤小鼠肝脏功能的影响肝损伤会伴随着肝细胞的破坏,导致血清学指标的明显改变,ALT、AST、TC和TG是常用的反映肝损伤的肝功能指标。Tab 2的小鼠血清学检测结果发现,酒精损伤模型组ALT、AST、TC、TG明显升高(P < 0.05);与模型组比较,给予不同剂量绞股蓝皂苷保护的小鼠上述指标明显降低(P < 0.05),并且呈现一定的剂量效应关系。提示绞股蓝皂苷对酒精性肝损伤具有保护作用。
| Group | Dose/mg·kg-1 | ALT/U·L-1 | AST/U·L-1 | TC/mmol·L-1 | TG/mmol·L-1 |
| Control | - | 31.20±5.82 | 62.10±11.31 | 1.24±0.23 | 0.63±0.22 |
| Model | - | 95.30±10.18* | 133.80±16.67* | 2.85±0.32* | 2.61±0.23* |
| GPs | 50 | 70.60±9.31# | 108.30±15.52# | 2.51±0.25# | 2.09±0.25# |
| 100 | 58.60±7.28# | 96.40±14.36# | 2.08±0.27# | 1.88±0.21# | |
| 200 | 46.70±8.37# | 78.10±12.49# | 1.79±0.23# | 1.25±0.24# | |
| *P < 0.05 vs control; #P < 0.05 vs alcohol model | |||||
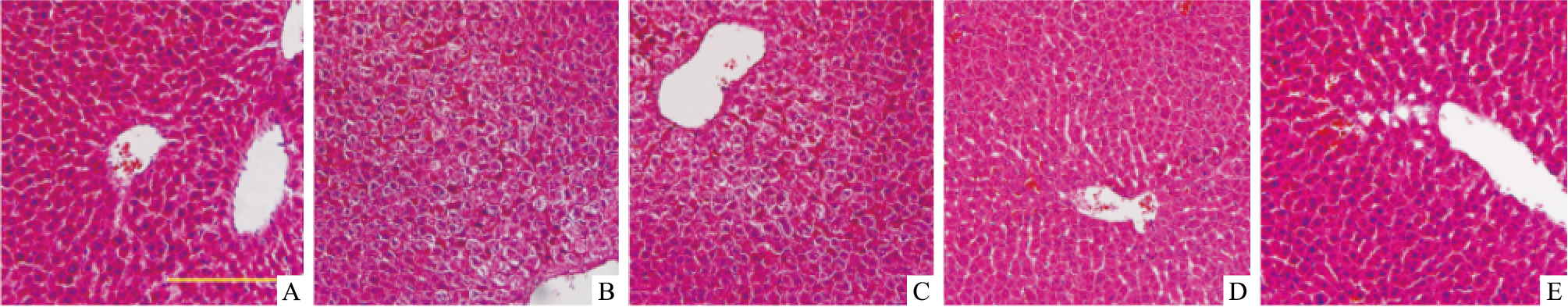
Fig 1的HE染色结果显示,正常对照组肝小叶结构完整、清楚,肝索呈放射状排列,肝细胞核清晰。酒精模型组肝细胞排列紊乱,肝细胞间隙不清,胞质淡染、出现水肿现象,可见局部变性坏死。给予不同剂量的绞股蓝皂苷可以有效抑制这些肝细胞损伤的形态学改变,呈现一定的剂量依赖的保护作用。
|
| Fig 1 Effect of gypenosides on pathological changes of liver of alcohol-treated mice(scale bar=200 μm) A:Control; B:Alcohol; C:Alcohol+50 mg·kg-1 GPs; D:Alcohol+100 mg·kg-1 GPs; E:C:Alcohol+200 mg·kg-1 GPs |
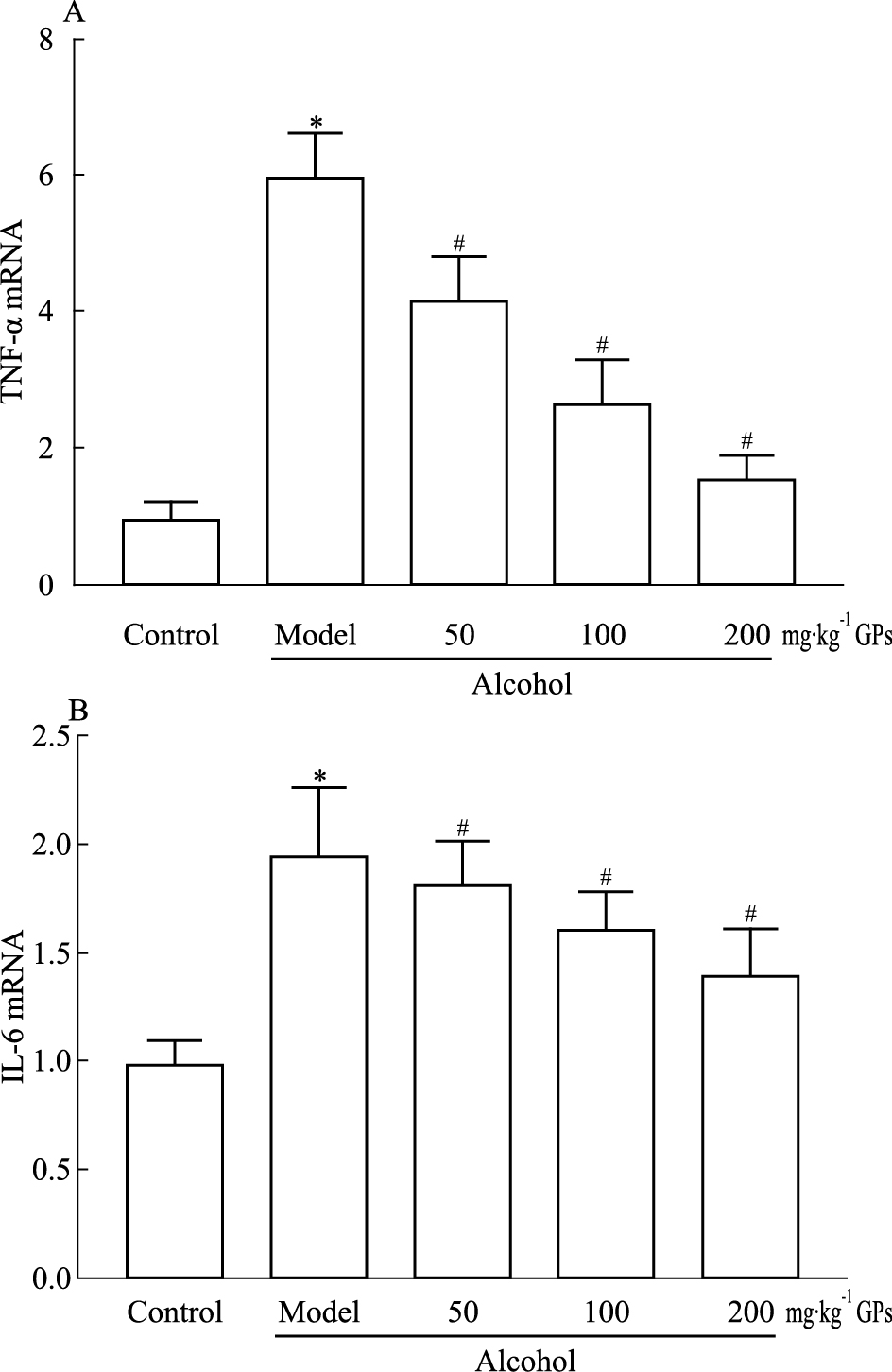
炎症在肝损伤中发挥重要作用,为此我们检测了两个代表性的炎症因子TNF-α和IL-6[5-6]。如Fig 2所示,与对照组比较,酒精性肝损伤小鼠肝组织内TNF-α和IL-6水平明显升高(P < 0.05),不同剂量绞股蓝皂苷能够有效降低酒精引起的TNF-α和IL-6水平的升高(P < 0.05)。提示绞股蓝皂苷可能通过降低炎症因子TNF-α和IL-6的分泌,发挥保护作用。
|
| Fig 2 Effect of gypenosides on TNF-α(A) and IL-6(B) mRNA expression in liver of alcohol-treated mice(x±s, n=10) *P < 0.05 vs control group; #P < 0.05 vs alcohol model group |
MDA是重要的氧化损伤产物,也是检测氧化损伤的常用指标[7]。Tab 3结果表明,给予酒精后可以明显提高肝组织MDA水平(P < 0.05),同时给予绞股蓝皂苷能够有效降低酒精引起的肝脏MDA水平升高(P < 0.05)。机体有一整套抗氧化体系能够清除ROS,减轻氧化应激,其中SOD、CAT和GSH是抗氧化体系的重要组成部分。Tab 3结果表明,酒精性肝损伤能够明显降低SOD、CAT、GSH的活性和水平(P < 0.05),而绞股蓝皂苷能够明显逆转这些被酒精抑制的抗氧化酶的活性和水平(P < 0.05),并且随着剂量增加效果更加明显。提示绞股蓝皂苷能够明显提高抗氧化酶的活性,减轻酒精引起的氧化损伤。
| Group | Dose/mg·kg-1 | MDA/nmol·g-1 Pro | SOD/kU·g-1 Pro | CAT/ kU·g-1 Pro | GSH/μmol·g-1 Pro |
| Control | - | 110.65±13.54 | 26.74±2.31 | 1.96±0.13 | 28.41±2.24 |
| Model | - | 190.43±18.26* | 16.58±2.44* | 1.38±0.17* | 19.56±2.84* |
| GPs | 50 | 170.69±17.64# | 20.19±2.35# | 1.51±0.15# | 23.57±2.51# |
| 100 | 155.61±16.56# | 22.44±2.76# | 1.77±0.16# | 25.19±2.33# | |
| 200 | 136.38±15.32# | 24.23±2.77# | 1.85±0.15# | 26.47±2.66# | |
| *P < 0.05 vs control; #P < 0.05 vs alcohol model | |||||
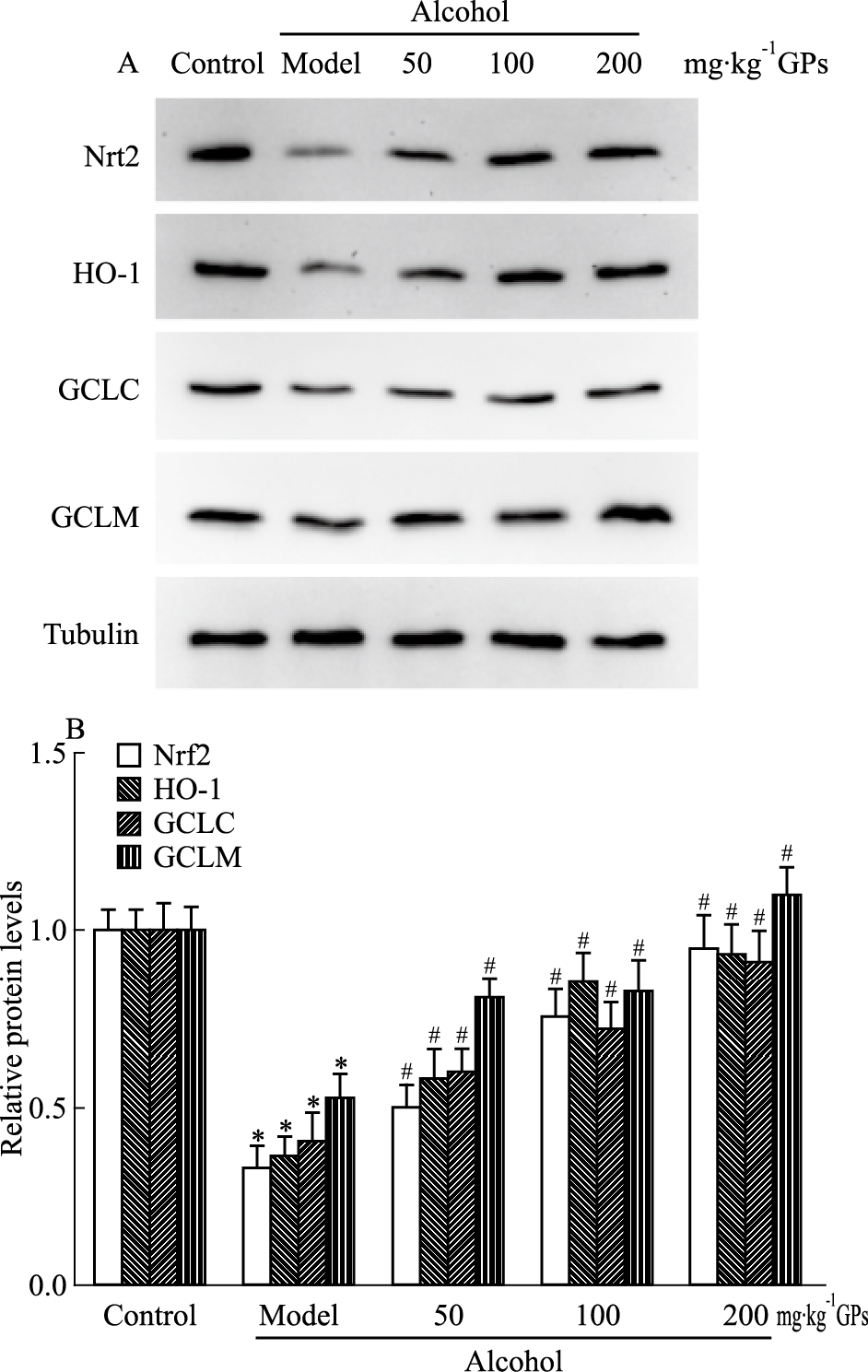
Nrf2是抗氧化防御体系上游的重要调控转录因子,调控着上百种抗氧化及解毒相关蛋白的转录表达[8]。如Fig 3所示,酒精性肝损伤能够明显降低Nrf2的蛋白水平(P < 0.05),进一步检测Nrf2调控的下游代表性抗氧化蛋白表达变化,发现下游抗氧化蛋白HO-1、GCLC和GCLM的表达水平明显降低(P < 0.05),表明酒精性肝损伤可以明显抑制Nrf2信号通路。不同剂量绞股蓝皂苷能够剂量依赖地提高Nrf2蛋白及其调控的下游靶蛋白HO-1、GCLC和GCLM蛋白水平(P < 0.05)。提示绞股蓝皂苷可以有效激活Nrf2信号通路,提高抗氧化体系能力。
|
| Fig 3 Effect of gypenosides on Nrf2, HO-1, GCLC and GCLM protein levels in liver of alcohol-treated mice *P < 0.05 vs control group; #P < 0.05 vs alcohol model group |
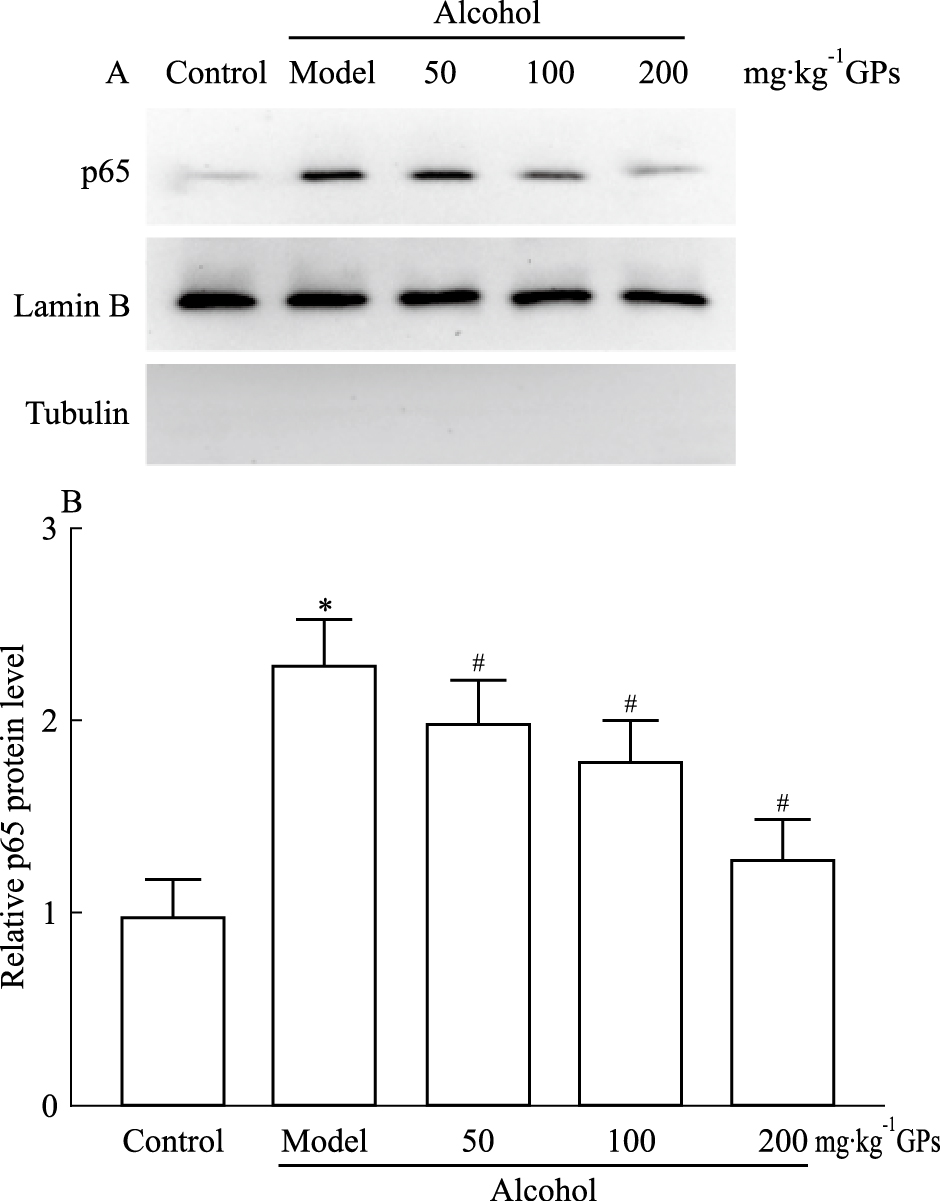
转录因子NF-κB是受氧化应激调控的重要转录因子,介导了众多炎症因子的转录表达[9]。NF-κB正常情况下存在胞质中,受到氧化应激等信号激活,会解离掉抑制亚基IкB,功能亚基如p65亚基转位到细胞核中,发挥转录调节作用。Fig 4结果表明,酒精性肝损伤可以引起明显的p65核转位(P < 0.05),不同剂量绞股蓝皂苷干预可以有效抑制p65的核转位(P < 0.05),并且呈现一定的剂量效应关系。提示绞股蓝皂苷可以有效地抑制酒精引起的转录因子NF-κB的细胞核转位,发挥抗炎作用。
|
| Fig 4 Effect of gypenosides on p65 nuclear translocation in liver of alcohol-treated mice *P < 0.05 vs control group; #P < 0.05 vs alcohol model group |
绞股蓝由于具有调节三高、抗衰老、抗肿瘤等多种药理学作用,加之其毒性小,近年来备受关注。绞股蓝中的主要药理成分为达玛烷型皂苷类,研究发现其具有很好的抗氧化作用[3]。酒精性肝损伤机制研究历史悠久,氧化应激是其中最重要机制之一[10]。氧化应激是各种内外因素引起的ROS产生量超过了抗氧化防御体系所能及时清除的范围,导致氧化-抗氧化失衡,从而造成氧化损伤。所以我们推测,绞股蓝皂苷很可能对酒精性肝损伤有保护作用。我们采用成熟的急性酒精性小鼠肝损伤模型,结果表明,酒精可以引起小鼠肝损伤血清学指标ALT、AST、TC和TG明显升高,炎症因子TNF-α、IL-6 mRNA表达水平也随之明显上升,而绞股蓝皂苷干预对这些损伤和炎症指标有很好的拮抗作用,说明绞股蓝皂苷对酒精肝损伤具有很好的保护作用。
为了探讨氧化应激在绞股蓝皂苷抗酒精肝损伤中的作用,我们进一步检测了氧化损伤产物及抗氧化酶的改变。结果表明,酒精可以引起肝组织氧化损伤指标MDA增加,同时降低抗氧化酶活性和水平,表明酒精性肝损伤可以引起氧化应激,而绞股蓝皂苷干预可以剂量依赖地降低MDA水平,提高SOD、CAT和GSH的活性和水平,提示绞股蓝皂苷很可能通过提高抗氧化酶的活性和水平,减轻酒精引起的氧化损伤。绞股蓝皂苷如何提高抗氧化酶的活性和水平并不清楚。在这些抗氧化酶上游的调控因子中,Nrf2是非常重要的转录因子,在维持机体的抗氧化体系中发挥着不可或缺的重要作用[11-12]。为此,我们进一步检测了Nrf2蛋白水平,以及其直接调控下游抗氧化因子HO-1、GCLC和GCLM水平。结果发现,酒精损伤可以明显降低Nrf2及其下游的HO-1、GCLC、GCLM蛋白水平,而绞股蓝皂苷能够剂量依赖地提高Nrf2及其下游的抗氧化蛋白水平。说明酒精损伤能够破坏Nrf2转录功能,而绞股蓝皂苷能够通过恢复Nrf2转录功能,提高抗氧化蛋白的表达,从而提高抗氧化防御体系能力,发挥抗酒精性肝氧化损伤作用。
那么氧化应激是通过何种机制诱导炎症损伤的呢?大量研究表明,NF-κB是能够被氧化应激激活的重要炎症转录调控因子[13]。正常情况下,NF-κB由多个亚基组成复合物存在于胞质中,只有受到诸如氧化应激等信号刺激时,复合物中的抑制亚基IкB解离掉,释放出其他功能亚基转位到细胞核中,发挥转录活性,调控包括TNF-α和IL-6在内的众多炎症因子的转录和表达[14-15]。为此,我们检测了代表性的功能亚基p65的核转位情况,结果发现,酒精能够导致p65大量聚集在细胞核中,而绞股蓝皂苷能够明显抑制p65在细胞核内的聚集,有效抑制NF-κB的核转位,从而发挥抗炎症损伤作用。
综上所述,本研究证明绞股蓝皂苷具有很好的抗酒精性肝氧化损伤作用,其很可能一方面通过激活Nrf2信号通路,提高抗氧化防御体系水平,减轻酒精性肝氧化损伤;另一方面通过抑制NF-κB的核转位,降低以TNF-α和IL-6为代表的炎症因子的表达,抑制炎症反应,从而发挥对酒精性肝损伤的保护作用。
| [1] |
鲍凤霞, 陶泠雪, 章海燕. 绞股蓝有效成分的药理作用研究进展[J]. 中国新药与临床杂志, 2018, 37(1): 11-7. Bao F X, Tao L X, Zhang H Y. Research progress on pharmacological effects of Gynostemma pentaphyllum active ingredients[J]. Chin J New Drugs Clin Rem, 2018, 37(1): 11-7. |
| [2] |
范冬冬, 匡艳辉, 向世勰, 等. 绞股蓝化学成分及其药理活性研究进展[J]. 中国药学杂志, 2017, 52(5): 342-52. Fan D D, Kuang Y H, Xiang S X, et al. Research progress in chemical constituents and pharmacological activities of gynostemma pentaphyllum[J]. Chin Pharm J, 2017, 52(5): 342-52. |
| [3] |
张猛猛, 田冰洁, 洪秀云, 等. 纯化的绞股蓝皂苷的抗氧化活性研究[J]. 生物技术, 2013, 23(1): 76-8. Zhang M M, Tian B J, Hong X Y, et al. Antioxidative activity of gypenosides purified[J]. Biotechnology, 2013, 23(1): 76-8. doi:10.3969/j.issn.1004-311X.2013.01.021 |
| [4] |
任哲, 任江南. 绞股蓝对非酒精性脂肪肝和酒精性脂肪肝血清生化指标的疗效[J]. 转化医学杂志, 2013, 2(3): 143-9. Ren Z, Ren J N. A clinical comparison with the efficacy of Gyrenosides for non-alcoholic and alcoholic fatty liver disease on blood biochemical index[J]. Transl Med J, 2013, 2(3): 143-9. doi:10.3969/j.issn.2095-3097.2013.03.004 |
| [5] |
Kawaratani H, Moriya K, Namisaki T, et al. Therapeutic strategies for alcoholic liver disease: focusing on inflammation and fibrosis[J]. Int J Mol Med, 2017, 40(2): 263-70. doi:10.3892/ijmm.2017.3015 |
| [6] |
Schmidt-Arras D, Rose-John S. IL-6?pathway in the liver: from physiopathology to therapy[J]. J Hepatol, 2016, 64(6): 1403-15. doi:10.1016/j.jhep.2016.02.004 |
| [7] |
Tsikas D. Assessment of lipid peroxidation by measuring malondialdehyde(MDA) and relatives in biological samples: analytical and biological challenges[J]. Anal Biochem, 2017, 524: 13-30. doi:10.1016/j.ab.2016.10.021 |
| [8] |
Bellezza I, Giambanco I, Minelli A, et al. Nrf2-Keap1 signaling in oxidative and reductive stress[J]. Biochim Biophys Acta, 2018, 1865(5): 721-33. doi:10.1016/j.bbamcr.2018.02.010 |
| [9] |
Pires B R B, Silva R C M C, Ferreira G M, Abdelhay E. NF-kappaB: two sides of the same coin[J]. Genes(Basel), 2018, 9(1): 24. |
| [10] |
Sugimoto K, Takei Y. Pathogenesis of alcoholic liver disease[J]. Hepatol Res, 2017, 47(1): 70-9. doi:10.1111/hepr.v47.1 |
| [11] |
Tonelli C, Chio I I C, Tuveson D A. Transcriptional regulation by Nrf2[J]. Antioxid Redox Signal, 2017, 7342. |
| [12] |
曹玲娟, 龚慧, 颜苗, 等. Nrf2-ARE信号通路参与肝脏疾病病理机制研究进展[J]. 中国药理学通报, 2015, 31(8): 1057-61. Cao L J, Gong H, Yan M, et al. Research progress on Nrf2-ARE signaling pathway involved in liver disease pathological mechanism[J]. Chin Pharmacol Bull, 2015, 31(8): 1057-61. doi:10.3969/j.issn.1001-1978.2015.08.006 |
| [13] |
Kaur U, Banerjee P, Bir A, et al. Reactive oxygen species, redox signaling and neuroinflammation in Alzheimer′s disease: the NF-κB connection[J]. Curr Top Med Chem, 2015, 15(5): 446-57. doi:10.2174/1568026615666150114160543 |
| [14] |
Mitchell S, Vargas J, Hoffmann A. Signaling via the NF-κB system[J]. Wiley Interdiscip Rev Syst Biol Med, 2016, 8(3): 227-41. doi:10.1002/wsbm.1331 |
| [15] |
周志勇, 陈亚昕, 李德鸿, 等. 竹节参总皂苷通过抑制NF-κB介导的炎性反应改善小鼠肿瘤恶病质研究[J]. 中国药理学通报, 2018, 34(4): 532-7. Zhou Z Y, Chen Y X, Li D H, et al. Total saponins of Panax japonicus improve cancer cachexia in mice through inhibiting inflammatory response mediated by NF-κB[J]. Chin Pharmacol Bull, 2018, 34(4): 532-7. doi:10.3969/j.issn.1001-1978.2018.04.019 |

