

脑卒中是由于脑部血管突然阻塞或破裂,导致血液不能进入大脑相应组织,引起的因缺血、缺氧导致的一类脑部疾病。据最新统计,我国卒中患者总数以及死亡率已经跃居世界第一[1]。阿替普酶(r-tPA)自1996年问世以来,仍然是全球唯一公认的临床上最有效的溶栓治疗药物。然而,由于狭窄的时间窗(4.5 h内),以及潜在的出血风险和炎性细胞毒副反应,其溶栓率在发达国家不到10%,而国内的使用率还不到1.5%[1]。因此,开拓针对急性缺血性脑卒中新的治疗手段成为了一项巨大和迫切的临床需求。
缺血性脑损伤病理生理十分复杂,是一个多信号通路同时激活,导致神经细胞死亡的过程。在此过程中,免疫细胞和神经细胞的活化是触发缺血后炎症反应的关键因素。临床治疗中,把溶栓疗法与其他神经保护制剂联用,以减少r-tPA使用过程中出现的再灌注损伤,并且延长溶栓治疗窗已成为当今卒中治疗新的探索方向,也有可能成为未来卒中治疗的主要手段[2],其中溶栓法与抗炎症神经保护剂联用的研究进展最为引人瞩目。近期,1项由200名急性缺血性卒中患者参与的前瞻性临床研究证明,三七总皂苷(Panax Notoginseng saponins,PNS)与r-tPA联用不但降低了溶栓过程中患者的出血性转化风险,而且联合治疗组患者在12个月后随访调查预后更好[3],该研究表明PNS可用于卒中的抢救治疗。本研究采用凝血酶致大鼠脑缺血模型,考察了r-tPA、PNS联用对模型动物脑损伤的神经保护作用,证实两药联用可以明显减少卒中动物的脑损伤和神经功能评分。
1 材料与方法 1.1 试剂与仪器红四氮唑(TTC)购于国药集团化学试剂公司; 凝血酶(Lot:T4648)、Percoll(Lot:P4937)、胶原蛋白酶(Type XI,Lot:C7657;TypeI-S,Lot:C1639)、透明质酸酶(Lot:H1115000)、Dulbecco磷酸盐缓冲液(DPBS,Lot:D8662)、细胞筛(Lot:Z742103)、脂多糖(lipopolysaccharides,LPS,Lot:025M4040V),均为Sigma公司产品; 小鼠F4/80荧光抗体,购于BD公司; DMEM高糖培养基、胎牛血清,购于BI公司; PNS由昆药集团股份有限公司提供; 阿替普酶(批号:705546)购自勃林格殷格翰; 依达拉奉注射液(批号:618160521),南京先声东元制药有限公司产品; 泊马度胺(pomalidomide,Lot:S156703)购自Selleck公司; 小鼠TNF-α ELISA试剂盒(Lot:228271215)、小鼠IL-6 ELISA试剂盒(Lot:220680144)购于联科生物。Biofuge冷冻高速离心机(Thermo公司); Adventurer天平(奥豪斯仪器上海有限公司); 多功能酶标仪(BioTek公司); Accuri C6流式细胞仪(BD公司)。
1.2 动物模型的制备与分组处理 1.2.1 线栓法致大鼠局灶性脑缺血模型健康SD大鼠,♂,体质量(260±20)g,由上海斯莱克实验动物有限公司提供,动物生产许可证号为SCXK(沪)2012-0002。按体质量分为4组,分别为阴性对照组、阳性对照组(依达拉奉注射液5 mg·kg-1,再灌时静脉注射给药)、PNS 10 mg·kg-1(再灌注时静脉注射给药)组、PNS 10 mg·kg-1(再灌注前10 min静脉注射给药)组。参照文献[4]的方法,制备缺血/再灌模型,并于缺血后24 h,对缺血大鼠进行行为学评分:无神经功能损伤,双前肢对称向地面伸展(0分); 对侧前肢持续内收(1分); 对侧前肢握力下降(2分); 轻微刺激大鼠尾巴,向对侧转圈(3分); 自主持续转圈(4分)。造模24 h后,迅速处死大鼠并断头取脑,将大脑平均冠状切为5片,放于TTC溶液中,37℃温育5~10 min染色。梗死区不着色,正常脑组织染成红色。拍照后,用Image J软件统计全脑片与梗死区面积,计算梗死百分率。
1.2.2 凝血酶致大鼠局灶性脑缺血模型凝血酶致大鼠局灶性脑缺血模型制作过程,参照郝春华等[5]报道方法,简述如下。健康♂SD大鼠,分为5组,分别为假手术组、模型组、缺血后3 h给药组(分别为r-tPA组、r-tPA+PNS 10 mg·kg-1组、r-tPA+PNS 40 mg·kg-1组),将大鼠以12%的水合氯醛腹腔注射麻醉(360 mg·kg-1)后,仰卧固定于手术台上。室温维持在25℃左右。切开右侧颈部皮肤,分离、结扎右侧颈总动脉、颈外动脉及其分支动脉。分离右侧颈总、颈内及颈外动脉,至鼓泡处可见其颅外分支翼腭动脉,根部结扎该分支。在颈外动脉远端结扎备线、放置动脉夹,颈外动脉拉直后在分叉处切口,插入改造过的充满凝血酶(5 U·μL-1)的PE-50管,管较粗端连接微量注射器,将PE-50管细端预先吸入4 μL凝血酶,然后经颈外动脉、颈内动脉插入至大脑中动脉(middle cerebral artery,MCA)起始端附近,回抽10 μL动脉血并留置10 min,后将血栓及凝血酶一起推入血管,留置导管至15 min后拔出。扎紧备线并缝合皮肤,并将手术大鼠分笼饲养。各实验组分别于缺血后3 h静脉注射给药,给药体积为2 mL·kg-1。术后24 h断头取脑,将大脑平均冠状切为5片,放于TTC溶液中,37℃温育5~10 min染色,随后拍照统计。
1.3 流式细胞术检测线栓法致小鼠局灶性脑缺血梗死侧大脑巨噬细胞的聚集健康ICR小鼠,♂,体质量(27±1)g,由昆药集团提供,动物生产许可证号为SCXK (滇)K2014-0001。根据体质量均匀分为3组,分别为假手术组、模型组、PNS 70 mg·kg-1组(再灌同时静脉注射给药)。参照文献[6]的方法制备缺血/再灌模型,并于24 h后迅速处死小鼠,取出大脑,分离左右半脑,取右脑以DPBS冲洗后,按照文献[7]的方法得到大脑单细胞混悬液,计数后,调整细胞浓度为1×109·L-1。随后加入1 mL含1%胎牛血清的DPBS,以1 000 r·min-1离心5 min,去上清后,剩余约100 μL细胞混悬液,随即加入小鼠F4/80荧光抗体,于4℃避光孵育20 min。再加入1 mL含1%胎牛血清的DPBS,1 000 r·min-1离心5 min,洗去残留抗体,去上清后,剩余约500 μL细胞混悬液,加2%的多聚甲醛固定。用流式细胞仪检测,每个样品检测1×105个细胞。
1.4 巨噬细胞/小胶质细胞LPS刺激实验取对数生长期的RAW264.7和BV-细胞(细胞株均来源于中国科学院昆明细胞库),调整细胞密度为2×108·L-1,每孔100 μL接种于96孔培养板,待细胞贴壁后,进行实验,具体分组为RAW264.7细胞:空白对照组、LPS(0.1 mg·L-1)处理组、LPS(0.1 mg·L-1)+PNS(100 mg·L-1)处理组、LPS(0.1 mg·L-1)+泊马度胺(0.1 μmol·L-1)处理组; BV-细胞:空白对照组、LPS(0.5 mg·L-1)处理组、LPS(0.5 mg·L-1)+PNS(100 mg·L-1)处理组、LPS(0.5 mg·L-1)+泊马度胺(0.1 μmol·L-1)处理组,泊马度胺为阳性药。各组处理24 h后,收集培养上清液,按照ELISA试剂盒说明书检测TNF-α和IL-6的水平。
1.5 统计学方法采用GraphPad 7.0软件进行数据处理与分析,实验数据以x±s表示。动物实验“1.2”数据用单因素方差分析,组间比较采用Fisher LSD分析。体外实验数据分析采用t检验。
2 结果 2.1 不同时间给予PNS对线栓法致局灶性脑缺血模型大鼠的影响造模后,大鼠出现明显的行为学缺陷,同时出现明显的脑组织坏死,表明造模成功(Tab 1、Fig 1)。再灌注后,立即尾静脉给予PNS(10 mg·kg-1)对大鼠的行为学评分及脑梗死百分率都有明显的降低作用(P < 0.01)。为了探讨PNS对卒中损伤的预防性治疗效果,再灌注前10 min尾静脉给予PNS(10 mg·kg-1),结果表明,预防给药组大鼠的行为学评分及脑梗死面积有明显的改善(P < 0.05)。阳性对照药依达拉奉注射液(5 mg·kg-1)可明显降低大鼠的行为学评分及脑梗死百分率(P < 0.05,P < 0.01)。
| Group | n | Dose/mg·kg-1 | Infarct volume/% | Neurological defects score |
| Model | 6 | - | 17.39±7.59 | 2.7±0.8 |
| PNS | 11 | 10(at the time of reperfusion) | 6.01±2.58** | 1.5±0.7** |
| 7 | 10(10 min prior to reperfusion) | 9.99±5.27* | 1.7±0.8* | |
| Edaravone | 7 | 5 | 9.13±5.32** | 1.7±0.8* |
| *P < 0.05,**P < 0.01 vs model group | ||||
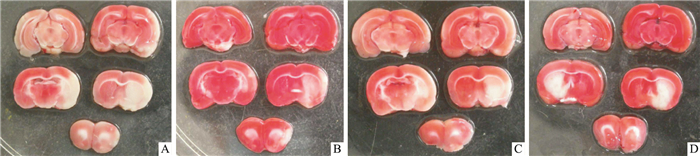
|
| Fig 1 Protectiveon effect of PNS on infarct volume in the ischemia-reperfusion rats A:Model; B:PNS 10 mg·kg-1 (at the time of reperfusion); C:PNS 10 mg·kg-1 (10 min prior to reperfusion); D:Edaravone(5 mg·kg-1). |
为了探讨PNS与r-tPA联用减少卒中后再灌注损伤的机制,建立了与临床相关度较高的凝血酶致大鼠局灶性脑缺血模型。造模后,大鼠有明显的行为学缺陷,同时出现了明显的脑组织坏死,表明造模成功(Tab 2、Fig 2)。缺血后3 h尾静脉给予r-tPA,对大鼠的行为学评分及脑梗死百分率都有明显的降低作用(P < 0.05),表明通过r-tPA启动的溶栓作用使血栓溶解,并实现了再灌; r-tPA联合PNS低剂量组(10 mg·kg-1)可降低大鼠的脑梗死百分率及行为学评分,但与r-tPA组比较差异无显著性(P>0.05)。然而,r-tPA联合PNS高剂量组(40 mg·kg-1)明显降低了大鼠的行为学评分及脑梗死百分率(P < 0.01),且与r-tPA单独使用组相比,脑梗死面积有进一步减少的趋势(P=0.073)。
| Group | n | Dose/mg·kg-1 | Infarct volume/% | Neurological defects score |
| Sham | 10 | - | 0.00±0.00 | 0.0±0.0 |
| Model | 8 | - | 25.49±10.47## | 2.8±1.0## |
| r-tPA(3 h) | 8 | 9 | 15.22±7.80* | 1.8±0.7* |
| r-tPA+PNS(3 h) | 8 | 9+10 | 16.89±8.48 | 2.1±0.8 |
| r-tPA+PNS(3 h) | 8 | 9+40 | 7.21±3.55** | 1.4±0.5** |
| ##P < 0.01 vs sham group; *P < 0.05, **P < 0.01 vs model group | ||||
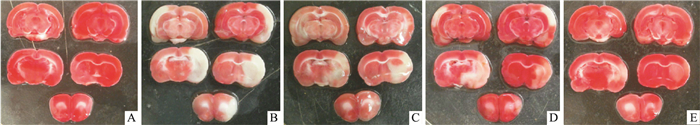
|
| Fig 2 Protective effect of PNS combined with r-tPA on infarct volume in the ischemia-reperfusion rats A:Sham; B:Model; C:r-tPA(3 h); D:r-tPA + PNS 10 mg·kg-1 (3 h); E:r-tPA + PNS 40 mg·kg-1 (3 h). |
在小鼠脑梗模型中,流式细胞术检测发现,与假手术组相比,模型鼠梗死侧大脑巨噬细胞的数量明显增加,而给予70 mg·kg-1 PNS后,巨噬细胞数量呈下降趋势(Fig 3)。表明PNS有降低巨噬细胞向受损脑组织浸润的抗炎作用。
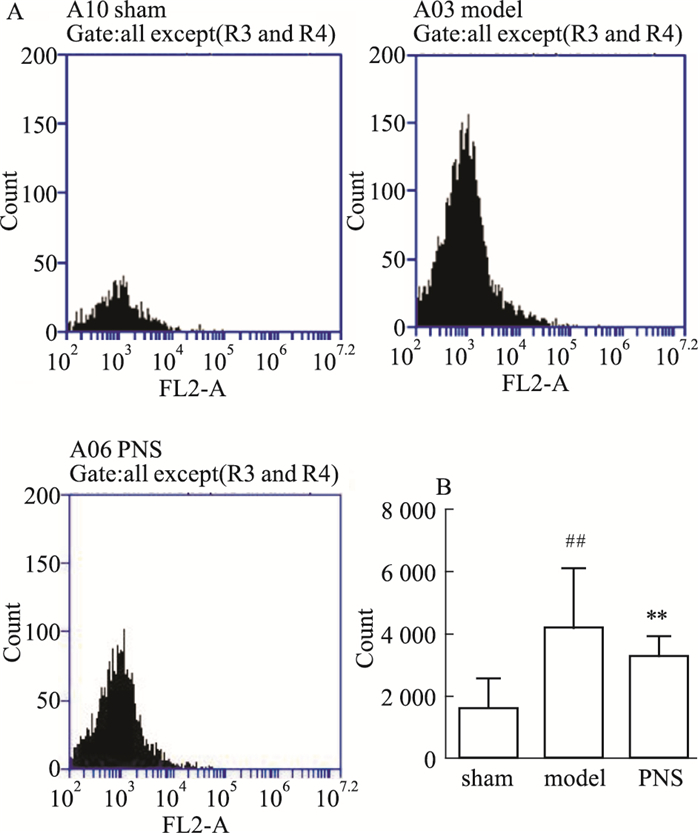
|
| Fig 3 Assessment of macrophage infiltration in mice ischemic brain(x±s, n=6) A:The result of flow cytometry; B:Bar graph of flow cytometry results. ##P < 0.01 vs sham group; **P < 0.01 vs model group. |
大量研究表明,体内巨噬细胞和小胶质细胞激活,是引发卒中性脑部炎症反应的第一步,因此,研究巨噬细胞和小胶质细胞体外的激活与抑制,成为探索炎症反应体内机制的基本手段。本研究采用PNS预处理与LPS诱导巨噬细胞(RAW264.7)和小胶质细胞(BV-)分泌炎性因子的方法,探索PNS对两种细胞的调节作用。Fig 4结果表明,PNS对巨噬细胞和小胶质细胞表达TNF-α和IL-6能力有明显的抑制作用。
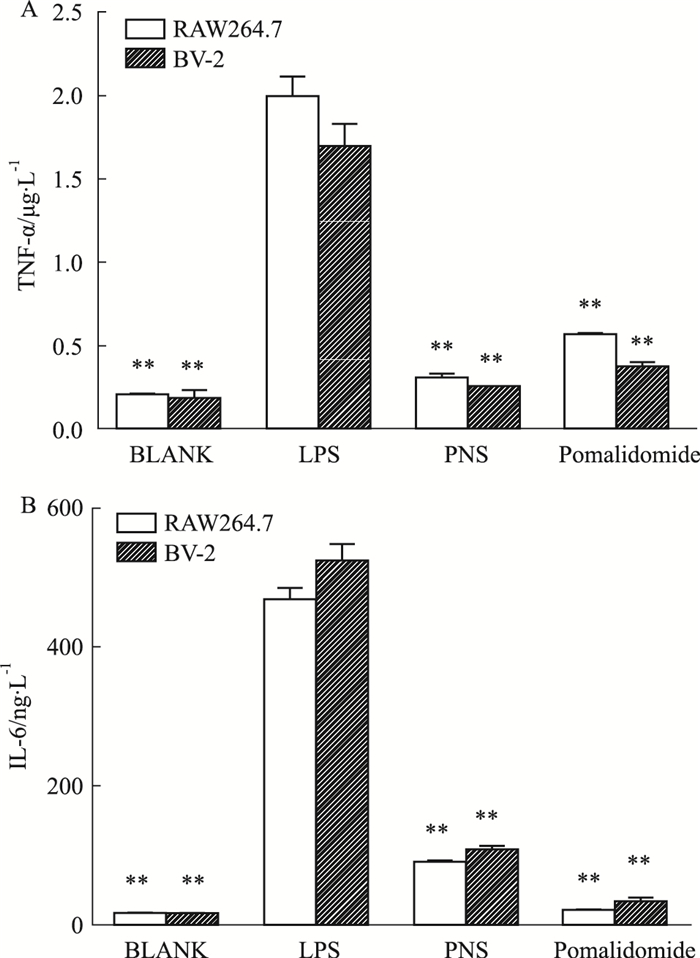
|
| Fig 4 Inhibitory effects of PNS on LPS-mediated pro-inflammatory cytokines TNF-α(A) and IL-6(B) releases in RAW264.7 cells and BV- cells(x±s, n=3) **P < 0.01 vs LPS group |
神经血管单元(neurovascular unit,NVU)是一个近期提出的描述大脑组织与周边微环境的概念[8]。NVU由微血管、神经胶质细胞、神经元、神经元轴突及胞外基质构成。这一理论为解读卒中过程中的病理过程,以及研究参与这一病理过程中各种组织变化,提供了理论基础,同时也逐渐成为卒中急救过程中的临床指导。基于这一理论,中风的干预性治疗主要涉及两个过程,即血管和神经两部分。前者是尽快实现再灌注,即溶栓或介入取栓治疗; 而后者则是阻断缺血/再灌引发的级联反应以降低脑损伤,即神经保护治疗。在临床上,为了获得对卒中患者最大的治疗效益,在使用溶栓法实现再灌基础上,尽早实施神经保护将是一种理性的治疗方案。
PNS的神经保护机制已有大量的阐述,其中主要集中在抗氧化、抗血管损伤、抗血小板聚集等方面的研究。近期人们把研究的目光聚焦在PNS的免疫调节与抗炎机制方面。有研究提示,PNS可能通过抑制NF-κB激活,降低细胞间黏附分子1(intercellular adhesion molecule 1,ICAM-1)在中性粒细胞表达,以减少中性粒细胞浸润反应,从而保护由心肌缺血/再灌注引起的损伤[9-10]。Wang等[11]发现,PNS的神经保护作用可能是基于对巨噬细胞Toll样受体(Toll-like receptor,TLR)通路的直接抑制。PNS主要由5种皂苷单体构成(R1、Rb1、Rg1、Re、Rd),其中的Rb1在体内可以转化成稀有型皂苷CK,是人参皂苷二醇组代谢产物的代表。研究发现,稀有型皂苷CK有明显的抗缺血性脑损伤作用,这一活性源于其对脑胶质细胞活化的调节功能[12]。越来越多的研究表明,缺血/再灌触发的脑部“非感染性”炎症反应是主导卒中中后期脑损伤的主要病理机制,干预脑部炎症反应是最佳的卒中后脑保护措施之一。
本研究的目的在于通过体内、体外实验,对李春生等[3]在临床上观察到的PNS与r-tPA联用的有效性做初步的药效学机制探讨。为了更好模拟卒中患者抢救中临床上实施的溶栓过程,我们建立了凝血酶诱导缺血性卒中联合r-tPA溶栓大鼠模型,并发现r-tPA与PNS联用组的脑保护作用(梗死面积与神经功能评分)优于单用r-tPA。大鼠线栓法模型是目前使用最多的卒中动物模型之一,使用该模型我们发现,无论是预防性给药(再灌前10 min)或是治疗性给药(再灌时同时给药)均可以明显降低模型动物脑损伤,而且与预防性给药组相比,再灌时同时给药(治疗性给药组)PNS的脑保护作用更强。有研究资料提示,缺血后缺血核心区的血流量将降低至正常状态的5%~10%,而半阴影区的血流量也将下降30%~40%,形成低灌注带[13],这显然直接影响到药物分子进入靶器官的浓度。此外,由缺血造成的颅内高压也会影响药物的传递。因此,提示在卒中治疗过程中,神经保护剂PNS的最佳给药时间应该是在溶栓或取栓的同时。
为了探索PNS在大鼠卒中模型中观察到的神经保护作用机制,我们使用流式细胞术分别对模型组和PNS药物组小鼠脑组织巨噬细胞浸润状态进行了分析,发现给予PNS药物组的模型鼠梗死侧大脑巨噬细胞的浸润明显低于模型组,提示PNS可能通过其固有的机制,调低了巨噬细胞对缺血脑组织部位的浸润,从而降低了脑部的炎症反应程度。为了进一步验证PNS对卒中炎症反应直接关联细胞的调节作用,我们利用巨噬细胞和小胶质细胞进行LPS刺激培养,发现PNS能明显降低LPS诱导的巨噬细胞/小胶质细胞TNF-α、IL-6的分泌。这一结果与之前其他研究者报道的结论完全相同[14]。
炎症反应是主宰缺血中后期脑损伤的关键因素。PNS是一种拥有多效性的神经保护剂,其中抗炎症反应可能是其在抗缺血/再灌脑损伤中发挥作用的关键药理学机制。随着血管内介入取栓疗法的日趋成熟和普及,如何防止介入取栓过程中诱发的再灌注损伤,也已经成为目前临床上亟待解决的难题。进一步探索PNS与溶栓法联用的合适配比与使用时间,也为未来PNS作为配合治疗介入取栓手术打下基础,使更多卒中患者在接受溶栓或介入取栓治疗时,获得更大的治疗效益。
( 致谢: 本研究中凝血酶诱导大鼠脑血栓模型构建得到上海医学工程院刘丽、王志勇博士的指导和支持,特此鸣谢!)
| [1] |
李萍, 赵树明, 胡亚男. 脑出血发病机制研究进展[J]. 中华老年心脑血管杂志, 2015, 17(2): 214-5. Li P, Zhao S M, Hu Y N. Progress on pathogenesis of cerebral hemorrhage[J]. Chin J Geriatr Heart Brain Ves Dis, 2015, 17(2): 214-5. |
| [2] |
Wang Y, Li Q, Wang J, et al. Combination of thrombolytic therapy and neuroprotective therapy in acute ischemic stroke:is it important?[J]. Eur Rev Med Pharmacol Sci, 2015, 19(3): 416-22. |
| [3] |
李春生, 高艳红, 常建军, 等. 三七总皂苷对急性缺血性卒中患者重组组织型纤溶酶原激活物静脉溶栓疗效及出血性转化的影响[J]. 中国现代神经疾病杂志, 2016, 16(11): 784-90. Li C S, Gao Y H, Chang J J, et al. Effect of panax notoginseng saponins on efficacy and hemorrhagic transformation of r-tPA intravenous thrombolysis in patients with acute ischemic stroke[J]. Chin J Contemp Neurol Neurosurg, 2016, 16(11): 784-90. doi:10.3969/j.issn.1672-6731.2016.11.012 |
| [4] |
孙念霞, 高维娟, 易忠良. 改良线栓法制作SD大鼠局灶性脑缺血再灌注模型[J]. 中国组织工程研究, 2014, 18(2): 225-30. Sun N X, Gao W J, Yi Z L. Improved suture occlusion method to prepare focal cerebral ischemia reperfusion models in Sprague-Dawley rats[J]. J Clin Rehabil Tis Eng Res, 2014, 18(2): 225-30. |
| [5] |
郝春华, 王维亭, 郑海娟, 等. 自体血栓和凝血酶致大鼠局灶性脑梗死模型的建立与应用[J]. 药物评价研究, 2014, 37(4): 300-4. Hao C H, Wang W T, Zheng H J, et al. Establishment of focal cerebral infarction model by autologous thromb and thrombin as well as application[J]. Drug Eval Res, 2014, 37(4): 300-4. |
| [6] |
甄毅岚, 王亚男, 李晟, 等. 线栓法制备不同体重KM小鼠局灶性脑缺血/再灌注模型的建立及评价[J]. 中国实验动物学报, 2013, 21(2): 39-44. Zhen Y L, Wang Y N, Li S, et al. Establishment and evaluation of focal cerebral ischemia/reperfusion induced by monofilament in differently weighing Kunming mice[J]. Acta Lab Anim Sci Sin, 2013, 21(2): 39-44. doi:10.3969/j.issn.1005-4847.2013.02.008 |
| [7] |
Chu H X, Kim H A, Lee S, et al. Immune cell infiltration in malignant middle cerebral artery infarction:comparison with transient cerebral ischemia[J]. J Cereb Blood Flow Metab, 2014, 34(3): 450-9. doi:10.1038/jcbfm.2013.217 |
| [8] |
Muoio V, Persson P B, Sendeski M M. The neurovascular unit-concept review[J]. Acta Physiol, 2014, 210(4): 790-8. doi:10.1111/apha.2014.210.issue-4 |
| [9] |
唐旭东, 姜建青, 姜大春, 等. 三七总皂苷对心肌缺血/再灌注中中性粒细胞核因子-κB活化及其粘附的影响[J]. 中国药理学通报, 2002, 18(5): 556-9. Tang X D, Jiang J Q, Jiang D C, et al. Experimental study on influence of total saponins of panax notoginseny on activation of NF-κB and adhesion of PMN in myocardial ischemic-reperfusion injury[J]. Chin Pharmacol Bull, 2002, 18(5): 556-9. doi:10.3321/j.issn:1001-1978.2002.05.019 |
| [10] |
李光, 邢小燕, 张美双, 等. 中药三七对缺血/再灌注损伤的保护作用及运用前景[J]. 中国药理学通报, 2015, 31(10): 1340-4. Li G, Xing X Y, Zhang M S, et al. Panax notoginseng in treatment of myocardial ischemia/ reperfusion injury and its application prospect[J]. Chin Pharmacol Bull, 2015, 31(10): 1340-4. doi:10.3969/j.issn.1001-1978.2015.10.003 |
| [11] |
Wang X, Wang S, Wang J, et al. Neuroprotective effect of Xueshuantong for injection (lyophilized) in transient and permanent rat cerebral ischemia model[J]. Evid Based Complement Alternat Med, 2015, 2015(3): 1-13. |
| [12] |
Chen J, Wu H, Wang Q, et al. Ginsenoside metabolite compound K suppresses T-cell priming via modulation of dendritic cell trafficking and costimulatory signals, resulting in alleviation of collagen-induced arthritis[J]. J Pharmacol Exp Ther, 2015, 353(1): 71-9. doi:10.1124/jpet.114.220665 |
| [13] |
Hossmann K A. The two pathophysiologies of focal brain ischemia:implications for translational stroke research[J]. J Cereb Blood Flow Metab, 2012, 32(7): 1310-6. doi:10.1038/jcbfm.2011.186 |
| [14] |
Lee Y Y, Park J S, Jung J S, et al. Anti-inflammatory effect of ginsenoside Rg5 in lipopolysaccharide-stimulated BV2 microglial cells[J]. Int J Mol Sci, 2013, 14(5): 9820-33. doi:10.3390/ijms14059820 |

