

2. 盐城市第一人民医院药剂科,江苏 盐城 224005
2. Dept of Pharmacy, Yancheng First People's Hospital, Yancheng Jiangsu 224005, China
肝脏是机体重要的新陈代谢和解毒器官,容易被一些化学物质如酒精、四氯化碳和对乙酰氨基酚(acetaminophen,APAP)损伤[1-2],导致肝细胞坏死和肝功能障碍。APAP是一种常用的非处方药,在治疗剂量下是安全的,但越来越多的临床试验和实验动物研究证实,APAP过量可引起急性肝衰竭[3]。治疗剂量时,APAP主要在肝脏被葡萄醛酸化和硫酸化,代谢为无毒的水溶性代谢产物,只有极少部分APAP被代谢成为有毒性的活性产物N-乙酰-对苯醌亚胺(N-acetyl-q-benzoquinone imine,NAQPI)。NAQPI可以与谷胱甘肽(glutathione,GSH)结合,形成APAP-谷胱甘肽、APAP-半胱氨酸和APAP-N-乙酰半胱氨酸来解毒。但是,当APAP过量导致NAQPI产生过多,继而耗竭细胞内GSH后,剩余的NAPQI可以共价结合细胞生物大分子形成NAQPI-蛋白质加合物,导致氧化应激反应,线粒体功能障碍和细胞核DNA断裂,最终导致肝细胞坏死和肝损伤[4]。
临床上对于APAP过量导致肝损伤的治疗,除了N-乙酰半胱氨酸(N-acetylcysteine, NAC)之外,目前亦无其他有效药物。二氢杨梅素(dihydromyricetin,DHM),3, 5, 7, 3′, 4′, 5′-六羟基2, 3-二氢黄酮醇,又名蛇葡萄素,是一种重要的黄酮醇化合物,来源广泛,存在于葡萄科、杨梅科、藤黄科、柳科等植物中,在藤茶属植物中含量最高。DHM具有多种药理学活性,如抗炎、抗氧化、护肝、抑制肿瘤细胞增殖、调节脂质及血糖代谢等[5]。既往研究发现,DHM能够抑制由氨基半乳糖诱导的大鼠乳酸脱氢酶、谷丙转氨酶(alanine aminotransferase, ALT)及谷草转氨酶(aspartate aminotransferase, AST)水平的升高,具有较好的肝保护作用。DHM体外对于小鼠肝脏谷胱甘肽-S-转移酶有抑制作用[6],体内能够升高乙醇诱导小鼠肝损伤模型肝脏还原性胱甘肽水平,降低肝脏丙二醛(malondialdehyde, MDA)水平,通过清除氧自由基、提高肝细胞的抗氧化能力,对乙醇性肝损伤具有明显的保护作用[7]。本实验研究预防性给予DHM对APAP诱导的小鼠急性肝损伤的影响,并探讨了其可能的作用机制。若能证实DHM干预对于APAP损伤的肝脏有保护效应,则可能为其实际应用于临床提供实验室证据。
1 材料 1.1 药物与试剂DHM(西安自然生物技术有限公司,批号161106, 纯度>98%);APAP(Abcam公司,Lot.APN12278-1-1, 纯度>98%);双环醇片(bicyclol,批号170205, 北京协和药厂);ALT、AST、GSH、超氧化物歧化酶(superoxide dismutase, SOD)及MDA检测试剂盒(南京建成生物有限公司);p-JNK、JNK、Bax一抗(CST公司);α-tubulin一抗、抗兔及抗鼠二抗(Proteintech公司);活性氧(reactive oxygen species, ROS)荧光探针-DHE(北京威格拉斯生物技术有限公司);PrimeScriptTM RT reagent kit试剂盒、SYBR GREEN(TaKaRa公司);BCA蛋白浓度测定试剂盒、PMSF和RIPA裂解液(碧云天生物技术研究所)。
1.2 实验动物SPF级C57BL/6小鼠,♂,6周龄,体质量18~22 g,购买并饲养于南通大学实验动物中心,自由饮食,动物合格证编号:SCXK(苏)2012-0031。实验严格按照国家和南通大学实验动物中心动物使用管理条例进行。
1.3 仪器PowerWaveX340型全自动酶标仪(美国Bio-Tek公司);电泳、转膜及化学发光成像系统(Bio-Rad公司);ABI7500荧光定量PCR仪(美国Applied Biosystem公司);冰冻切片机(Leica公司);OLYMPUS DP72荧光显微镜(日本Olympus公司)。
2 方法 2.1 实验动物分组及给药24只C57BL/6小鼠,自由饮食,适应性饲养1周后,随机分为对照组(Control)、模型组(Model)、DHM 300 mg·kg-1组、阳性对照药双环醇200 mg·kg-1组(bicyclol 200 mg·kg-1),每组6只。按体质量10 mL·kg-1灌胃给药,每天1次,对照组与模型组每天灌胃等体积生理盐水,连续7 d。末次给药禁食(不禁水)24 h后,除对照组外,每组小鼠腹腔注射300 mg·kg-1 APAP生理盐水溶液(10 mL·kg-1)[3-4];对照组给予相同体积生理盐水腹腔注射。APAP腹腔注射4 h后,眼眶后静脉丛取血,处死小鼠。生理盐水灌注心脏后取肝脏组织,部分经4%多聚甲醛固定,用于组织病理学检测,另一部分组织-80℃保存备用。
2.2 小鼠血清ALT和AST水平检测各组小鼠眼眶后静脉丛取血,室温静置30 min后,血液凝固,3 000 r·min-1离心10 min,取上清,-80℃保存备用。按照试剂盒说明书操作,酶标仪于不同波长处测定吸光度值,绘制标准曲线,计算样品浓度。
2.3 小鼠肝脏ROS荧光探针-DHE染色新鲜切取小鼠肝脏,用OCT冰冻切片包埋剂包埋后,迅速冷冻固定,切片。用稀释到合适浓度的ROS荧光探针室温避光孵育1 h,PBS清洗后滴加防淬灭剂封片。通过荧光显微镜观察,拍照。
2.4 小鼠肝脏组织中GSH、MDA含量及SOD活力测定取约100 mg小鼠肝脏组织块,加入9倍体积的生理盐水,在冰浴中匀浆后,4℃、2 500 r·min-1离心15 min,吸取上清液,BCA法测定蛋白浓度。取匀浆上清液0.1 mL,加0.1 mL试剂一混匀,4℃、3 500 r·min-1离心10 min,按照试剂盒说明书操作,测定吸光度值,计算样品浓度。
2.5 实时荧光定量PCR法检测小鼠肝组织IL-6、TNF-α、IL-1β mRNA表达取100 mg肝组织匀浆,TRIzol法提取总RNA,使用PrimeScriptTM RT reagent kit试剂盒,按照说明书进行反转录,随后采用20 μL反应体系通过荧光定量PCR仪进行扩增。所用引物序列如下:IL-6:(Forward)5′-UCCACTTCACAAGTCGGAGGCTTA-3′,(Reverse)5′-CCAGTTTGGTAGCATCCATCATTTC-3′;TNF-α:(Forward)5′-CACCATGAGCACAGAAAGCA-3′,(Reverse)5′-TAGACAGAAGAGCGTGGTGG-3′;IL-1β:(Forward)5′-ACTCATTGTGGCTGTGGAGA-3′,(Reverse)5′-TTGTTCATCTCGGAGCCTGT-3′;GAPDH:(Forward)5′-GCACCGTCAAGGCTGAGAAC-3′,(Reverse)5′-TGGTGAAGACGCCAGTGGA-3′。以GAPDH为内参基因,采用2-△△Ct计算目的基因相对表达量。
2.6 Western blot检测小鼠肝脏组织中Bax、p-JNK及JNK蛋白表达取100 mg肝组织,加入1 mL预冷的RIPA裂解液,匀浆后提取总蛋白,用BCA法定量。每组取40 μg蛋白进行SDS聚丙烯酰胺凝胶电泳,半干转膜法转膜至PVDF膜,5%脱脂牛奶封闭2 h,加入相应一抗,4℃孵育过夜,洗膜后加入相应二抗室温孵育2 h,ECL发光,化学发光成像系统扫描,Image J软件测定条带灰度值,以目的条带和内参比值用于统计分析。
2.7 统计学处理实验数据用GraphPad Prism 5软件进行统计,以x±s表示,组间比较采用单因素方差分析,两组间比较采用t检验。
3 结果 3.1 DHM预处理减轻了APAP诱导的小鼠急性肝损伤血清ALT和AST水平反映了小鼠肝细胞的损伤程度。与正常对照组相比,在经APAP处理后,模型组小鼠血清ALT和AST水平明显升高(P < 0.01),说明APAP腹腔注射诱导小鼠急性肝损伤造模成功。与模型组相比,DHM和阳性对照药双环醇可以明显抑制APAP诱导的AST水平增加(P < 0.05);对于升高的ALT水平,DHM和双环醇也有一定抑制效应,但差异无统计学意义(Fig 1A、1B)。进一步通过HE染色观察小鼠肝组织损伤情况,如Fig 1C所示,模型组小鼠肝脏出现大量空泡状肝细胞和炎性细胞浸润;预先给予小鼠DHM和双环醇能明显减少空泡状肝细胞数量,并减少了炎性细胞在局部病灶的聚集、浸润。同时,各组小鼠肝脏指数无明显差异(Fig 1D)。
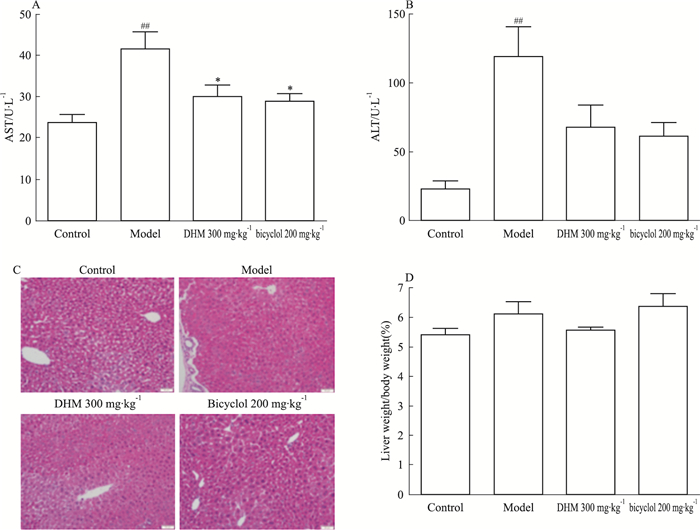
|
| Fig 1 Pretreatment of DHM alleviated APAP-induced acute liver injury in mice(x±s, n=6) Serum AST(A) and ALT(B), histopathologic examination(C, ×200) and liver ratio of weight(D) were used for the measurement of liver injury.##P < 0.01 vs control group; *P < 0.05 vs model group |
MDA反映了组织的脂质过氧化水平,由Fig 2A可知,与正常对照组相比,模型组小鼠肝组织MDA水平明显升高(P < 0.05),提示模型组小鼠存在明显的氧化应激损伤。进一步对小鼠肝脏冰冻切片进行ROS荧光探针-DHE染色,如Fig 2B所示,模型组小鼠肝脏荧光强度明显增加,说明组织中ROS水平较高。预先给予小鼠DHM能明显降低肝组织MDA水平(P < 0.05),明显减弱组织荧光强度。提示DHM对于APAP肝损伤的保护作用可能与减少ROS产生、减轻氧化应激有关。
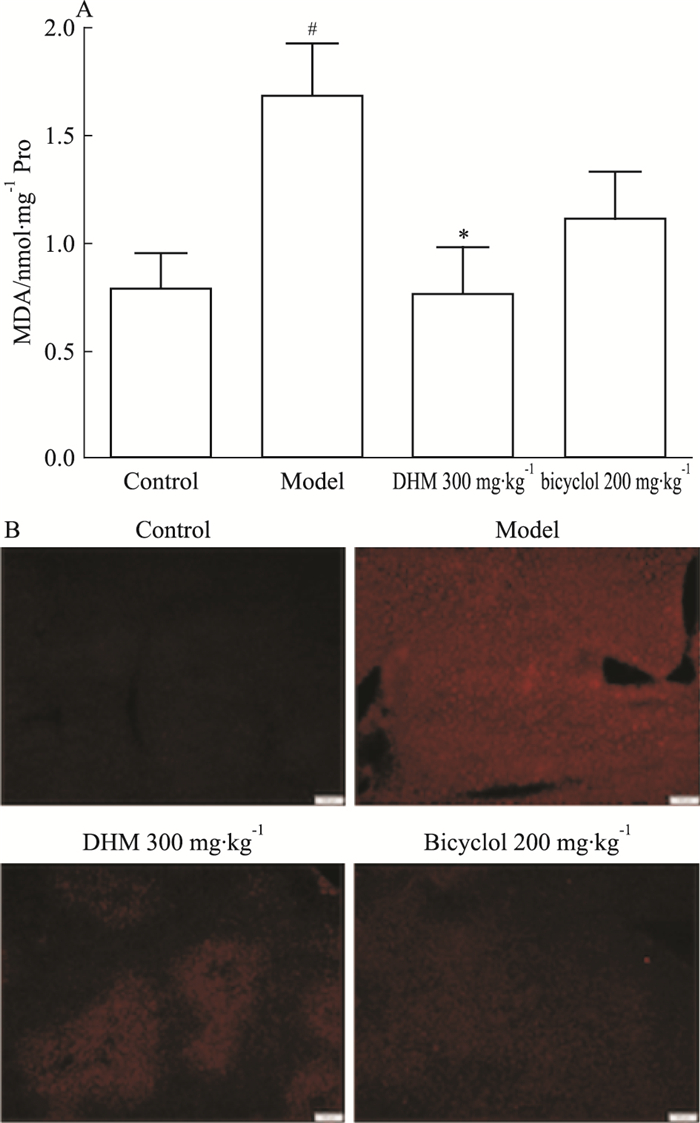
|
| Fig 2 Pretreatment of DHM decreased levels of MDA(A)and ROS(B) in liver of APAP-treated mice(x±s, n=6) #P < 0.05 vs control group; *P < 0.05 vs model group |
APAP过量时产生大量具有高度亲电子活性的中间产物NAPQI,消耗胞内GSH。当80%~90% GSH被消耗后,过多的NAPQI就会和肝细胞蛋白共价结合形成半胱氨酸加和物,进而导致细胞的氧化应激反应、线粒体损伤等胞内过程,最终导致细胞死亡。如Fig 3所示,APAP模型组GSH水平明显降低(P < 0.01),说明肝细胞内GSH被消耗,而DHM和双环醇能抑制这种消耗(P < 0.05),对肝细胞起保护作用。此外,SOD活力反映了细胞对自由基的清除能力,APAP明显降低了小鼠肝组织中SOD活力(P < 0.01),而DHM组和双环醇组SOD活力较模型组明显升高(P < 0.05)。这些结果提示,DHM可通过增加GSH水平和SOD活力来保护受到APAP损伤的肝细胞。
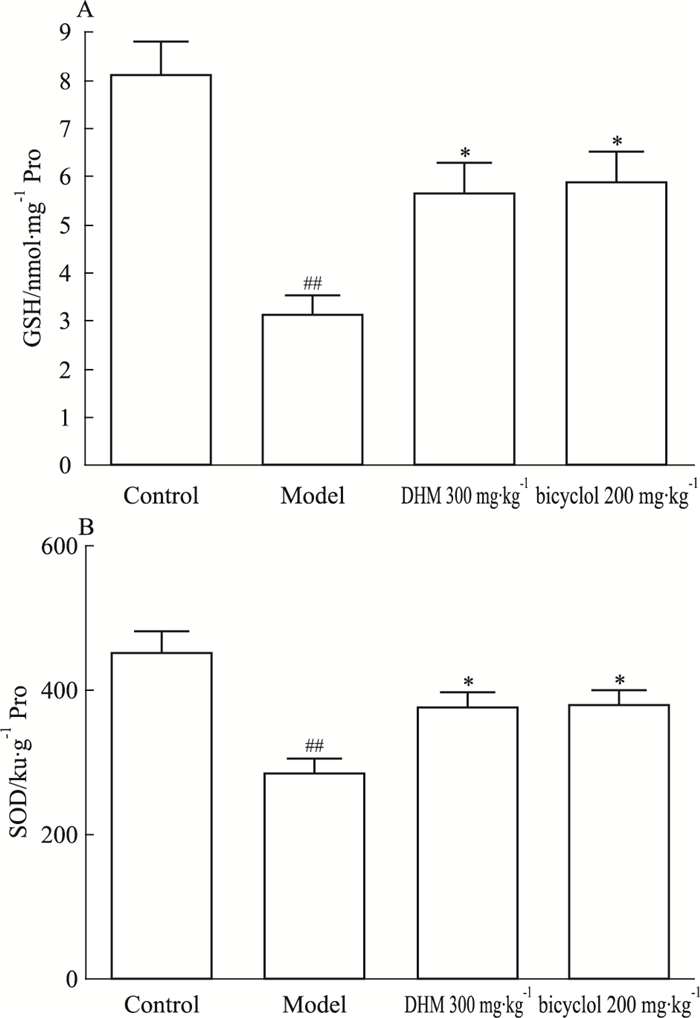
|
| Fig 3 Pretreatment of DHM increased GSH level(A) andSOD activity(B) in liver of APAP-treated mice(x±s, n=6) ##P < 0.01 vs control group; *P < 0.05 vs model group |
如Fig 4所示,与对照组相比,模型组小鼠肝脏IL-6、TNF-α、IL-1β mRNA水平均明显升高(P < 0.01);DHM和双环醇均可以降低模型组肝脏中升高的IL-6、TNF-α mRNA水平(P < 0.05),对升高的IL-1β mRNA水平也有抑制作用,但差异无统计学意义。结果提示,DHM和双环醇可减轻APAP引起的炎症反应。

|
| Fig 4 Pretreatment of DHM decreased mRNA levels of IL-6, TNF-α and IL-1β in liver of APAP-treated mice(x±s, n=5) ##P < 0.01 vs control group; *P < 0.05, **P < 0.01 vs model group |
细胞内氧化应激会引发c-Jun N末端激酶(JNK)途径的激活,并引发JNK磷酸化,将JNK转移到线粒体,进而造成线粒体损伤和功能异常,最终导致细胞死亡。同时,JNK途径被激活后会协同氧化应激反应,继续激活许多不同的Bcl-2家族蛋白,主要包括Bcl-2相关的X蛋白(Bax),Bax是一种重要的促凋亡蛋白。Fig 5的Western blot实验发现,APAP造成了肝细胞JNK磷酸化水平和Bax蛋白表达明显升高P < 0.05),DHM干预抑制JNK的磷酸化及Bax蛋白表达(P < 0.05),通过保护细胞线粒体、抑制肝细胞凋亡,进而保护肝细胞。

|
| Fig 5 Pretreatment of DHM decreased JNK phosphorylation andBax protein expression in liver of APAP-treated mice(x±s, n=5) #P < 0.05, ##P < 0.01 vs control group; *P < 0.05 vs model group |
APAP作为临床上应用广泛的解热镇痛抗炎药,大剂量或长期服用可能会造成肝损伤。本实验采用APAP诱导的小鼠急性肝损伤模型,观察DHM预防性干预对受损肝组织的效应,并推测其可能的作用机制。
APAP主要在肝脏进行代谢,正常情况下,大多数迅速被葡萄糖醛酸化或被硫酸化,转化为无毒性代谢产物[7-9];过量则大量消耗GSH,形成半胱氨酸加合物,引发严重的氧化应激反应、线粒体损伤、激酶通路激活等[10],最终引起肝细胞死亡。在本文中,模型组小鼠因过量APAP作用而导致肝组织GSH水平明显降低,氧化应激损伤明显,这些结果都与之前文献报道一致;而DHM干预能明显升高小鼠肝组织GSH水平及SOD活力,缓解由过量APAP导致的氧化应激损害。这些证据表明,DHM对于肝细胞的保护作用可能与其具有较强抗氧化作用,并能提高细胞内GSH水平有关。
据报道,除了氧化应激之外,APAP肝毒性与炎症反应也密切相关。APAP代谢产物亦会导致肝脏枯否细胞活化,炎症细胞浸润和大量炎症细胞因子,如TNF-α、IL-6等产生,引发了炎症反应[11]。炎症反应募集炎性细胞至肝脏,进一步促进产生大量有毒性的ROS,加重氧化应激损伤。在本实验中,APAP模型组小鼠肝组织TNF-α、IL-6、IL-1β mRNA水平较对照组明显升高,DHM干预能明显降低升高的炎症相关因子mRNA水平,提示其对肝脏的保护作用除了与抗氧化作用有关之外,亦与其具有抗炎作用相关。
严重氧化应激会导致JNK途径的激活,并引起JNK磷酸化水平增高,并将JNK转移到线粒体[12]。JNK迁移到线粒体能明显增强线粒体氧化应激,刺激线粒体功能障碍和开孔[13],线粒体膜蛋白如细胞凋亡因子和内切核酸酶G的泄漏,直接攻击DNA,最终导致细胞DNA裂解和细胞死亡[14]。在本实验中,我们观察到APAP模型组JNK磷酸化蛋白的明显增高,DHM对这种APAP诱导的磷酸化升高有抑制效应。JNK磷酸化和氧化应激同时也激活许多不同的细胞凋亡相关的Bcl-2家族蛋白,主要包括Bax蛋白等[15]。Bax是一个促凋亡因子,被激活表达增加后,会促使细胞凋亡发生。Western blot法检测肝组织中Bax蛋白表达,发现在APAP模型组中其表达明显升高,而DHM的干预能够降低Bax蛋白表达水平。结合之前实验结果,提示DHM对于APAP损伤小鼠肝脏的保护作用是综合了其抗炎、抗氧化、抑制JNK信号通路的激活以及肝细胞凋亡的结果。
综上所述,DHM在APAP诱导小鼠肝损伤模型中发挥抗炎和抗氧化应激作用,进而抑制JNK信号通路的激活,并抑制肝细胞凋亡,保护了APAP损伤的小鼠肝脏。本实验结果为DHM及其相关产品用于药物性肝损伤的预防和治疗提供了实验依据。
( 致谢: 本实验在南通大学药学院药理学教研室及南通大学实验动物中心完成,衷心感谢各位老师的支持和帮助。)
| [1] |
万星, 郭琼, 刘向东, 等. 鬼箭羽醇提取物对四氯化碳诱导小鼠肝纤维化模型的作用[J]. 中国药理学通报, 2018, 34(4): 585-90. Wan X, Guo Q, Liu X D, et al. The inhibitory effect of Euonymus alatus against mouse hepatic fibrosis induced by CCl4[J]. Chin Pharmacol Bull, 2018, 34(4): 585-90. |
| [2] |
李艳艳, 于微, 冯里茹, 等. 槲皮素对慢性酒精暴露小鼠肝脏自噬的调控[J]. 中国药理学通报, 2018, 34(1): 82-6. Li Y Y, Yu W, Feng L R, et al. Quercetin alleviates chronic alcohol exposure induced liver autophagy dysfunction[J]. Chin Pharmacol Bull, 2018, 34(1): 82-6. doi:10.3969/j.issn.1001-1978.2018.01.018 |
| [3] |
Fu T H, Wang S J, Liu J P, et al. Protective effects of α-mangostin against acetaminophen-induced acute liver injury in mice[J]. Eur J Pharmacol, 2018, 827: 173-80. doi:10.1016/j.ejphar.2018.03.002 |
| [4] |
Feng R B, Wang Y, Liu C H, et al. Acetaminophen-induced liver injury is attenuated in transgenic fat-1 mice endogenously synthesizing long-chain n-3 fatty acids[J]. Biochem Pharmacol, 2018, 154: 75-88. |
| [5] |
侯小龙, 王文清, 施春阳, 等. 二氢杨梅素药理作用研究进展[J]. 中草药, 2015, 46(4): 603-8. Hou X L, Wang W Q, Shi C Y, et al. Research progress in pharmacological effects of dihydromyricelin[J]. Chin Tradit Herb Drugs, 2015, 46(4): 603-8. |
| [6] |
杨秀芬, 扬子明. 二氢杨梅素对小鼠肝脏谷胱甘肽-S-转移酶的抑制作用及其动力学分析[J]. 中国药理学通报, 2010, 26(7): 894-8. Yang X F, Yang Z M. Inhibition of glutathione-S-transferase by dihydromyricetin and its kinetics analysis in liver of mice[J]. Chin Pharmacol Bull, 2010, 26(7): 894-8. |
| [7] |
Chen S H, Zhao X L, Wan J, et al. Dihydromyricetin improves glucose and lipid metabolism and exerts anti-inflammatory effects in nonalcoholic fatty liver disease:a randomized controlled trial[J]. Pharmacol Res, 2015, 99: 74-81. doi:10.1016/j.phrs.2015.05.009 |
| [8] |
Ni H M, Mitchell R M, Chao X J, et al. Removal of acetaminophen-protein adducts by autophagy protects against acetaminophen-induced liver injury in mice[J]. J Hepatol, 2016, 65(2): 354-62. doi:10.1016/j.jhep.2016.04.025 |
| [9] |
Jaeschke H, McGill M R, Ramachandran A. Oxidant stress, mitochondria, and cell death mechanisms in drug-induced liver injury: lessons learned from acetaminophen hepatotoxicity[J]. Drug Metab Rev, 2012, 44: 88-106. doi:10.3109/03602532.2011.602688 |
| [10] |
Abdel-Zaher A O, Abdel-Rahman M M, Hafez M M, Omran F M. Role of nitric oxide and reduced glutathione in the protective effects of aminoguanidine, gadolinium chloride and oleanolic acid against acetaminophen-induced hepatic and renal damage[J]. Toxicology, 2007, 234: 124-34. doi:10.1016/j.tox.2007.02.014 |
| [11] |
Kubes P, Mehal W Z. Sterile inflammation in the liver[J]. Gastroenterology, 2012, 143: 1158-72. doi:10.1053/j.gastro.2012.09.008 |
| [12] |
Hanawa N, Shinohara M, Saberi B, et al. Role of JNK translocation to mitochondria leading to inhibition of mitochondria bioenergetics in acetaminophen-induced liver injury[J]. J Biol Chem, 2008, 283: 13565-77. doi:10.1074/jbc.M708916200 |
| [13] |
Saito C, Lemasters J J, Jaeschke H. c-Jun N-terminal kinase modulates oxidant stress and peroxynitrite formation independent of inducible nitric oxide synthase in acetaminophen hepatotoxicity[J]. Toxicol Appl Pharmacol, 2010, 246: 8-17. doi:10.1016/j.taap.2010.04.015 |
| [14] |
Bajt M L, Ramachandran A, Yan H M, et al. Apoptosis inducing factor modulates mitochondrial oxidant stress in acetaminophen hepatotoxicity[J]. Toxicol Sci, 2011, 122: 598-605. doi:10.1093/toxsci/kfr116 |
| [15] |
Bajt M L, Farhood A, Lemasters J J, Jaeschke H. Mitochondrial Bax translocation accelerates DNA fragmentation and cell necrosis in a murine model of acetaminophen hepatotoxicity[J]. J Pharmacol Exp Ther, 2008, 324: 8-14. |

