


2. 中国医学科学院,北京协和医学院药用植物研究所药理毒理中心,北京 100193;
3. 云南省彝良县天麻产业开发办公室,云南 昭通 657600

 ,
SUN Xiao-bo2
,
SUN Xiao-bo2

2. Pharmacology and Toxicology Center, Institute of Medicinal Plant Development, Chinese Academy of Medical Sciences, Beijing 100193, China;
3. Yiliang County, Yunnan Province Tianma Industrial Development Office, Zhaotong Yunnan, 657600, China
阿尔茨海默病(Alzheimer's disease, AD)又称老年性痴呆,是一种严重的中枢神经系统退行性疾病,其临床表现为进行性的认知功能减退或障碍[1]。随着人口老龄化倾向,该病发病率有增高趋势,严重影响了人类的身心健康及生活质量。
天麻(Gastrodia elata Bl.)为兰科天麻属植物,是我国名贵中药材,具有息风、定惊,治眩晕眼黑、头风头痛、肢体麻木、止痉等功效。近年来的临床研究表明,天麻能改善AD患者的学习记忆功能,具有提高患者生活能力的作用[2]。小草坝天麻是云南省昭通市彝良县小草坝镇的特产,其品质优良,药用价值高。且据分析检测,彝良小草坝天麻的天麻素、无机元素和氨基酸含量明显优于省外主要产地的天麻[3]。据报道,东莨菪碱所致学习记忆障碍模型被认为是AD药物研究经典的初筛模型[4]。为了探究小草坝天麻对AD的功效与作用,本文采用东莨菪碱建立小鼠记忆获得障碍模型,通过行为学实验观察天麻提取物对小鼠学习记忆的影响,并测定脑组织、海马组织及皮层组织中的乙酰胆碱酯酶(acetylcholinesterase,AchE)、超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malondialdehyde,MDA)的含量,初步探讨其作用机制。
1 材料与方法 1.1 实验动物与分组实验采用SPF级ICR小鼠135只,♂,体质量(22±2)g,由北京维通利华实验动物技术有限公司提供(实验动物合格证编号:No.11400700227833),随机分为6组(每组15只):空白组及模型组分别以超纯水灌胃,每只0.2 mL;阳性药石杉碱甲组以石杉碱甲0.08 mg·kg-1·d-1灌胃;小草坝天麻水提物低、中、高剂量组分别以10、20、40 mg·kg-1·d-1灌胃,连续15 d进行预防性给药。后进行为期4 d的水迷宫学习训练。学习结束后,正式进行5 d水迷宫定位航行实验,1 d水迷宫空间探索实验。
1.2 药物与试剂小草坝天麻购于云南省彝良县,天麻水提物由北京协和医学院药用植物研究所化学中心提供;东莨菪碱标准品(货号:BWB50313)、石杉碱甲中药对照品(批号:07041114),由北京北纳创联生物技术研究院提供;考马斯亮蓝蛋白测定试剂盒(批号:20170908)、AChE测试盒(批号:20170825)、MDA测试盒(批号:20170919)、SOD测试盒(批号:20170922),均由南京建成生物工程研究所提供。
1.3 仪器Morris水迷宫(直径100 cm, 水深50 cm, 安全平台直径9 cm)及视频分析系统,由中国医学科学院药物研究所提供,型号DMS-2;离心机(深圳安科高技术股份有限公司); 酶标仪(美国Bio-Tek);高通量组织研磨仪(北京鼎昊源科技有限公司)。
1.4 方法 1.4.1 水迷宫筛选小鼠进行水迷宫筛选前,先将小鼠放在平台上20 s,让其认知平台,然后将小鼠从平台对角象限头朝水迷宫内壁放入水中,观察其2 min内能否找到平台,能找到平台的纳入正式实验,不能找到平台的小鼠人为将其引导上平台停留20 s,10 min后进行第2次筛选实验,能找到的纳入正式实验,两次都不能找到平台的小鼠剔除出实验。
1.4.2 水迷宫训练将筛选合格的小鼠进行4 d水迷宫训练实验,训练实验同筛选实验方法,如此连续训练10次,确保每只小鼠都能在规定的时间内找到平台。训练期间按相应剂量给药。
1.4.3 小鼠定位航行实验水迷宫实验周期为6 d,定位航行实验周期为5 d,正常给药后,在水迷宫实验小鼠入水前20 min,一次性腹腔注射东莨菪碱3 mg·kg-1,复制小鼠学习记忆获得障碍模型,空白组小鼠注射相应剂量无菌生理盐水。自动记录小鼠第1次找到隐匿平台时间(逃避潜伏期)等各项指标。
1.4.4 小鼠空间探索实验空间探索实验周期为1 d,实验时不给药,仅在小鼠入水前20 min进行记忆障碍模型造模。移去平台,自动记录第1次到达原平台所在位置时间和跨越平台次数,时间为120 s。水迷宫注意事项:平台低于水面1 cm,水温(25.0±1.0)℃,实验期间迷宫外参照物保持不变。
1.5 小鼠组织制备及生化指标测定 1.5.1 脑组织匀浆的制备水迷宫实验结束后,将小鼠处死,取出脑组织,分离每组小鼠大脑皮质和海马,置于离心管中,-80℃冷冻保存。制备匀浆时,取约100 mg组织,加入9倍量0.9%氯化钠溶液,置EP管中,并放入钢珠,于高通量组织研磨仪中充分研磨,制成10%脑组织匀浆,3 000 r·min-1离心10 min,吸取上清液备用。
1.5.2 脑组织蛋白含量测定取10%脑组织匀浆液100 μL,按考马斯亮蓝蛋白测定测试盒说明书操作步骤和计算公式,酶标仪在595 nm波长处比色,测定海马组织及皮层组织蛋白浓度,以此作为小鼠脑组织蛋白定量。
1.5.3 脑组织AChE活力测定取10%海马及皮层组织匀浆液各40 μL,按AChE测试盒说明书,酶标仪在412 nm波长处比色,测定海马组织及皮层组织匀浆中AChE活力。
1.5.4 脑组织SOD活力测定取10%海马及皮层组织匀浆液各20 μL,按SOD测定试剂盒说明书,酶标仪在450 nm波长处比色,测定海马组织及皮层组织匀浆中SOD活力。
1.5.5 脑组织MDA含量测定取10%海马及皮层组织匀浆液各20 μL,按MDA测试盒说明书,酶标仪在532 nm波长处比色,测定海马组织及皮层组织匀浆中MDA含量。
1.6 统计学处理运用SPSS 12.0统计软件进行统计分析,实验数据以x±s表示,各组数据采用方差分析,两两样本均数的LSD检验进行统计学处理。
2 结果 2.1 天麻对小鼠定位航行实验的影响Fig 1的定位航行实验路径图结果显示,与空白组相比,模型组小鼠寻找平台所需的时间明显增多,说明记忆障碍模型造模成功。石杉碱甲组和天麻组与模型组相比,寻找平台所需时间明显减少。
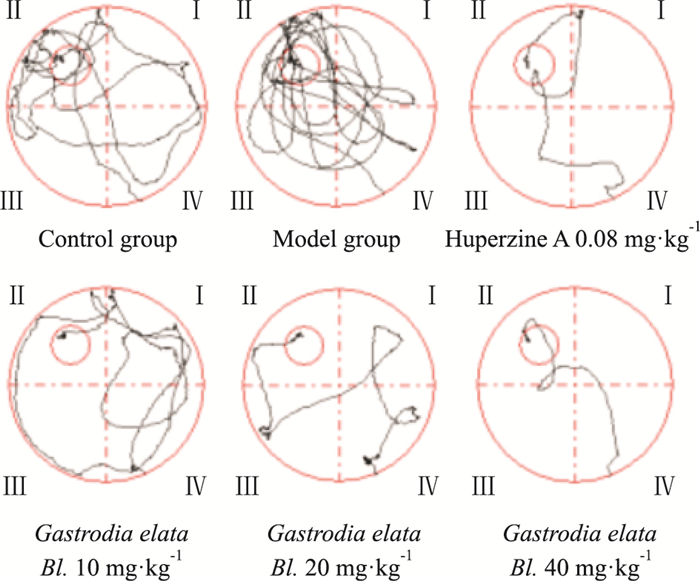
|
| Fig 1 Comparison of path diagramsfor positioning navigation experiments |
Fig 2的水迷宫空间探索实验路径图结果显示,与空白组相比,模型组小鼠在目标象限占比没有明显趋势;与模型组相比,石杉碱甲组和天麻组在目标象限时间占比明显增多,小鼠更趋向于目标象限。
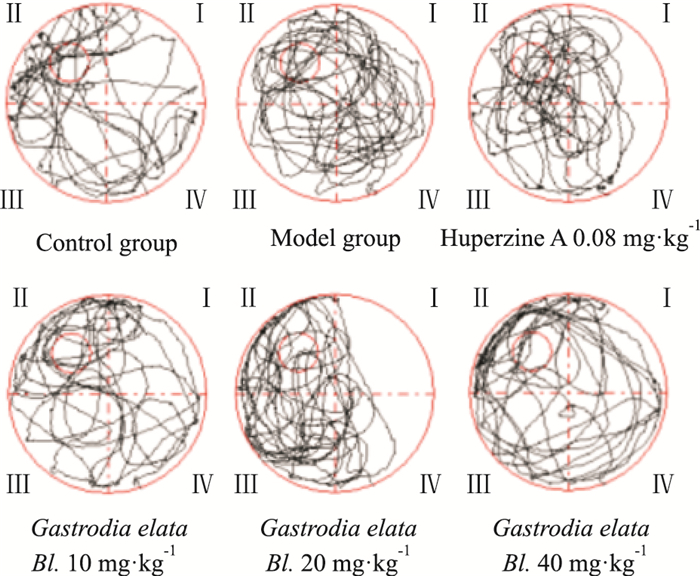
|
| Fig 2 Comparison of path diagramsfor positioning sailing experiment |
空间探索实验潜伏期、小鼠在目标象限时间及路程见Fig 3。结果显示,对潜伏期而言,模型组小鼠潜伏期相比空白组更长,即模型组第1次找到平台花费的时间要比空白组更多(P < 0.05);天麻组相比于模型组,其潜伏期短,其中高剂量组差异有显著性(P < 0.01)。对目标象限时间而言,模型组小鼠在目标象限所处的时间相比空白组更少(P < 0.01),石杉碱甲组差异也有显著性(P < 0.01);相比于模型组,天麻组在目标象限所处时间更长,中、高剂量组差异有显著性(P < 0.05)。同理,对目标象限路程而言,模型组目标象限路程相比于空白对照组更短(P < 0.05);相比模型组,石杉碱甲组目标象限路程明显增加(P < 0.05),天麻组中剂量差异具有显著性(P < 0.05)。
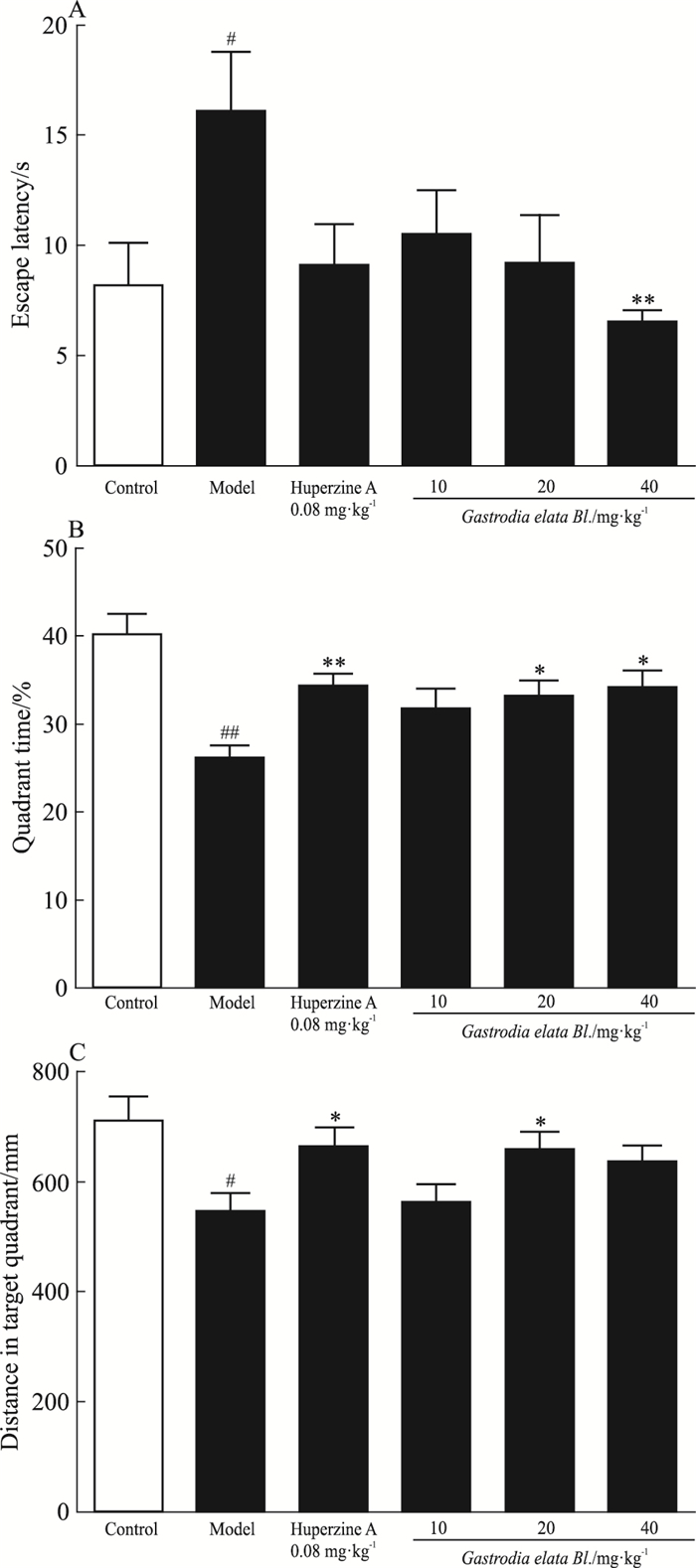
|
| Fig 3 Result of space exploration experiment(x±s, n=12) A:Escape labency; B:Quadrant time; C:Distance in target quadrant.*P < 0.05, **P < 0.01 vs model; #P < 0.05, ##P < 0.01 vs control |
海马组织和皮层组织AchE活力测定结果见Fig 4。海马组织和皮层组织模型组的AchE活力相比于空白组均有明显的升高(P < 0.01)。海马组织中,与模型组相比,小草坝天麻AchE活力明显降低(P < 0.05);皮层组织中,与模型组相比,低剂量组AchE含量明显降低(P < 0.01)。
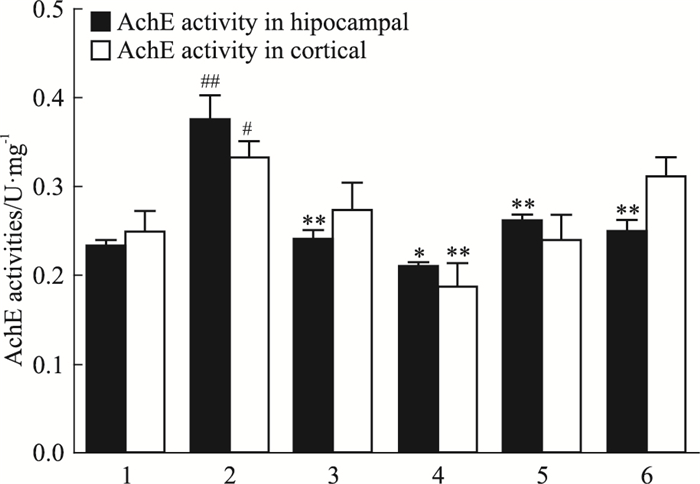
|
| Fig 4 Result of AchE activity in hippocampaland cortical tissues(x±s, n=12) *P < 0.05, **P < 0.01 vs model; #P < 0.05, ##P < 0.01 vs control.1:Control group; 2:Model group; 3:Huperzine A 0.08 mg·kg-1; 4:Gastrodia elata Bl.10 mg·kg-1; 5:Gastrodia elata Bl.20 mg·kg-1; 6:Gastrodia elata Bl.40 mg·kg-1 |
海马组织和皮层组织SOD活力测定结果见Tab 1。相比于对照组,皮层组织模型组的SOD活力明显降低(P < 0.05);天麻给药组SOD活力与模型组相比明显升高(P < 0.05,P < 0.01)。海马组织SOD活力组间差异无显著性。
| Group | Dose/ mg·kg-1 | Cortex SOD activity/kU·g-1 Pro | Hippocampus SOD activity/kU·g-1 Pro |
| Control | - | 26.55±10.55 | 229.31±119.29 |
| Model | - | 13.67±5.01# | 161.66±43.82 |
| Huperzine A | 0.08 | 29.26±7.87* | 119.24±23.05 |
| Gastrodia elata Bl. | 10 | 34.39±8.83** | 177.18±66.08 |
| 20 | 31.51±14.28* | 121.80±5.93 | |
| 40 | 34.30±13.57** | 103.17±2.62 | |
| *P < 0.05, **P < 0.01 vs model; #P < 0.05 vs control | |||
海马组织和皮层组织MDA活力测定结果见Tab 2。模型组海马组织中MDA含量相比于对照组明显升高;天麻给药组海马组织中MDA活力与模型组相比明显降低(P < 0.01)。皮层组织中MDA含量组间差异无显著性。
| Group | Dose/ mg·kg-1 | Cortex MDA level/ μmol·g-1 Pro | Hippocampus MDA level/μmol·g-1 Pro |
| Control | - | 32.44±16.15 | 5.92±2.03 |
| Model | - | 42.45±26.77 | 8.34±0.54## |
| Huperzine A | 0.08 | 45.54±15.44 | 5.16±0.32** |
| Gastrodia elata Bl. | 10 | 40.44±16.51 | 5.21±0.48** |
| 20 | 43.86±26.47 | 5.37±0.76** | |
| 40 | 53.04±28.74 | 5.29±0.61** | |
| **P < 0.01 vs model; ##P < 0.01 vs control | |||
AD早期会出现轻度胆碱能功能障碍,胆碱能系统活性降低的程度也与认知功能障碍的程度有关。因此,研究胆碱能系统对记忆的影响,以及利用现有的药理学工具对继发性功能障碍恢复也是至关重要的[5]。训练前,由东莨菪碱所致的胆碱能阻滞可以导致顺行记忆障碍,学习记忆受损[6]。东莨菪碱诱导的记忆障碍可作为老年记忆障碍和AD记忆障碍的模型,是抗AD药物实验研究中常用的造模药物之一[7]。而天麻对于改善记忆、延缓衰老、增强免疫力等方面临床应用效果明显[8]。通过研究东莨菪碱记忆障碍模型,评价彝良小草坝乌天麻对动物学习记忆的影响,结果表明,小草坝乌天麻可明显改善小鼠的学习记忆能力;另外,还发现天麻的作用机制可能与抑制AchE活性有关。本实验结果与韩春妮等[2]通过采用Hestrin碱性羟胺比色法,根据组织湿重计算乙酰胆碱含量测定天麻提取物对记忆获得障碍模型小鼠影响所得结果一致。
海马是人类和其他哺乳动物前脑胆碱能系统的重要区域,在空间导向和巩固长期记忆中起着重要作用[9]。而记忆的巩固依赖于神经递质系统的调节,其中,中枢胆碱能系统参与了主要的学习和记忆的过程。据报道,AD患者的一个重要特征表现是乙酰胆碱(Ach)含量降低,AChE活力升高[10]。本实验还发现,天麻另外的作用机制有可能通过增强SOD活力及降低MDA含量实现。另外,相比明建等[11]的研究,本实验进一步探索了小草坝天麻水提物的作用机制。本实验在考察Ach和MDA含量的同时,还考察了SOD含量,目的是确证小草坝天麻是否对抗氧化能力有一定的作用。从实验结果可以看出,小草坝天麻改善学习记忆能力可能与一定程度上增强小鼠的抗氧化能力有关。
本实验侧重于评价彝良小草坝乌天麻的道地性,选用了道地药材彝良小草坝乌天麻作为受试药物来源。与刘智慧等[12]选用天麻素等单体进行实验相比,本实验使用了天麻水提物,着重凸显天麻整体的作用与药效。实验结果发现,小草坝天麻在改善小鼠学习记忆方面有较好的作用,这为提升彝良小草坝乌天麻的道地药材价值提供了可靠的依据。
综上所述,本研究比较了不同剂量的天麻水提物在东莨菪碱导致的学习记忆障碍模型中的作用,并分析了其可能作用机制。另外,天麻的镇静、抗衰老等作用具体作用通路还未见报道,进一步的研究还可从深入探讨天麻对记忆障碍影响的机制入手,确证其信号通路。同时,也可考虑使用其他行为学方法来考察相关指标,进一步研究天麻的作用机制,为天麻的药理药效提供更多的实验依据。
( 致谢: 本实验于中国医学科学院药用植物研究所药理毒理中心实验室完成,感谢所有参与实验的老师及同学们!)
| [1] |
赵波, 张新宇, 付学锋. 阿尔茨海默病动物模型的研究进展[J]. 神经解剖学杂志, 2012, 28(1): 102-4. Zhao B, Zhang X Y, Fu X F. Advances in animal models of Alzheimer′s disease[J]. Chin J Neuroanatomy, 2012, 28(1): 102-4. |
| [2] |
韩春妮, 何芳雁, 田野, 等. 天麻提取物对记忆获得障碍模型小鼠胆碱能系统的影响[J]. 中国药业, 2014, 23(21): 3-4. Han C N, He F Y, Tian Y, et al. Effects of extract from Gastrodiae Rhizoma on cholinergic system in mouse memory acquisition barrier model[J]. Chin Pharm, 2014, 23(21): 3-4. |
| [3] |
王忠巧, 贺娜, 徐田. 小草坝天麻仿野生栽培技术[J]. 林业建设, 2015, 10(5): 63-6. Wang Z Q, He N, Xu T. Bionic cultivation techniques of gastrodia elata in Xiaocaoba[J]. Forestry Construction, 2015, 10(5): 63-6. |
| [4] |
高莉, 彭晓明, 张富春, 等. 不同剂量东莨菪碱对小鼠学习记忆功能的影响[J]. 医药导报, 2013, 32(5): 573-6. Gao L, Peng X M, Zhang F C, et al. Effects of Scopolamine at different doses on learning and memory function in mice[J]. Herald Med, 2013, 32(5): 573-6. doi:10.3870/yydb.2013.05.006 |
| [5] |
Blake M G, Boccia M M, Krawczyk M C, et al. Choline reverses scopolamine-induced memory impairment by improving memory reconsolidation[J]. Neurobiol Learn Mem, 2012, 98(2): 112-21. doi:10.1016/j.nlm.2012.07.001 |
| [6] |
Blake M G, Boccia M M, Baratti C M. Behavioral differences on memory retrieval between two variants of step-through inhibitory avoidance task in mice[J]. Neurosci Lett, 2008, 444(1): 102-5. doi:10.1016/j.neulet.2008.08.010 |
| [7] |
宋奇, 王琴, 吴韦黎, 等. 新药T-006对东莨菪碱所致记忆障碍模型动物学习记忆的改善作用[J]. 中国药理学通报, 2016, 32(6): 812-7. Song Q, Wang Q, Wu W L, et al. Effects of new drug T-006 on improving learning and memory abilities in scopolamine-induced dementia Kunming mice[J]. Chin Pharmacol Bull, 2016, 32(6): 812-7. doi:10.3969/j.issn.1001-1978.2016.06.015 |
| [8] |
周慧君. 天麻有效成分的药理作用与临床应用研究进展[J]. 中医临床研究, 2016, 8(22): 56-8. Zhou H J. A review on pharmacological action of active principle in gastrodia elata and the clinical application[J]. Clin J Chin Med, 2016, 8(22): 56-8. doi:10.3969/j.issn.1674-7860.2016.22.020 |
| [9] |
Chen W, Cheng X, Chen J, et al. Lycium barbarum polysaccharides prevent memory and neurogenesis impairments in scopolamine-treated rats[J]. PLoS One, 2014, 9(2): e88076. doi:10.1371/journal.pone.0088076 |
| [10] |
Chen Q, Prior M, Dargusch R, et al. A novel neurotrophic drug for cognitive enhancement and Alzheimer′s disease[J]. PLoS One, 2011, 6(12): e27865. doi:10.1371/journal.pone.0027865 |
| [11] |
明建, 曾凯芳, 吴素蕊, 等. 天麻多糖PGEB-3-H对东莨菪碱所致小鼠学习记忆障碍的影响[J]. 食品科学, 2010, 31(3): 246-9. Ming J, Zeng K F, Wu S R, et al. Effect of soluble polysaccharide PGEB-3-H from Gastrodia elata Blume on scopolamine-induced learning and memory disorders in mice[J]. Food Sci, 2010, 31(3): 246-9. |
| [12] |
刘智慧, 马浩, 王伟平, 等. 天麻素及派立辛改善东莨菪碱致学习记忆障碍的构效关系[J]. 药学学报, 2016, 51(5): 743-8. Liu Z H, Ma H, Wang W P, et al. Structure-activity relationship of gastrodin and parishins on learning and memory deficits induced by scopolamine[J]. Acta Pharm Sin, 2016, 51(5): 743-8. |