


高血压、冠心病、心肌梗死等多种心血管疾病是导致慢性心衰最常见、最重要的高危因素之一,其发病人数及发病率逐年上升[1]。各种病理性因素刺激引发的心室重构是导致心衰的内在原因。研究发现,若能去除这些因素的刺激,心室重构是一个可逆的病理生理过程[2]。玉郎伞(又称龙眼参)系蝶形花科植物疏叶崖豆Millettia pulchra (Benth.) Kurz var. Laxior (Dunn) Z.Wei的块根,已被收录于地方民族药志《广西自治区壮药质量标准(2008年版)》。为了进一步明确玉郎伞治疗心血管疾病的药效学基础,我们对玉郎伞进行了一系列化学成分提取、分离,获得了多个单体[3]。其中,药效筛选实验表明,17-甲氧基-7-羟基-苯并呋喃查尔酮(17-methoxyl-7-hydroxy-benzene-furanchalcone, MHBFC)活性较强。前期研究发现,MHBFC能明显恢复内皮细胞的分泌功能,提高心肌组织内皮型一氧化氮合酶(endothelial nitric oxide synthase, eNOS)活性,增加NO释放,能明显逆转大鼠压力超负荷诱导的心血管重构[4]。而eNOS活性是如何被调控的,其机制尚未清楚。因此,本研究在前期工作基础上,复制大鼠压力超负荷心室重构模型,造模给药后,分离提取心肌微血管内皮细胞(myocardial microvascular endothelial cell, MMVEC),探讨MHBFC预处理对压力超负荷心室重构大鼠MMVEC eNOS-NO信号通路相关基因和蛋白表达的影响,以期了解MHBFC预处理逆转压力超负荷心室重构大鼠的调控机制,进一步明确MHBFC的作用靶点,对于有效控制压力超负荷心室重构的发生、发展具有重要的理论意义。
1 材料 1.1 实验动物SPF级SD大鼠,♂,体质量(140±20)g,广西医科大学实验动物中心提供。实验动物生产及使用许可证号分别为SCXK桂2014-0002、SYXK桂2014-0003。
1.2 药物与试剂玉郎伞采自广西灵山,经广西中医药研究院赖茂祥研究员鉴定为蝶形花科植物疏叶崖豆的块根;玉郎伞黄酮单体MHBFC,由广西医科大学药学院提取分离,经HPLC检测纯度为95%;亚硝基左旋精氨酸甲酯(Nω-nitro-L-arginine methyl ester hydrochloride, L-NAME)(Sigma,批号BCBF4375V);戊巴比妥钠(Merck,批号P11011);Ⅱ型胶原酶(Gibco,批号1212804);0.25%胰蛋白酶(Gibco,批号1830857);内皮细胞培养基(endothelial cell medium, ECM)(ScienCell,批号21959);Dil-乙酰低密度脂蛋白(Dil-acetylated low-density lipoprotein, Dil-Ac-LDL)(Solarbio,批号20170414);增强型RIPA裂解液(博士德生物工程有限公司,批号11K18B02);Bradford蛋白浓度测定试剂盒(Beyotime Biotechnology,批号060216160810);兔抗鼠eNOS、p-eNOS、Akt、p-Akt单克隆抗体、红外荧光染料标记的羊抗兔IgG二抗(美国CST公司);兔抗鼠PI3K p85、p-PI3K p85 Tyr607单克隆抗体(OriGene Technologies公司);PCR引物及试剂盒(TaKaRa公司)。
1.3 仪器BB-150细胞培养箱(Thermo公司);CKX-41荧光倒置显微镜(奥林巴斯有限公司);ABI7300实时荧光定量PCR仪(美国ABI公司);Odyssey双色红外荧光成像系统(美国LI-COR公司)。
2 方法 2.1 动物造模、分组及给药按照文献[4]缩窄大鼠腹主动脉,诱导心室重构模型。假手术组大鼠只游离腹主动脉,不缩窄。术后d 4,将存活大鼠随机分为6组,每组5只:①假手术组;②模型组;③ MHBFC 6 mg·kg-1组;④ MHBFC 12 mg·kg-1组;⑤ MHBFC 12 mg·kg-1 + L-NAME 50 mg·kg-1组;⑥ L-NAME 50 mg·kg-1组。分组后灌胃给予相应药物,各组药物用蒸馏水溶解配制成相应浓度,连续给药42 d,每天灌胃1次。
2.2 MMVEC分离培养及鉴定参照文献[5]酶消化法并加以适当改进。麻醉大鼠后,75%酒精消毒2 min,取心脏,Hanks液洗3遍,剪取左心室,75%酒精灭活心内外膜组织15 s,将心肌组织剪成约1 mm3大小的组织块,把组织块夹到15 mL离心管,分别滴加0.2%Ⅱ型胶原酶5 mL和0.25%胰蛋白酶6 mL,各消化10 min,消化结束后,滴加内含5%胎牛血清、1%内皮细胞生长因子和1%青霉素/链霉素的ECM终止消化,200目金属筛网过滤,1 200 r·min-1离心8 min,弃上清,用2 mL ECM反复吹打,直到混成单细胞悬液,将细胞悬液接种到培养瓶中,每个培养瓶再加入2 mL ECM,轻轻摇晃,使细胞分散,放到37 ℃、5% CO2细胞培养箱中培养6 h,倒出培养液,滴加ECM继续培养,以后每3 d换液1次,并在倒置显微镜下观察细胞生长状态。采用Dil-Ac-LDL吞噬实验鉴定MMVEC,鉴定方法参照文献[6]。
2.3 qPCR检测MMVEC eNOS、PI3K、Akt基因表达目的基因eNOS、PI3K、Akt及内参GAPDH引物序列见Tab 1。用Applied Biosystems 7300 Fast Real-Time PCR system进行PCR扩增。采用公式2-ΔΔCt计算MMVEC各基因相对表达量。
| Gene | Accession no. | Primer (5′→3′) |
Length /bp |
| eNOS | NM_021838.2 | F:CAAGACCGATTACACGACATTGAGA | 148 |
| R:TGAGGACTTGTCCAAACACTCCAC | |||
| Akt | NM_033230.2 | F:ATGGACTTCCGGTCAGGTTCA | 126 |
| R:GCCCTTGCCCAGTAGCTTCA | |||
| PI3K | XM_017602181.1 | F:TCAAGCAAGAGAAGAAGGATGAGA | 118 |
| R:GCAGGATTTAGAGGGGACAGAA | |||
| GAPDH | NM_017008.3 | F:GGCACAGTCAAGGCTGAGAATG | 143 |
| R:ATGGTGGTGAAGACGCCAGTA |
当细胞长满90%时,倒掉细胞培养基,每瓶MMVEC中加入500 μL配好的混合液(每1 mL冷的蛋白裂解液加入10 μL增强型RIPA裂解液和10 μL磷酸酶抑制剂),裂解,提取MMVEC蛋白,蛋白定量后煮沸,SDS-PAGE恒压电泳分离蛋白质后,转印蛋白于PVDF膜,封闭液摇床1 h,将膜分别放入装有相应比例稀释的一抗中,4 ℃孵育14~24 h,洗膜后,将膜放入二抗稀释液稀释的红外荧光染料标记的羊抗兔IgG二抗中(1 :15 000),摇床上室温避光孵育1 h。采用Odyssey双色红外荧光成像系统扫膜,保存图片。用Odyssey扫膜软件分析各条带的灰度值,结果以目的条带和内参条带的灰度值比值来表示该蛋白的表达水平。
2.5 统计学方法采用SPSS 20.0软件进行统计学分析,数据以x±s表示。组间均数比较采用方差分析(One-way ANOVA);若方差不齐则采用秩和检验分析。组间两两比较运用S-N-K法。
3 结果 3.1 MMVEC的形态学观察取部分原代培养d 3的细胞在倒置显微镜下观察可见,细胞大部分已贴壁,体积较小,多数呈短梭状,少数呈多角形或三角形,散在单层排列(Fig 1A)。随着培养天数的增加,细胞生长迅速,大部分细胞已完全伸展开,体积变大,呈梭形、三角形或多角形。培养至d 5,贴壁细胞较多,几乎长满瓶底,呈现典型内皮细胞的铺路石样结构(Fig 1B)。
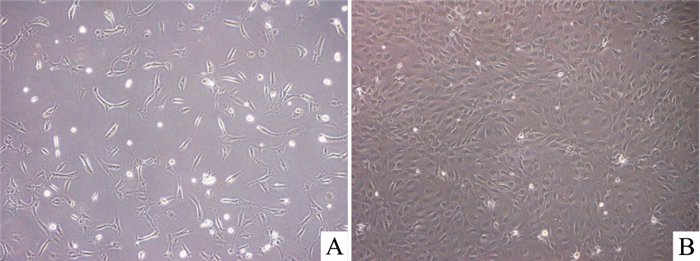
|
| Fig 1 MMVEC morphology(×200) A: Cultured for 3 d; B: Cultured for 5 d. |
取培养至d 5的原代细胞,采用Dil-Ac-LDL吞噬实验鉴定。细胞经Dil-Ac-LDL染色后,于荧光倒置显微镜下观察,细胞呈现红色荧光,其阳性表达率 > 95%(Fig 2),说明该细胞为MMVEC。阴性对照细胞不能观察到荧光。
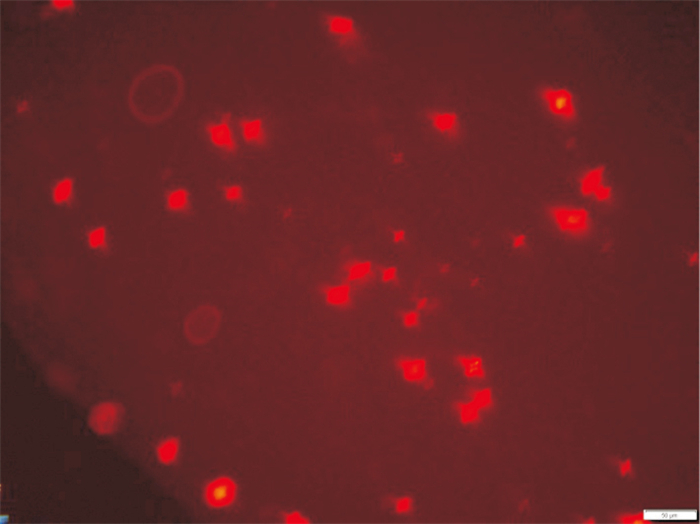
|
| Fig 2 Dil-Ac-LDL dyed picture of MMVEC (×200) |
如Tab 2所示,缩窄腹主动脉6周后,模型组和L-NAME组大鼠MMVEC eNOS、PI3K、Akt mRNA表达均明显下调(P < 0.05);L-NAME组大鼠MMVEC eNOS mRNA表达比模型组下调更明显(P < 0.05),但合用MHBFC后,被抑制的eNOS、PI3K、Akt mRNA表达明显上调(P < 0.05);另外,MHBFC预处理组eNOS、PI3K、Akt mRNA表达明显上调(P < 0.05)。
| Group | eNOS/GAPDH | PI3K/GAPDH | Akt/GAPDH |
| Sham-operated | 1.01±0.07 | 1.00±0.09 | 1.01±0.05 |
| Model | 0.56±0.09# | 0.43±0.09# | 0.47±0.07# |
| MHBFC 6 mg·kg-1 | 0.79±0.09#* | 0.87±0.07#* | 0.78±0.06#* |
| MHBFC 12 mg·kg-1 | 0.93±0.10* | 0.95±0.04* | 0.95±0.07* |
| MHBFC 12 mg·kg-1+ L-NAME 50 mg·kg-1 |
0.65±0.12#△ | 0.69±0.10#*△ | 0.65±0.07#*△ |
| L-NAME 50 mg·kg-1 | 0.34±0.09#* | 0.35±0.08# | 0.38±0.09# |
| #P < 0.05 vs sham-operated; *P < 0.05 vs model; △P < 0.05 vs L-NAME 50 mg·kg-1 | |||
如Fig 3、Tab 3所示,缩窄腹主动脉6周后,模型组和L-NAME组大鼠MMVEC p-eNOS、p-PI3K和p-Akt蛋白表达均明显下调(P < 0.05),总eNOS、PI3K和Akt蛋白表达水平也下调,但各组间总的eNOS、PI3K和Akt蛋白表达水平差异无统计学意义。合用MHBFC后,被抑制的MMVEC p-eNOS、p-PI3K和p-Akt蛋白表达明显上调(P < 0.05);另外,MHBFC预处理组MMVEC p-eNOS、p-PI3K和p-Akt蛋白表达明显上调(P < 0.05)。
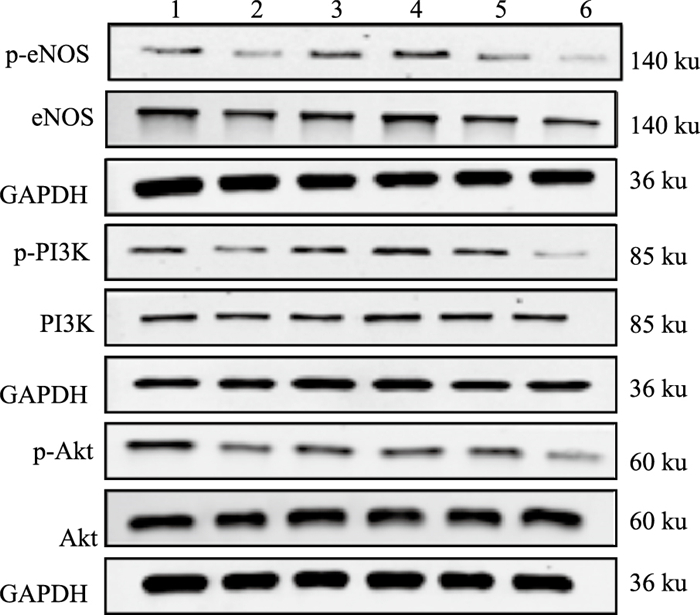
|
| Fig 3 Representative Western blot bands of p-eNOS, eNOS, p-Akt, Akt, p-PI3K, PI3K and GAPDH 1: Sham-operated group; 2: Model group; 3: MHBFC 6 mg·kg-1 group; 4: MHBFC 12 mg·kg-1 group; 5: MHBFC 12 mg·kg-1 +L-NAME 50 mg·kg-1 group; 6: L-NAME 50 mg·kg-1 group. |
| Group | p-eNOS/eNOS | p-PI3K/PI3K | p-Akt/Akt |
| Sham-operated | 0.55±0.14 | 0.97±0.09 | 0.98±0.08 |
| Model | 0.14±0.03# | 0.32±0.04# | 0.32±0.05# |
| MHBFC 6 mg·kg-1 | 0.40±0.13* | 0.69±0.13#* | 0.66±0.10#* |
| MHBFC 12 mg·kg-1 | 0.52±0.16* | 0.88±0.12* | 0.87±0.09* |
| MHBFC 12 mg·kg-1+ L-NAME 50 mg·kg-1 |
0.16±0.03#△ | 0.53±0.08#*△ | 0.55±0.11#*△ |
| L-NAME 50 mg·kg-1 | 0.07±0.03#* | 0.29±0.03# | 0.27±0.07# |
| #P < 0.05 vs sham-operated; *P < 0.05 vs model; △P < 0.05 vs L-NAME 50 mg·kg-1 | |||
通过缩窄腹主动脉诱导心室重构模型是目前常用的一种方法。缩窄大鼠的腹主动脉会导致后负荷迅速增加,在短时间内很容易导致心肌肥厚,一般造模4周就可出现心血管重构的主要病理生理性改变[7]。内皮功能障碍会导致血管舒缩功能障碍、内皮通透性增加、血小板黏附聚集、细胞因子产生等,促进心室重构向心衰发展。尤其是血管内皮细胞的损伤会导致高血压、动脉粥样硬化、冠心病等血管损伤性疾病。由eNOS合成的NO能调节血管张力,抑制血小板黏附与聚集,改善血管内皮舒张功能,改善血流剪切应力,保护内皮细胞[8]。
研究表明,内皮细胞的分泌功能是非常强大的,其中MMVEC不仅可以调节血管的舒缩功能、血管壁的通透性、细胞生长和增殖等,而且还能释放一些生物活性物质,如NO、前列环素、血管紧张素Ⅱ、内皮素-1等,调节心肌组织功能[9]。本实验选择MMVEC作为研究对象,大鼠造模给药结束后,采用酶化学消化法分离培养大鼠原代MMVEC,分离获得的MMVEC表现典型的铺路石样结构,而且通过采用比较公认的Dil-Ac-LDL吞噬实验鉴定,证实该细胞为MMVEC。该分离培养方法获得的MMVEC纯度高,数量多,生长状态良好且长得快,是目前分离培养原代MMVEC较成熟的一种方法。前期研究发现MHBFC能改善MMVEC的分泌功能,增加NO合成和释放,抑制MMVEC凋亡,发挥抗心肌肥大作用,逆转大鼠压力超负荷心室重构。
eNOS-NO信号通路介导MMVEC中的eNOS催化产生保护性的NO,在压力超负荷心室重构中主要表现为抗心肌肥大作用。L-NAME是NOS抑制剂,其能抑制NOS活性,减少NO生成,不仅可以升高血压,而且还会促进左心室重构发生和发展[10]。单独给予NOS阻断剂L-NAME 6周后,MMVEC p-eNOS蛋白表达比模型组明显降低,但合用MHBFC组MMVEC p-eNOS蛋白表达水平比模型组上调,且eNOS蛋白磷酸化表达水平明显高于L-NAME组。提示MHBFC能提高eNOS酶活性,增加NO含量,且该调控机制可能与MHBFC能明显增加eNOS蛋白磷酸化水平有关。
eNOS可在多个丝∕苏氨酸位点上发生磷酸化或去磷酸化反应,从而调节eNOS酶活性及NO的产量。研究已经证实,提高eNOS活性,增加p-eNOS的表达量具有明显的降压和抗心肌肥大作用[11]。另外,PI3K和Akt是eNOS-NO信号通路上游的重要调控因子,在调节心肌细胞生长、心肌肥大和心力衰竭的发展进程中起着重要作用[12]。激活PI3K/Akt信号通路,能上调p-Akt的表达,降低细胞凋亡,改善心肌肥大,逆转心室重构[13-14]。研究发现,MHBFC预处理组MMVEC eNOS、PI3K和Akt蛋白磷酸化水平比模型组均明显上调,且MMVEC eNOS、PI3K、Akt mRNA表达也明显上调,但L-NAME组MMVEC eNOS蛋白磷酸化水平及eNOS mRNA相对表达水平比模型组明显降低,而合用MHBFC组MMVEC eNOS、PI3K和Akt蛋白磷酸化水平及基因表达水平比L-NAME组均明显上调。提示MHBFC增加MMVEC eNOS蛋白磷酸化和基因表达,与其增加eNOS-NO信号通路上游的MMVEC p-PI3K和p-Akt蛋白的表达及MMVEC PI3K、Akt mRNA表达有关。
综上所述,MHBFC逆转压力超负荷心室重构的调控机制可能是通过增加eNOS-NO信号通路上游MMVEC PI3K和Akt蛋白磷酸化,以及增加MMVEC PI3K、Akt mRNA表达,进而增加MMVEC eNOS蛋白磷酸化及eNOS mRNA表达,激活eNOS-NO信号通路,从而对压力超负荷引起的心肌损伤产生保护作用。激活eNOS-NO信号通路后,MHBFC具体如何发挥保护心肌损伤作用,还需进一步研究。
| [1] | Kelly T N, Gu D, Chen J, et al. Hypertension subtype and risk of cardiovascular disease in Chinese adults[J]. Circulation, 2008, 118(15): 1558-66. doi:10.1161/CIRCULATIONAHA.107.723593 |
| [2] | Byrne N J, Levasseur J, Sung M M, et al. Normalization of cardiac substrate utilization and left ventricular hypertrophy precede functional recovery in heart failure regression[J]. Cardiovasc Res, 2016, 110(2): 249-57. doi:10.1093/cvr/cvw051 |
| [3] | 简洁, 黄建春, 焦杨, 等. 制备液相色谱分离制备玉郎伞查尔酮类化合物[J]. 中草药, 2011, 42(7): 1313-6. Jian J, Huang J C, Jiao Y, et al. Isolation and preparation of chalcone compounds from tuber of Millettia pulchra var. laxior by pre-HPLC[J]. Chin Tradit Herb Drugs, 2011, 42(7): 1313-6. |
| [4] | Huang J, Tang X, Liang X, et al. The effects of 17-methoxyl-7-hydroxy-benzene-furanchalcone on the pressure overload-induced progression of cardiac hypertrophy to cardiac failure[J]. PLoS One, 2014, 9(3): e91834. doi:10.1371/journal.pone.0091834 |
| [5] | Feng B, Zhang Q, Wang X, et al. Effect of andrographolide on gene expression profile and intracellular calcium in primary rat myocardium microvascular endothelial cells[J]. J Cardiovasc Pharmacol, 2017, 70(6): 369-81. |
| [6] | 辛毅, 许秀芳, 黄益民, 等. 小鼠心肌微血管内皮细胞的原代培养及生物学特性[J]. 中国病理生理杂志, 2013, 29(3): 565-70. Xin Y, Xu X F, Huang Y M, et al. Biological characteristics of primarily cultured microvascular endothelial cells in mouse myocardium[J]. Chin J Pathophysiol, 2013, 29(3): 565-70. doi:10.3969/j.issn.1000-4718.2013.03.033 |
| [7] | Lewalle A, Land S, Carruth E, et al. Decreasing compensatory ability of concentric ventricular hypertrophy in aortic-banded rat hearts[J]. Front Physiol, 2018, 9: 37. doi:10.3389/fphys.2018.00037 |
| [8] | 张伟, 刘晓丹, 李菲, 等. 血府逐瘀汤调控内皮祖细胞修复损伤血管内皮的研究[J]. 中国药理学通报, 2016, 32(3): 427-33. Zhang W, Liu X D, Li F, et al. Influence of Xuefuzhuyu decoction on EPC repairing injured vascular endothelium[J]. Chin Pharmacol Bull, 2016, 32(3): 427-33. doi:10.3969/j.issn.1001-1978.2016.03.025 |
| [9] | Zhou Q, Meng G, Teng F, et al. Effects of astragalus polysaccharide on apoptosis of myocardial microvascular endothelial cells in rats undergoing hypoxia/reoxygenation by mediation of the PI3K/Akt/eNOS signaling pathway[J]. J Cell Biochem, 2018, 119(1): 806-16. doi:10.1002/jcb.26243 |
| [10] | Bunbupha S, Prachaney P, Kukongviriyapan U, et al. Asiatic acid alleviates cardiovascular remodelling in rats with L-NAME-induced hypertension[J]. Clin Exp Pharmacol Physiol, 2015, 42(11): 1189-97. doi:10.1111/1440-1681.12472 |
| [11] | 付剑江, 王曦聆, 吕红, 等. 罗布麻叶提取物的抗高血压作用及其机制研究[J]. 中国实验方剂学杂志, 2013, 19(7): 159-64. Fu J J, Wang X L, Lyu H, et al. Anti-hypertensive effects of extracts from leaves of Apocynum venetum through activating PI3K/Akt pathway on human endothelial cells[J]. Chin J Exp Tradit Med Form, 2013, 19(7): 159-64. |
| [12] | Ou H C, Lee W J, Lee S D, et al. Ellagic acid protects endothelial cells from oxidized low-density lipoprotein-induced apoptosis by modulating the PI3K/Akt/eNOS pathway[J]. Toxicol Appl Pharmacol, 2010, 248(2): 134-43. doi:10.1016/j.taap.2010.07.025 |
| [13] | 余娅, 王虹又, 易宗平, 等. 帕瑞昔布对大鼠心梗后心室重构的改善作用及对PI3K/Akt信号通路的影响[J]. 中国药理学通报, 2017, 33(6): 863-8. Yu Y, Wang H Y, Yi Z P, et al. Improvement effects of parecoxib on ventricular remodeling after acute myocardial infarction in rats and its influence in PI3K/Akt signaling pathway[J]. Chin Pharmacol Bull, 2017, 33(6): 863-8. doi:10.3969/j.issn.1001-1978.2017.06.023 |
| [14] | Chang W, Wu Q Q, Xiao Y, et al. Acacetin protects against cardiac remodeling after myocardial infarction by mediating MAPK and PI3K/Akt signal pathway[J]. J Pharmacol Sci, 2017, 135(4): 156-63. doi:10.1016/j.jphs.2017.11.009 |

