


2. 重庆医科大学药理学教研室,重庆 400016
 ,
SHAO Ying1,2,
ZHU Jia-hui1,2,
LIAO Yun-peng1,2,
MA Yan1,2,
REN Wen-yan1,2,
ZHOU Lin-yun1,2,
WU Ke1,2,
HE Bai-cheng1,2
,
SHAO Ying1,2,
ZHU Jia-hui1,2,
LIAO Yun-peng1,2,
MA Yan1,2,
REN Wen-yan1,2,
ZHOU Lin-yun1,2,
WU Ke1,2,
HE Bai-cheng1,2

2. Dept of Pharmcology, Pharmacy School of Chongqing Medical University, Chongqing 400016, China
罗格列酮(rosiglitazone, RSG)可作为过氧化物酶体增殖体活化受体γ(peroxisome proliferator-activated receptor γ, PPARγ)的激动剂,对2型糖尿病有明显治疗效果。但RSG长期使用后可明显致骨质疏松,尤其是对年老女性患者[1]。据报道,RSG及其同类药物可诱导骨髓间充质干细胞(bone marrow stromal cells, bMSCs)向脂肪细胞分化[2],打破骨形成与骨吸收之间的平衡,引起骨质疏松。目前,临床上主要使用RSG与二磷酸盐联用治疗2型糖尿病,预防由RSG所引起的骨质疏松[3]。但是,二磷酸盐本身也存在很多严重不良反应,如房颤等[4]。因此,二磷酸盐类药物可能并非预防RSG所致骨质疏松的最佳选择。
间充质干细胞是一种具有多向分化潜能的干细胞[5-6],包括bMSCs以及C3H0T1/2和C2C12等。小鼠胚胎成纤维细胞(mouse embryonic fibroblasts, MEFs)也具有多向分化潜能,可定向分化为成骨或脂肪细胞等。MEFs易于获取,且基因组未进行任何修饰,可能更适合用于干细胞定向分化研究。PPARγ是调节成脂分化关键的转录因子之一[7-8],通过与类视黄醇X受体(retinoid X receptor,RXR)结合,调节bMSCs或其他干细胞向脂肪细胞分化。研究表明,PPARγ对干细胞向成骨细胞分化也具有促进作用[9]。因此,RSG可能对干细胞的成脂和成骨分化均具有重要作用。全反式维甲酸(all-trans retinoic acid,ATRA)是维生素A的重要代谢物之一,在胚胎和个体发育中具有重要的调节作用[10]。ATRA与维甲酸受体(retinoic acid receptor,RAR)或RXR结合,发挥对机体各种生物过程的调节作用[10-11]。研究表明,ATRA可促进骨形态发生蛋白9(bone morphogenetic protein 9, BMP9)诱导前体脂肪细胞骨向分化的作用[12]。因此,RSG与ATRA合用可能对干细胞骨向分化有调节作用。本研究主要分析RSG与ATRA联合应用能否诱导干细胞定向骨分化,及介导该过程的可能分子机制。
1 材料与方法 1.1 材料 1.1.1 实验动物与细胞株NIH孕鼠(E12.5)购于重庆医科大学实验动物中心。成肌细胞C2C12和间充质干细胞C3H10T1/2购买于美国ATCC(American Type Culture Collection)。实验所用的细胞培养条件为5% CO2和37℃,采用高糖DMEM(含10%胎牛血清、100 kU·L-1青霉素、0.1 g ·L-1链霉素)进行培养。
1.1.2 试剂一抗OPN、OCN、RUNX2、Smad1/5/8、p-Smad1/5/8、GAPDH、C/EBPα等,均购自Santa Cruz Biotechnology公司。ATRA由重庆华邦制药馈赠;罗格列酮购自Sigma-Aldrich公司,二者均采用DMSO为溶媒。
1.1.3 仪器CO2培养箱(美国Thermo公司), 倒置荧光显微镜(日本Nikon),化学发光和荧光测定仪(美国BIOSCAN公司),台式低温离心机(美国Thermo公司),定量PCR仪(Bio-Rad公司),垂直电泳槽、湿式转膜仪(北京六一)。
1.2 小鼠胚胎成纤维细胞(MEFs)的提取MEFs细胞从NIH小鼠12.5 d的胚胎中提取获得。将胎鼠去除内脏后,用手术刀切成小块,用1 mL 0.25%的胰蛋白酶在37℃消化15 min,然后加入10 mL含血清的DMEM培养基终止消化。最后,将其放入100 mm的培养皿中37℃培养24 h,贴壁的细胞即为MEFs。
1.3 RNA提取以及聚合酶链反应将细胞种到T25培养瓶中,按实验设计用相应因素处理。采用TRIzol法提取总RNA,然后通过逆转录反应得到cDNA。将得到的cDNA稀释10倍,作为定量PCR和常规PCR的模板。实验所涉及到的引物序列详见Tab 1。
| Gene | Sequence (5′→3′) | |
| PPARγ | F | TTTTCAAGGGTGCCAGTTTC |
| R | AATCCTTGGCCCTCTGAGAT | |
| RXRα | F | ACCCAGTTAGGGTGGGAATC |
| R | AACTGGGGGACATGACAGAG | |
| RXRβ | F | GGCAACACTTAGCAGGGTTC |
| R | GCCAAATGAGAAGGAAGCAG | |
| RXRγ | F | TGTGGTCAACAGTGTCAGCA |
| R | AGAAGCCTTTGCAACCTTCA | |
| RARα | F | TCTCCCTGGACATTGACCTC |
| R | GTGTCTTGCTCAGGCGTGTA | |
| RARβ | F | AATGCCACCTCTCATTCAGG |
| R | GAATGTCTGCAACAGCTGGA | |
| RARγ | F | AGGCAGCAGACTGACCATTT |
| R | TTCTGGTAGGTGTGCAGCAG | |
| Smad6 | F | GTGTTGCAACCCCTACCACT |
| R | GACATGCTGGCATCTGAGAA | |
| Smad7 | F | GCATCTTCTGTCCCTGCTTC |
| R | CCGGTCTTCCTTTCCTTTTC | |
| GAPDH | F | ACCCAGAAGACTGTGGATGG |
| R | CACATTGGGGGTAGGAACAC |
将细胞用0.25%的胰酶消化后接种到6孔板中,细胞贴壁后,分别加入RSG、ATRA或RSG+ATRA等处理因素。加入同体积的DMSO作为对照组,ATRA和RSG的终浓度分别是0.4 μmol·L-1和20 μmol·L-1。分别提取1、2、9、11 d的蛋白后,用10%的聚丙烯胺凝胶进行电泳,按常规Western blot实验进行操作。最后用凝胶成像仪进行成像。结果均重复3次。
1.5 碱性磷酸酶(alkaline phosphatase,ALP)活性检测将细胞用0.25%的胰酶消化后接种到24孔板培养板中,用RSG、ATRA、RSG+ATRA分别处理MEFs细胞(同体积的DMSO作为空白对照组),ATRA和RSG的浓度分别为0.4 μmol·L-1和20 μmol·L-1。于d 5、7按BCIP/NBT碱性磷酸酶显色试剂盒说明书进行染色,检测ALP的活性。每组实验重复3次。
1.6 茜素红染色将细胞消化后接种到24孔细胞培养板,并按实验设计加入相应处理因素。细胞培养21 d后进行茜素红染色,检测基质矿化的形成情况。步骤简述如下:弃去培养基后,PBS洗3次,加入2.5%戊二醛固定20 min,弃戊二醛后,用pH为4.2的PBS洗1次,再用茜素红工作液孵育30 min。最后,弃染液并用水清洗即可。每组实验重复3次。
1.7 油红O染色将细胞种于24孔培养板中,并加入相应处理因素,于14 d后,进行油红O染色。弃去培养基后PBS洗2遍,10%甲醛固定30 min后,用PBS清洗。用新鲜配制的油红O工作液孵育30 min,用水清洗后进行拍照。每组实验重复3次。
1.8 萤光素酶报告质粒检测实验将细胞消化后种到T25培养瓶中,待细胞贴壁后采用Lipofectamine 2000转染2 μg报告质粒。16 h后,将细胞重新消化并种于24孔细胞培养板,在细胞贴壁后加入相应因素进行处理。24 h后将细胞裂解,按试剂盒操作说明测定报告质粒转录活性。采用BCA法测定总蛋白浓度,用于校正萤光素酶活性。每组实验重复3次。
1.9 统计学分析数据用x±s表示。利用Microsoft的Excel进行统计分析。本实验结果为多组比较宜选用方差分析(F检验),再作两两比较。
2 结果 2.1 PPARγ、RAR、RXR受体及其亚型在干细胞中的表达情况本研究主要目的是分析RSG诱导的干细胞成脂分化是否可以在ATRA存在的情况下向成骨分化。RSG是PPARγ的激动剂,而ATRA则是RAR和RXR的激动剂。因此,本研究首先分析这些受体在干细胞中的表达情况。Fig 1定量PCR检测结果显示,以上受体在C2C12、C3H10T1/2、MEFs等细胞中均有表达。结果提示,RSG和ATRA在这些干细胞中可与相应的受体相结合发挥调控功能。由于MEFs是原代细胞,其基因组未经过任何修饰,所以本研究选用MEFs进行后续实验。

|
| Fig 1 Endogenous expression of PPARγ, RXR and RAR in C2C12, C3H10T1/2 and MEFs 1:PPARγ; 2:RXRα; 3:RXRβ; 4:RXRγ; 5:RARα; 6:RARβ; 7:RARγ. Quantitative PCR analysis results showed the endogenous expression level of PPARγ and the different isoforms of RXR and RAR in the available cell lines and MEFs. The results were expressed as the ratio of mRNA expression level of each receptor to corresponding GAPDH expression |
本研究首先检测RSG或ATRA在MEFs细胞中对ALP活性的影响。结果表明,ATRA浓度依懒性地明显增强MEFs细胞中ALP活性,即使浓度在0.1 μmol·L-1时也具有促进作用(Fig 2A、2C)。RSG能增强MEFs细胞的ALP活性,但所需最低浓度明显高于ATRA(Fig 2B、2D)。以上结果表明,RSG或ATRA都有增加MEFs细胞ALP活性的潜能。本研究进一步分析RSG和ATRA之间是否存在协同诱导MEFs细胞ALP活性的作用。结果显示,在MEFs细胞中,RSG可促进ATRA诱导的ALP活性(Fig 2E);同样,ATRA也明显促进RSG诱导的ALP活性。以上结果提示,RSG与ATRA或许可以促进MEFs细胞定向骨分化。

|
| Fig 2 Effects of RSG or/and ATRA on ALP activities in MEFs A: ALP staining results showed the effect of ATRA on ALP activities in MEFs; B: ALP staining results showed the effect of RSG on ALP activities in MEFs; C: ALP activity assay results showed the effect of ATRA on ALP activities in MEFs; D: ALP activity assay results showed the effect of RSG on ALP activities in MEFs. **P < 0.01 vs control; E: ALP staining results showed the effect of RSG on ATRA-induced ALP activities in MEFs; F: ALP staining results showed the effect of ATRA on RSG-induced ALP activities in MEFs; G: ALP activities assay results showed the effect of RSG on ATRA-induced ALP activities in MEFs; H: ALP activities assay results showed the effect of ATRA on RSG-induced ALP activities in MEFs. ##P < 0.01 vs control group; **P < 0.01 vs RSG or ATRA treated group. |
虽然RSG与ATRA合用可增强MEFs细胞中ALP的活性,但还不足以说明两者联用可促进骨干细胞分化。因此,本研究继续进行相关成骨分化实验分析。Western blot分析结果显示,RSG合用ATRA不仅促进OPN和OCN表达(Fig 3A),还明显诱导钙盐沉积(Fig 3B~3D)。但RSG或ATRA单独处理MEFs细胞时,并未出现明显钙盐沉积。以上实验结果提示,RSG联合ATRA至少在体外可诱导MEFs细胞定向骨分化。

|
| Fig 3 Effects of RSG and/or ATRA on different osteogenic markers in MEFs A: Western blot assay results showed the effect of RSG and/or ATRA on the expression of OPN and OCN in MEFs. GAPDH was used as loading control; B: Alizarin Red S staining results showed the effect of RSG and/or ATRA on matrix mineralization in MEFs; C: Quantification results of Alizarin Red S staining showed the effect of RSG and/or ATRA on matrix mineralization in MEFs. **P < 0.01 vs control; D: Representative images for Alizarin Red S staining results showed the effect of RSG and/or ATRA on matrix mineralization in MEFs. |
以上结果证实,RSG联合ATRA可促进MEFs骨向分化,但相关作用分子机制目前尚不明确。RSG导致骨质疏松的主要原因是bMSCs向脂肪细胞分化所致。因此,ATRA联合RSG诱导MEFs骨向分化可能与干扰脂肪分化有关。油红O染色实验结果显示,RSG处理组脂滴增加明显,ATRA处理组无明显脂滴生成,RSG合并ATRA组脂滴生成明显减少(Fig 4A、4B)。Western blot结果显示,RSG在MEFs中明显诱导C/EBPα表达,ATRA抑制C/EBPα表达,且明显降低RSG诱导的C/EBPα表达(Fig 4C、4D)。以上结果提示,RSG与ATRA合用促进MEFs骨向分化的作用可能与ATRA抑制RSG诱导成脂分化有关。
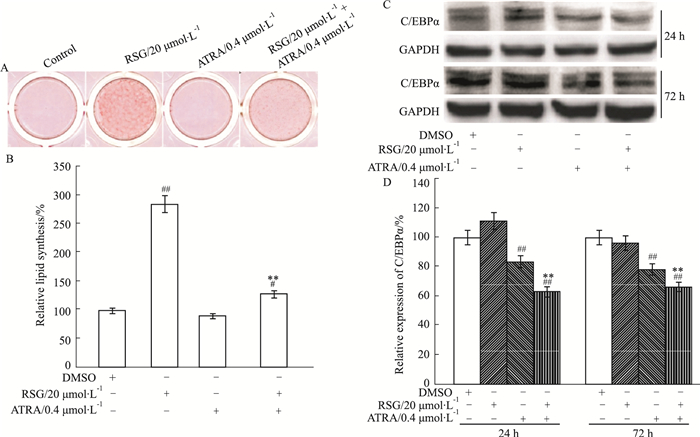
|
| Fig 4 Effects of RSG and/or ATRA on adipogenic differentiation in MEFs A: Oil Red O staining results showed the effect of RSG and/or ATRA on the adipogenesis in MEFs; B: Quantification of Oil Red O staining results showed the effect of RSG and/or ATRA on the adipogenesis in MEFs; C: Western blot assay results showed the effect of RSG and/or ATRA on the expression of C/EBPα in MEFs. GAPDH was used as loading control; D: Quantification of Western blot assay results showed the effect of RSG and/or ATRA on the expression of C/EBPα in MEFs. # P < 0.05, ##P < 0.01 vs control; **P < 0.01 vs RSG. |
Runx2是成骨分化调节重要的早期转录因子之一,报告质粒检测结果显示,ATRA联用RSG明显增加Runx2荧光素酶报告质粒的转录活性(Fig 5A);Western blot实验结果也显示,RSG与ATAR均增加Runx2表达,两者联合明显增加Runx2在MEFs细胞中的蛋白水平(Fig 5B)。作为一种重要的成骨分化转录调节因子,Runx2受到BMP/Smad信号调节。荧光素酶报告质粒分析结果显示,RSG对报告质料的转录活性无影响,ATRA可增加其转录活性;ATRA与RSG联合应用时报告质粒的转录活性明显增加(Fig 5C)。Western blot结果显示,RSG可增加p-Smad1/5/8的水平,但这种作用不如ATRA明显,两者合用明显增加p-Smad1/5/8的水平(Fig 5D)。PCR结果显示,ATRA与RSG合用明显增加Smad6的表达,但对Smad7表达有抑制作用(Fig 5E)。以上实验结果提示,ATRA与RSG联合应用促进MEFs骨向分化的机制可能也与增强BMP/Smad信号转导活性有关。

|
| Fig 5 Effects of RSG and/or ATRA on expression of Runx2 and BMPs/Smads signal transduction in MEFs A: Luciferase reporter assay results showed the effect of RSG and/or ATRA on the transcriptional activities of p6×OSE-Luc reporter; B: Western blot results showed the effect of RSG and/or ATRA on the expression of Runx2 in MEFs. GAPDH was used as loading control; C: BMPR Smads binding elements luciferase reporter (p12×SBE-Luc) assay results showed the effect of RSG and/or ATRA on the activation of BMPs/Smads signaling transduction in MEFs; D: Western blot assay results showed the effect of RSG and/or ATRA on the level of Smad1/5/8 and p-Smad1/5/8 in MEFs. GAPDH was used as loading control; E: PCR assay results showed the effect of RSG and/or ATRA on the expression of Smad6 and Smad7. *P < 0.05, **P < 0.01 vs control. |
RSG及其同类药物对2型糖尿病具有较好的治疗效果,但长期使用可导致骨质疏松。本研究发现,RSG与ATRA联用可以诱导MEFs定向骨分化。这种作用可能与RSG和ATRA联用抑制脂肪分化,以及增加BMP/Smad的信号转导活性有关。因此,ATRA可能对RSG及其类似药物所导致的骨质疏松具有预防或治疗作用。
RSG可增加机体对胰岛素的敏感性而对2型糖尿病有明显疗效。但由于RSG能促进bMSCs向脂肪细胞分化,所以长期使用可致骨质疏松,尤其是对年老的女性患者[1]。目前,临床上常用RSG与二磷酸盐合用治疗2型糖尿病,以减轻RSG对骨代谢平衡影响。二磷酸盐可在某种程度上预防骨密度的降低[7],但并不能抑制RSG诱导bMSCs成脂分化;同时,二磷酸盐本身也具有上消化道不良反应、下颌骨坏死以及房颤等不良反应[7]。因此,二磷酸盐类药物可能并不是预防RSG等所导致骨质疏松的最佳选择。虽然RSG作为PPARγ激动剂可诱导干细胞向脂肪细胞分化,但当PPARγ沉默后,干细胞骨向分化的能力同样也减弱。ATRA作为维生素A的重要代谢物之一,可与RAR或RXR结合形成异二聚体,发挥ATRA对机体生理功能的调节作用。目前,ATRA对干细胞骨向分化存有争议:有研究认为,ATRA能抑制成骨分化且在高浓度时会诱发骨质疏松[12];但课题组前期研究表明,ATRA能增加BMP9所诱导的干细胞成骨分化。这种不同的结果可能与ATRA的浓度(或剂量)、细胞种类以及诱导因子有关。以上研究提示,PPARγ信号可参与调节并促进干细胞骨向分化;同时,RSG与ATRA合用可能会促进干细胞骨向分化。
为此,本研究就RSG与ATRA合用对干细胞骨向分化的影响进行分析。目前,C2C12、C3H10T1/2及MEFs等常用于定向分化研究。由于C2C12与C3H10T1/2细胞为细胞系,其基因组存在人为修饰,故本研究采用原代MEFs进行实验。结果显示,RSG或ATRA均能增加MEFs的ALP活性,但RSG所需浓度更高;同时,RSG与ATRA合用协同增加ALP活性。RSG与ATRA合用能促进OPN和OCN表达及诱导钙盐沉积。提示,RSG与ATRA能诱导干细胞骨向分化。进一步分析结果显示,RSG能促进C/EBPα表达,但ATRA明显抑制RSG的这种作用。因此,RSG与ATRA合用诱导MEFs骨向分化的机制可能与ATRA抑制RSG诱导脂肪分化有关。虽然ATRA能抑制脂肪分化,且增加MEFs的ALP活性,但ATRA本身并不能诱导MEFs骨向分化。提示,ATRA与RSG合用促进干细胞骨向分化还与另外的机制有关。BMP/Smad信号是干细胞骨向分化的重要调节信号之一。分析结果显示,RSG与ATRA合用能促进Runx2表达,促进Smad1/5/8磷酸化和增加Smad6的mRNA水平。因此,RSG与ATRA合用促进MEFs骨向分化可能与增加BMP/Smad信号转导活性也有关。
综上所述,本研究发现RSG与ATRA联用可以诱导MEFs骨向分化, 机制可能与抑制脂肪分化和增加BMP/Smad信号转导活性有关。该发现为预防RSG及其同类药的骨质疏松不良反应提供了实验基础。
| [1] | Dakshinamurti K. Vitamins and their derivatives in the prevention and treatment of metabolic syndrome diseases (diabetes)[J]. Can J Physiol Pharmacol, 2015, 93(5): 355-62. doi:10.1139/cjpp-2014-0479 |
| [2] | 范丽君, 肖倩蓉, 林凯桑, 等. 大鼠脂肪干细胞和骨髓间充质干细胞向内皮分化的能力比较[J]. 南方医科大学学报, 2016, 36(9): 1247-54. Fan L J, Xiao Q R, Lin K S, et al. Comparison of endothelial differentiation capacity of adipose-derived stem cells and bone marrow mesenchymal stem cells from rats[J]. J Southern Med Univ, 2016, 36(9): 1247-54. doi:10.3969/j.issn.1673-4254.2016.09.15 |
| [3] | Guo X, Yang W, Ni J, et al. A role for suppressed bone formation favoring catch-up fat in the pathophysiology of catch-up growth after food restriction[J]. Eur J Nutr, 2011, 50(8): 645-55. doi:10.1007/s00394-011-0174-7 |
| [4] | Howard P A, Barnes B J, Vacek J L, et al. Impact of bisphosphonates on the risk of atrial fibrillation[J]. Am J Cardiovasc Drugs, 2010, 10(6): 359-67. doi:10.2165/11584720-000000000-00000 |
| [5] | Iglesias J E, Salum F G, Figueiredo M A, et al. Important aspects concerning alendronate-related osteonecrosis of the jaws: a literature review[J]. Gerodontology, 2015, 32(3): 169-78. doi:10.1111/ger.2015.32.issue-3 |
| [6] | James A W. Review of signaling pathways governing MSC osteogenic and adipogenic differentiation[J]. Scientifica (Cairo), 2013, 2013: 684736. |
| [7] | 洪海棉, 谢秀利, 洪桂祝, 等. 大黄素激活AMPK、PPARγ对3T3-L1脂肪细胞葡萄糖摄取的影响[J]. 中国药理学通报, 2015, 31(11): 1569-75. Hong H M, Xie X L, Hong G Z, et al. Activation of AMPK and PPARγ by emodin influences glucose uptake in 3 T3-L1 adipocytes[J]. Chin Pharmacol Bull, 2015, 31(11): 1569-75. doi:10.3969/j.issn.1001-1978.2015.11.018 |
| [8] | Liu Y, Liu Y, Zhang R, et al. All-trans retinoic acid modulates bone morphogenic protein 9-induced osteogenesis and adipogenesis of preadipocytes through BMP/Smad and Wnt/beta-catenin signaling pathways[J]. Int J Biochem Cell Biol, 2014, 47: 47-56. doi:10.1016/j.biocel.2013.11.018 |
| [9] | Murphy M B, Moncivais K, Caplan A I. Mesenchymal stem cells: environmentally responsive therapeutics for regenerative medicine[J]. Exp Mol Med, 2013, 45: e54. doi:10.1038/emm.2013.94 |
| [10] | Niger C, Luciotti M A, Buo A M, et al. The regulation of runt-related transcription factor 2 by fibroblast growth factor-2 and connexin 43 requires the inositol polyphosphate/protein kinase Cdelta cascade[J]. J Bone Miner Res, 2013, 28(6): 1468-77. doi:10.1002/jbmr.1867 |
| [11] | Piscitelli P, Auriemma R, Neglia C, et al. Alendronate: new formulations of an old and effective drug to improve adherence avoiding upper gastrointestinal side effects[J]. Eur Rev Med Pharmacol Sci, 2014, 18(24): 3788-96. |
| [12] | Sardone L D, Renlund R, Willett T L, et al. Effect of rosiglitazone on bone quality in a rat model of insulin resistance and osteoporosis[J]. Diabetes, 2011, 60(12): 3271-8. doi:10.2337/db10-1672 |
| [13] | Wang J H, Liu Y Z, Yin L J, et al. BMP9 and COX-2 form an important regulatory loop in BMP9-induced osteogenic differentiation of mesenchymal stem cells[J]. Bone, 2013, 57(1): 311-21. doi:10.1016/j.bone.2013.08.015 |
| [14] | Wang R N, Green J, Wang Z, et al. Bone morphogenetic protein (BMP) signaling in development and human diseases[J]. Genes Dis, 2014, 1(1): 87-105. doi:10.1016/j.gendis.2014.07.005 |
| [15] | 黄军, 刘映孜, 袁霜雪, 等. 环氧酶-2在骨形态蛋白9诱导间充质干细胞骨向分化中的作用研究[J]. 中国药理学通报, 2014, 30(7): 1006-11. Huang J, Liu Y Z, Yuan S X, et al. Effects of cyclooxygenase-2 on the bone differentiation of mesenchymal stem cells induced by bone morphogenetic protein 9[J]. Chin Pharmacol Bull, 2014, 30(7): 1006-11. doi:10.3969/j.issn.1001-1978.2014.07.026 |