


2. 贵州医科大学 贵州省药物制剂重点实验室,贵州 贵阳 550004;
3. 贵州医科大学 药学院,贵州 贵阳 550004
2. Guizhou Provincial Key Lab of Pharmaceutics, Guizhou Medical University, Guiyang 550004, China;
3. School of Pharmacy, Guizhou Medical University, Guiyang 550004, China
类风湿性关节炎(rheumatoid arthritis,RA)属于一种慢性、炎性、系统性的自身免疫性疾病。RA的发生可造成关节破坏、关节畸形、甚至残疾,同时还伴有发热、血管炎、贫血、淋巴肿大等关节外表现,RA在世界各地的各个种族均有发病,其成人患病率为1%[1-2]。目前用于治疗RA的西药由于长期使用和过度使用引起了严重的不良反应,因此,从天然药物中寻找治疗RA的药物已经成为热点[3]。黑骨藤(Periploca forrestii Schltr.)为传统的苗族用药材,主治风湿性关节痛、跌打损伤、月经不调等症,目前研究表明,黑骨藤主要含有强心苷类、C21甾类、萜类、黄酮类等化合物,其药理作用主要有抗炎、镇痛、抗RA等[4]。课题组前期研究发现,用乙醇提取黑骨藤,回收乙醇后的水溶解部分上D101大孔树脂,80%乙醇洗脱所得组分具有较好的抗RA作用[5],并对该组分进行了系统的化学成分研究,发现其含有大量咖啡酰基奎宁酸类化合物,该类成分在黑骨藤中首次报道[6]。为进一步探讨该组分抗RA的主要活性成分,本实验选取8个啡酰基奎宁酸类化合物进行体外抗MH7A细胞增殖的作用研究,并探讨其中活性较好的2个化合物作用的分子机制,为黑骨藤治疗RA提供理论基础。
1 材料与方法 1.1 材料 1.1.1 细胞株人类风湿性关节炎成纤维样滑膜细胞(MH7A)购自广东吉尼欧生物技术公司(细胞来源于日本RIKEN研究所生物资源中心)。
1.1.2 药物与试剂注射用甲氨蝶呤(MTX,江苏恒瑞医药股份有限公司,批号16031416);实验中的8个单体化合物由课题组前期分离得到[6],分别为1, 3-O-二咖啡酰基奎宁酸(1, 3-DCQA)、3, 4-O-二咖啡酰基奎宁酸(3, 4-DCQA)、3, 5-O-二咖啡酰基奎宁酸(3, 5-DCQA)、4, 5-O-二咖啡酰基奎宁酸(4, 5-DCQA)、5-O-咖啡酰基奎宁酸(5-CQA)、3-O-咖啡酰基奎宁酸(3-CQA)、4-O-咖啡酰基奎宁酸(4-CQA)、3-O-咖啡酰基奎宁酸甲酯(3-CQAMM)。DMEM高糖培养基、青霉素、链霉素溶液、胎牛血清(Gibco公司,批号分别8117013、J150023、1347575);0.25%的胰蛋白酶溶液(Hyclone公司,批号1785989);MTS试剂(Promega公司,批号0000163420);人TNF-α重组蛋白(Peprotech公司,批号0607B25);NO、IL-1β、PGE2试剂盒(南京建成生物公司,批号分别为S0021、20161021、20161028);COX-2、iNOS、NF-κB p65、IκB、p-IκB、ERK、p-ERK、JNK、p-JNK、p38、p-p38、β-actin抗体,以及辣根过氧化氢酶标记的山羊抗兔二抗(Abcam公司,批号分别为ab62331、ab178945、ab32536、ab32518、ab133462、ab184699、ab223500、ab179461、ab124956、ab32142、ab47363、ab179467、ab6721)。
1.1.3 仪器CO2培养箱、Fresco17型冷冻离心机(美国Thermo公司);TS100型倒置显微镜(日本Nikon公司);680型酶标仪(上海伯乐生命医学产品有限公司);PowerPacBasic型电泳仪、Trans-Blot Turbo型蛋白快速转印仪、GBOXChemiXL1.4型凝胶成像系统(美国Bio-Rad公司)。
1.2 方法 1.2.1 细胞培养MH7A细胞用含10%胎牛血清、100 mg·L-1链霉素、1×105 U·L-1青霉素的DMEM高糖培养液培养于37℃、5% CO2培养箱中。细胞2 d换1次液,每3~4 d进行传代,选取5~10代生长良好的细胞用于实验。
1.2.2 MTS法测定细胞增殖活性将MH7A细胞密度调整为1×108·L-1,接种于96孔培养板中,每孔100 μL,于37℃、5% CO2培养箱中培养24 h后,吸弃原培养液,用PBS洗2遍。实验设置空白组(加DMEM高糖培养液)、TNF-α模型组(50 μg·L-1 TNF-α)、MTX组(44 μmol·L-1 MTX + 50 μg·L-1 TNF-α)、各单体药物组(25、50、100、200 μmol·L-1各单体药物+ 50 μg·L-1 TNF-α),每孔100 μL,每个浓度设6个复孔。继续培养24 h,每孔加入MTS 5 μL,继续培养4 h,酶标仪490 nm波长处测定吸光度A值,计算细胞增殖抑制率。细胞增殖抑制率=(TNF-α模型组A值-药物组A值)/ TNF-α模型组A值×100%
1.2.3 MH7A细胞上清中NO、IL-1β、PGE2含量的测定实验方法及分组按“1.2.2”项下操作,细胞给药培养24 h后,分别吸取上清液。NO的测定按NO试剂盒说明书操作,于酶标仪540 nm波长处测定吸光度A值;IL-1β及PGE2的测定按ELISA相关试剂盒说明书操作,于酶标仪490 nm波长处测定。绘制标准曲线,计算样品中NO、IL-1β、PGE2的含量。
1.2.4 Western blot法检测MH7A细胞中相关蛋白表达将MH7A细胞密度调整为5×108·L-1,接种于6孔板中,每孔2 mL,于37℃、5% CO2培养箱中孵育24 h后,实验分为空白组(加DMEM高糖培养液)、TNF-α模型组(50 μg·L-1 TNF-α)、各单体药物组(200 μmol·L-1各单体药物+50 μg·L-1 TNF-α),每孔2 mL。继续培养24 h后,吸弃上清液,加入适量RIPA裂解液(含蛋白酶抑制剂或蛋白磷酸酶抑制剂),冰上裂解30 min,于4℃、12 000×g离心5 min,取上清,BCA法测定总蛋白浓度。取50 μg蛋白上样后,进行10% SDS-PAGE凝胶电泳,电泳结束后将蛋白转印至PVDF膜上,用5%牛血清蛋白封闭2 h。分别加入一抗COX-2(1:1 000)、iNOS(1:1 000)、NF-κB p65(1:25 000)、IκB(1:10 000)、p-IκB(1:10 000)、ERK(1:10 000)、p-ERK(1:400)、JNK(1:1 000)、p-JNK(1:5 000)、p38(1:5 000)、p-p38(1:500)或β-actin(1:5 000),室温振摇孵育2 h或4℃过夜。TBST洗膜、加入辣根过氧化氢酶标记的二抗(1:5 000),室温振摇孵育2 h。二抗孵育结束后,洗膜,ECL plus超敏化学发光液显色、曝光、拍照保存。采用Quantity one凝胶成像蛋白分析软件进行分析,结果以目的蛋白与内参蛋白灰度值的比值表示。
1.2.5 统计学处理实验数据以x±s表示,采用SPSS 13.0软件进行统计学分析,组间比较采用单因素方差分析和t检验。
2 结果 2.1 化合物对MH7A细胞增殖的影响与空白组相比,TNF-α模型组细胞明显增殖(P < 0.01);与TNF-α模型组相比,各给药组均不同程度地降低MH7A细胞的增殖(P < 0.05,P < 0.01),其相应的抑制率见Tab 1。在200 μmol·L-1浓度下,3-CQA抑制作用最为明显,抑制率为21.3%,其次是1, 3-DCQA,抑制率18.8%。
| Group | Dose/ μmol·L-1 |
Cell proliferation | NO /μmol·L-1 |
IL-1β /ng·L-1 |
PGE2 /ng·L-1 |
|
| A value | Inhibitory rate/% | |||||
| Control | - | 0.605±0.012 | - | 6.52±0.03 | 3.06±0.01 | 8.15±0.01 |
| Model | - | 0.712±0.007## | - | 14.77±2.13## | 6.77±0.01## | 16.82±0.02## |
| MTX | 44 | 0.595±0.003** | 16.4 | 7.97±0.66** | 3.57±0.00** | 6.67±0.08** |
| 3, 5-DCQA | 25 | 0.664±0.005* | 6.7 | 13.06±0.20 | 5.72±0.01** | 10.02±0.15** |
| 50 | 0.653±0.002* | 8.3 | 12.11±0.16* | 4.53±0.01** | 9.87±0.01** | |
| 100 | 0.617±0.004* | 13.3 | 9.65±1.54** | 3.88±0.02** | 9.15±0.02** | |
| 200 | 0.601±0.012** | 15.6 | 7.24±0.57** | 3.82±0.01** | 8.27±0.04** | |
| 3, 4-DCQA | 25 | 0.639±0.005* | 9.9 | 11.39±0.95* | 4.43±0.01** | 10.21±0.04** |
| 50 | 0.637±0.007* | 10.5 | 10.59±0.29** | 3.75±0.00** | 9.29±0.05** | |
| 100 | 0.625±0.013* | 12.2 | 7.92±0.42** | 3.67±0.02** | 8.50±0.25** | |
| 200 | 0.615±0.002** | 13.6 | 7.19±0.57** | 3.63±0.03* | 5.77±0.04** | |
| 4, 5-DCQA | 25 | 0.662±0.003* | 7.0 | 14.34±0.55 | 4.10±0.02** | 10.53±0.05** |
| 50 | 0.634±0.004* | 10.9 | 13.66±0.25 | 3.84±0.01** | 9.77±0.01** | |
| 100 | 0.613±0.003* | 13.9 | 8.87±0.39** | 3.76±0.01** | 7.97±0.04** | |
| 200 | 0.597±0.006 ** | 16.2 | 6.37±0.74** | 3.75±0.02* | 7.85±0.04** | |
| 1, 3-DCQA | 25 | 0.639±0.008* | 10.3 | 10.38±0.24** | 3.39±0.01** | 8.67±0.34** |
| 50 | 0.636±0.008* | 10.7 | 8.47±0.82** | 3.24±0.01** | 7.85±0.04** | |
| 100 | 0.629±0.012* | 11.7 | 7.29±0.12** | 2.38±0.02** | 6.89±0.10** | |
| 200 | 0.578±0.006** | 18.8 | 5.51±0.22** | 2.33±0.01** | 4.85±0.14** | |
| 5-CQA | 25 | 0.662±0.005* | 7.0 | 12.56±2.60* | 4.65±0.01** | 8.47±0.02** |
| 50 | 0.657±0.012* | 7.7 | 8.95±0.35** | 3.62±0.02** | 7.04±0.03** | |
| 100 | 0.653±0.010* | 8.3 | 6.72±0.17** | 3.58±0.00** | 6.73±0.08** | |
| 200 | 0.641±0.014** | 10.0 | 6.34±0.25** | 3.50±0.01** | 5.63±0.01** | |
| 3-CQA | 25 | 0.655±0.017* | 8.0 | 11.41±0.62* | 4.64±0.01** | 10.43±0.05** |
| 50 | 0.593±0.003** | 16.7 | 7.78±0.12** | 2.39±0.01** | 5.83±0.11** | |
| 100 | 0.576±0.013** | 19.1 | 6.28±0.24** | 2.16±0.01** | 5.47±0.03** | |
| 200 | 0.560±0.003** | 21.3 | 4.07±0.10** | 2.05±0.00** | 3.35±0.02** | |
| 4-CQA | 25 | 0.658±0.023* | 7.6 | 11.33±0.39* | 3.60±0.01** | 12.72±0.15** |
| 50 | 0.645±0.014* | 9.4 | 9.93±0.24** | 3.56±0.01** | 11.87±0.01** | |
| 100 | 0.640±0.008* | 10.1 | 7.39±0.32** | 2.87±0.01** | 11.36±0.01** | |
| 200 | 0.639±0.012** | 10.3 | 6.95±0.27** | 2.58±0.04** | 9.12±0.03** | |
| 3-CQAMM | 25 | 0.671±0.018* | 5.8 | 12.14±0.45* | 3.85±0.02** | 11.50±0.01** |
| 50 | 0.669±0.015* | 6.0 | 10.29±0.44** | 3.58±0.03** | 10.09±0.03** | |
| 100 | 0.665±0.020* | 6.6 | 8.79±0.68** | 3.24±0.01** | 6.74±0.12** | |
| 200 | 0.645±0.018* | 9.4 | 7.15±0.63** | 3.08±0.02** | 5.75±0.01** | |
| ##P < 0.01 vs control; *P < 0.05, **P < 0.01 vs TNF-α model | ||||||
与空白组相比,TNF-α可以明显诱导MH7A细胞分泌NO、IL-1β、PGE2(P < 0.01);与TNF-α模型组比较,各成分均可明显下调TNF-α诱导的MH7A细胞炎症因子NO、IL-1β、PGE2的释放(P < 0.05,P < 0.01),并呈现较好的浓度依赖性。其中3-CQA效果最为明显,其次是1, 3-DCQA。见Tab 1。
2.3 化合物对MH7A细胞COX-2、iNOS蛋白表达的影响“2.1”“2.2”项结果显示,当浓度为200 μmol·L-1时,各单体化合物中3-CQA效果最为明显(P < 0.01),其次是1, 3-DCQA(P < 0.01)。因此,我们选取了200 μmol·L-1的3-CQA和1, 3-DCQA进行机制研究。如Fig 1所示,与空白组比较,TNF-α模型组细胞中COX-2、iNOS蛋白表达明显升高(P < 0.01);与TNF-α模型组比较,3-CQA和1, 3-DCQA组均明显降低细胞中COX-2、iNOS蛋白表达(P < 0.01),且3-CQA的作用更明显。
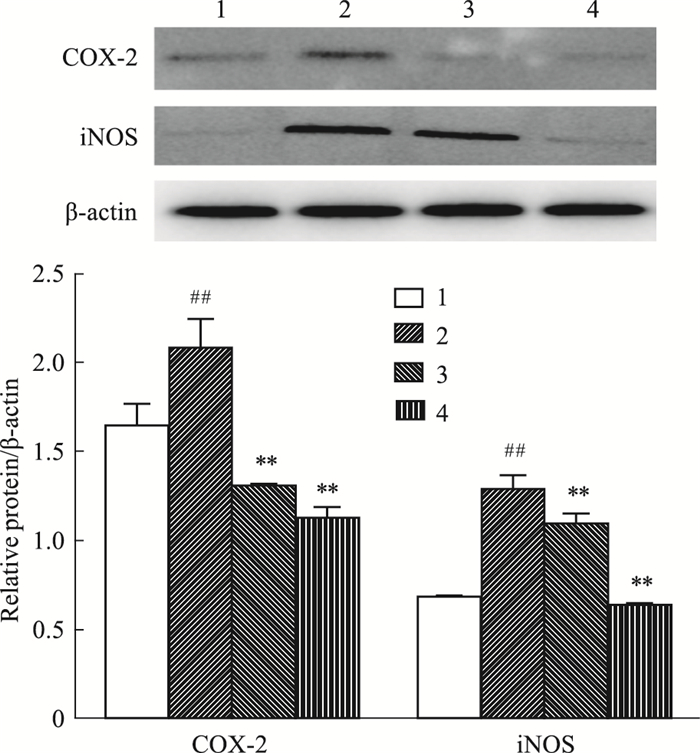
|
| Fig 1 Effect of monomeric compounds on protein expression levels of COX-2, iNOS in MH7A cells(x±s, n=3) 1:Control group; 2:TNF-α (50 μg·L-1) model group; 3:TNF-α +1, 3-DCQA (200 μmol·L-1) group; 4:TNF-α +3-CQA (200 μmol·L-1) group. ##P < 0.01 vs control group; **P < 0.01 vs TNF-α model group. |
如Fig 2所示,与空白组比较,TNF-α模型组细胞中NF-κB p65蛋白表达、IκB的磷酸化水平明显升高(P < 0.01);与TNF-α模型组比较,3-CQA和1, 3-DCQA组均明显降低细胞中NF-κB p65蛋白表达及IκB的磷酸化水平(P < 0.01),且3-CQA的作用更明显。
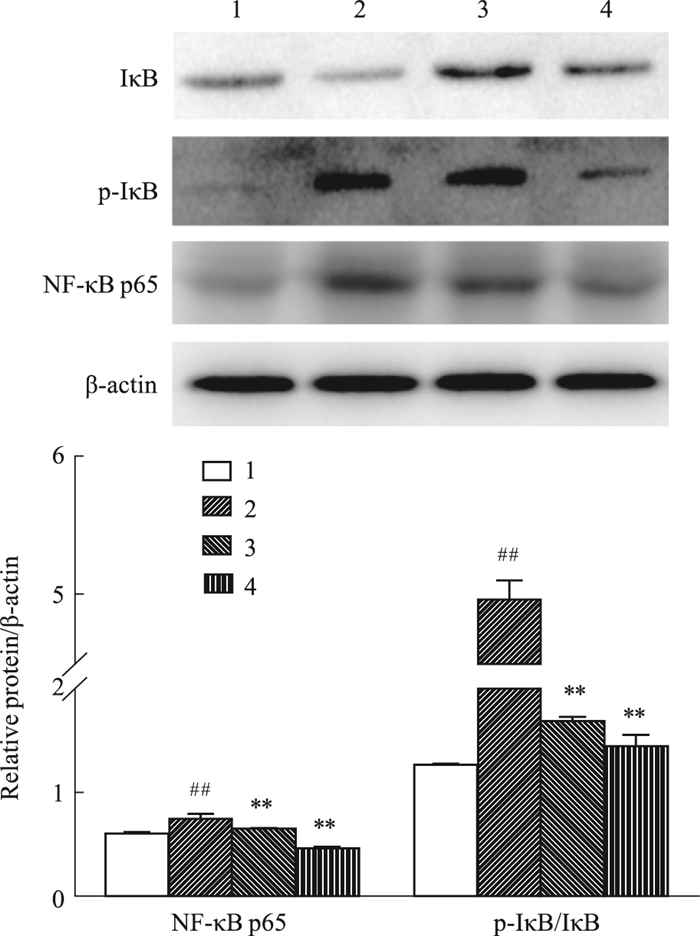
|
| Fig 2 Effect of monomeric compounds on expression levels of NF-κB p65, p-IκB/IκB in MH7A cells(x±s, n=3) 1:Control group; 2:TNF-α (50 μg·L-1) model group; 3:TNF-α + 1, 3-DCQA (200 μmol·L-1) group; 4:TNF-α + 3-CQA (200 μmol·L-1) group. ##P < 0.01 vs control group; **P < 0.01 vs TNF-α model group. |
如Fig 3所示,与空白组比较,TNF-α模型组细胞中p-ERK/ERK、p-JNK/JNK、p-p38/p38的比值明显升高(P < 0.01);与TNF-α模型组比较,3-CQA和1, 3-DCQA组均明显降低细胞中p-ERK/ERK、p-JNK/JNK、p-p38/p38的比值(P < 0.01),且3-CQA的作用更明显。
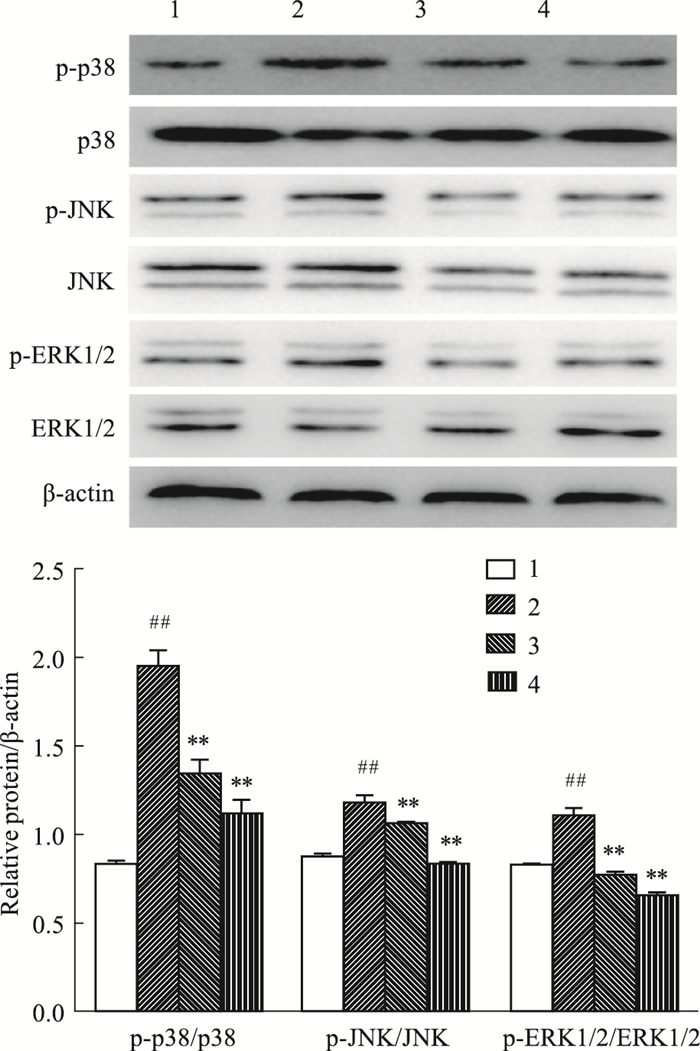
|
| Fig 3 Effect of monomeric compounds on protein expression levels of MAPK signal in MH7A cells(x±s, n=3) 1:Control group; 2:TNF-α (50 μg·L-1) model group; 3:TNF-α +1, 3-DCQA (200 μmol·L-1) group; 4:TNF-α +3-CQA (200 μmol·L-1) group. ##P < 0.01 vs control group; **P < 0.01 vs TNF-α model group. |
成纤维样滑膜细胞(fibroblast-like synoviocytes,FLS)是滑膜的组成部分,在RA的进程中起着至关重要的作用。RA-FLS的发展具有肿瘤细胞样的特性,它们还产生和释放促炎细胞因子、基质金属蛋白酶(matrix metalloproteinases,MMPs)和影响其他细胞的生长因子[7-8]。促炎细胞因子在RA的发病机制中起着重要的作用,其中,NO是炎症反应中的关键效应因子,其过量产生将导致一系列的炎性损伤。TNF-α是炎症反应的重要因素之一,TNF-α的过度表达,参与炎症反应通路,引起滑膜的炎症和关节损伤,并能诱导其他细胞因子的产生,如IL-1、IL-6、IL-8等[9]。IL-1β涉及多种慢性炎症疾病,在诱发滑膜炎症中起关键作用,同时它也是诱导PGE2和MMPs,导致骨吸收和软骨破坏的关键介质[10]。本研究采用50 μg·L-1的TNF-α活化MH7A细胞,发现黑骨藤80%乙醇组分中8个咖啡酰基奎宁酸类化合物均可不同程度抑制TNF-α诱导的MH7A细胞增殖,并随药物浓度的增加抑制率增加。化合物在最高浓度200 μmol·L-1时,3-CQA对MH7A细胞的增殖抑制作用最强(抑制率为21.3%),其次为1, 3-DCQA(抑制率为18.8%);其余3个双咖啡酰基奎宁酸化合物抑制率均在15%左右,单咖啡酰基奎宁酸化合物抑制率均在10%左右。结果还表明,与空白组比较,TNF-α模型组均能增加细胞上清中NO、IL-1β、PGE2的含量,而药物组均可不同程度下调MH7A细胞中NO、IL-1β、PGE2的水平,并具有良好的浓度依赖性。结果提示,黑骨藤中啡酰基奎宁酸类化合物具有较好的抗RA活性。
NF-κB/MAPK信号转导通路在RA的病理过程中发挥着关键作用[11]。NF-κB未受刺激时主要以非活化状态存在于细胞质中,并可与抑制性的IκBα蛋白结合,形成NF-κB/IκBα复合物。IκBα的活化又被IκB激酶(IκB kinases,IKK)复合物控制,IKK复合物可被外来刺激诱导活化,并引起IκBα磷酸化,进而导致IκBα迅速泛素化降解,释放出NF-κB,使其恢复转录活性,并转移到细胞核内,促进促炎细胞因子及相应基因的表达,如COX-2、TNF-α等的分泌或活性,进而对细胞损伤、炎症等起到一定的促进作用[12-13]。病理状况下,TNF-α可激活NF-κB,诱导iNOS表达,引起NO合成增加,iNOS、COX-2是NF-κB信号转导通路中重要的两种信号蛋白分子,COX-2的高表达可引起PGE2的含量升高,产生炎症、疼痛及损伤等[14]。MAPK信号通路在RA中起着重要的作用,是由蛋白质激酶组成的家族,主要包括ERK、JNK、p38 3个成员,它们参与了许多重要细胞过程,如细胞凋亡的调控、增殖和炎症反应[15]。激活的ERK1/2、JNK、p38 MAPK均可活化NF-κB,进一步引发炎症反应[12]。本研究中,对咖啡酰基奎宁酸类化合物中抗RA作用较为明显的两个化合物的机制研究发现,3-CQA和1, 3-DCQA均能抑制TNF-α活化的MH7A细胞中MAPK的激活,降低NF-κB相关蛋白的表达,抑制其下游炎症因子NO、IL-1β、PGE2的表达。
综上所述,本实验在前期基础上,对黑骨藤分离得到的单体化合物进行抗RA活性及机制研究,结果显示,咖啡酰基奎宁酸类化合物能降低TNF-α诱导的MH7A细胞增殖,下调NO、IL-1β、PGE2的分泌,降低ERK、JNK、p38 MAPK磷酸化水平,降低IκBα磷酸化及NF-κB p65蛋白表达水平。提示黑骨藤中咖啡酰基奎宁酸类化合物具有抗RA的作用,其机制可能与抑制MAPK信号通路的激活,降低NF-κB活性,抑制下游炎症因子表达,进而减轻炎症反应有关。
( 致谢: 本实验在贵州医科大学民族药与中药开发应用教育部工程研究中心与贵州省药物制剂重点实验室完成,感谢实验室老师与同学们给予的指导和帮助!)
| [1] | Noack M, Miossec P. Selected cytokine pathways in rheumatoid arthritis[J]. Semin Immunopathol, 2017, 39(4): 365-83. doi:10.1007/s00281-017-0619-z |
| [2] | Wang X, He X, Zhang C F, et al. Anti-arthritic effect of berberine on adjuvant-induced rheumatoid arthritis in rats[J]. Biomed Pharmacother, 2017, 89: 887-93. doi:10.1016/j.biopha.2017.02.099 |
| [3] | Xiang Y, Zhang T, Yin C, et al. Effects of the stem extracts of Schisandra glaucescens Diels on collagen-induced arthritis in Balb/c mice[J]. J Ethnopharmacol, 2016, 194: 1078-86. doi:10.1016/j.jep.2016.11.011 |
| [4] | 甘秀海, 周欣, 赵超, 等. 黑骨藤化学成分及药理作用研究进展[J]. 广东化工, 2012, 9(39): 20-1. Gan X H, Zhou X, Zhao C, et al. The research progress on the chemical component and the pharmacologyaction of Periploca Forrestii Schltr.[J]. Guangdong Chemical Industry, 2012, 9(39): 20-1. |
| [5] | 王霞, 杨健, 宋菲, 等. 苗药黑骨藤中咖啡酰基奎宁酸类部位对人类风湿性关节炎成纤维样滑膜细胞MH7A增殖及炎症因子分泌的影响[J]. 中国药房, 2017, 28(28): 3949-52. Wang X, Yang J, Song F, et al. Effects of caffeoylquinic acid derivative fractions in Miao medicine Periploca forrestii on proliferation and secretion of inflammatory cytokines in human rheumatoid arthritis fibroblast-like synoviocytes MH7A[J]. J China Pharm, 2017, 28(28): 3949-52. doi:10.6039/j.issn.1001-0408.2017.28.17 |
| [6] | 赵珊, 张宝, 熊丹丹, 等. 苗药黑骨藤的化学成分研究[J]. 中草药, 2017, 48(8): 1513-8. Zhao S, Zhang B, Xiong D D, et al. Chemical constituents from Periploca Radix[J]. Chin Tradit Herb Drugs, 2017, 48(8): 1513-8. |
| [7] | Lee J W, Lee J, Um S H, et al. Synovial cell death is regulated by TNF-α-induced expression of B-cell activating factor through an ERK-dependent increase in hypoxia-inducible factor-1α[J]. Cell Death Dis, 2017, 8(4): e2727. doi:10.1038/cddis.2017.26 |
| [8] | 白琳, 杨雨欣, 万巧凤, 等. 黄芩苷经TLR2 /NF-κB途径减轻类风湿关节炎大鼠滑膜炎[J]. 中国药理学通报, 2017, 33(11): 1569-73. Bai L, Yang Y X, Wang Q F, et al. Baicalin alleviated rheumatoid arthritis synovitis of SD rats through TLR2-NF-κB pathway[J]. Chin Pharmacol Bull, 2017, 33(11): 1569-73. doi:10.3969/j.issn.1001-1978.2017.11.018 |
| [9] | Xu J, Itoh Y, Hayashi H, et al. Dihydrotestosterone inhibits interleukin-1alpha or tumor necrosis factor alpha-induced proinflammatory cytokine production via androgen receptor-dependent inhibition of nuclear factor-kappaB activation in rheumatoid fibroblast-like synovial cell line[J]. Biol Pharm Bull, 2011, 34(11): 1724-30. doi:10.1248/bpb.34.1724 |
| [10] | Siebert S, Tsoukas A, Robertson J, et al. Cytokines as therapeutic targets in rheumatoid arthritis and other inflammatory diseases[J]. Pharmacol Rev, 2015, 67(2): 280-309. doi:10.1124/pr.114.009639 |
| [11] | Chen N, Gao R F, Yuan F L, et al. Recombinant human endostatin suppresses mouse osteoclast formation by inhibiting the NF-κB and MAPKs signaling pathways[J]. Front Pharmacol, 2016, 7: 145-50. |
| [12] | Yang G, Li S, Yuan L, et al. Effect of nobiletin on the MAPK/NF-κB signaling pathway in the synovial membrane of rats with arthritis induced by collagen[J]. Food Funct, 2017, 8(12): 4668-74. doi:10.1039/C7FO01311F |
| [13] | 宁乔怡, 周静, 李东晓, 等. 苗族药金乌健骨汤对类风湿关节炎滑膜成纤维细胞NF-κB p65, IKK-α及IKK-β表达的影响[J]. 中国实验方剂学杂志, 2017, 23(7): 152-9. Ning Q Y, Zhou J, Li D X, et al. Effect of Miao medicine jinwu jiangu decoction on expression of NF-κB p65, IKK-α and IKK-β in FLS of RA[J]. Chin J Exp Tradit Med Form, 2017, 23(7): 152-9. |
| [14] | Sung M S, Lee E G, Jeon H S, et al. Quercetin inhibits IL-1beta-induced proliferation and production of MMPs, COX-2, and PGE2 by rheumatoid synovial fibroblast[J]. Inflammation, 2012, 35(4): 1585-94. doi:10.1007/s10753-012-9473-2 |
| [15] | Zuo J, Yan X, Xiang L, et al. Selective modulation of MAPKs contribute to the anti-proliferative and anti-inflammatory activities of 1, 7-dihydroxy-3, 4-dimethoxyxanthone in rheumatoid arthritis-derived fibroblast-like synoviocyte MH7A cells[J]. J Ethnopharmacol, 2015, 168: 248-54. doi:10.1016/j.jep.2015.03.069 |

