


2. 中国医学科学院北京协和医学院药物研究所 北京市晶型药物研究重点实验室,北京 100050
 ,
ZHOU Qi-meng1,
WANG Hai-gang1,
CHENG Xiao1,
ZHAO Xiao-yue1,
LYU Yang2,
FANG Lian-hua1
,
ZHOU Qi-meng1,
WANG Hai-gang1,
CHENG Xiao1,
ZHAO Xiao-yue1,
LYU Yang2,
FANG Lian-hua1
 ,
DU Guan-hua1
,
DU Guan-hua1

2. Beijing Key Lab of Polymorphic Drugs, Instiute of Materia Medica, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100050, China
高尿酸血症是由于机体内尿酸合成或排泄失衡,造成的一种代谢性疾病。《高尿酸血症和痛风治疗的中国专家共识》指出,随着我国人民生活水平的提高,我国高尿酸血症逐年上升,特别是在经济发达的城市和沿海地区,患病率达到5%~23.5%[1]。高尿酸血症也是痛风发病的关键因素[2]。目前,已上市治疗高尿酸血症的药物主要有黄嘌呤氧化酶抑制剂、尿酸转运体抑制剂、重组尿酸酶补充剂等几大类,但是其不良反应和肝肾毒性均较大。
芒果苷(mangiferin,2-β-D-吡喃葡萄糖苷-1, 3, 6, 7-四羟基-9H-氧杂蒽酮),又称知母宁、芒果素,主要从漆树科和龙胆科植物的叶、茎、果实、树皮中提取得到,也是中药知母的主要活性成分[3]。芒果苷作为药用植物中提取的单一化合物,具有多种药理学活性。近年来,已有多篇论文报道了芒果苷的降尿酸作用。本研究采用固体灌胃方式给予晶Ⅴ型芒果苷后,从脏器指数、生化指标、肾脏病理变化方面,探讨其对高尿酸血症小鼠的治疗作用,从尿酸转运体相关基因方面探讨其治疗作用机制。
1 材料 1.1 实验动物SPF级昆明种♂小鼠70只,体质量(20±2)g,购自北京市华阜康生物科技股份有限公司,许可证号:SCXK 2014-0004。饲养于12 h照明、温度(25±2)℃环境中。
1.2 试剂晶Ⅴ型芒果苷(中国医学科学院药物研究所晶型中心提供);氧嗪酸钾(oteracil potassium)、别嘌呤醇(allopurinol, AP);苯海岸马隆(benzbromarone, BR)均购自Sigma公司;羧甲基纤维素钠(CMC-Na)、TRIzol(Thermo Fisher Scientific公司);反转录试剂盒(RR037Q)、实时荧光定量试剂盒(RR820Q),均购自TaKaRa公司;尿酸(uric acid,UA)、谷丙转氨酶(alanine aminotransferase,ALT)、谷草转氨酶(aspartate aminotransferase,AST)、血尿素氮(blood urea nitrogen,BUN)、肌酐(creatinine,CRE)、低密度脂蛋白(low density lipoprotein,LDL)测定试剂盒,高密度脂蛋白(high density lipoprotein, HDL)测定试剂盒,均购自中生北控生物科技股份有限公司;黄嘌呤氧化酶(xanthine oxidase,XO)检测试剂盒(南京建成生物工程研究所)。
1.3 仪器TBA-40全自动生化仪(日本东芝公司);EclipseTi-U荧光显微镜(日本尼康公司);小鼠固体给药系统(中国医学科学院药物研究所国家药物筛选中心研制)[4];实时荧光定量PCR仪(Bio-Rad公司);微量紫外/荧光核酸测定仪(DeNovix公司);低温高速离心机(Beckman公司);金属浴(杭州奥盛仪器有限公司);24孔样品研磨均质匀浆仪(OMNI公司)。
2 方法 2.1 动物分组、给药和造模将小鼠随机分为7组:正常对照组(Control)、模型组(Model)、别嘌呤醇组(AP,25 mg·kg-1)、苯溴马隆组(BR,25 mg·kg-1)、晶Ⅴ型芒果苷低、中、高剂量组(10、30、100 mg·kg-1),每组10只。正常对照组每天腹腔注射CMC-Na溶液,其他各组每天下午腹腔注射氧嗪酸钾CMC-Na混悬液(300 mg·kg-1)。连续造模7 d后,d 8起每天上午灌胃给予各组相应药物,其中晶Ⅴ型芒果苷各剂量组通过固体给药方法灌胃,下午继续腹腔注射氧嗪酸钾混悬液,连续给药14 d。在末次给予氧嗪酸钾1 h后,每组取部分小鼠称重后摘眼球取血,解剖取肝脏、双侧肾脏称重,立即放入液氮中,再转移至-80 ℃冰箱,备用。其余小鼠4%多聚甲醛灌流,取肾,4%多聚甲醛固定,备用。
2.2 脏器指数、血清生化指标、肝脏XO活性测定脏器指数为自身组织重量与自身体质量的比值。全血7 000 r·min-1离心10 min,分离血清,全自动生化分析仪测定UA、ALT、AST、BUN、CRE、LDL、HDL。取肝组织,加入适量预冷生理盐水,全自动匀浆器匀浆,4 ℃、12 000 r·min-1离心40 min,重复2次,取上清,12 000 r·min-1再次离心10 min,取上清,按试剂盒说明书测定肝XO活性。
2.3 肾组织苏木精-伊红(HE)染色组织从低到高浓度乙醇脱水,二甲苯浸泡,石蜡包埋,切片成7 μm厚的组织样本。染色前,二甲苯脱去切片石蜡,用从高到低的浓度的乙醇浸泡,去离子水浸泡。HE染色,再脱水、透明、中性树胶封固。显微镜下观察并统计。
2.4 RT-qPCR检测肾、肠尿酸转运体mRNA、肝XO mRNA的表达参考文献并查询NCBI,利用Pubmed中Pick Primer在线软件挑选引物,并对产物进行Blast,确保扩增基因特异性(Tab 1)。取50~100 mg肾脏、肝脏、结直肠组织到研磨管中,每管加入1 mL TRIzol,并低温研磨提取总RNA。取1 μL总RNA,测定纯度和浓度。总RNA定量2 μg加入反转录体系(5×Prime Script Buffer 2 μL,RrimeScript RT Enzyme Mix 0.5 μL,Oligo dT Primer 0.5 μL,Random 6 mers 0.5 μL,DEPC水定量至20 μL),37℃反转录15 min,85℃ 5 s。取反转录产物2 μL,加入实时荧光定量体系(SYBR Premix Ex Taq Ⅱ 12.5 μL,PCR上、下游引物各1 μL,无菌dH2O 8.5 μL),95℃ 30 s,95℃ 5 s,60℃ 30 s,40个循环。采用2-△△t相对定量法统计。
| Description (Mus musculus) |
Gene | Genbank | Product size/bp |
Primer sequence (5’-3’) |
| URAT1 | Slc22a12 | NM_009203.3 | 162 | ATGGCTGGGTTTACGACCAC |
| GCCCAAACCTATCTGAGGCA | ||||
| GLUT9 | Slc2a9 | NM_001102415.1 | 189 | CTTCCTGTGGACTCTGCCTC |
| GACGAGCGAGAAGGACCATT | ||||
| OAT1 | Slc22a6 | NM_008766.3 | 170 | GCAGCCTATGCACCCAACTA |
| AACTGGCCCAAGCTGTAGAC | ||||
| ABCG2 | Abcg2 | NM_011920.3 | 198 | TCTCAACTCCACTGCAAGC |
| ACGTGGTCATTACTGGAAGACA | ||||
| OAT3 | Slc22a8 | NM_031194.5 | 182 | TAAAACAACCCTTTGGCGGC |
| GAGCTGGATTCAGTTGGGCT | ||||
| OAT2 | Slc22a7 | NM_144856.2 | 116 | ACCCTGGTTGGGTACCTGAT |
| AGAAGCCATCGTGCAGACTC | ||||
| OCTN1 | Slc22a4 | NM_001330304.1 | 73 | GGGCCAGATCTCCAACTACG |
| GATGATGCGAACCGACTTGC | ||||
| NPT1 | Slc17a1 | NM_009198.3 | 117 | AGGGCTTTTGGGGTCCTTCC |
| CCCTGGAACTTTCTTGGGGAG | ||||
| PDZK1 | Pdzk1 | NM_021517.2 | 80 | GTAGTGTTCACAGCGGGGAG |
| CTCTGGGGTTGAAGGTGGAG | ||||
| XO | Xdh | NM_011723.3 | 165 | TCAGAAGCCAAGAAGGTG |
| ATGTTCTGGGGTGTCAGC | ||||
| GAPDH | Gapdh | NM_001289726.1 | 123 | AGGTCGGTGTGAACGGATTTG |
| TGTAGACCATGTAGTTGAGGTCA |
GraphPad Prism 5软件对数据进行统计分析并作图。所有数据采用x±s表示,组间显著性差异采用One-way ANOVA-Tukey进行分析比较。
3 结果 3.1 晶Ⅴ型芒果苷对高尿酸血症小鼠脏器指数的影响Tab 2结果显示,与正常组比较,阳性药BR组小鼠肝脏指数明显增高(P < 0.01),而晶Ⅴ型芒果苷各剂量组肝脏指数正常。与正常组比较,阳性药AP和BR组肾脏指数均有所升高,提示两种阳性药对肾脏可能有一定的影响,而晶Ⅴ型芒果苷各剂量组肾脏指数正常。晶Ⅴ型芒果苷低剂量组的脾脏指数明显增大(P < 0.01),其他各组对脾脏指数无明显影响。
| Group | Dose/ mg·kg-1 |
Liver index | Kidney index |
| Control | - | 0.057±0.050 | 0.012±0.001 |
| Model | - | 0.059±0.008 | 0.012±0.002 |
| AP | 25 | 0.060±0.003 | 0.014±0.003 |
| BR | 25 | 0.068±0.006## | 0.014±0.001 |
| Mangiferin(Ⅴ) | 10 | 0.058±0.009 | 0.011±0.001 |
| 30 | 0.056±0.006 | 0.012±0.001 | |
| 100 | 0.058±0.005 | 0.012±0.001 | |
| ##P < 0.01 vs control | |||
Tab 3结果显示,与正常组比较,模型组小鼠血尿酸水平明显升高(P < 0.01),而两个阳性药组和晶Ⅴ型芒果苷中剂量组均能明显降低UA水平(P < 0.01),晶Ⅴ型芒果苷低、高剂量组也具有一定降UA趋势。与正常组比较,模型组小鼠AST水平明显增加(P < 0.05),阳性药AP组和晶Ⅴ型芒果苷高剂量组也明显增高AST水平(P < 0.01)。与正常组和模型组比较,阳性药AP组能够明显增高BUN和CRE水平(P < 0.01)。与模型组比较,阳性药BR组、晶Ⅴ型芒果苷低、高剂量组均能明显降低血清LDL(P < 0.01,P < 0.05)。与正常组比较,除BR组外,其他各组均能明显降低血清HDL水平(P < 0.05,P < 0.01)。
| Group | Dose/ mg·kg-1 |
UA/μmol·L-1 | ALT/U·L-1 | AST/U·L-1 | BUN/μmol·L-1 | CRE/μmol·L-1 | LDL/mmol·L-1 | HDL/mmol·L-1 |
| Control | - | 206.33±48.32 | 26.83±10.87 | 110.80±12.50 | 8.42±1.60 | 21.90±3.11 | 0.46±0.12 | 1.63±0.37 |
| Model | - | 359.27±40.05## | 22.96±18.68 | 136.32±35.76# | 8.06±1.39 | 25.72±10.51 | 0.47±0.14 | 1.36±0.26# |
| AP | 25 | 26.07±21.00** | 21.36±3.54 | 150.93±23.70## | 11.71±3.47##** | 49.29±13.54##** | 0.42±0.18 | 1.25±0.32## |
| BR | 25 | 211.07±37.65** | 24.60±8.18 | 132.13±14.21 | 8.30±1.27 | 31.20±7.80 | 0.29±0.09** | 1.44±0.24 |
| Mangiferin(Ⅴ) | 10 | 304.36±118.70 | 23.07±15.34 | 133.21±16.94 | 7.03±1.71 | 24.79±5.338 | 0.33±0.15* | 1.31±0.25# |
| 30 | 276.38±68.65** | 21.38±4.65 | 134.23±18.34 | 6.74±1.23 | 29.38±9.152 | 0.34±0.11 | 1.19±0.23## | |
| 100 | 296.55±62.48 | 26.91±11.7 | 160.55±21.29## | 7.05±0.87 | 32.18±7.985 | 0.31±0.08* | 1.27±0.23# | |
| #P < 0.05, ##P < 0.01 vs control; *P < 0.05, **P < 0.01 vs model | ||||||||
如Fig 1所示,与正常组比较,模型组小鼠肝脏XO活性增高,阳性药和晶Ⅴ型芒果苷均可以降低XO水平,其中AP和晶Ⅴ型芒果苷高剂量组与模型组比较,差异具有显著性(P < 0.05)。
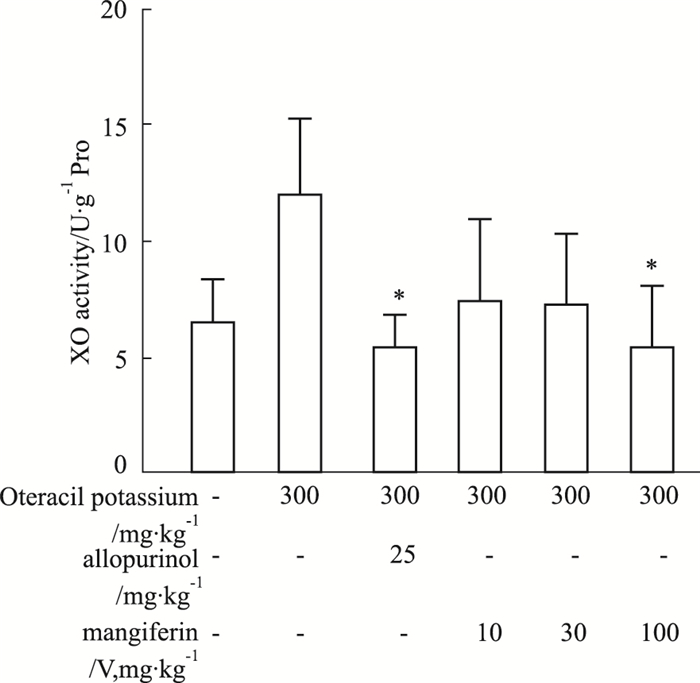
|
| Fig 1 Effect of mangiferin (crystalⅤ) on activity of hepatic XO in hyperuricemia mice induced by potassium oxonate(x±s, n=3) *P < 0.05 vs model |
如Fig 2所示,与正常组相比,模型组肾小管上皮基底膜变薄,肾小管组织缺失。阳性药别嘌呤醇组肾小球萎缩,肾小球囊壁层收缩,结构不完整;BR组基底膜轻微变薄,近曲小管不完整。晶Ⅴ型芒果苷低、中、高剂量组肾小管上皮细胞增厚,形态与正常组基本一致。

|
| Fig 2 Effect of mangiferin(crystalⅤ) on histopathology in hyperuricemic mice induced by potassium oxonate(×100) A: Control; B: Model; C: AP; D: BR; E: Mangiferin(Ⅴ, 10 mg·kg-1); F: Mangiferin (Ⅴ, 30 mg·kg-1); G: Mangiferin(Ⅴ, 100 mg·kg-1). |
如Fig 3所示,在小鼠肾脏尿酸盐阴离子转运体1(urate anion transporter 1,URAT1)mRNA表达水平方面,阳性药BR与晶Ⅴ型芒果苷各剂量组明显高于正常组和模型组;肾脏葡萄糖转运蛋白9(glucose transporter 9,GLUT9)mRNA表达水平方面,模型组、阳性药BR和晶Ⅴ型芒果苷高剂量组表达水平上调,低、中剂量组表达低于模型组;肾脏ABC转运蛋白2(ATP-binding cassette superfamily member 2,ABCG2)mRNA表达水平方面,模型组表达水平明显降低,阳性药AP、BR能明显升高其表达,并高于正常组,而晶Ⅴ型芒果苷各剂量组与模型组比较,表达水平无明显变化;肾脏有机阴离子转运蛋白1(organic anion transporter 1,OAT1)mRNA表达水平方面,模型组表达水平降低,阳性药BR组表达水平上调,其他各组与模型组比较差异无显著性;肾脏OAT2、OAT3 mRNA表达水平方面,与正常组比较,其他各组表达水平均明显降低;磷酸盐转运蛋白1(sodium-dependent phosphate transport protein 1,NPT1)mRNA表达水平方面,各组表达水平无显著性差异;肾脏有机阳离子转运体1(organic cation transporter 1,OCTN1)mRNA表达水平方面,与正常组比较,模型组有一定的上调,与模型组比较,BR和晶Ⅴ型芒果苷中剂量组表达有一定的下降;肾脏转运体支架蛋白1(PDZ domain containing 1,PDZK1)mRNA表达水平方面,与正常组比较,模型组、BR和晶Ⅴ型芒果苷高剂量各组表达均上升,其余各组较模型组表达下降。
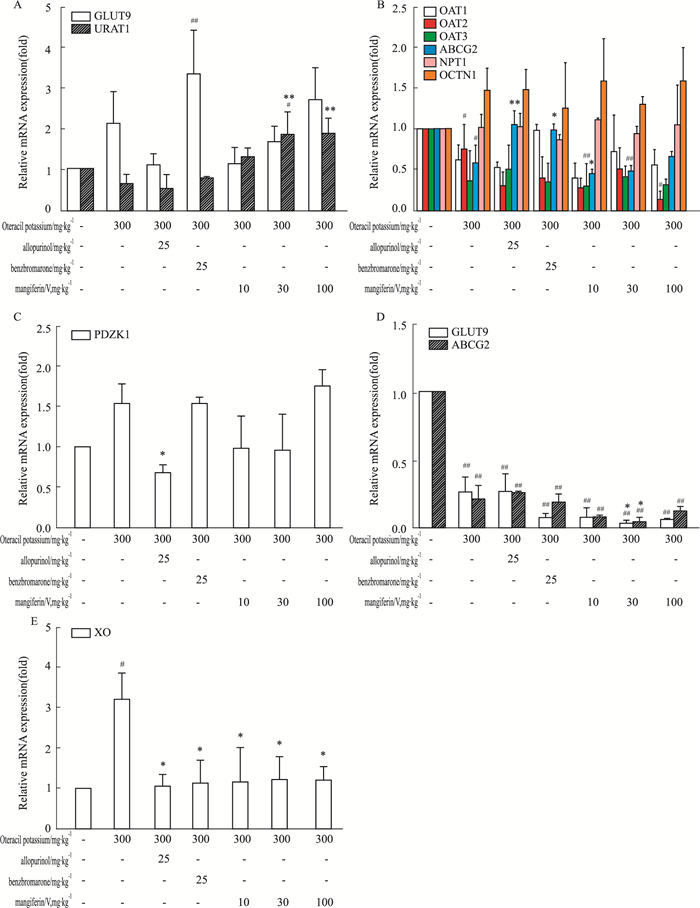
|
| Fig 3 Effect of mangiferin (crystalⅤ) on mRNA expressions of renal urate transporters, intestine urate transporters and hepatic xanthine oxidase in hyperuricemic mice induced by potassium oxonate(x±s, n=3) A: GLUT9, URAT1 mRNA from kidney in mice; B: OAT1, OAT2, OAT3, NPT1, OCTN1 mRNA from kidney in mice; C: PDZK1 mRNA from kidney in mice; D: ABCG2, GLUT9 mRNA from colorectum in mice; E: XO mRNA from liver in mice. #P < 0.05, ##P < 0.01 vs control; *P < 0.05, **P < 0.01 vs model. |
在小鼠肠道ABCG2 mRNA表达水平方面,与正常组比较,其他各组表达水平均明显下降;肠道GLUT9 mRNA表达水平方面,与正常组比较,其他各组表达水平均明显下降,同时晶Ⅴ型芒果苷中剂量组能明显下调模型小鼠的表达水平;在小鼠肝脏XO mRNA表达水平方面,模型组表达水平明显高于正常组,其他各给药组均能明显降低模型小鼠的XO mRNA的表达(Fig 3)。
4 讨论高尿酸血症是由于机体内尿酸合成和排泄失衡造成的代谢性疾病。尿酸的合成依靠一系列酶促反应,其中XO是尿酸合成的关键酶,核酸类化合物在肝脏组织中通过XO等酶促反应生成尿酸。根据核酸体内外来源不同,尿酸合成分为内源性和外源性两个部分。尿酸的排泄大部分通过肾脏排泄(70%),其余通过肠道(30%)。尿酸经过肾小球滤过、肾小管重吸收及分泌,一部分排出体外,另一部分重吸收入血[5]。当机体过多摄入核酸类物质或者尿酸排泄障碍时,均可以引起高尿酸血症。针对导致高尿酸血症的两种途径,目前已上市药物和在研药物的作用机制可以分为两类,抑制尿酸合成途径相关酶和调节尿酸排泄相关蛋白。另外,还可以向人体直接注入外源重组尿酸酶,瞬时降低尿酸水平。
近年来,针对尿酸转运蛋白的靶点研究愈发深入,它们主要分布在肾脏近曲小管上皮细胞基底外侧膜、顶侧膜和管腔膜。依据对尿酸转运机制不同,主要分为3种类型蛋白:第1类尿酸重吸收蛋白,包括葡萄糖转运蛋白9(GLUT9)、尿酸盐阴离子转运体1(URAT1)、有机阴离子转运蛋白4(OAT4)等;第2类尿酸分泌蛋白,包括机阴离子转运蛋白1(OAT1)、有机阴离子转运蛋白2(OAT2)、有机阴离子转运蛋白3(OAT3)、ABC转运蛋白2(ABCG2)、磷酸盐转运蛋白(NPT1)、肉毒碱转运体(OCTN1)等;第3类转运体支架蛋白1(PDZK1)[6]。肠道中,特别是结直肠上皮细胞中,也表达尿酸转运蛋白[7]。以上这些蛋白均参与尿酸的排泄,或辅助相关蛋白形成复合物,参与尿酸的排泄。URAT1是已上市药物苯溴马隆、丙磺舒、Verinurad治疗高尿酸血症的经典靶蛋白[8-9]。
本研究观察各组脏器指数结果,发现阳性药AP、BR组肝脏和肾脏指数均增大,提示肝肾可能出现病变,这种病变与两种阳性药的毒性和超敏反应有一定的相关性[10-11]。全血生化指标显示,腹腔给予氧嗪酸钾后,模型组小鼠血尿酸水平明显升高,阳性药AP、BR及晶Ⅴ型芒果苷均能明显降低血尿酸水平,但是AP组的AST、BUN、CRE明显升高,提示阳性药AP具有一定的肝肾毒性,这与文献报道一致,而晶Ⅴ型芒果苷中剂量组未出现肝、肾毒性。以上结果说明,晶Ⅴ型芒果苷能降低尿酸,同时肝、肾毒副作用小。
肝脏XO活性测定和基因表达检测结果显示,模型组肝脏XO的活性和mRNA表达均明显升高,晶Ⅴ型芒果苷各剂量组可以一定程度上降低XO活性,明显降低XO mRNA表达。提示晶Ⅴ型芒果苷能够通过尿酸合成途径,抑制XO的合成,从而减少体内尿酸的生成。对小鼠肾脏、结直肠尿酸转运蛋白的机制研究显示,晶Ⅴ型芒果苷低、中剂量组可以降低高尿酸血症小鼠肾脏和肠道中尿酸重吸收蛋白GLUT9 mRNA的表达,提高肾脏PDZK1 mRNA的表达。但是对其他转运蛋白无调节作用,或起到相反的调节作用。综合尿酸转运蛋白mRNA表达结果提示,晶Ⅴ型芒果苷可能作用于GLUT9和PDZK1两种蛋白靶点,发挥排泄途径的降尿酸作用。这与已上市促尿酸排泄药物作用靶点不一样。
高尿酸血症能够引起急性尿酸肾病和慢性尿酸肾病。发病原理是由于高浓度尿酸导致尿酸结晶析出,并沉积在肾间质中,堵塞集合管,压迫远端肾血管,改变肾脏血流动力学变化,同时造成肾小管内皮损伤。尿酸肾病还可继续发展为尿酸性肾结石,甚至肾衰竭。治疗高尿酸血症肾损伤最根本的方法还是及时降低体内尿酸浓度,同时保护内皮,抑制炎症因子的释放[12]。本实验通过HE染色方法,考察各给药组对肾脏的影响,结果表明,晶Ⅴ型芒果苷各组能够减少空泡化程度,肾皮质饱满,一定程度上改善肾损伤。而阳性药AP组出现更加严重的病理变化,这与其全血生化指标和脏器指数显示的肝、肾毒性现象一致。
本实验选用的晶Ⅴ型芒果苷为前期筛选的优势晶型,生物利用度高。实验中采用固体给药的方式,避免溶解药物对晶型的破坏,使化合物在体内充分发挥药理作用。
综上所述,晶Ⅴ型芒果苷作为来源于植物提取的优势晶型单一化合物,可以有效降低高尿酸血症小鼠血尿酸水平,改善高尿酸血症造成的肾损伤,未出现明显肝、肾毒性或损伤,发挥了天然产物低毒、有效的作用特点。机制研究表明,晶Ⅴ型芒果苷通过作用于尿酸合成和排泄两个途径,起降尿酸作用。
| [1] | 中华医学会内分泌学分会. 高尿酸血症和痛风治疗的中国专家共识[J]. 中华内分泌代谢杂志, 2013, 29(11): 913-20. Chinese Society of Endocrinology. Chinese expert consensus about hyperuricemia and gout treatment[J]. Chin J Endocrinol Metab, 2013, 29(11): 913-20. doi:10.3760/cma.j.issn.1000-6699.2013.11.001 |
| [2] | Kuo C F, Grainge M J, Zhang W, Doherty M. Global epidemiology of gout: prevalence, incidence and risk factors[J]. Nat Rev Rheumatol, 2015, 11(11): 649-62. doi:10.1038/nrrheum.2015.91 |
| [3] | 杨海光, 方莲花, 杜冠华. 芒果苷的药理作用研究进展[J]. 中国药理学通报, 2016, 32(1): 5-8. Yang H G, Fang L H, Du G H. Research progress of pharmacological effect of mangiferin[J]. Chin Pharmacol Bull, 2016, 32(1): 5-8. doi:10.3969/j.issn.1001-1978.2016.01.002 |
| [4] | 杜冠华.固体灌胃器: 中国, CN201870770U[P]. 2011-06-22. Du G H. Fill the stomach: China, CN201870770U[P].2011-06-22. |
| [5] | Rock K L, Kataoka H, Lai J J. Uric acid as a danger signal in gout and its comorbidities[J]. Nat Rev Rheumatol, 2013, 9(1): 13-23. doi:10.1038/nrrheum.2012.143 |
| [6] | Reginato A M, Mount D B, Yang I, Choi H K. The genetics of hyperuricaemia and gout[J]. Nat Rev Rheumatol, 2012, 8(10): 610-21. doi:10.1038/nrrheum.2012.144 |
| [7] | Hosomi A, Nakanishi T, Fujita T, Tamai I. Extra-renal elimination of uric acid via intestinal efflux transporter BCRP/ABCG2[J]. PLoS One, 2012, 7(2): e30456. doi:10.1371/journal.pone.0030456 |
| [8] | Philip K, Tan P K, Liu S, et al. Discovery and characterization of verinurad, a potent and specific inhibitor of URAT1 for the treatment of hyperuricemia and gout[J]. Sci Rep, 2017, 7(1): 665. doi:10.1038/s41598-017-00706-7 |
| [9] | Tan P K, Ostertag T M, Miner J N. Mechanism of high affinity inhibition of the human urate transporter URAT1[J]. Sci Rep, 2016, 6: 34995. doi:10.1038/srep34995 |
| [10] | Shalom R, Rimbroth S, Rozenman D, Markel A. Allopurinol-induced recurrent DRESS syndrome: pathophysiology and treatment[J]. Ren Fail, 2008, 30(3): 327-9. doi:10.1080/08860220701861045 |
| [11] | Assaneeyakul W, Jantararoungtong T, Chen P, et al. Strong association between HLA-B*5801 and allopurinol-induced Stevens-Johnson syndrome and toxic epidermal necrolysis in a Thai population[J]. Pharmacogenet Genomics, 2009, 19(9): 704-9. doi:10.1097/FPC.0b013e328330a3b8 |
| [12] | 赵娟, 张卓莉. 高尿酸血症与肾损害[J]. 中国医学前沿杂志(电子版), 2014, 6(10): 8-10. Zhao J, Zhang Z L. Hyperuricemia and renal damage[J]. Chin J Front Med Sci (Electron Version), 2014, 6(10): 8-10. doi:10.3969/j.issn.1674-7372.2014.10.006 |