


2. 南方医科大学中心实验室,广东 广州 510515
 ,
LIU Wei1,
LI Jing2,
LI Chan1,
FANG Miao1,
CHEN Zhi-jie1,
ZHOU Yu-ting1,
LUO Chao-hua1,
MO Zhi-xian1
,
LIU Wei1,
LI Jing2,
LI Chan1,
FANG Miao1,
CHEN Zhi-jie1,
ZHOU Yu-ting1,
LUO Chao-hua1,
MO Zhi-xian1

2. Central Lab, Southern Medical University, Guangzhou 510515, China
钩藤具有清热平肝、息风止痉的功效,是治疗头痛眩晕、惊痫抽搐、妊娠子痫等病证的常用中药[1]。钩藤主要含生物碱、黄酮、三萜类等,其中钩藤碱含量约占总碱的34.5%~51.0%,为其主要有效成分,具有降血压、镇静、抗血小板聚集和抗血栓形成的作用[2]。本团队初期研究发现,钩藤碱具有抑制甲基苯丙胺(methamphetamine, METH)引起的条件性位置偏爱(conditioned place preference,CPP)的作用。酪氨酸羟化酶(tyrosine hydroxylase, TH)是多巴胺合成的限速酶,它是控制运动和奖励相关行为的重要物质[3-4]。本文旨在探索钩藤碱对METH诱导的小鼠CPP的作用,应用蛋白免疫印迹和免疫组化法检测TH的表达,进一步阐明钩藤碱对METH依赖小鼠CPP的分子作用机制。
1 材料 1.1 药品与试剂盐酸甲基苯丙胺,购自国家麻醉品实验室,批号:1212-9802;钩藤碱,购自日本MATSUURA YKUGYO公司;盐酸氯胺酮注射液(规格:2 mL:0.1 g),江苏恒瑞医药股份有限公司生产;三卡因甲磺酸盐(MS222),购自Sigma公司; 抗TH抗体(AB152),购自Millipore公司。
1.2 仪器Noldus EthoVision XT 8.5软件(荷兰Noldus公司);ChemiImager 550凝胶成像仪(美国Alpha Innotech公司)。
1.3 实验动物SPF级昆明种小鼠,体质量18~22 g,♀♂各半,由南方医科大学动物中心提供,许可证号:SCXK(粤)2011-0015。
2 方法 2.1 CPP箱的制作CPP箱由两个长15 cm,宽15 cm,高15 cm的箱体组成,其中一箱体涂成黑色,另一箱体涂成白色;两箱体之间由一透明活动挡板分隔开,当透明挡板抽开时,小鼠可在两箱体间自由活动[5]。
2.2 小鼠基线测定实验前,将小鼠放于抽出挡板的CPP箱中,适应性喂养3 d后,进行小鼠位置偏爱测试。测试前将挡板抽出,小鼠放置于两箱体中间,记录小鼠在15 min内在黑白箱中的活动时间(以头部为准)。结果表明,自然状态下,>90%的小鼠偏爱黑箱,因此,将黑箱选为偏爱箱,白箱选为伴药箱。小鼠筛选以在黑箱中的活动时间>8 min为合格。
2.3 CPP模型的复制与给药取基线测定合格的小鼠50只,随机分成5组,分别为:空白对照组、模型组、钩藤碱低剂量组(40 mg·kg-1)、钩藤碱高剂量组(80 mg·kg-1)、氯胺酮组(15 mg·kg-1)。d 1, 记录小鼠15 min内在CPP箱中的活动。d 2~5,模型组和给药组每天上午8 :00皮下注射METH 4 mg·kg-1(对照组注射同体积生理盐水),之后放入伴药箱中训练1 h;钩藤碱组从d 3开始,在注射METH前30 min,灌胃相应剂量的钩藤碱;氯胺酮组从d 3开始,在注射METH之前15 min,腹腔注射氯胺酮(15 mg·kg-1);各组下午4 :00给予生理盐水(0.15 mL,sc)后,放入黑箱中训练1 h,连续4 d。d 6即末次给药24 h后,记录各组小鼠在CPP箱中15 min内的活动。
2.4 免疫组化法检测小鼠海马区TH的表达行为学测定完成后,处死小鼠,取脑组织,于4%多聚甲醛中固定24 h。脑组织进行常规脱水、包埋、切片,厚度约5 μm, 用防脱载玻片捞起,进行常规脱蜡和水化。按常规免疫组化法进行TH免疫组化染色,一抗为TH(1 :100),二抗为辣根过氧化物酶标记的山羊抗兔IgG(1 :200),阴性对照则用PBS液代替一抗。结果判定阳性表达为胞膜和(或)胞质内呈棕黄色颗粒染色,若无棕黄色颗粒则为阴性。
2.5 Western blot检测TH的表达行为学测定结束后,将小鼠处死,取出小鼠的脑组织,加入RIPA裂解液和PMSF(50 :1),进行超声匀浆提取组织蛋白,用BCA法检测蛋白浓度,参考之前的文献进行Western blot实验。一抗为TH(1 :100),以β-actin为内标;二抗为辣根过氧化物酶标记的山羊抗兔IgG(1 :1 000)。用ChemiImager 550凝胶成像仪采集图像,并用Image-Pro Plus 6.0软件分析每个条带的积分光密度(IOD)值。
2.6 统计学处理采用SPSS 22.0软件进行统计学分析,所有数据以x±s表示,采用单因素方差分析,利用SNK检验法进行组间比较。
3 结果 3.1 小鼠训练前后在伴药箱的活动时间变化用Noldus EthoVision XT8.5软件,分析训练前后小鼠在伴药箱中的停留时间和运动轨迹,比较训练前后各组小鼠在伴药箱中活动时间的差值(小鼠训练后在伴药箱中的活动时间-小鼠训练前在伴药箱中的活动时间)。由Tab 1可见,与空白组相比,注射METH 4 mg·kg-1后,模型组小鼠在伴药箱中停留时间明显增加(P < 0.01);与模型组相比,钩藤碱低、高剂量组小鼠在伴药箱中的停留时间明显减少(P < 0.01)。各组小鼠造模前后在CPP箱的运动路线图见Fig 1。
| Group | Does/ mg·kg-1 |
Mice activity time in non-preferred compartment before and after administration/s |
| Control | - | 8.80±12.30 |
| Model | 4 | 417.60±112.78** |
| Rhynchophylline | 40 | 415.10±158.81 |
| 80 | 57.60±17.16## | |
| Ketamine | 15 | 43.50±16.71## |
| **P < 0.01 vs control group; ## < 0.01 vs model group | ||

|
| Fig 1 Road maps of mice in CPP compartment A: Control group before modeling; B: Control group after modeling; C: Methamphetamine model group before modeling; D: Methamphetamine model group after modeling; E: Rhynchophylline low-dose group before modeling; F: Rhynchophylline low-dose group after modeling; G: Rhynchophylline high-dose group before modeling; H: Rhynchophylline high-dose group after modeling; I: Ketamine group before modeling; J: Ketamine group after modeling. |
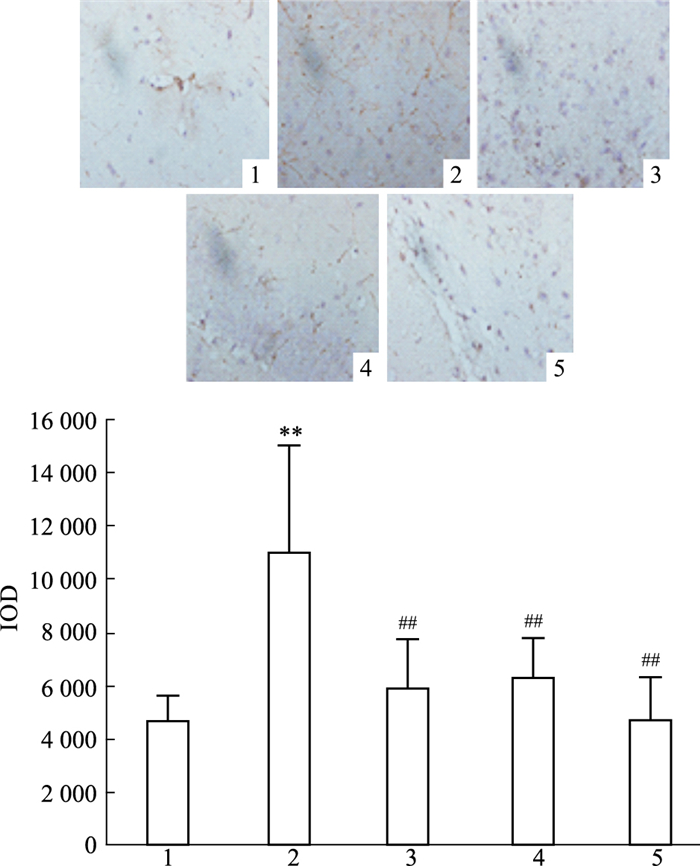
采用Image-Pro Plus 6.0图像分析软件,测定阳性细胞的IOD值,取其平均值作为该组各项指标的相对含量。如Fig 2所示,与对照组相比,经过CPP训练后,模型组小鼠海马区中TH阳性细胞数明显增加(P < 0.01);与模型组相比,给予钩藤碱干预后,小鼠海马区TH阳性细胞数明显下降(P < 0.01)。
|
| Fig 2 Micrographs of TH positive cells in hippocampus of mice (x±s, n=10) 1: Control group; 2: Model group of methamphetamine; 3: Low-dose of rhynchophylline group; 4: High-dose of rhynchophylline group; 5: Ketamine group. **P < 0.01 vs control group; ##P < 0.01 vs model group. |
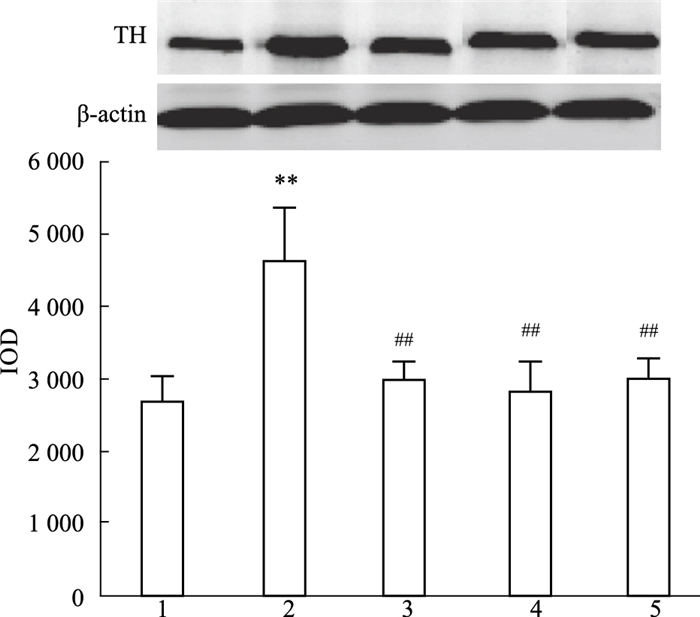
如Fig 3所示,小鼠脑内的TH表达IOD值存在统计学差异。与对照组相比,模型组小鼠脑内的TH表达增加(P < 0.01);与模型组相比,钩藤碱低、高剂量组小鼠脑内的TH表达明显减少(P < 0.01)。
|
| Fig 3 Expression of TH of mice by western blot(x±s, n=3) 1: Control group; 2: Model group of methamphetamine; 3: Low-dose of rhynchophylline group; 4: High-dose of rhynchophylline group; 5: Ketamine group. **P < 0.01 vs control group; ##P < 0.01 vs model group. |
METH为白色透明不规则晶体,俗称“冰毒”,1919年由日本科学家首次合成,其特点为见效快、药效持续时间长。国家禁毒办公布的《2017年中国禁毒报告》显示,2016年缴获各类毒品82.1吨,其中冰毒晶体17.4吨,位于榜首。METH有很强的中枢兴奋作用,极易成瘾,且复吸率高。
CPP实验是一种常用的药物奖赏效应以及药物渴求研究的动物模型,是评估药物依赖精神依赖性最方便、最常用、最经典的实验。人为地将药物与动物先天的非偏爱侧相联系,通过对比动物在非偏爱侧停留时间的长短,判断药物精神依赖性的强弱[6]。本实验结果表明,与对照组比较,给予METH 4 mg·kg-1后,模型组小鼠在伴药箱中的时间明显增加,说明注射METH 4 mg·kg-1可以诱导小鼠产生CPP效应。与模型组相比,钩藤碱低、高剂量组(40、80 mg·kg-1)小鼠在伴药箱中的逗留时间明显减少,表明低、高剂量钩藤碱对METH依赖小鼠CPP具有一定的抑制作用。
药物成瘾的机制十分复杂,与脑内多种蛋白质表达和结构功能改变有关。TH在儿茶酚胺生物合成过程中至关重要,是其中最重要的关键酶,同时也是多巴胺能神经元的标记酶,与药物依赖奖赏通路密切相关。研究表明,与正常组相比,给予苯丙胺50 mg·kg-1, 可使斑马鱼端脑区TH mRNA的表达明显上调[7]; 斑马鱼腹腔注射40 mg·kg-1 METH 3次后,其脑内TH蛋白的表达明显增加[8]。腹腔注射METH(2.5、10 mg·kg-1)7 d后,小鼠纹状体中TH蛋白的表达,以及黑质TH基因表达水平和TH阳性神经元数量减少[9]。将TH-GFP转基因斑马鱼(头部荧光)浸泡在浓度为0.6 mg·L-1 METH中,转基因斑马鱼头部荧光明显增强[10]。本实验结果表明,与对照组比较,给予METH 4 mg·kg-1后,METH依赖小鼠脑内TH阳性细胞数及TH蛋白的表达明显增加;给予钩藤碱干预后,小鼠脑内TH阳性细胞数和TH蛋白表达明显减少,表明TH与钩藤碱抑制METH引起的CPP效应有关,是动物行为学改变的神经生物学机制之一。
钩藤碱是中药钩藤的主要活性成分,本团队前期研究发现,钩藤碱能抑制苯丙胺类物质诱导大鼠产生CPP,抑制苯丙胺所致大鼠脑内氨基酸类神经递质含量变化和大鼠伏隔核、杏仁核中NR2B蛋白表达的变化[11-12]。钩藤碱可抑制METH引起的大鼠伏隔核内GluR2/3亚基蛋白表达上调,以及下丘脑内GluR2/3亚基蛋白表达下调[13]。钩藤碱(60 mg·kg-1)可抑制METH依赖大鼠海马CA1区和纹状体中p-CREB、c-Fos阳性细胞数明显增加的趋势,使p-CREB及c-Fos阳性细胞数恢复正常[14]。
本研究表明,钩藤碱具有抑制METH依赖小鼠CPP的作用,这种作用可能与降低小鼠脑内TH蛋白的表达有关。由于药物成瘾的发生与发展极其复杂,关于钩藤碱调控TH的机制仍需进一步深入研究。
| [1] | Ndagijimana A, Wang X, Pan G, et al. A review on indole alkaloids isolated from Uncaria rhynchophylla and their pharmacological studies[J]. Fitoterapia, 2013, 86: 35-47. doi:10.1016/j.fitote.2013.01.018 |
| [2] | 汪江涛, 丁伯平. 钩藤碱和异钩藤碱药理作用研究进展[J]. 中国医药刊, 2012, 14(7): 1224-5, 1221. Wang J T, Ding B P. Progress in research of rhynchophylline and isorhynchophylline on pharmacological[J]. Chin J Med Guide, 2012, 14(7): 1224-5, 1221. |
| [3] | Tokuoka H, Muramatsu S I, Sumi-Ichinose C, et al. Compensatory regulation of dopamine after ablation of the tyrosine hydroxylase gene in the nigrostriatal projection[J]. J Biol Chem, 2011, 286(50): 43549-58. doi:10.1074/jbc.M111.284729 |
| [4] | 张阳, 张志坚, 俞晓岚, 等. 慢病毒介导的新型Tet-On系统调控大鼠GDNF和TH双基因表达对帕金森病大鼠的实验研究[J]. 中国药理学通报, 2015, 31(2): 251-6. Zhang Y, Zhang Z J, Yu X L, et al. Experimental study on expression of TH and GDNF bi-gene of lentivirus by improved Tet-On system for a rat model of Parkinson's disease[J]. Chin Pharmacol Bull, 2015, 31(2): 251-6. doi:10.3969/j.issn.1001-1978.2015.02.021 |
| [5] | 武变瑛, 李娜, 刘秀平. 复方石菖蒲合剂对吗啡依赖小鼠位置偏爱效应及血中单胺类递质的影响[J]. 中国疼痛医学杂志, 2009, 15(5): 283-6. Wu B Y, Li N, Liu X P, et al. Effect of acrous-tatrinown-schott mixture on morphine-induced place preference and blood monoamine neurotransmitters in mice[J]. Chin J Pain Med, 2009, 15(5): 283-6. doi:10.3969/j.issn.1006-9852.2009.05.009 |
| [6] | 邓慧琼, 周旭辉, 张登科, 等. 条件性位置实验方法及非倾向性实验设计在药物依赖研究中的应用[J]. 中国药物依赖性杂志, 2006, 15(2): 8-11. Deng H Q, Zhou X H, Zhang D K, et al. The application of conditional location experiment method and non-biased experiment design in drug dependence research[J]. Chin J Drug Depend, 2006, 15(2): 8-11. doi:10.3969/j.issn.1007-9718.2006.02.003 |
| [7] | Volkoff H. The effects of amphetamine injections on feeding behavior and the brain expression of orexin, CART, tyrosine hydroxylase (TH) and thyrotropin releasing hormone (TRH) in goldfish (Carassius auratus)[J]. Fish Physiol Biochem, 2013, 39(4): 979-91. doi:10.1007/s10695-012-9756-4 |
| [8] | Zhu C, Liu W, Luo C H, et al. Inhibiting effects of rhynchophylline on methamphetamine-dependent zebrafish are related with the expression of tyrosine hydroxylase (TH)[J]. Fitoterapia, 2017, 117: 47-51. doi:10.1016/j.fitote.2017.01.001 |
| [9] | Park S W, He Z, Shen X, et al. Differential action of methamphetamine on tyrosinehydroxylase and dopamine transport in the nigrostriatal pathway of mu-opioid receptor knockout mice[J]. Int J Neurosci, 2012, 122(6): 305-13. doi:10.3109/00207454.2011.652319 |
| [10] | Jiang M J, Chen Y F, Li C, et al. Inhibiting effects of rhynchophylline on zebrafish methamphetamine dependence are associated with amelioration of neurotransmitters content and down-regulation of TH and NR2B expression[J]. Prog Neuropsychopharmacol Biol Psychiatry, 2016, 68: 31-43. doi:10.1016/j.pnpbp.2016.03.004 |
| [11] | 周吉银, 莫志贤. 钩藤碱对苯丙胺依赖大鼠伏核和杏仁核中NR2B蛋白表达的影响[J]. 中国药物依赖性杂志, 2007, 16(1): 12-9. Zhou J Y, Mo Z X. The effect of rhynchophylline on NR2B expression in nucleus accubens and amygdaloid of amphetamine-dependent rats[J]. Chin J Drug Depend, 2007, 16(1): 12-9. doi:10.3969/j.issn.1007-9718.2007.01.004 |
| [12] | 周吉银, 莫志贤. 钩藤碱对苯丙胺依赖大鼠神经核团中NR2B mRNA表达的影响[J]. 中国药理学通报, 2007, 23(9): 1141-5. Zhou J Y, Mo Z X. The effect of rhynchophylline on NR2B mRNA expression in nucleus of amphetamine-dependent rats[J]. Chin Pharmacol Bull, 2007, 23(9): 1141-5. doi:10.3321/j.issn:1001-1978.2007.09.006 |
| [13] | Zhou J, Chen J, Zhou S, et al. Individual an combined effects of ehychophylline and ketamine on proliferation, NMDAR1 and GluA2/3 protein expression in PC12 cells[J]. Fitoterapia, 2013, 85: 125-9. doi:10.1016/j.fitote.2013.01.012 |
| [14] | Liu W, Peng Q, Lin X, et al. Effect of rhynchophylline on the expression of p-CREB and sc-Fos in triatum and hippocampal CA1 area of methamphetamine-induced conditioned place preference rats[J]. Fitoterapia, 2014, 92: 16-22. doi:10.1016/j.fitote.2013.10.002 |