

2. 安徽卫生健康职业学院,安徽 池州 247099;
3. 安徽医科大学附属第一医院内分泌科,安徽 合肥 230022;
4. 安徽医科大学药学院临床药学专业2014级,安徽 合肥 230032;
5. 安徽中医药大学附属第一医院内分泌科,安徽 合肥 230031
2. Anhui Hygiene and Health Professional School, Chizhou Anhui 247099, China;
3. Dept of Endocrinology, the First Affiliated Hospital of Anhui Medical University, Hefei 230022, China;
4. Grade 2014, Dept of Clinical Pharmacy, School of Pharmacy, Anhui Medical University, Hefei 230032, China;
5. Dept of Endocrinology, the First Affiliated Hospital of Anhui University of Traditional Chinese Medicine, Hefei 230031, China
慢性肾脏疾病(chronic kidney disease,CKD)是各种原因引起的慢性肾脏结构和功能障碍,其中肥胖是CKD进展的渐进性独立风险因子,但影响的具体途径尚不确切[1]。最近临床和动物实验表明,肥胖引起的CKD肾中由脂类的异位沉积、脂类代谢失调和氧化应激组成的应激信号网络共同参与CKD的发生、发展[2]。
丹蛭降糖胶囊(Danzhi Jiangtang Capsule,DJC)是安徽中医药大学第一附属医院院内制剂,由太子参、生地黄、菟丝子、牡丹皮、水蛭等药组成,具有益气、养阴、活血之功效,对2型糖尿病及其并发症有确切的疗效[3]。DJC改善糖尿病大鼠肾功能的机制可能是通过抗氧化,从而抑制JAK2/STAT3炎症信号通路的活化,降低肾脏局部炎症因子的表达[4]。DJC也可通过下调肥胖大鼠骨骼肌细胞CD36的表达,减轻骨骼肌脂质沉积,来改善骨骼肌胰岛素抵抗[4]。但目前关于DJC是否可作为调血脂药物,改善脂代谢紊乱和肾损伤及其机制的研究尚未见报道,因此,本文探讨DJC保护高脂血症大鼠肾损伤的作用机制,为该药用于临床治疗肥胖引起的CKD提供实验依据。
1 材料与方法 1.1 材料 1.1.1 实验动物清洁级SD大鼠,♂,8周龄,体质量180~200 g,购自安徽医科大学实验动物中心,生产许可证号:SCXK(皖)2006-001,适应性饲养1周。
1.1.2 药物与试剂DJC购自安徽中医药大学附属第一医院药房;RNAiso Reagent、逆转录试剂盒、Premix TaqTM购自大连宝生物工程有限公司;RIPA裂解液购自碧云天生物技术有限公司;兔抗磷酸化腺苷酸活化的蛋白激酶α(phospho-AMP-activated protein kinase α,p-AMPKα)和AMPKα单克隆抗体购自美国CST公司;兔抗过氧化物酶体增殖剂活化受体α(peroxisome proliferator-activated receptor α, PPARα)、PPARγ多克隆抗体购自美国Affinity公司;兔抗CD36多克隆抗体购自美国Santa Cruz公司;鼠抗β-actin、山羊抗鼠IgG、山羊抗兔IgG购自北京中杉金桥生物技术有限公司;ECL高灵敏度化学发光试剂盒购自美国ThermoFisher公司;甘油三酯(triglyceride,TG)、丙二醛(malondialdehyde,MDA)、总超氧化物歧化酶(total superoxide dismutase,TSOD)、过氧化氢酶(catalase,CAT)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、总一氧化氮合酶(total nitric oxide synthase,TNOS)试剂盒购自南京建成生物工程研究所。所有引物均采用Primer 5.0软件设计,由上海生工生物工程有限公司合成。
1.1.3 仪器Olympus AU640全自动生化分析仪;日本Nikon 80i荧光正置显微镜;英国Teche PCR仪;北京六一仪器厂电泳仪、电转仪;Gel Documentation system曝光系统和Chemi Scope series凝胶成像系统均购自Clinx科学仪器有限公司。
1.2 方法 1.2.1 动物分组与处理将SD大鼠随机分为正常对照组(CON,n=10),高脂饮食组(HFD,n=40)。CON组喂基础饲料,HFD组喂自制的高脂饮食(由55%基础饲料、12%猪油、5%蔗糖、8%奶粉、5%花生、10%鸡蛋、3%芝麻油、2%食盐组成)。12周后,取体质量明显增加的大鼠30只,随机分为HFD组、高脂饮食+低剂量DJC治疗组(HFD+DJCL)和高脂饮食+高剂量DJC治疗组(HFD+DJCH),每组10只。HFD组继续给予高脂饮食8周,HFD+DJCL和HFD+DJCH组在给予高脂饮食的同时,分别给予DJC 500、1 000 mg·kg-1·d-1干预8周,CON和HFD组分别灌胃等体积的蒸馏水。所有操作均遵守安徽医科大学实验动物伦理委员会要求。
1.2.2 血清代谢指标分析所有大鼠禁食12 h后称重,水合氯醛麻醉,腹主动脉取血分离血清(3 000 r·min-1,15 min),分析血清TG、总胆固醇(total cholesterol,TC)、高密度脂蛋白胆固醇(high density lipoprotein-cholesterol,HDL-C)、尿素氮(blood urea nitrogen,BUN)、尿酸(uric acid,UA)、肌酐(serum creatinine,Scr)水平。
1.2.3 肾匀浆TG和氧化应激指标测定称取肾组织,冰水浴条件下,用匀浆器制备成10%的组织匀浆,4℃、3 000 r·min-1离心10 min,取上清。MDA、TSOD、CuZn-SOD、CAT、GSH-Px、TNOS测定均按照相应的试剂盒说明书进行。称取组织后,按100 g·L-1加入无水乙醇,匀浆器匀浆,4℃放置1 h,4℃、4 000 r·min-1离心15 min,取上清液进行TG的测定。
1.2.4 肾脏的HE、油红O和PAS染色将大鼠肾脏用4%的多聚甲醛溶液固定72 h,石蜡包埋,3 μm切片后行HE染色,并拍照。将-80℃冻存的肾脏取出制备冰冻切片,4%的多聚甲醛溶液固定30 min,1,2-丙二醇室温孵育2 min,油红O工作液染色60 min,苏木精染液复染后,甘油明胶封片。PAS染色按照试剂盒说明书进行,将切片用95%的乙醇固定10 min,10 g·L-1过碘酸液作用20 min,Schiff染液中染色60 min,苏木精染液复染10 min后拍照。
1.2.5 肾脏免疫组化分析石蜡包埋肾组织以4 μm连续切片,SABC法进行CD36的免疫组化分析,DAB显色,脱水、透明和封片,光镜下观察并拍照,每张切片随机选取10个视野,棕黄色颗粒区为阳性信号,并用生物图像软件计算各组免疫阳性细胞的平均光密度值(integral optical density, IOD)。
1.2.6 RT-PCRRNAiso Plus提取各组大鼠肾组织的RNA,按照RT试剂盒说明书操作得到cDNA后,常规PCR反应扩增基因。PCR产物经过琼脂糖电泳后,凝胶成像系统拍照并分析灰度值。RNA的相对表达水平以目的基因灰度值与内参GAPDH的比值表示。检测的目的基因及引物序列见Tab 1。
| Gene | Primers(5′-3′) |
| SREBP1c | F: ATGGACGAGCTGGCCTTCGGTGAGGCGGCT |
| R: CCAGAGAGGAACCCAGGGCCGCAG | |
| FASN | F:GGAGGTGGTGATAGCCGGTAT |
| R:TGGGTAATCCATAGAGCCCAG | |
| GAPDH | F: GGCACAGTCAAGGCTGAGAATG |
| R: ATGGTGGTGAAGACGCCAGTA |
RIPA裂解液提取各组肾组织的蛋白质后,BCA法测定其浓度,10% SDS-PAGE电泳分离,转膜,分别以β-actin(1:400)、phospho-AMPKα(1:1 000)、AMPK(1:1 000)、PPARα(1:800)、PPARγ(1:800)孵育过夜,二抗(1:10 000)孵育2 h,TBST漂洗,电化学发光系统显色成像,凝胶分析软件计算目标蛋白的相对表达含量,实验重复3次。
1.3 统计学分析计量数据以x±s表示,采用SPSS 16.0软件分析,多组间均数比较采用单因素方差分析(ANOVA),两两比较采用最小显著差异法(LSD法)。
2 结果 2.1 DJC对高脂饮食大鼠体质量及血清脂代谢、肾功能的影响与CON组相比,HFD组大鼠血清TG、TC、BUN、UA、Scr浓度均升高,HDL-C浓度下降,差异有统计学意义(P<0.05或P<0.01);与HFD组相比,HFD+DJCL、HFD+DJCH组的血清TG、TC、UA、Scr水平均降低,HDL-C水平上升,差异有统计学意义(P<0.05或P<0.01),有一定的剂量效应。4组大鼠之间体质量的变化差异无统计学意义(Tab 2)。
| Group | Body weight/g | TG/mmol·L-1 | TC/mmol·L-1 | HDL-C/mmol·L-1 | BUN/mmol·L-1 | UA/mmol·L-1 | Scr/mmol·L-1 |
| CON | 409.38±132.81 | 0.39±0.14 | 1.00±0.36 | 1.09±0.21 | 6.17±0.86 | 66.25±4.57 | 31.75±7.45 |
| HFD | 450.25±29.63 | 0.77±0.12# | 1.44±0.28# | 0.54±0.08## | 7.48±0.57# | 118.33±56.65## | 53.00±2.64## |
| HFD+DJCL | 422.84±109.93 | 0.57±0.25** | 1.24±0.35* | 0.85±0.43** | 6.40±2.38 | 98.43±22.11* | 45.73±2.45* |
| HFD+DJCH | 435.75±29.15 | 0.48±0.28** | 1.04±0.27* | 1.11±0.25** | 6.12±1.79 | 75.65±6.13** | 36.12±2.36** |
| #P < 0.05,##P < 0.01 vs CON group; *P < 0.05,**P < 0.01 vs HFD group | |||||||
如Fig 1所示,与CON组相比,HFD组大鼠肾匀浆TG明显升高(P<0.01),而与HFD组相比,DJC 2个剂量组均可明显降低肾匀浆的TG含量(P<0.05)。与CON组相比,HFD组肾匀浆CAT、TNOS、TSOD、CuZn-SOD水平明显降低,GSH-Px、MDA水平明显上升,差异有统计学意义(P<0.05或P<0.01);DJC组肾匀浆CAT、TNOS、TSOD、Cu Zn-SOD水平上升,GSH-Px、MDA水平明显降低,以HFD+DJCH组最为明显,并有一定的剂量效应(P<0.05,P<0.01)。见Tab 3。
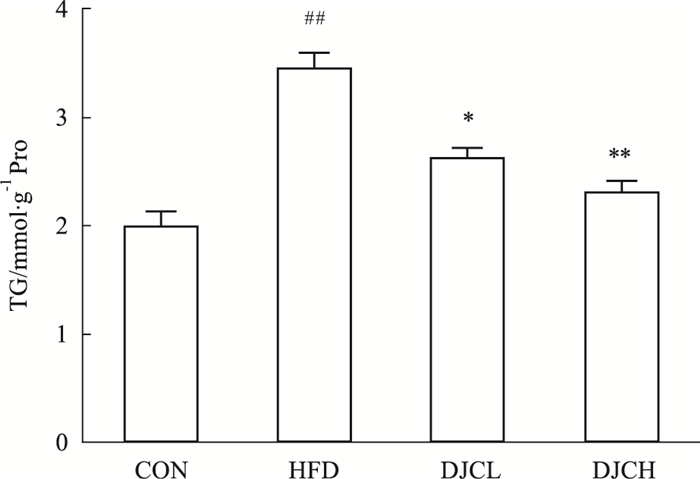
|
| Fig 1 Effect of DJC on triglyceride levels in kidney ##P < 0.01 vs CON group; *P < 0.05, **P < 0.01 vs HFD group |
| Group | CAT/kU·g-1 Pro | GSH-Px/kU·g-1 Pro | MDA/μmol·g-1 Pro | TNOS/kU·g-1 Pro | CuZn-SOD/kU·g-1 Pro | TSOD/kU·g-1 Pro |
| CON | 2.374±0.85 | 4.92±0.83 | 1.23±0.45 | 1.79±0.37 | 150.00±10.40 | 115.00±12.14 |
| HFD | 0.773±0.22# | 15.23±1.15# | 1.80±0.72# | 0.40±0.31# | 75.00±6.13# | 63.00±5.32# |
| HFD+DJCL | 1.264±0.91* | 12.80±0.94* | 1.24±0.54* | 1.27±1.05** | 105.00±18.10* | 89.00±8.34* |
| HFD+DJCH | 1.865±0.73** | 8.13±1.03* | 1.18±0.32* | 1.53±0.79** | 123.00±20.12** | 105.00±11.10* |
| #P < 0.05 vs CON group; *P < 0.05, **P < 0.01 vs HFD group | ||||||
HE结果显示,与CON组对比,HFD组大鼠肾脏的肾小球体积明显增大,系膜细胞增殖,肾小囊腔变大;DJC治疗后肾脏的上述病变明显减轻,以HFD+DJCH组更为明显(Fig 2)。油红O结果显示,与CON组对比,HFD组大鼠的肾小球和肾小管脂质沉积明显增多;DJC治疗后肾小管的脂质沉积明显减轻,差异有统计学意义(P<0.05,P<0.01)。PAS染色结果显示,与CON组比较,HFD组大鼠的肾小球系膜基质中有大量糖原沉积,而DJC治疗组大鼠的肾小球系膜基质中的糖原含量减少,差异有统计学意义(P<0.05,P<0.01),以HFD+DJCH组病变程度更轻,有一定的剂量效应(Fig 3)。
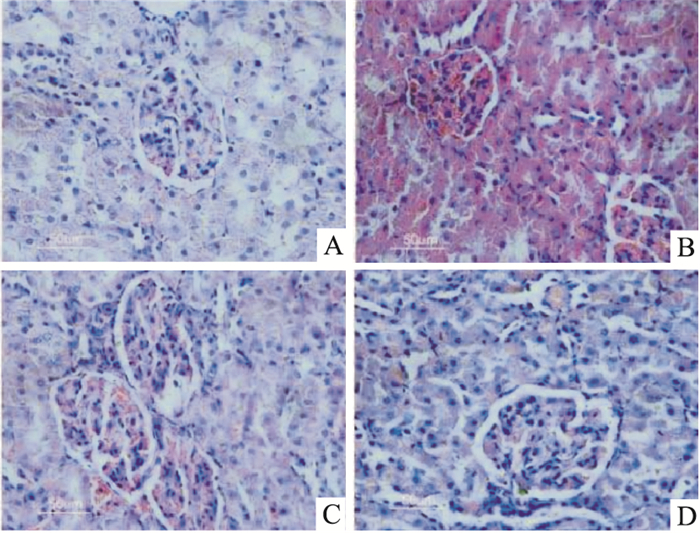
|
| Fig 2 Effect of DJC on pathological changes in kidney induced by HFD(HE staining, ×400) A: Control diet group; B:HFD group; C:HFD and DJC 500 mg·kg-1·d-1 group; D:HFD and DJC 1 000 mg·kg-1·d-1 group. |
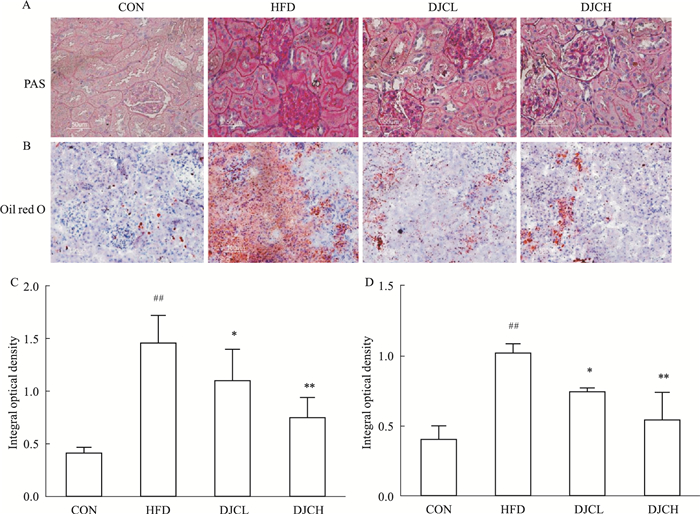
|
| Fig 3 Effect of DJC on pathological changes in kidney induced by HFD(×400) A: PAS staining of kidney; B: Oil red-O staining of kidney; C: Quantification of PAS staining; D: Quantification of Oil red-O staining. ##P < 0.01 vs CON group; *P < 0.05, **P < 0.01 vs HFD group. |
CD36主要分布在胞膜和胞质的核内体、内质网及线粒体[6]。与CON组对比,HFD组大鼠肾脏CD36的表达明显增多,差异有统计学意义(P<0.01);DJC治疗组肾脏CD36的表达明显降低,差异有统计学意义(P<0.01),且随着剂量的增大,CD36的表达进一步降低(Fig 4)。
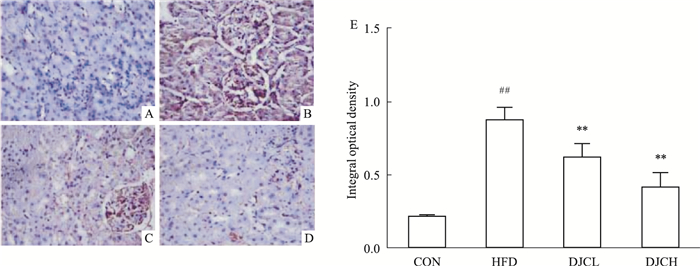
|
| Fig 4 Effect of DJC on expression and distribution of FAT/CD36 in kidney by immunohistochemistry(×400) A:Control diet group; B: High-fat diet group; C: HFD and DJC 500 mg·kg-1·d-1 group; D: HFD and DJC 1 000 mg·kg-1·d-1 group; E: Quantification of immunohistochemistry. ##P < 0.01 vs CON group; **P < 0.01 vs HFD group. |
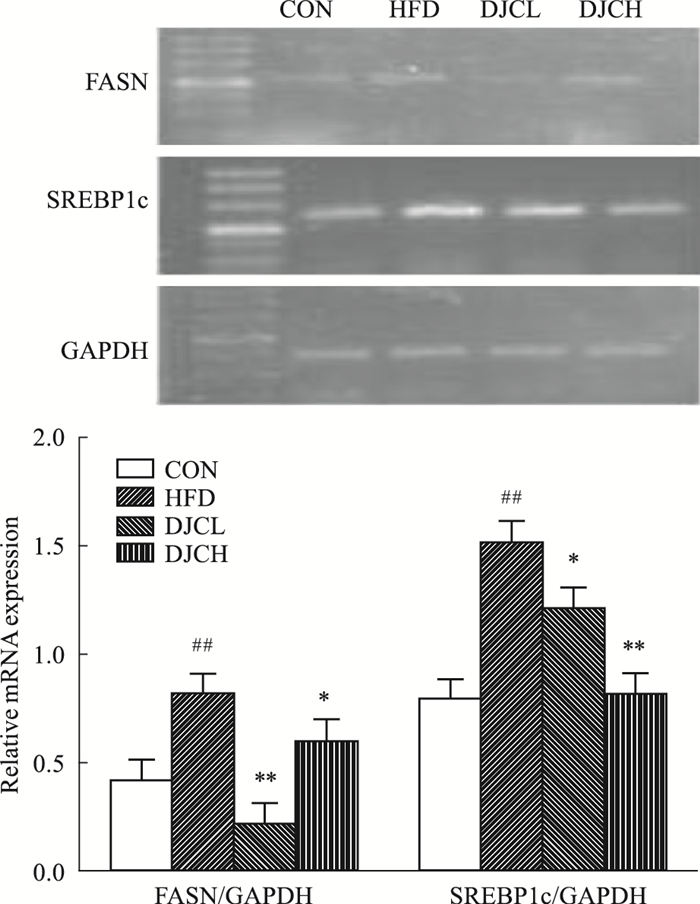
与CON组对比,HFD组肾脏组织中SREBP1c、FASN基因的mRNA水平表达明显上调,差异有统计学意义(P<0.01),HFD+DJC组的SREBP1c、FASN基因表达明显降低,差异有统计学意义(P<0.05,P<0.01), 见Fig 5。
|
| Fig 5 Effect of DJC on mRNA expression of SREBP1cand FASN in kidney by RT-PCR ##P < 0.01 vs CON group; *P < 0.05, **P < 0.01 vs HFD group |
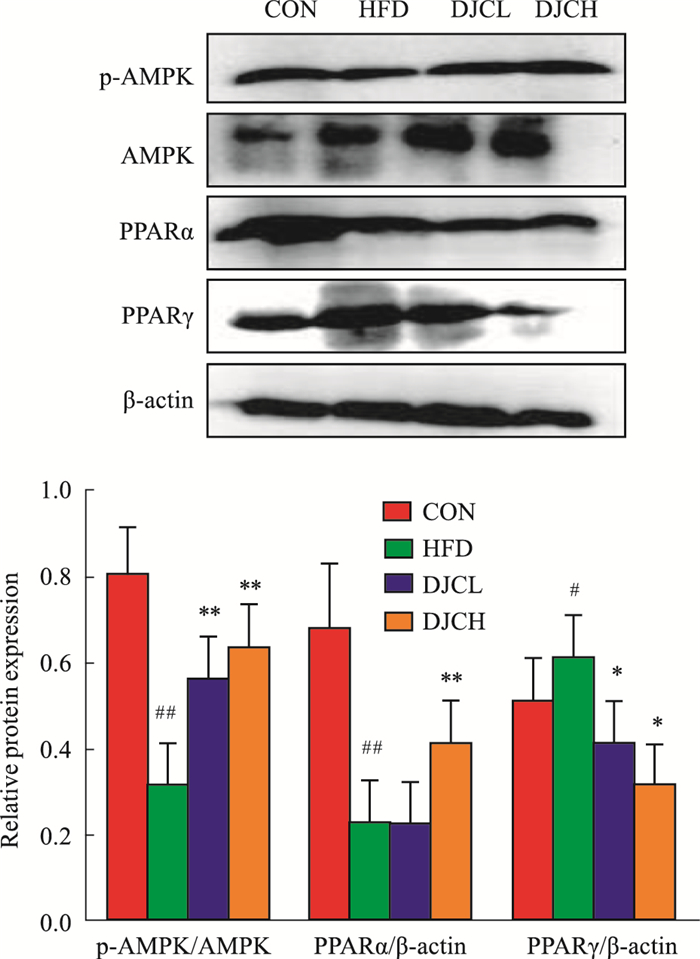
与CON组对比,HFD组肾脏组织中的p-AMPK、PPARα蛋白表达明显减少,PPARγ的表达明显增加,差异有统计学意义(P<0.05,P<0.01);与HFD组相比,HFD+DJC组肾脏组织p-AMPK、PPARα蛋白表达明显升高,PPARγ的蛋白水平明显降低,差异有统计学意义(P<0.05,P<0.01),且有一定的剂量效应(Fig 6)。
|
| Fig 6 Effect of DJC on expression of p-AMPK/AMPK, PPARα and PPARγ in kidney by Western blot #P < 0.05, ##P < 0.01 vs CON group; *P < 0.05, **P < 0.01 vs HFD group |
中心性肥胖和脂代谢紊乱、高尿酸血症可引起并加重肾脏损害。在本研究中,我们应用SD大鼠高脂血症模型评价了DJC的降脂活性,并探讨了其基于AMPK信号通路的降脂作用机制。HFD组大鼠表现为高脂血症和高尿酸、肌酐、尿素氮血症,肾脏内有明显的脂质沉积;DJC治疗后,血脂、尿酸、肌酐、尿素氮和肾内脂质沉积明显降低,提示其具有改善血脂、肾功能和肾内脂质异位沉积的作用,并有一定的剂量效应。
脂质在肾脏内沉积,可通过过氧化反应产生MDA和各种自由基,引起氧化应激。现代药理学研究表明,DJC组方中太子参、牡丹皮能升高SOD活性,降低MDA水平,减少氧化应激[7-8];地黄被广泛地用于滋阴养肾,其中的活性成分梓醇能降低糖尿病大鼠的血浆TC、TG水平,升高HDL-C水平,同时通过升高胰腺中SOD、GSH-Px、CAT水平,减少MDA水平来减少氧化应激[9]。因此,推测复方制剂DJC可能也有减少氧化应激的作用。本研究证实了DJC能通过增加肾脏中CAT、TSOD的表达以及激活TNOS、降低MDA水平来发挥抗氧化作用,并有一定的剂量效应。Sun等[10]的研究也证实,在糖尿病肾病模型中,DJC有抗氧化作用,与本研究的结果一致。DJC中与抗氧化作用相关的单体成分还有待进一步的分离鉴定。
CD36是介导长链脂肪酸、氧化型脂质等的结合和摄取的多功能受体。肾脏CD36主要表达在肾小管上皮细胞、足细胞和系膜细胞中,高脂血症、高血糖和CKD患者中CD36的表达明显上调,在小鼠中阻止CD36的表达可防止CKD的进展,提示其在肾损伤中的重要作用,成为CKD的潜在治疗靶标[11]。本研究结果表明,高脂饮食确实引起了CD36在肾组织中的表达升高,这与文献报道一致,而不同剂量的DJC治疗均可减少CD36的表达,且有一定的剂量效应,提示DJC治疗CKD的作用可能与其调节CD36的表达有关。
AMPK是一种重要的细胞能量调节器,与肥胖、高脂血症、糖尿病等多种由能量代谢异常引起的疾病相关[12]。有文献报道,AMPK的激活抑制了肝SREBP1c的功能,从而抑制了肝脏脂肪的生成[13]。我们的研究则表明DJC可能通过激活高脂血症大鼠肾组织中AMPK,增加下游脂肪分解基因PPARα的表达,减少下游PPARγ、SREBP1c、FASN基因的表达,来减少肾脏脂质的沉积和减轻体重,改善肾组织内的脂代谢紊乱。
综上所述,DJC能有效降低高脂血症大鼠的血脂、肾脏TG和缓解肾脏内的氧化应激水平,并能明显改善大鼠的肾功能。机制研究表明,DJC能通过激活AMPK,进而活化下游脂肪分解基因PPARα的表达,抑制CD36和脂肪生成基因PPARγ、SREBP1c、FASN的表达,并有一定的剂量效应,这为DJC在CKD的临床治疗应用上提供了新的证据支持。
( 致谢: 本实验在安徽医科大学基础医学院药理学教研室、生物化学与分子生物学教研室和综合实验室完成,感谢实验室老师和同学们给予的帮助和指导!)
| [1] | de Vries A P, Ruggenenti P, Ruan X Z, et al. Fatty kidney: emerging role of ectopic lipid in obesity-related renal disease[J]. Lancet Diabetes Endocrinol, 2014, 2(5): 417-26. doi:10.1016/S2213-8587(14)70065-8 |
| [2] | Bin Feng, Meng R, Bin Huang, et al. Silymarin protects against renal injury through normalization of lipid metabolism and mitochondrial biogenesis in high fat-fed mice[J]. Free Radic Biol Med, 2017, 110: 240-9. doi:10.1016/j.freeradbiomed.2017.06.009 |
| [3] | 程龙艳, 贾会玉, 陈光亮. 丹蛭降糖胶囊治疗2型糖尿病实验与临床研究进展[J]. 中医药临床杂志, 2014, 26(8): 870-2. Cheng L Y, Jia H Y, Chen G L. Progress in experimental and clinical research of Danzhijiangtang Capsule on therapy of type 2 diabetes mellitus[J]. Clin J Trad Chin Med, 2014, 26(8): 870-2. |
| [4] | 陈明卫, 夏同佳, 方朝晖, 等. 丹蛭降糖胶囊改善高脂饮食诱导的肥胖大鼠骨骼肌胰岛素抵抗机制的初步研究[J]. 中华临床医师杂志:电子版, 2014, 8(9): 1697-702. Chen M W, Xia T J, Fang Z H, et al. Experimental research on mechanisms of Danzhi Jiangtang Capsule in the improvement of skeletal insulin resistance in obese rats fed with high-fat diet[J]. Chin J Clin (Electron Ed), 2014, 8(9): 1697-702. |
| [5] | 李艳, 卜文婕, 朱建梁, 等. 丹蛭降糖胶囊对糖尿病大鼠肾脏的保护作用[J]. 中国药学杂志, 2015, 50(10): 857-62. Li Y, Bu W J, Zhu J L, et al. Nephroprotective effect of Danzhi Jiangtang Capsule on diabetic rats and its mechanism[J]. Chin Pharm J, 2015, 50(10): 857-62. |
| [6] | Glatz J F, Luiken J J. From fat to FAT (CD36/SR-B2): understanding the regulation of cellular fatty acid uptake[J]. Biochimie, 2017, 136: 21-6. doi:10.1016/j.biochi.2016.12.007 |
| [7] | Rui G, Wei W, Yuliang W, et al. Protective effects of Radix Pseudostellariae extract against retinal laser injury[J]. Cell Physiol Biochem, 2014, 33(6): 1643-53. doi:10.1159/000362947 |
| [8] | Zhang M H, Feng L, Zhu M M, et al. Antioxidative and anti-inflammatory activities of paeoniflorin and oxypaeoniflora on AGEs induced mesangial cell damage[J]. Planta Med, 2013, 79(14): 1319-23. doi:10.1055/s-00000058 |
| [9] | Zhu H, Wang Y, Liu Z, et al. Antidiabetic and antioxidant effects of catalpol extracted from Rehmannia glutinosa (Di Huang) on rat diabetes induced by streptozotocin and high-fat, high-sugar feed[J]. Chin Med, 2016, 11: 25. doi:10.1186/s13020-016-0096-7 |
| [10] | Sun M, Li Y, Bu W, et al. DJC suppresses advanced glycation end products-induced JAK-STAT signaling and ROS in mesangial cells[J]. Evid Based Complement Alternat Med, 2017, 2017: 2942830. |
| [11] | Yang X C, Okamura D M, Lu X F, et al. CD36 in chronic kidney disease: novel insights and therapeutic opportunities[J]. Nat Rev Nephrol, 2017, 13(12): 769-81. doi:10.1038/nrneph.2017.126 |
| [12] | 孙乐, 贺震旦, 杨润梅, 等. 粗壮女贞总苷降脂作用及其基于AMPK通路的降脂作用机制研究[J]. 中国药理学通报, 2017, 33(8): 1073-9. Sun L, He Z D, Yang R M, et al. Hypolipidemic activity of total phenylpropanoid glycosides from Ligustrum robustum(Roxb.)Blume and its mechanisms on AMPK pathway[J]. Chin Pharmacol Bull, 2017, 33(8): 1073-9. |
| [13] | Li Y, Xu S, Mihaylova M M, et al. AMPK phosphorylates and inhibits SREBP activity to attenuate hepatic steatosis and atherosclerosis in diet-induced insulin-resistant mice[J]. Cell Metab, 2011, 13(4): 376-88. doi:10.1016/j.cmet.2011.03.009 |

