

2. 重庆医科大学药理学教研室,重庆 400016;
3. 贵州省遵义市妇幼保健院药剂科,贵州 遵义 563000
 ,
HU Pei3,
MA Yan1,2,
REN Wen-yan1,2,
ZHOU Lin-yun1,2,
HE Bai-cheng1,2,
SUN Wen-juan1,2
,
HU Pei3,
MA Yan1,2,
REN Wen-yan1,2,
ZHOU Lin-yun1,2,
HE Bai-cheng1,2,
SUN Wen-juan1,2

2. Dept of Pharmcology, Pharmacy School of Chongqing Medical University, Chongqing 400016, China;
3. Dept of Pharmacy, Zunyi Maternal and Child Health Care Hospital of Guizhou, Zunyi Guizhou 563000, China
和厚朴酚(honokiol,HNK)隶属于木兰科落叶乔木植物,是中药厚朴的最主要的两个活性组分之一[1]。研究表明,和厚朴酚不仅具有抗氧化、抗病毒、中枢性肌肉松弛、神经抑制等作用[2],还能够抑制肿瘤细胞的生长、调控肿瘤血管生成、诱导肿瘤细胞分化、抑制肿瘤细胞的侵袭转移等,对前列腺癌、结肠癌、宫颈癌都具有良好的抗肿瘤效果[3]。但其具体的分子机制还不十分清楚。
本实验中,我们发现,和厚朴酚可能通过上调骨形态发生蛋白7(bone morphogenetic protein 7,BMP7)的表达来调控其对结肠癌细胞的增殖抑制作用以及促凋亡作用。前期研究结果显示,与正常人源结肠细胞FHC相比,BMP7在HCT116细胞中的内源性表达明显升高[4]。我们的实验结果也表明,和厚朴酚对人结肠癌细胞HCT116的增殖具有明显的抑制作用,其作用可能与上调BMP7的表达有关。利用分子生物学技术以及加入BMP7过表达腺病毒和抗体来验证,实验结果显示,和厚朴酚确实可以通过激活BMP7这个靶点来调控肿瘤细胞的增殖与凋亡,但确切的机制研究还不十分清楚。
1 材料 1.1 细胞株人结肠癌细胞HCT116和HEK-293细胞购自American Type Culture Collection(ATCC);
1.2 试剂和厚朴酚购自西安昊轩生物科技有限公司(纯度为99.9%);实验所用抗体(BMP7、BCl-2和PCNA)购自Santa Cruz Biotechnology公司;结晶紫购自北京索莱宝有限公司;凋亡试剂盒购自凯基生物;重组腺病毒所用试剂(穿梭质粒、骨架质粒以及Taq)购自TaKaRa公司;GAPDH与BMP7的引物来源于奥科鼎盛生物科技有限公司。
1.3 仪器细胞培养箱(Thermo公司);细胞培养超净台(安泰技术有限公司);倒置荧光显微镜(日本Nikon);低温离心机(Thermo公司);湿式转膜仪、垂直电泳槽(六一仪器厂);酶标仪、凝胶成像系统(Bio-Rad公司)。
2 方法 2.1 细胞培养人结肠癌细胞HCT116用含10% FBS的DMEM培养基培养(100 kU·L-1青霉素和0.1 g·L-1链霉素)。孵箱条件为:恒温37℃,CO2浓度为5%。全部实验均采用对数生长期的细胞进行实验。
2.2 实验分组实验设计分为实验组与对照组,实验组加入浓度梯度的和厚朴酚(初始浓度为10 μmol·L-1,用DMSO溶解并稀释)。根据处理的最高药物浓度组,对照组用相同体积的DMSO进行处理,其余组用DMSO补齐。
2.3 结晶紫染色检测细胞增殖将处于指数生长期的HCT116细胞接种于24孔板,待6 ~8 h细胞贴壁之后,和厚朴酚不同浓度(0、0.5、1.0、1.5、2.0、2.5 μmol·L-1)处理细胞。分别在处理后的24、48、72 h进行结晶紫染色。方法如下:弃去24孔板的上层培养基,用PBS洗2次。每孔加入0.2 mL 0.25%的结晶紫溶液,室温下染色20 min。倒掉结晶紫溶液,用PBS小心清洗3次,风干后扫描并进行定量分析(用20 %的甲醛溶液完全溶解,并在酶标仪上读数,波长为490 nm)。每组实验重复3次。
2.4 流式分析检测细胞周期与凋亡将处于指数生长期的细胞均匀铺于6孔板中,加入和厚朴酚(0、1.0、1.5、2.0 μmol·L-1),48 h后收集细胞。先用PBS清洗细胞,再用不含EDTA的胰酶消化,收集细胞,1 000 r·min-1离心5 min,PBS洗涤并离心2次,最后用70%乙醇固定24 h。分别加入Annexin-V EGFP和PI(按试剂盒操作进行),流式细胞仪检测增殖。当检测凋亡时,在最后一步,用PBS离心2次之后,用1 mL PBS重悬,加入染色试剂,经流式细胞仪检测。每组实验重复3次。
2.5 总RNA的提取和PCR实验弃细胞上清液,用PBS清洗细胞2次。采用TRIzol试剂裂解细胞,并用常规方法提取RNA,根据逆转录试剂盒反转录为cDNA。逆转录程序如下:37℃ 15 min,85℃ 5 s。所用引物序列如下:GAPDH上游引物5′-CAA CGAATTTGGCTACAGCA-3′, 下游引物5′-AGGGGAG ATTCAGTGTGGTG-3′;BMP7上游引物5′-GGCAGG ACTGGATCATCG-3′,下游引物5′- AAGTGGACC AGCGTCTGC-3′。每组实验重复3次。
2.6 Western blot实验将处于对数生长期的HCT116细胞种于6孔板中,贴壁后按实验设计加入HNK(1.0、1.5、2.0 μmol·L-1),并于24、48 h提取细胞总蛋白。采用12%的聚丙烯酰胺凝胶进行电泳,冰浴转移至PVDF膜上。按照常规的方法加入一抗与二抗,采用ECL试剂盒显影并成像。每组实验重复3次。
2.7 重组BMP7腺病毒构建采用AdEasy系统构建BMP7腺病毒,并用绿色荧光标记。将目的基因编码序列进行PCR扩增并克隆到穿梭质粒中。测序后将穿梭质粒线性化,与骨架质粒重组。将重组后得到的质粒线性化,转染到HEK-293细胞中包装,即得到携带目的基因的重组腺病毒。BMP7腺病毒用绿色荧光标记,以GFP重组腺病毒(AdGFP)作空白对照。
2.8 统计学分析实验数据均以x±s表示。实验数据均用SPSS 11.0进行分析,3组以上比较宜用方差分析,再作两两比较。
3 结果 3.1 和厚朴酚对HCT116细胞增殖的影响结晶紫染色实验结果显示,和厚朴酚浓度与时间依赖性地抑制HCT116细胞的增殖,并且这种作用在d 3,和厚朴酚浓度为2.0 μmol·L-1时更加明显(Fig 1A,B)。Annexin-V EGFP/PI双染流式分析结果显示,和厚朴酚使HCT116细胞阻滞在G2期(Fig 1C,D);Western blot结果显示,和厚朴酚浓度与时间梯度性地上调了增殖细胞核抗原(proliferation cell nuclear antigen,PCNA)的表达(Fig 1E,F)。
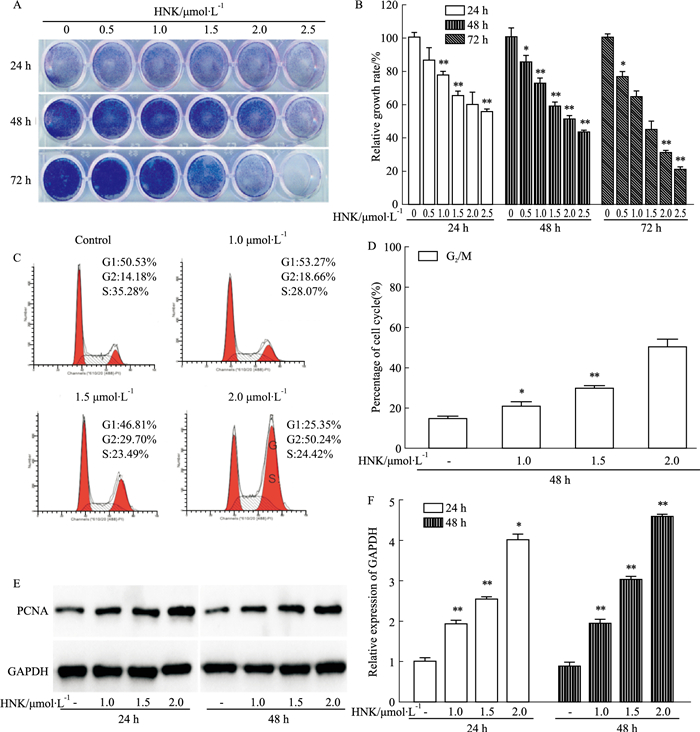
|
| Fig 1 Effect of HNK on proliferation and cell cycle in HCT116 cells A:Crystal violet staining results showed the effect of HNK on proliferation in HCT116 cells; C:Flow cytometry analysis results showed the effect of HNK on cell cycle in HCT116 cells; E:Western blot results showed the effect of HNK on expression of PCNA in HCT116 cells; B, D, F:the quantitative diagram of A, C, E diagram respectively. *P < 0.05, **P < 0.01 vs control. |
Western blot分析结果显示,与对照组相比,和厚朴酚下调了Bcl-2蛋白的表达,并具有浓度及时间依赖性(Fig 2A,B)。流式检测结果与Western blot结果一致(Fig 2C,D)。结果表明,和厚朴酚对HCT116细胞凋亡具有促进作用。
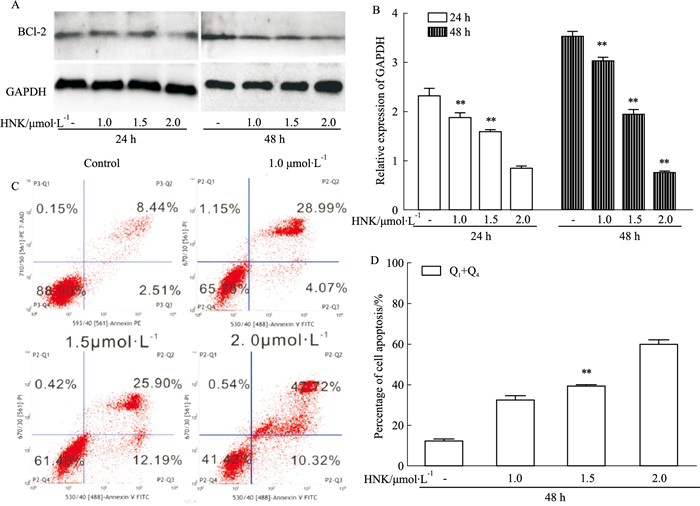
|
| Fig 2 Effect of HNK on apoptosis of HCT116 cells A:Western blot results showed the effect of HNK on BCl-2 in HCT116 cells; C:Flow cytometry analysis results showed the effect of HNK on apoptosis in HCT116 cells; B, D:the quantitative diagram of A, C diagram respectively. *P < 0.05, **P < 0.01 vs control. |
半定量PCR (Fig 3A,B)与Western blot (Fig 3C,D)分析结果显示,随着和厚朴酚浓度与作用时间的增加,HCT116细胞中内源性BMP7的蛋白及mRNA表达水平也逐渐增加。结果提示,BMP7可能与和厚朴酚调控HCT116细胞增殖、凋亡有关。
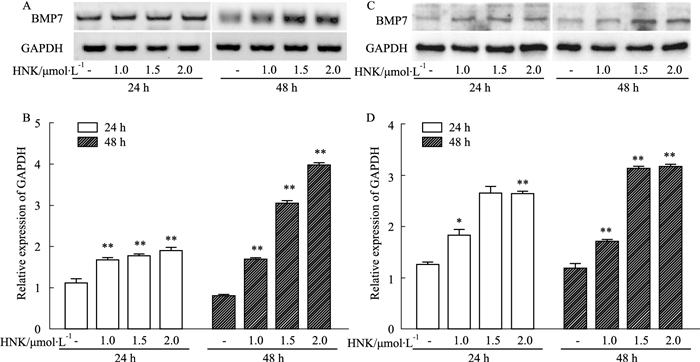
|
| Fig 3 Effect of HNK on expression of endogenous BMP7 in HCT116 cells A:PCR results showed the effect of HNK on mRNA expression of BMP7 in HCT116 cells; C:Western blot results showed the effect of HNK on protein expression of BMP7 in HCT116 cells; B, D:the quantitative diagram of A, C diagram respectively. *P < 0.05, **P < 0.01 vs control. |
结晶紫定量分析实验显示,重组腺病毒表达BMP7(AdBMP7)成功转染入HCT116细胞中后(24、48、72 h),能够增强和厚朴酚的增殖抑制作用(Fig 4A)。流式检测(Fig 4B,C)及Western blot(Fig 4D,E)结果显示,过表达BMP7能够增强和厚朴酚所诱导的增殖抑制作用,以及促进凋亡作用。
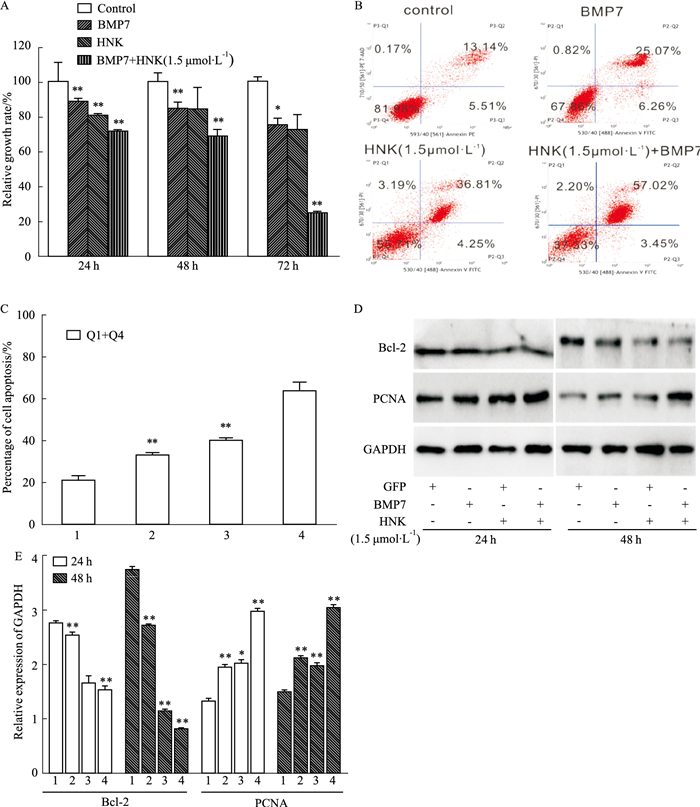
|
| Fig 4 Effects of BMP7 on anti-proliferation and apoptosis inducing activities of HNK in HCT116 cells A:Quantification results of crystal violet staining showed the effect of BMP7 on anti-proliferation effect of HNK in HCT116 cells. *P < 0.05, **P < 0.01 vs control group; B:Flow cytometry analysis results showed the effects of BMP7 on apoptosis induced by HNK in HCT116 cells; D:Western blot assay results showed the effect of BMP7 on expression of Bcl-2 and PCNA, affected by HNK in HCT116 cells; C, E:the quantitative diagram of B, D diagram respectively(1:GFP; 2:BMP7;3:HNK; 4:HNK+BMP7). |
结晶紫定量分析实验显示,BMP7抗体能够减弱和厚朴酚的增殖抑制作用(Fig 5A)。流式检测(Fig 5B,C)及Western blot(Fig 5D,E)结果显示,和厚朴酚所诱导的增殖抑制作用以及凋亡促进作用能够被BMP7抗体部分翻转。结果提示,和厚朴酚可能通过BMP7来调控细胞的增殖凋亡,这可能成为治疗结肠癌的一个新靶点。
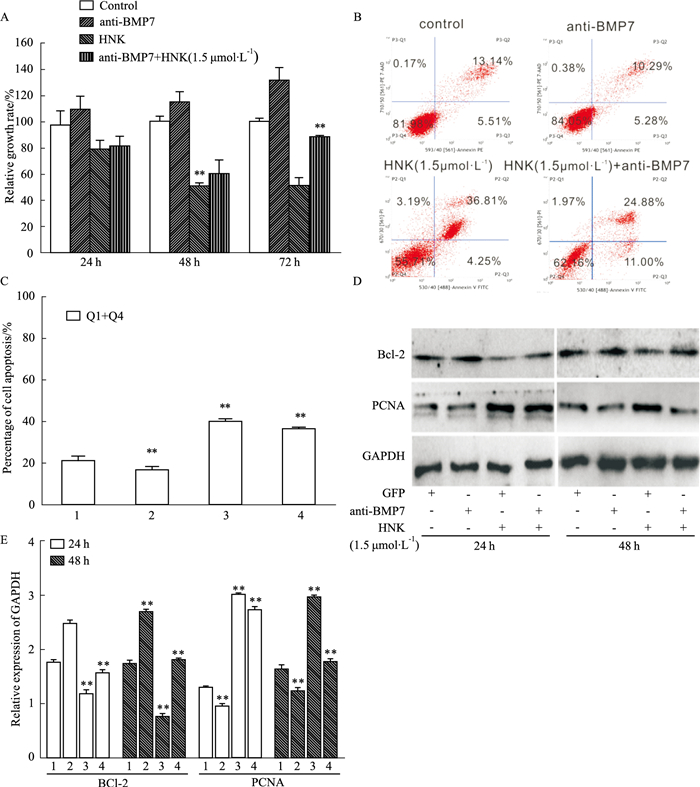
|
| Fig 5 Effects of BMP7 on anti-proliferation and apoptosis inducing activities of HNK in HCT116 cells A:Quantification results of crystal violet staining showed the effect of anti-BMP7 on anti-proliferation effect of HNK in HCT116 cells. *P < 0.05, **P < 0.01 vs control group; B:Flow cytometry analysis results showed the effects of anti-BMP7 on apoptosis induced by HNK in HCT116 cells; D:Western blot assay results showed the effect of anti-BMP7 on expression of Bcl-2 and PCNA, affected by HNK in HCT116 cells; C, E:the quantitative diagram(1:GFP; 2:anti-BMP7;3:HNK; 4:HNK+anti-BMP7) of B, D diagram respectively. |
Western blot结果显示,加入外源性BMP7过表达腺病毒,能够协同和厚朴酚的作用,促进BMP7的表达,在48 h协同作用最为明显(Fig 6A,B);另一方面,加入BMP7抗体能够减弱此作用,降低BMP7的表达(Fig 6C,D)。

|
| Fig 6 Effects of HNK combined with AdBMP7/anti-BMP7 on expression of BMP7 in HCT116 cells A:Western blot assay results showed the effect of HNK and BMP7 on level of BMP7 in HCT116 cells; C:Western blot assay results showed the effect of HNK and anti-BMP7 on level of BMP7 in HCT116 cells; B, D:the quantitative diagram of A, C diagram respectively. *P < 0.05, **P < 0.01 vs control. |
结肠癌属于消化系统恶性肿瘤,具有较高的发病率和死亡率。据报道,全球每年约有50万患者死于结肠癌[5]。在我国的恶性肿瘤死亡率中,结肠癌的死亡率居第3位,仅次于肝癌和肺癌[6]。研究表明,结肠癌的发生与饮食习惯、肥胖和基因突变有关[7]。在结肠癌细胞中,基因突变可引起细胞增殖凋亡和信号传导异常,这些异常信号包括p53、Wnt/β-catenin、BMP/Smad、TGF-β、PI3K/Akt等,从而对肿瘤细胞的增殖失去调控能力,导致肿瘤的发生、发展[8]。
和厚朴酚具有广泛的药理作用,抑制肿瘤细胞增殖是其最具有前景的特点之一。Chen等[9]报道,在人结肠癌RKO细胞中,和厚朴酚能抑制VEGF基因转录与蛋白的表达,降解HIF-α活性,抑制肿瘤血管生成,降低实体瘤的生长率。Li等[10]报道,和厚朴酚双重阻断上皮-间质转化(EMT)和抑制肿瘤干细胞的生成,抑制肾癌细胞(RCC)的转移。由此可见,和厚朴酚在抗肿瘤的各个方面都具有较大的潜力。
骨形态蛋白(BMPs)属于转化生长因子β(TGF-β)超家族,他们不仅在成骨中发挥重要作用,而且还能调控肿瘤细胞的增殖、凋亡、侵袭、转移、分化等[11]。已有文献报道,BMP信号通路异常涉及多种肿瘤的发生,如结肠癌、骨肉瘤等。BMP7是BMPs成员,也被称为成骨蛋白(OP-1)。BMP7由于其明显的成骨活性,临床上已经被批准用于脊柱外科的治疗。越来越多的证据表明,BMP7也参与了肿瘤的发生发展。Motoyama等[12]研究报道,在大多数的结直肠癌患者中,BMP7在癌组织中的表达明显高于癌旁组织,并且表达的强度与肿瘤侵袭的深度密切相关。因此,BMP7基因表达可作为一个非常有用的预后指标。
本研究结果表明,和厚朴酚能够明显抑制结肠癌细胞HCT116的增殖,诱导细胞阻滞在G2期,促进细胞凋亡,其作用可能与BMP7有关。另有相关研究显示,和厚朴酚对总的Smad1/5/8和磷酸化的Smad1/5/8水平无明显影响[13],提示BMP7介导该抗癌效果可能是通过非经典的BMP信号通路,但细节机制仍不清楚。本课题组还将利用其他的结肠癌细胞来分析验证和厚朴酚抑制细胞生长与BMP7的关系,并初步阐明其调控机制,为和厚朴酚更好地应用于临床提供理论和实验基础。
(本实验是在重庆市生物化学与分子药理学重点实验室完成,感谢各位老师和同学对本实验的指导及帮助。)
| [1] | 杨爽, 刘晓岩, 胡振宇, 等. 和厚朴酚通过抑制脑MPTP开放和调节PARP-1活性保护全脑缺血的作用研究[J]. 中国药理学通报, 2012, 28(2): 218-21. Yang S, Liu X Y, Hu Z Y, et al. Honokiol protects brain against global brain ischemia in mice through inhibiting MPTP opening and PARP-1 activity[J]. Chin Pharmacol Bull, 2012, 28(2): 218-21. |
| [2] | 王冬娥, 陆羡. 和厚朴酚的药理作用及其抗肿瘤的机制研究进展[J]. 医学综述, 2009, 15(11): 1725-7. Wang D E, Lu X. Research progress on the pharmacological function and the antitumor mechanism of honokiol[J]. Med Recapitulate, 2009, 15(11): 1725-7. doi:10.3969/j.issn.1006-2084.2009.11.040 |
| [3] | Sun Q L, Zhao C P, Wang T Y, et al. Expression profile analysis of long non-coding RNA associated with vincristine resistance in colon cancer cells by next-generation sequencing[J]. Gene, 2015, 572(1): 79-86. doi:10.1016/j.gene.2015.06.087 |
| [4] | Ren C M, Li Y, Chen Q Z, et al. Oridonin inhibits the proliferation of human colon cancer cells by upregulating BMP7 to activate p38 MAPK[J]. Oncol Rep, 2016, 35(5): 2691-8. doi:10.3892/or.2016.4654 |
| [5] | Tárraga López P J, Albero J S, Rodríguez-Montes J A. Primary and secondary prevention of colorectal cancer[J]. Clin Med Insights Gastroenterol, 2014, 74: 33-46. |
| [6] | Mehravi B, Ahmadi M, Amanlou M, et al. Cellular up-take and imagingstudies of glycosylated silica nanoprob (GSN) in human colon adenocarcinoma (HT 29 cell line)[J]. Int J Nanomedicine, 2013, 8(10): 3209-16. |
| [7] | Duan L, Ye L, Wu R, et al. Inactivation of the phosphatidylinositol 3-kinase/Akt pathway is involved in BMP9-mediated tumor-suppressive effects in gastric cancer cells[J]. J Cell Biochem, 2015, 116(6): 1080-9. doi:10.1002/jcb.25063 |
| [8] | 袁霜雪, 王东旭, 伍秋香, 等. 白藜芦醇抑制HCT116结肠癌细胞增殖与Wnt/β-catenin的关系研究[J]. 中国药理学通报, 2015, 31(4): 537-41. Yuan S X, Wang D X, Wu Q X, et al. Study on the relationship between the anti-proliferation effect of resveratrol on HCT116 colon cancer cells and Wnt/β-catenin[J]. Chin Pharmacol Bull, 2015, 31(4): 537-41. |
| [9] | Chen F, Wang T, Wu Y F, et al. Honokiol:a potent chemotherapy candidate for human colorectal carcinoma[J]. World J Gastroenterol, 2004, 10(23): 3459-63. doi:10.3748/wjg.v10.i23.3459 |
| [10] | Li W, Wang Q, Su Q, et al. Honokiol suppresses renal cancer cells' metastasis via dual-blocking epithelial-mesenchymal transition and cancer stem cell properties through modulating miR-141/ZEB2 signaling[J]. Mol Cells, 2014, 37(5): 383-8. doi:10.14348/molcells.2014.0009 |
| [11] | Kamiya N, Ye L, Kobayashi T, et al. Disruption of BMP signaling in osteoblasts through type IA receptor (BMPRIA) increases bone mass[J]. J Bone Miner Res, 2008, 23(12): 2007-17. doi:10.1359/jbmr.2008.23.issue-12 |
| [12] | Motoyama K, Tanaka F, Kosaka Y, et al. Clinical significance of BMP7 in human colorectal cancer[J]. Ann Surg Oncol, 2008, 15(5): 1530-7. doi:10.1245/s10434-007-9746-4 |
| [13] | Liu RX, Ren WY, Ma Y, et al. BMP7 mediates the anticancer effect of honokiol by upregulating p53 in HCT116 cells[J]. Int J Oncol, 2017, 51(3): 907-17. doi:10.3892/ijo.2017.4078 |