


2. 蚌埠医学院第一附属医院呼吸与危重症医学科,安徽 蚌埠 233030;
3. 蚌埠医学院临床医学院,安徽 蚌埠 233030;
4. 陕西省核工业二一五医院麻醉科,陕西 咸阳 712000
2. Dept of Respiratory Medicine, the First Affiliated Hospital of Bengbu Medical College, Bengbu Anhui 233000, China;
3. Dept of Clinical Medicine, Bengbu Medical College, Bengbu Anhui 233000, China;
4. Dept of Anesthesiology, No.215 hospital of Shanxi nuclear industry, Shanxi Xianyang 712000
近年来,糖尿病(diabetes mellitus,DM)在全球发病率逐年上升,并伴发多种脏器并发症,是严重危害人类生活质量的慢性疾病之一[1]。糖尿病心肌病(diabetic cardiomyopathy,DCM)是糖尿病的主要并发症之一,心肌纤维化是DCM最常见的病理改变之一[2],其发生与细胞外基质(extracellular matrix,ECM)蛋白堆积密切相关[3]。国内外研究多集中于心肌成纤维细胞导致的纤维化发生,关于心肌细胞纤维化的机制报道较少。基质金属蛋白酶(matrx metalloproteinases,MMPs)与组织金属蛋白酶抑制剂(tissue matrix metalloproteinase inhibitors,TIMPs)调控ECM的降解,MMPs/TIMPs平衡紊乱会引起ECM改变,参与心肌纤维化的发生。DCM心室重构的发生与高血糖引起的氧化应激及MMPs/TIMPs比例失衡密切关联[4]。MMPs/TIMPs比例失衡是否参与高糖诱导的心肌细胞损伤呢?这是我们的关注点之一。
线粒体乙醛脱氢酶2(aldehyde dehydrogenase 2,ALDH2)主要存在于线粒体基质,可氧化醛类物质为无毒代谢产物。ALDH2基因突变与糖尿病、心血管疾病等密切相关。前期我们观察到冠心病合并糖尿病患者ALDH2基因突变型组高血压发生率高于野生型组,ALDH2基因突变增加了高血压的发病率,且与高胰岛素血症、胰岛素抵抗等有一定的协同作用。国内外先后报道,ALDH2基因突变的糖尿病患者易出现更严重的心室舒张功能障碍;ALDH2基因敲除糖尿病小鼠亦出现心室舒张功能障碍、代谢储备失代偿和能量代谢紊乱;ALDH2基因敲除小鼠出现更严重的因压力超负荷、内质网应激等引起的心脏功能障碍。我们还观察到,激动ALDH2在大鼠心肌缺血/再灌注损伤及糖尿病大鼠心肌损伤中发挥保护作用,可能与减轻氧化应激和心肌纤维化、抑制凋亡发生等有关[5]。但ALDH2与MMP通路在高糖诱导的心肌细胞损伤中的关系尚不清楚。因此,本研究首先观察激动ALDH2是否减轻高糖诱导的原代大鼠心肌细胞损伤,进一步分析ALDH2与MMP-14、TIMP-4在糖尿病心肌损伤中的关系。
1 材料 1.1 实验动物SPF级Sprague Dawley(SD)乳鼠1~3 d,来源于蚌埠医学院实验动物中心,实验动物合格证号:SCXK(浙2014-0001)。
1.2 药品与试剂F12培养基、高糖培养基、低糖培养基均购于美国Hyclone公司;胎牛血清购于杭州四季青公司;HBSS缓冲液、细胞蛋白提取液、蛋白酶抑制剂(PMSF)、含EDTA的胰酶细胞消化液、蛋白定量试剂盒等,均购于上海碧云天生物公司;Ⅱ型胶原酶、DNA酶Ⅰ、二氢乙啶(dihydroethidium,DHE)、MTT、5-Brdu购于美国Sigma公司;小鼠抗大鼠横纹肌肌动蛋白(α-sarcomeric actin,α-SA)抗体、FITC标记的二抗IgG、兔抗大鼠GAPDH购自湖北武汉博士德生物公司;兔抗大鼠ALDH2抗体、MMP-14抗体、TIMP-4抗体购自美国Abcam公司;曝光液购于美国Millipore公司。
1.3 仪器酶标仪(美国BioTek Epoch仪器公司);CO2细胞培养箱(德国Memmert公司);倒置荧光显微镜(日本Olympus公司);Western blot仪器、ChemiDo-cTM Toch Image Syste化学发光仪(美国Bio-Rad公司)。
2 方法 2.1 大鼠心肌细胞培养在超净工作台取乳鼠心尖部组织,放于预冷的HBSS液中,轻轻挤压出血,进行清洗,将心脏组织块剪碎成黏稠状,再加入混合酶(终浓度分别为0.07%的含EDTA的胰蛋白酶、0.08%的Ⅱ型胶原酶、10 mg·L-1的DNA酶Ⅰ)消化,37℃、5% CO2培养箱静置7~10 min,弃去浑浊上清。重复以上消化步骤约5~8次,直至心肌组织蓬松。加入等体积预冷的含10% FBS的低糖培养基终止消化,轻柔吹打剪碎的组织6~10次,静置,待大块组织沉淀后,吸取浑浊上清液入另一离心管中,放入4℃冰箱以保持细胞活力。重复以上步骤,直至组织完全被吹散,收集的细胞混合液1 000 r·min-1离心6 min,获取细胞沉淀。低糖培养基将细胞沉淀重悬。将细胞种入60 mm培养皿中,于CO2培养箱培养90 min后,小心吸取培养液,1 000 r·min-1离心6 min,获取细胞沉淀,含10% FBS的F12培养基将其重悬,再加入5-Brdu(工作浓度为0.1 mmol·L-1,抑制混合的成纤维细胞生长),种于细胞培养皿中,进一步增加心肌细胞纯度。倒置显微镜下观察贴壁生长的心肌细胞,起初为点状圆形,然后为梭形,培养至d 3~4,细胞互相接触交错,出现同步化搏动。
2.2 大鼠心肌细胞鉴定将原代心肌细胞爬片,用PBS液轻柔清洗,4%的多聚甲醛37℃固定30 min,PBS液清洗,0.5% Triton X-100 37℃孵育30 min,PBS液清洗,5%的BSA 37 ℃封闭30 min,PBS液清洗,α-SA抗体(1 :300)4℃孵育过夜。次日清洗后,加入FITC-羊抗小鼠IgG(1 :59),37℃孵育40 min,PBS液清洗3次,每次5 min,加入DAPI(1 mg·L-1)染细胞核15 min,甲醇漂洗1次、5 min,PBS液清洗后,避光条件下,在载玻片上滴加5~10 μL抗荧光衰减剂,荧光显微镜下拍照,镜下可见阳性细胞胞质发出绿色荧光,即为心肌细胞,计算有绿色荧光标记的细胞所占总细胞数的百分比,重复3次,推算其纯度。
2.3 实验分组含10% FBS的F12完全培养基培养心肌细胞,干预前予以无血清培养基处理24 h,使其处于同步化状态。分别给予不同浓度葡萄糖干预心肌细胞,葡萄糖浓度分别为5.5 mmol·L-1(normal glucose concentration,NG)、15 mmol·L-1(middle glucose concentration,MG)、30 mmol·L-1(high glucose concentration,HG),处理24、48、72 h。MTT测定心肌细胞活力,确定高糖诱导的心肌细胞损伤模型。
高糖诱导的心肌细胞损伤模型确定后,实验分为4组:(1)正常对照组(normal control group,NG):心肌细胞在葡萄糖浓度为5.5 mmol·L-1中培养48 h;(2)NG+Alda-1组:将ALDH2特异性激动剂Alda-1加入葡萄糖浓度为5.5 mmol·L-1的完全培养基中,使其终浓度为20 μmol·L-1[12],培养48 h;(3)高糖组(high glucose,HG):葡萄糖浓度为30 mmol·L-1的完全培养基培养48 h;(4)HG+Alda-1组:将ALDH2特异性激动剂20 μmol·L-1的Alda-1加入葡萄糖浓度为30 mmol·L-1的完全培养基中培养48 h;(5)高渗组(hypertonic pressure group,HPG):含5.5 mmol·L-1葡萄糖+24.5 mmol·L-1甘露醇的完全培养基,培养48 h。
2.4 MTT检测各处理组细胞活力心肌细胞计数,每孔1×104个细胞接种在96孔板培养,每组5个复孔。实验干预前,予以无血清培养基同步化处理24 h。不同葡萄糖浓度分别培养24、48、72 h后,各孔加入20 μL MTT溶液(终浓度0.5 g·L-1),37℃继续培养4 h,产生结晶,小心去除液体,每孔加入150 μL的DMSO,置于摇床上15~30 min,使结晶完全溶解,酶标仪检测波长为490 nm的吸光度值。确定高糖诱导心肌细胞损伤模型,同样的方法检测各干预组心肌细胞活力。
2.5 DHE检测心肌细胞在不同处理组的氧化应激水平以每孔2×105个细胞接种于6孔板培养,实验干预前,以无血清培养基同步化处理48 h,实验干预条件处理48 h后,PBS清洗,按照说明书各孔加入含有DHE的F12完全培养基(DHE终浓度10 μmol·L-1),37 ℃避光孵育30 min,PBS清洗,4%的多聚甲醛固定10 min,倒置荧光显微镜下拍照。使用ImageJ 1.48v软件计算出各组图片的荧光灰度值,进行量化分析。
2.6 Western blot检测心肌细胞中ALDH2、MMP-14、TIMP-4蛋白表达收集不同批次培养的心肌细胞沉淀,加入细胞蛋白提取液(RIPA)和PMSF,提取细胞总蛋白,按照试剂盒说明书检测蛋白浓度。获取的蛋白按照40 μg对应的体积加样,进行聚丙烯酰胺凝胶电泳,转膜。常温下5%的脱脂牛奶(脱脂奶粉+TBST液)封闭150 min,分别加入ALDH2抗体(1 :4 000)、MMP-14抗体(1 :4 500)、TIMP-4抗体(1 :2000)、GAPDH抗体(1 :5 000),4℃孵育过夜。次日洗膜后,加二抗IgG(1 :8 000),孵育60 min,TBST洗膜后,凝胶成像系统显影液曝光。以GAPDH为内参,凝胶成像系统进行条带灰度值扫描,分别算出ALDH2、MMP-14、TIMP-4与GAPDH的比值。
2.7 统计学方法使用Prism6.0统计分析,数据以x±s表示,采用单因素方差分析(One Way ANOVA),并用Newman-Keuls进行组间比较。
3 结果 3.1 免疫荧光鉴定心肌细胞如Fig 1所示,荧光显微镜下胞质中呈现绿色荧光(α-SA抗原免疫荧光呈阳性反应)、DAPI染色胞核呈现蓝色荧光的即为心肌细胞。免疫荧光染色表明,本实验培养的细胞为原代心肌细胞,纯度为(97.6±3.4)%。
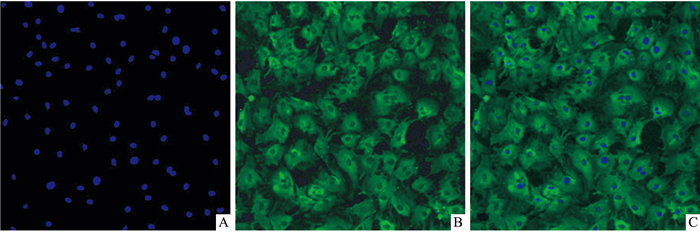
|
| Fig 1 Immune fluorescence identification of rat primary cardiomyocytes (×100) A:DAPI; B:α-SA; C:Merged |
心肌细胞干预24 h后,与NG组比较,MG组心肌细胞活性无明显变化,HG心肌细胞活性降低。心肌细胞干预48、72 h后,随着葡萄浓度增加,与NG相比,MG和HG组心肌细胞活性均降低;与MG相比,HG心肌细胞活性明显降低(Tab 1),提示葡萄糖诱导的心肌细胞损伤呈浓度依赖性。结合Yao等[6]报道和本实验结果,确定以高糖(30 mmol·L-1)诱导心肌细胞48 h作为诱导原代心肌细胞损伤模型。NG组和HPG(高渗组)组心肌细胞存活率差异无显著性,提示高渗环境对于心肌细胞活力无明显影响,故在后续实验中未开展高渗组的实验。如Fig 2所示,与NG组比较,HG组细胞活力下降明显(P < 0.01);与HG组相比,HG+Alda-1组细胞活力升高(P < 0.01)。NG+Alda-1组与NG组相比无明显差异。
| Group | Time | ||
| 24 h | 48 h | 72 h | |
| NG | 0.587±0.099 | 0.571±0.067 | 0.535±0.047 |
| MG | 0.576±0.098 | 0.517±0.037* | 0.481±0.077* |
| HG | 0.488±0.062*# | 0.310±0.043**## | 0.248±0.025**## |
| NG:5.5 mmol·L-1 glucose group;MG:15 mmol·L-1 glucose group;HG:30 mmol·L-1 glucose group. *P < 0.05,**P < 0.01 vs NG;#P < 0.05, ##P < 0.01 vs MG | |||
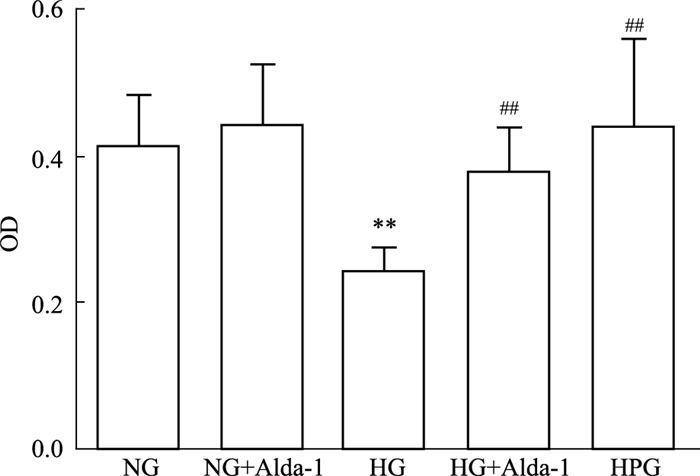
|
| Fig 2 Changes of cell viability in primary cardiomyocytes in different groups(x±s, n=6) **P < 0.01 vs NG; ##P < 0.01 vs HG |
荧光探针DHE可穿破活细胞膜进入胞内,氧化氧自由基(reactive oxygen species,ROS),产生氧化乙啶,染色体DNA与其掺和,发出红色荧光,依据红色荧光强度可判断各组细胞氧化应激水平情况。与NG组相比,NG+Alda-1组荧光强度无明显区别;HG组红色荧光强度明显增强(P < 0.01),提示氧化应激水平升高;与HG组相比,HG+Alda-1组中细胞红色荧光强度明显减弱(P < 0.01),氧化应激水平降低(Fig 3)。
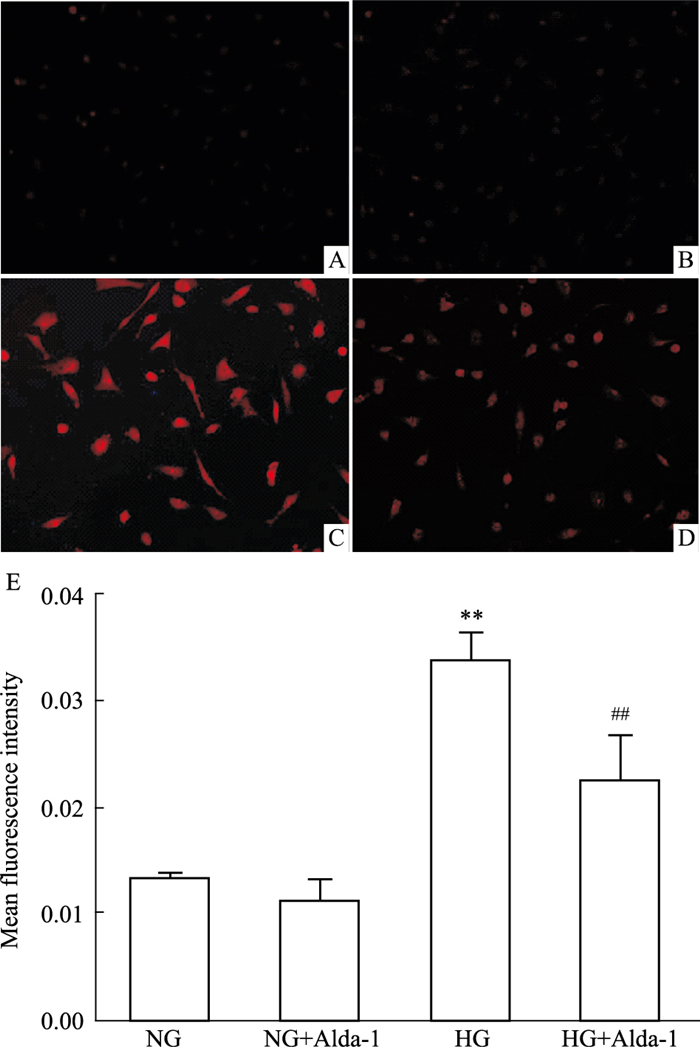
|
| Fig 3 Changes of superoxide production in primary cardiomyocytes in different groups by DHE staining(×100) A: NG; B: NG+Alda-1; C: HG; D: HG+Alda-1; E: Statistical results of DHE mean fluorescence intensity (x±s, n=4). **P < 0.01 vs NG; ##P < 0.01 vs HG. |
如Fig 4所示,与NG组相比,HG组中ALDH2、MMP-14蛋白表达明显降低(P < 0.01),TIMP-4蛋白表达升高(P < 0.01);与HG组相比,HG+Alda-1组ALDH2、MMP-14蛋白表达增高(P < 0.01),TIMP-4蛋白水平降低(P < 0.01)。与NG组相比,HG组中MMP-14/TIMP-4比值明显降低(P < 0.01);与HG组相比,HG+Alda-1组中MMP-14/TIMP-4比值明显升高(P < 0.01)。NG+Alda-1组与NG组相比无明显差异。
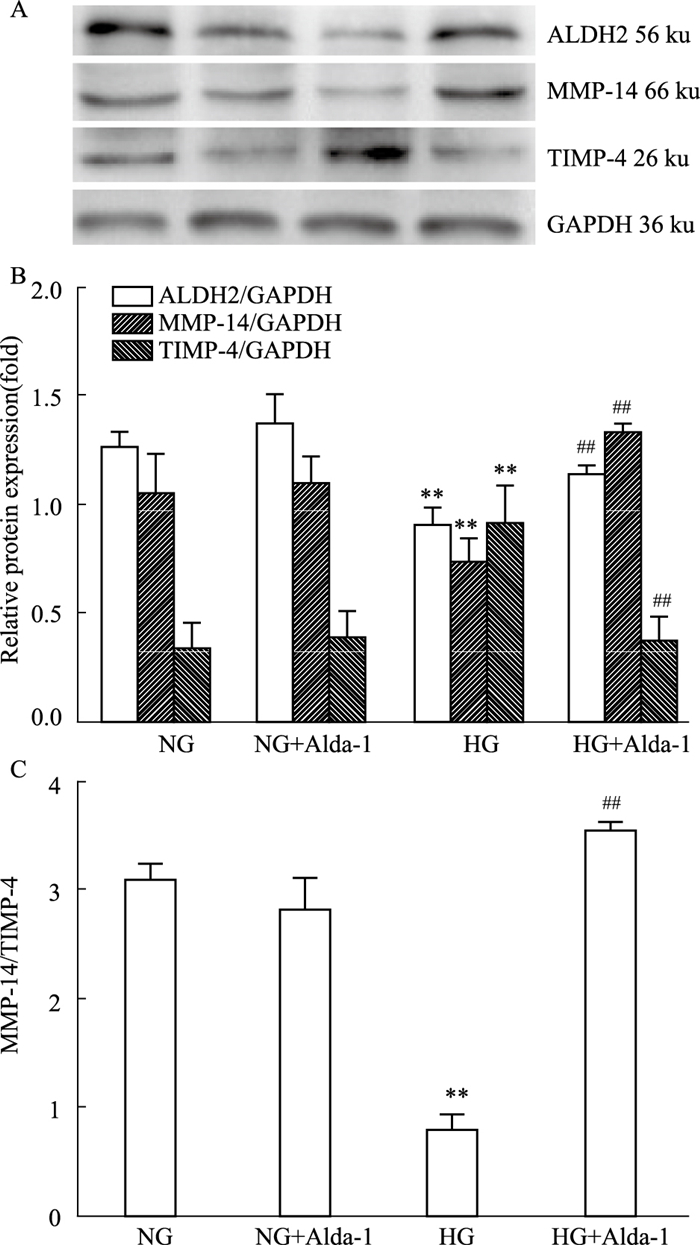
|
| Fig 4 Changes of ALDH2, MMP-14, TIMP-4 protein expressions (A, B) and the ratio of MMP-14/TIMP-4 (C) protein in primary cardiomyocytes (x±s, n=4) **P < 0.01 vs NG; ##P < 0.01 vs HG |
DM是常见的慢性代谢性疾病,近年来其发病日趋年轻化[7]。国内外大量报道表明,氧化应激是许多病理因素造成心血管损伤的共同机制,高脂血症、缺血性心脏病、动脉粥样硬化等病理过程中都存在过量的ROS大量释放,引起心肌损伤。DCM的发生、发展与氧化应激密切相关[8]。本研究采用高糖处理大鼠原代心肌细胞,与正常对照组相比,心肌细胞活力明显下降,DHE荧光染色显示ROS水平明显增高,提示高糖干预引起心肌细胞氧化应激损伤。
ALDH2主要存在于线粒体中,在酒精代谢中起到关键作用,是活性最强的醛类氧化酶,能氧化并清除活性醛类物质。ALDH2在糖尿病等病理情况下,对心肌具有保护作用[9]。激动ALDH2可对抗多种干预引起的氧化应激损伤。Alda-1是ALDH2的特异性激动剂,Chen等[10]首先报道,特异性激动ALDH2可改善心肌缺血/再灌注损伤中氧化应激的发生,发挥心肌保护作用。我们观察到20 μmol·L-1 Alda-1可通过特异性激动ALDH2,改善高糖引起的心肌成纤维细胞损伤[11]。本研究观察到,与正常对照组相比,高糖干预48 h后,心肌细胞氧化应激水平增高,同时ALDH2蛋白表达明显下降;给予Alda-1激动ALDH2后,与高糖组相比,心肌细胞活力明显升高,氧化应激水平明显降低,ALDH2蛋白水平升高明显。提示Alda-1通过增加ALDH2的表达,改善细胞活力、降低氧化应激水平,从而改善高糖刺激引起的心肌细胞损伤。
MMPs家族的主要作用是降解ECM。MMPs家族目前已知有26个成员,其中MMP-14除能降解ECM外,还能活化其他MMPs成员。TIMPs与MMPs结合,特异性抑制MMPs生成,对抗其降解ECM的作用。目前,已发现的4种TIMPs中,TIMP-4在心脏中高表达。DCM大鼠心肌氧化应激、心肌间质纤维化同时,MMPs表达明显下调[12]。Felkin等[13]报道,心脏衰竭患者TIMP-4表达明显增高。MMPs/TIMPs的平衡状态参与维持ECM正常生理功能,慢性心衰和心肌肥大等病理过程中,MMPs/TIMPs比例失衡,导致基质成分改变,引起心肌纤维化。高糖环境下,细胞中氧自由基生成增多,脂质过氧化、醛类代谢产物生成增多,诱导MMPs家族成员改变。有文献报道,氧化应激损伤中,醛类代谢产物4-羟基壬烯醛(4-hydroxynonenal,4-HNE)通过激活线粒体ROS介导的Akt/NF-kB途径,引起血管平滑肌细胞MMP-2生成增多[14];4-HNE浓度依赖性地引起肺动脉平滑肌细胞MMP-2、MMP-9蛋白表达增多,激动ALDH2,减轻肺动脉平滑肌细胞氧化应激和4-HNE的生成[15]。本研究中,我们不仅观察了MMP-14的变化,同时观察了心脏高表达的MMPs抑制剂TIMP-4的改变,更好地分析MMPs通路在心肌损伤中的可能变化。实验观察到,与正常对照组比较,高糖处理组心肌细胞氧化应激增加。同时,ALDH2、MMP-14蛋白水平下降,TIMP-4蛋白水平升高,MMP-14/TIMP-4比值下降明显,结合文献报道,我们推测高糖引起的ALDH2表达降低和氧化应激损伤可能导致心脏高表达的MMPs抑制剂TIMP-4表达增加,从而抑制MMP-14在心肌的表达,间接引起其他MMPs成员表达降低,心肌基质降解受抑制,纤维化加重;与高糖处理组相比,给予Alda-1特异性激动ALDH2后,氧化应激降低同时,MMP-14蛋白水平升高,TIMP-4蛋白水平下降,MMP-14/TIMP-4比值回升,提示Alda-1激动ALDH2高表达后,减轻氧化应激程度,抑制TIMP-4蛋白表达,其对MMP-14的抑制作用减弱,使得MMPs成员对心肌基质降解作用增强,从而保护心肌。
综上所述,激动ALDH2改善高糖引起的心肌损伤和纤维化的发生,可能与抑制氧化应激、促进MMP-14高表达、抑制TIMP-4表达有关。这为研究ALDH2在DCM中起着保护作用提供了新途径。但ALDH2与MMPs家族其他成员的关系及其具体机制还需进一步探究。MMP家族不同成员作用不同,作用机制复杂,不同MMP成员对心肌产生的作用及深入机制仍需进一步探讨。
( 致谢: 本实验在安徽省蚌埠医学院科研中心心脑血管研究室完成,感谢课题组老师及同学给予的帮助和支持。)
| [1] | 孙晓慧, 王燕, 牟艳玲. 2型糖尿病大鼠心肌PI3K/Akt/mTOR信号通路的改变及Sirt1的调控机制研究[J]. 中国药理学通报, 2017, 33(6): 793-8. Sun X H, Wang Y, Mu Y L. Alteration of PI3K/Akt/mTOR signaling during development of diabetic cardiomyopathy and regulation of SIRT1[J]. Chin Pharmacol Bull, 2017, 33(6): 793-8. |
| [2] | Lorenzo-Almorós A, Tuñón J, Orejas M, et al. Diagnostic approaches for diabetic cardiomyopathy[J]. Cardiovasc Diabetol, 2017, 16(1): 28. doi:10.1186/s12933-017-0506-x |
| [3] | Zhang X, Pan L, Yang K, et al. H3 relaxin protects against myocardial injury in experimental diabetic cardiomyopathy by inhibiting myocardial apoptosis, fibrosis and inflammation[J]. Cell Physiol Biochem, 2017, 43(4): 1311-24. doi:10.1159/000481843 |
| [4] | Nabeebaccus A, Hafstad A, Eykyn T, et al. Cardiac-targeted NADPH oxidase 4 in the adaptive cardiac remodelling of the murine heart[J]. Lancet, 2015, 385(Suppl 1): S73. |
| [5] | Gao Q, Wang H J, Wang X M, et al. Activation of ALDH2 with ethanol attenuates diabetes induced myocardial injury in rats[J]. Food Chem Toxicol, 2013, 56: 419-24. doi:10.1016/j.fct.2013.02.057 |
| [6] | Yao Y, Li R, Ma Y, et al. α-Lipoic acid increases tolerance of cardiomyoblasts to glucose/glucose oxidase-induced injury via ROS-dependent ERK1/2 activation[J]. Biochim Biophys Acta, 2012, 1823(4): 920-9. doi:10.1016/j.bbamcr.2012.02.005 |
| [7] | Chen C H, Ferreira J C B, Gross E R, et al. Targeting aldehyde dehydrogenase 2: new therapeutic opportunities[J]. Physiol Rev, 2014, 94(1): 1-34. doi:10.1152/physrev.00017.2013 |
| [8] | Liu P, Su J, Song X, et al. Activation of nuclear β-catenin/c-Myc axis promotes oxidative stress injury in streptozotocin-induced diabetic cardiomyopathy[J]. Biochem Biophys Res Commun, 2017, 493(4): 1573-80. doi:10.1016/j.bbrc.2017.10.027 |
| [9] | Guo Y L, Yu W J, Sun D D, et al. A novel protective mechanism for mitochondrial aldehyde dehydrogenase (ALDH2) in type Ⅰ diabetes-induced cardiac dysfunction: role of AMPK-regulated autophagy[J]. Biochim Biophys Acta, 2015, 1852(2): 319-31. doi:10.1016/j.bbadis.2014.05.017 |
| [10] | Chen C H, Budas G R, Churchill E N, et al. Activation of aldehyde dehydrogenase-2 reduces ischemic damage to the heart[J]. Science, 2008, 321(5895): 1493-5. doi:10.1126/science.1158554 |
| [11] | Gu X Y, Fang T T, Kang P F, et al. Effect of ALDH2 on high glucose-induced cardiac fibroblast oxidative stress, apoptosis, and fibrosis[J]. Oxid Med Cell Longev, 2017: 9257967. |
| [12] | Wang X T, Gong Y, Zhou B, et al. Ursolic acid ameliorates oxidative stress, inflammation and fibrosis in diabetic cardiomyopathy rats[J]. Biomed Pharmacother, 2018, 97: 1461-7. doi:10.1016/j.biopha.2017.11.032 |
| [13] | Felkin L E, Birks E J, George R, et al. A quantitative gene expression profile of matrix metalloproteinases (MMPs) and their inhibitors (TIMPs) in the myocardium of patients with deteriorating heart failure requiring left ventricular assist device support[J]. J Heart Lung Transplant, 2006, 25(12): 1413-9. doi:10.1016/j.healun.2006.09.006 |
| [14] | Lee S J, Seo K W, Yun M R, et al. 4-Hydroxynonenal enhances MMP-2 production in vascular smooth muscle cells via mitochondrial ROS-mediated activation of the Akt/NF-kappaB signaling pathways[J]. Free Radic Biol Med, 2008, 45(10): 1487-92. doi:10.1016/j.freeradbiomed.2008.08.022 |
| [15] | Xu T, Liu S, Ma T, et al. Aldehyde dehydrogenase 2 protects against oxidative stress associated with pulmonary arterial hypertension[J]. Redox Bio, 2017, 11: 286-96. doi:10.1016/j.redox.2016.12.019 |

