

2. 福建中医药大学 康复技术工程研究中心, 福建 福州 350122
2. Fujian University of traditional Chinese Medicine Rehabilitation Technology Engineering Research Center, Fuzhou, Fujian 350122, China
炎症反应是脑缺血/再灌注损伤的关键性机制[1]。白细胞是机体重要的炎性细胞之一,其黏附并穿越血管内皮细胞向炎症部位移行,成为炎症的重要标志,黏附分子是白细胞和血管内皮细胞表达的产生炎症反应的重要分子基础。P-选择素(P-selectin)作为细胞黏附分子家族成员之一,在炎症发生时,主要功能是介导白细胞与血管内皮细胞、白细胞与血小板之间的黏附,在炎症早期过程中尤为关键。因此,寻找或合成具有影响P-selectin表达及功能的药物,将为炎症发病机制的揭示及治疗提供新的手段。
红景天苷(salidroside,Sal)是景天科红景天的主要有效成分,具有保护各个器官免受自由基损伤、增强记忆、改善心血管系统功能、增强免疫、抗疲劳、耐缺氧等多种药理作用[3]。课题组关于红景天苷对脑缺血/再灌注的保护作用主要集中于体内研究[3-5]。本实验在体外模拟缺血/再灌注损伤模型,以人脐静脉内皮细胞(human umbilical vein endothelial cells, HUVECs)氧糖剥夺/复氧(oxygen-glucose deprivation/reoxygenation, OGD/R)损伤为模型,观察红景天苷对OGD/R诱导的HUVEC损伤的保护作用及其对P-selectin表达的影响。
1 材料 1.1 细胞株HUVEC由厦门大学国家传染病诊断与疫苗工程技术研发中心提供。
1.2 试剂红景天苷(福建中医药大学药学院生物医药研发中心,纯度≥99%);胎牛血清(fetal bovine serum, FBS)、青霉素-链霉素双抗溶液(penicillin-streptomycin, PS)、DMEM无糖培养基、0.25%胰蛋白酶(Life Technologies);DMEM高糖培养基、PBS缓冲溶液(Hyclone);P-selectin抗体(Santa Cruz);DAB-0031试剂盒、即用型免疫组化EliVisionTM plus试剂盒(福州迈新生物技术开发有限公司);乳酸脱氢酶(lactic dehydrogenase, LDH)试剂盒、一氧化氮(nitric oxide, NO)试剂盒(南京建成生物技术有限公司);MTT(Biosharp);AnnexinV-FITC/PI细胞凋亡检测试剂盒(上海翊圣生物科技有限公司)。
1.3 仪器三气缺氧培养箱Galaxy 170R(New Brunswick),CO2培养箱HERACELL 150i(Thermo Scientific),光学显微镜ECLIPSE TS100-F(Nikon),低速台式离心机TDL-50B(上海安亭科学仪器厂),多功能酶标仪Infinite M200 Pro(TECAN),洁净工作台SW-CJ-1FD(苏净集团苏州安泰空气技术有限公司),数码显微图像分析软件系统Motic Med 6.0(厦门麦克奥迪实业集团有限公司),BD facscalibur流式细胞仪(碧迪医疗器械上海有限公司)。
2 方法 2.1 HUVEC的培养HUVEC复苏,常规方法培养于含10% FBS、1% PS的DMEM高糖培养基中,置于37℃、5% CO2及饱和湿度培养箱培养。当细胞长至约80%~90%时,胰酶消化,传代培养。
2.2 HUVEC细胞OGD/R模型的建立将正常培养(含10% FBS、1% PS DMEM高糖培养基)的HUVEC按每孔3×105铺于6孔板,24 h后生长密度达到80%~85%,用移液枪吸去培养基,加入2 mL 1×PBS清洗1遍,吸掉PBS,换成DMEM无糖培养基(含1% FBS、1%PS),置于缺氧培养箱(37℃、5.0% CO2、1.0% O2)培养,进行氧糖剥夺培养;氧糖剥夺后,弃去无糖培养基,置于含1% FBS、1% PS的DMEM高糖培养基,正常条件培养24 h。
2.3 MTT法检测HUVEC存活率确定最佳造模时间点HUVEC以每孔1×104密度接种于96孔培养板中,分为正常组(Ctrl)、模型组(OGD/R)、红景天苷给药组(Sal 10 μmol·L-1),分别进行12、16、20 h的造模,缺氧时间达到后,Sal组换成含有10 μmol·L-1红景天苷的DMEM高糖培养基(1% FBS、1% PS),继续于37℃、5% CO2正常培养箱复氧24 h。加10 μL MTT(5 g·L-1),孵育4 h,弃去MTT及培养基,每孔加入200 μL的二甲基亚砜,振荡10 min,酶标仪在490 nm测定吸光度(A),计算细胞存活率:细胞存活率=(A实验组/A对照组)×100%。
2.4 细胞培养液中LDH外漏量测定探索最佳给药浓度取对数生长期的HUVEC,以每孔1×104密度接种于96孔培养板中,分为正常对照组、OGD/R组、不同浓度红景天苷组(Sal 0.01、0.1、1、10、100 μmol·L-1),进行OGD 16 h后,Sal组分别给予红景天苷继续于37℃、5% CO2正常培养箱复氧24 h。取各组细胞培养液于1.5 mL离心管中,根据LDH试剂盒说明书操作方法检测LDH活性,计算公式如下:LDH活性/U·L-1=(测定孔OD值-对照孔OD值)/(标准孔OD值-空白孔OD值)×标准浓度(0.2 mmol·L-1)×稀释倍数×1 000。
2.5 细胞培养液中NO含量的测定确定最佳给药浓度取对数生长期的HUVEC,以每孔1×104密度接种于96孔培养板中,分为正常对照组、OGD/R组、不同浓度红景天苷组(Sal 0.1、1、5、10 μmol·L-1),进行OGD 16 h后,Sal组分别给予红景天苷继续于37℃、5% CO2正常培养箱复氧24 h。收集各组细胞培养液,按照测试盒说明书,采用硝酸还原酶法检测胞内NO的含量,计算公式如下:NO含量/μmol·L-1=(测定孔OD值-空白孔OD值)/(标准孔OD值-空白孔OD值)×标准品浓度(100 μmol·L-1)×稀释倍数。
2.6 OGD/R对HUVEC形态的影响取对数生长期的HUVEC,以每孔3×105接种于6孔培养板,分为正常对照组、OGD/R组、Sal组(10 μmol·L-1),融合后进行16 h氧糖剥夺,复氧时Sal组给予含Sal 10 μmol·L-1的培养基继续培养24 h。在倒置显微镜下分别观察各组HUVEC的细胞生长情况。
2.7 Annexin Ⅴ/PI法检测HUVEC凋亡细胞分组及给药方法同“2.6”,培养结束后,收集各组细胞,按照测试盒说明书操作,使用流式细胞仪检测HUVEC凋亡情况。
2.8 免疫组化法测定P-selectin蛋白表达水平将已爬好的玻片用PBS浸洗3次;4%多聚甲醛常温固定20 min;PBS洗3次,滴加5% BSA,室温封闭1 h,滴加50~100 μL稀释后的一抗(1 :100),4℃孵育过夜;PBS洗3次,甩干,滴加适量二抗,室温孵育1 h;PBS冲洗5次,甩干,滴加适量DAB溶液,10~30 s后迅速用PBS荡洗干净,滴加Mayer’s苏木精,复染1.5~2 min,自来水中返蓝5 min,中性树胶封片。每张切片200倍镜下选5个视野,运用数码显微图像分析软件系统Motic Med 6.0测量P-selectin的灰度值(灰度值是反映透光密度的定量指标,其与P-selectin的表达量呈负相关,即灰度值越高,P-selectin蛋白表达量越少)。
2.9 统计学分析采用SPSS 21.0进行统计分析,计量资料采用x±s表示,组间比较均采用单因素方差分析(One-way analysis of variance,ANOVA)。
3 结果 3.1 最佳造模时间点的确定如Fig 1所示,与正常组相比,HUVEC在OGD 16、20 h细胞活力均明显降低(P < 0.01);与OGD/R组比较,Sal组细胞活力在16 h增高(P < 0.05)。因此,确定HUVEC细胞OGD模型的最佳造模时间点为16 h。
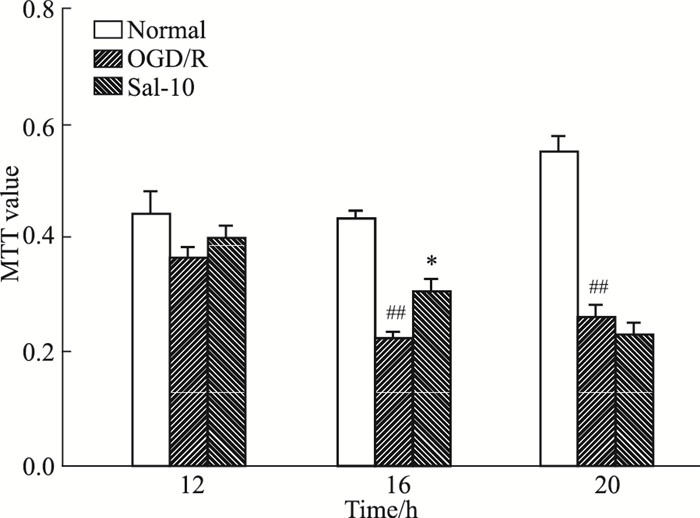
|
| Fig 1 Effect of salidroside on activity of HUVECs after OGD/R ##P < 0.01 vs normal control; *P < 0.05 vs OGD/R |
如Fig 2所示,OGD/R组细胞LDH漏出率明显增加(P < 0.01);与OGD/R组比较,Sal组(1、10、100 μmol·L-1)细胞培养液LDH漏出率明显降低(P < 0.05),说明红景天苷能减少HUVEC细胞OGD/R损伤模型LDH的释放,且10 μmol·L-1的浓度效果最好(P < 0.01)。
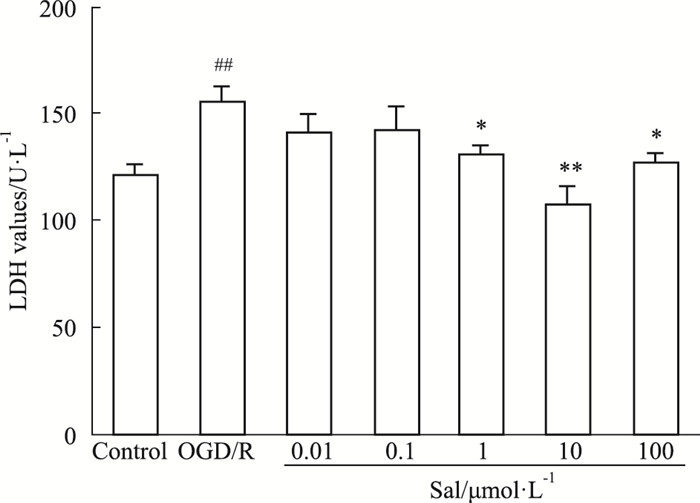
|
| Fig 2 Effect of salidroside on LDH activity of HUVECs after OGD/R ##P < 0.01 vs control; *P < 0.05, **P < 0.01 vs OGD/R |
如Fig 3所示,与对照组相比,OGD/R组细胞NO含量增加(P < 0.01);与OGD/R组比较,Sal组细胞NO含量降低(P < 0.05),且随着给药浓度的增加,NO的含量降低越明显,在10 μmol·L-1浓度时NO的含量最低。说明红景天苷能降低HUVEC细胞OGD/R损伤模型NO的含量,并确定Sal 10 μmol·L-1为最佳给药浓度。
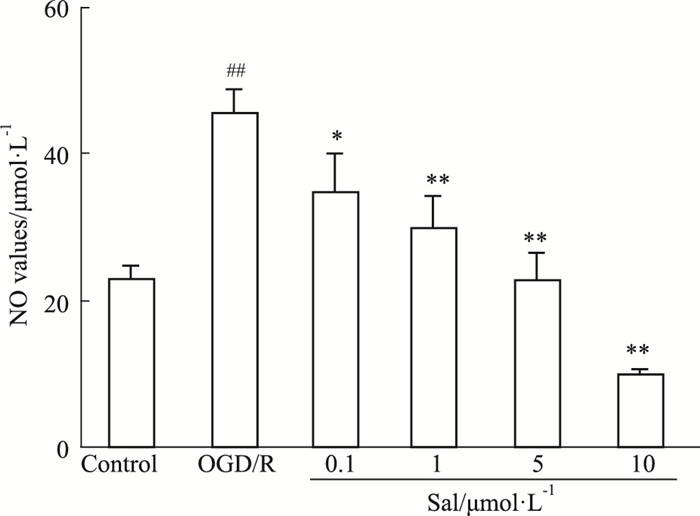
|
| Fig 3 Effect of salidroside on NO content of HUVECs after OGD/R ##P < 0.01 vs control; *P < 0.05, **P < 0.01 vs OGD/R |
如Fig 4所示,正常培养的HUVEC核清晰,呈圆形或椭圆形,核分裂像多见,核仁、胞质丰富,内含小颗粒;HUVEC在OGD/R处理后,细胞形态发生明显改变,表现为细胞排列紊乱,明显梭形化或变为不规则形,细胞折光率低,胞体皱缩,核仁、胞质贫乏,大多数细胞胞质有暗色颗粒;而给药组经10 μmol·L-1红景天苷处理后,细胞形态有所改善,细胞不再暗沉,细胞梭形化或不规则形状减少,核仁、胞质较丰富。
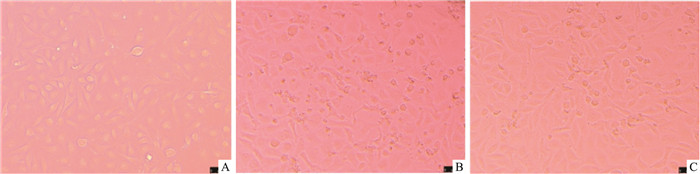
|
| Fig 4 Effect of salidroside on morphology of HUVECs after OGD/R (×200) A: Control group; B: OGD/R group; C: Sal 10 μmol·L-1 group. |
如Fig 5所示,与对照组相比,OGD/R组细胞凋亡率升高(P < 0.01);与OGD/R组比较,Sal组(10 μmol·L-1)细胞凋亡率降低(P < 0.05)。说明红景天苷能降低HUVEC细胞OGD/R损伤模型的凋亡率。
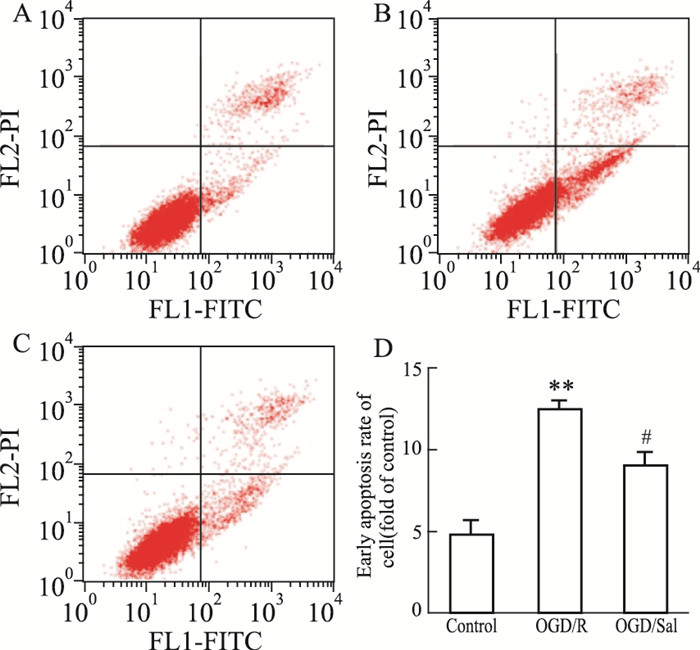
|
| Fig 5 Effect of salidroside on apoptosis of HUVEC after OGD/R A: Control group; B: OGD/R group; C: Sal 10 μmol·L-1 group; D: Statistical results. ##P < 0.01 vs control; *P < 0.05 vs OGD/R. |
如Fig 6所示,正常状态下,HUVEC表达P-selectin较弱,主要分布于核膜周围;在OGD/R处理后,P-selectin的阳性表达明显增多,广泛分布于核膜、胞质及胞膜周围,与对照组相比差异有显著性(P < 0.01);与OGD/R组比较,给予10 μmol·L-1 Sal后,细胞P-selectin表达量降低(P < 0.01)。说明红景天苷能降低HUVEC细胞OGD/R损伤模型P-selectin蛋白表达水平。
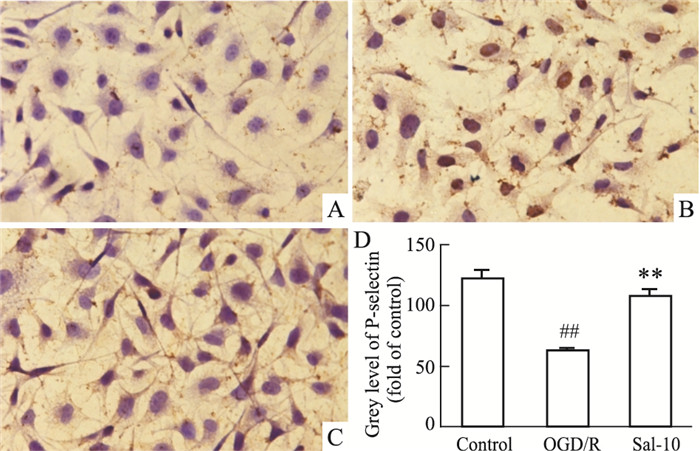
|
| Fig 6 Effect of salidroside on expression of p-selectin in HUVECs after OGD/R A: Control group; B: OGD/R group; C: Sal 10 μmol·L-1 group; D: Statistical results. ##P < 0.01 vs control; **P < 0.01 vs OGD/R. Grey level is a quantitative index reflecting light transmission density, which is negatively correlated with the amount of P-selectin expression. |
炎症反应在脑缺血/再灌注损伤中起着重要作用[1],炎症产生的重要过程包括白细胞在血管中的流动、募集、黏附和渗出,而炎症发生的重要标志则是以血管反应为核心的白细胞渗出[6-7]。炎症反应发生的最初现象是白细胞与内皮细胞的黏附,白细胞在内皮细胞的黏附和渗出,导致了组织的破坏与清除,进而产生炎症。血管内皮细胞是机体重要的内分泌及靶器官,在维持内环境的稳态中发挥着关键作用。有研究表明,作为高活性分子和其他损伤因子作用的重要靶点,内皮细胞的损伤活化在缺血/再灌注损伤病理演变过程中起到关键作用[8-9]。选择素(selectin)为一类可与特定构型糖基结合的单链跨膜受体,主要分布在细胞表面,属于膜蛋白,是参与炎症反应的重要分子,主要在血管系统中起作用[10]。P-selectin主要分布于血小板-α颗粒和内皮细胞的Webel-Palade小体中,在巨核细胞、活化血小板和活化的内皮细胞上表达,并通过识别其相应配体,介导白细胞在内皮细胞上的滚动,作为内皮细胞和血小板活化的标志,能对炎症作出早、晚两期反应,其在炎症过程的早期甚为重要。P-selectin还能刺激单核细胞表达组织因子,从而启动外源性凝血机制,加重急性炎症反应[11]。
本研究通过对HUVEC体外OGD/R,建立了细胞氧糖剥夺模型,以此模拟体内血管内皮细胞缺血/再灌注损伤引起脑缺血的病理过程。显微镜下观察,OGD/R处理后,细胞排列紊乱,折光性下降,贴壁功能下降,部分细胞裂解成碎片,最后死亡;给予Sal保护后,细胞不再暗沉,细胞折光性增强,细胞碎片减少。Annexin Ⅴ/PI检测结果表明,红景天苷组HUVEC凋亡率降低,表明红景天苷能够明显减轻OGD/R引起的HUVEC损伤。LDH是一种细胞内标志酶,存在于各种组织细胞的胞质中。LDH在正常细胞中释放较少,但细胞缺糖缺氧时,细胞膜通透性增加,大量的LDH释放,且LDH释放量与细胞损伤程度呈正比,故其释放量的多少可作为反映细胞损伤程度的重要生化指标[12]。本研究测定细胞培养液中LDH活性来观察细胞的损伤程度,发现在造模16 h后,OGD/R组细胞培养液中LDH活性明显升高,而Sal组LDH降低,提示该时间点Sal可减轻OGD引起的细胞损伤。NO是生物体内重要的信使分子和效应分子,具有神经介导和调节的功能,可通过介导兴奋性氨基酸毒性、诱导自由基生成、损伤线粒体和DNA、引发血脑屏障开放等机制,产生神经细胞毒性作用,与氧化损伤密切相关[13]。本研究结果显示,缺氧缺糖后HUVEC中NO含量明显增加,而Sal可浓度依赖性地降低NO含量,提示Sal能够通过抗氧化作用,发挥其对OGD损伤细胞的保护作用。本研究还通过免疫组化法观察了P-selectin的蛋白表达水平,结果显示,正常状态下HUVEC表达P-selectin较弱,主要分布于核膜周围,在OGD/R处理后P-selectin的阳性表达明显增多,广泛分布于核膜、胞质及胞膜周围。提示在OGD/R作用下,P-selectin在胞膜的大量表达促进了白细胞的黏附作用,并随着血管通透性增加,通过黏附、浸润、游走等一系列过程侵入到组织间隙,导致炎症反应。而经过红景天苷处理后,P-selectin的表达明显下降。
综上所述,Sal可改善HUVEC细胞OGD/R引起的形态变化,且能增加细胞存活率,减少LDH释放量、降低NO含量、降低P-selectin的表达,表明Sal对OGD/R造成的HUVEC损伤具有保护作用,其机制可能与红景天苷能够降低P-selectin的表达,进一步降低血管通透性,减少白细胞黏附并穿越血管内皮细胞向炎症部位移行,从而抑制炎症反应有关。
( 致谢: 本实验在福建中医药大学药理学实验室完成,感谢各位老师和同学的帮助与支持。)
| [1] | Jin R, Yang G, Li G. Inflammatory mechanisms in ischemic stroke: role of inflammatory cells[J]. J Leukoc Biol, 2010, 87(5): 779-89. doi:10.1189/jlb.1109766 |
| [2] | 韩雪娇, 郭娜, 朱美宣, 等. 红景天苷药理作用及其作用机理研究进展[J]. 中国生化药物杂志, 2015, 35(1): 171-5. Han X J, Guo N, Zhu M X, et al. Research progress on the pharmacological action and mechanism of salidroside[J]. Chin J Biochem Drugs, 2015, 35(1): 171-5. |
| [3] | 赖文芳, 张小琴, 洪海棉, 等. 红景天苷对大鼠局灶性脑缺血/再灌注损伤的神经保护作用[J]. 中国药理学通报, 2015, 31(6): 775-80. Lai W F, Zhang X Q, Hong H M, et al. The neuroprotective effect of salidroside on focal cerebral ischemia/reperfusion injury in rats[J]. Chin Pharmacol Bull, 2015, 31(6): 775-80. |
| [4] | 宋百颖, 赖文芳, 苏燕青, 等. 红景天苷通过抑制补体C3的表达对MCAO大鼠缺血侧NeuN、Egr4影响的研究[J]. 中国药理学通报, 2017, 33(11): 1579-84. Song B Y, Lai W F, Su Y Q, et al. The effects of salidroside on NeuN and Egr4 in the ischemic side of MCAO rats by inhibiting the expression of complement C3[J]. Chin Pharmacol Bull, 2017, 33(11): 1579-84. doi:10.3969/j.issn.1001-1978.2017.11.020 |
| [5] | 张小琴, 苗学蒸, 周丽英, 等. 红景天苷对局灶性脑缺血/再灌注大鼠轴突再生及Akt/GSK-3β/CRMP-2表达的影响[J]. 中国药理学通报, 2017, 33(9): 1320-4. Zhang X Q, Miao X Z, Zhou L Y, et al. Effects of salidroside on axonal regeneration and expression of Akt/GSK-3β/CRMP-2 in focal cerebral ischemia/reperfusion rats[J]. Chin Pharmacol Bull, 2017, 33(9): 1320-4. |
| [6] | 步宏主编. 病理学[M]. 北京: 人民卫生出版社, 2002, 53-62. Bu Hong editor. Pathology[M]. Beijing: People's Health Press, 2002, 53-62. |
| [7] | 金惠铭, 卢建, 殷莲华. 细胞分子病理生理学[M]. 郑州: 郑州大学出版社, 2002. Jin H M, Lu J, Yin L H. Cellular and Molecular Pathophysiology[M]. Zhengzhou: Zhengzhou University Press, 2002. |
| [8] | Endemann D H, Schiffrin E L. Endothelial dysfunction[J]. Circulation, 2003, 108(17): 2060-1. doi:10.1161/01.CIR.0000099580.72044.83 |
| [9] | Misra M K, Sarwat M, Bhakuni P, et al. Oxidative stress and ischemic myocardial syndromes[J]. Med Sci Monit, 2009, 15(10): RA209-19. |
| [10] | 潘景业, 金可可, 陈雷, 等. 选择素在急性炎症反应中的作用[J]. 实用医学杂志, 2003, 19(11): 1279-82. Pan J Y, Jin K K, Chen L, et al. P-selectin in acute inflammation[J]. J Pract Med, 2003, 19(11): 1279-82. doi:10.3969/j.issn.1006-5725.2003.11.048 |
| [11] | Ludwig R J, Schön M P, Boehncke W H. P-selectin:a common therapeutic target for cardiovascular disorders, inflammation and tumour metastasis[J]. Expert Opin Ther Targets, 2007, 11(8): 1103-17. |
| [12] | 郝银菊, 周茹, 姚婉霞, 等. 苦豆碱对氧糖剥夺再灌注损伤后海马神经元的保护作用[J]. 中药药理与临床, 2016, 32(1): 44-6. Hao Y J, Zhou R, Yao W X, et al. The protective effect of Sophora alopecinin on hippocampal neurons after oxygen glucose deprivation injury[J]. Pharmacol Clin Chin Mater Med, 2016, 32(1): 44-6. |
| [13] | Ahuja-Jensen P, Johnsen-Soriano S, Ahuja S, et al. Low glutathione peroxidase in rd1 mouse retina increases oxidative stress and proteases[J]. Neuroreport, 2007, 18(8): 797-801. |

