

2. 南昌大学转化医学研究院心血管疾病研究中心,江西 南昌 330001
2. Institute of Translational Medicine, Nanchang University, Nanchang 330001, China
脑血管疾病具有发病率高、致残率高、死亡率高等危害,其中约85%为缺血性脑损伤。在脑部缺血的病理损伤过程中,血脑屏障这一维持中枢神经系统稳态的自身屏障结构和功能改变,引起血脑屏障调控失衡,并最终导致脑损伤。紧密连接是血脑屏障结构和功能完整性的重要基础,维系缺血区血脑屏障紧密连接结构[1],对缺血性脑损伤及其后遗症的发生、发展具有重要意义。临床现有针对改善脑缺血的治疗方式,如溶栓、抗血小板、改善循环等,是以恢复和改善血流再通的基础治疗手段,对血脑屏障损伤难有实质性改善,其机制也不十分明确。细胞微囊泡(microvesicles, MVs)含有蛋白质、mRNA、miRNAs等多种信息物质,在机体内环境变化时,可通过分泌至邻近细胞或组织,介导细胞间通讯。微囊泡本身可作为辅助诊断缺血性脑梗死、动脉粥样硬化疾病发生和发展的生物标志物[2]。然而,微囊泡跨血脑屏障对中枢神经系统的调控机制目前尚未完全阐明,深入研究能够为缺血性脑血管疾病的分子机制和治疗提供全新的研究方向。本实验建立小鼠大脑中动脉栓塞(middle cerebral artery occlusion, MCAO)模型,提取缺血脑组织中的微囊泡,以注射微囊泡的方式探讨微囊泡对小鼠缺血脑组织损伤的影响及相关机制。
1 材料与方法 1.1 材料 1.1.1 实验动物♂SPF级C57BL/6J小鼠,3月龄,72只,体质量(18~22) g,由扬州大学比较医学中心提供,动物许可证号:SCXK(苏)2007-0001。小鼠饲养于南昌大学第一附属医院12 h光暗循环的中心实验室,饲养环境温度为(22±2)℃,湿度为40%~60%,给予过滤水和营养饲料。
1.1.2 试剂抗occludin、claudin-5抗体为Abcam公司产品;occludin和claudin-5免疫组化抗体购自美国Zyemd公司;TLR4、β-actin、NF-κB p65、p38、p-NF-κB p65、p-p38抗体为CST公司产品;miR-27a序列及U6购自上海吉凯基因化学技术有限公司;小鼠白细胞介素1β(interleukin 1β,IL-1β)和肿瘤坏死因子α(tumor necrosis factor alpha,TNF-α)检测试剂盒购自南京建成生物工程研究所;其余试剂为国产分析纯。
1.1.3 仪器100000NWCO超滤膜、Model 8050旋转超滤仪(美国Millipore公司);iZON颗粒分析仪(英国Malvern公司);电泳仪、实时定量PCR仪(美国Bio-Rad公司);透射电镜(日本JEOL公司);激光共聚焦显微镜(美国Thorlabs公司)。
1.2 微囊泡提取鉴定及微囊泡miR-27a表达测定设立假手术组和缺血2 h组。建立MCAO缺血模型,10 mL·kg-1腹腔注射4%水合氯醛麻醉,分离并暴露小鼠右侧的颈总动脉、颈外动脉及颈内动脉,近心端预留结扎线。于颈外动脉远心端切口,插入直径约0.2 mm的线栓,通过颈总动脉分叉进入颈内动脉,过颈总动脉分叉8 mm后伤口常规缝合。手术过程中观察小鼠生命体征并检测缺血侧脑血流,弃去手术超过15 min或手术中出血、麻醉过深及基准血流30%以下的小鼠,术中小鼠肛温维持在37℃。缺血2 h后,各组小鼠断头取血后,分离血清并-80℃保存。取600 μL冻存血清置于25℃水浴溶解后,4℃ 300×g离心10 min,取上清液,再2 000×g离心20 min取上清液,经0.22 μm孔径过滤后,加入100000 NWCO超滤膜的Model 8050旋转超滤仪中,氮气及最大进气压力517.125 kPa以下,涡旋上清液并过滤。过滤物50 mL PBS超滤3次,得过滤膜上微囊泡,-80℃保存备用[3]。微囊泡经iZON颗粒分析仪检测直径。
1.3 股静脉注射微囊泡及动物分组实验动物分为4组,每组6只,分别为假手术组、缺血2 h组、注射微囊泡+缺血2 h组、阻断剂antagomiR-27a+注射微囊泡+缺血2 h组。阻断剂antagomiR-27a组为尾静脉注射溶于200 μL PBS的miR-27a阻断剂antagomiR-27a(20 mg·kg-1),连续注射3 d;注射微囊泡为缺血0.5 h时,自股静脉以5 mg·kg-1注射溶于生理盐水的微囊泡溶液,其他两组注射相同体积的生理盐水。
1.4 实时定量PCR检测微囊泡中miR-27a的表达提取各组缺血脑组织中总miRNA,反转录和实时定量PCR按照文献[4]条件进行。miR-27a引物序列为:5′-ACAGGCTAGCGCCGCCTAAC 3′(forward)和5′-CCTTAAGGCCCAAGATTACG 3′(reverse);U6引物序列为:5′-TCGCTTCGGCAGCACATATAC-3′(forward)和5′-TATGGAACGCTTCACGAATTT G-3′(reverse),各组以U6作为内参,采用相对Ct方法2-△△Ct法进行计算。
1.5 TTC染色法测定脑梗死体积TTC溶于0.01 mol·L-1的PBS中,终浓度为1 %。构建MCAO模型缺血2 h后,小鼠迅速断头取脑,-20℃冷冻约15 min后,切成厚度为1.5 mm的冠状切片,迅速置于1%的TTC磷酸缓冲液中,37℃避光孵育约10 min。正常脑组织染为深红色,脑梗死区为灰白色,10%福尔马林固定,并用Image J图像分析系统测量脑梗死体积。
1.6 免疫组化测定缺血脑组织中occludin和claudin-5蛋白表达构建MCAO模型缺血2 h后,处死各组小鼠,从左心室灌注生理盐水冲洗至无明显血丝,4%多聚甲醛中固定24 h,干燥后石蜡包埋,厚5 μm切片。在occludin和claudin-5抗体中孵育(1 :50),PBS冲洗,4℃与二抗孵育过夜。在3-CCD彩色摄像机下20倍镜拍摄[5],每个脑组织取8个视野进行统计。
1.7 Western blot蛋白印迹法构建MCAO模型缺血2 h后,提取各组脑组织中总蛋白,BCA定量蛋白质量为40 μg上样。采用12% SDS聚丙烯酰胺凝胶电泳,抗occludin、claudin-5、TLR4、β-actin抗体及NF-κB、p38磷酸化抗体(1 :1 000)4℃孵育过夜,用辣根过氧化物酶抗体孵育50 min。使用Bio-Rad生物图像系统捕获图像并进行分析。
1.8 ELISA检测IL-1β和TNF-α水平构建MCAO模型缺血2 h后,从各组脑组织提取总蛋白,4℃、3 000 r·min-1离心5 min,按照试剂盒说明书加入试剂反应,在450 nm波长测定吸光度值,测定IL-1β和TNF-α含量。
1.9 数据处理与分析所有数据采用x±s表示,两组间的比较用t检验,当3组或3组以上比较时,采用单因素方差分析(ANOVA)或非配对t检验对数据进行统计学分析。
2 结果 2.1 循环微囊泡miR-27a的鉴定Fig 1透射电子显微镜显示,微囊泡形态为圆形或近圆形的双层膜结构小囊泡。经检测,样品颗粒的直径大多分布在45~350 nm,颗粒平均直径为160 nm,无论是形态还是直径均符合微囊泡的形态学特征[7]。Real-time PCR结果显示,缺血组较假手术组中微囊泡miR-27a表达异常升高。
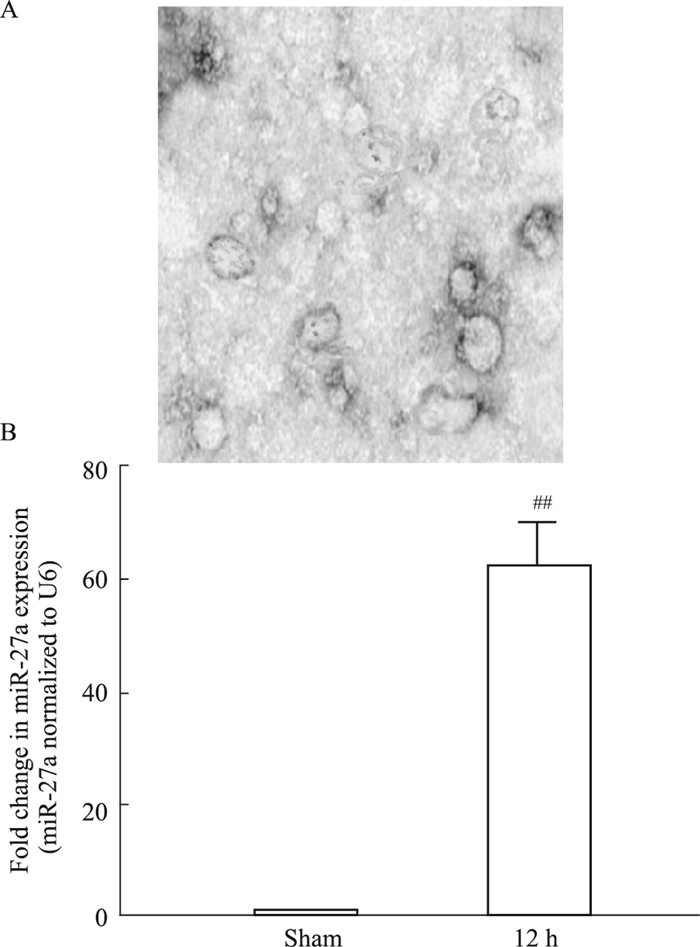
|
| Fig 1 Morphological characteristics of microesicles A: Transmission electron microscopy was used to observe the morphology of microvesicles; B: Real-time PCR was applied to detect the expression of miR-27a in microvesicles. ##P < 0.01 vs sham group. |
如Fig 2所示,缺血2 h组与假手术组相比,脑梗死体积明显增加,提示造模成功。与缺血2 h组比较,注射微囊泡后能够增加缺血小鼠脑梗死体积,而之前给予阻断剂antagomiR-27a能够减轻注射微囊泡对脑组织的损伤。同样,缺血脑组织中occludin和claudin-5蛋白阳性染色降低,注射微囊泡miR-27a后进一步降低occludin和claudin-5蛋白染色表达,而给予阻断剂antagomiR-27a能够抑制微囊泡对occludin和claudin-5蛋白染色的降低(Fig 3)。
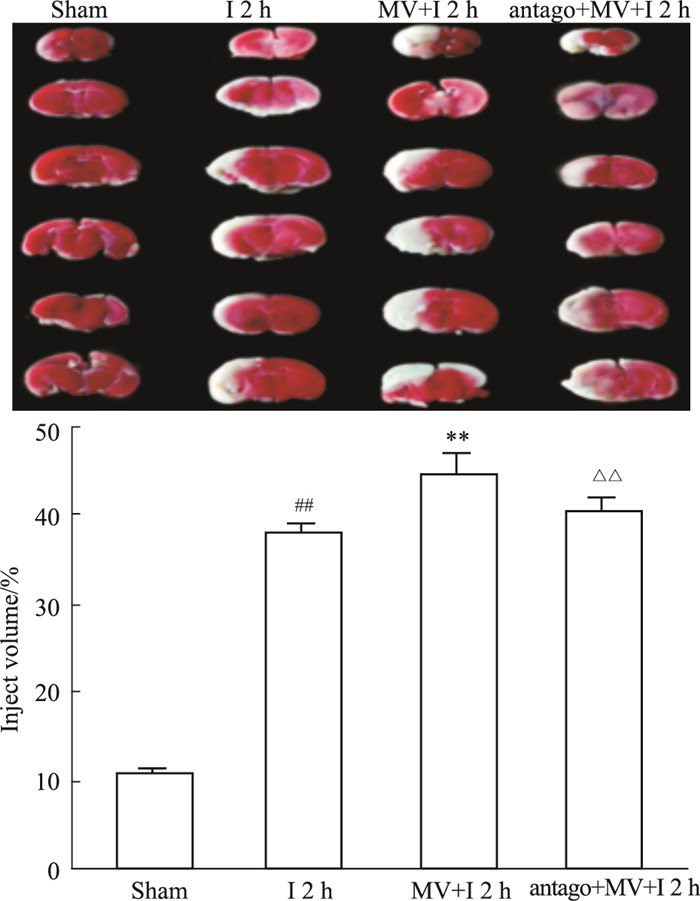
|
| Fig 2 Cerebral infarct volume of each group ##P < 0.01 vs sham group; **P < 0.01 vs 2 h of ischemia group; △△P < 0.01 vs injection of MV and 2 h of ischemia group |
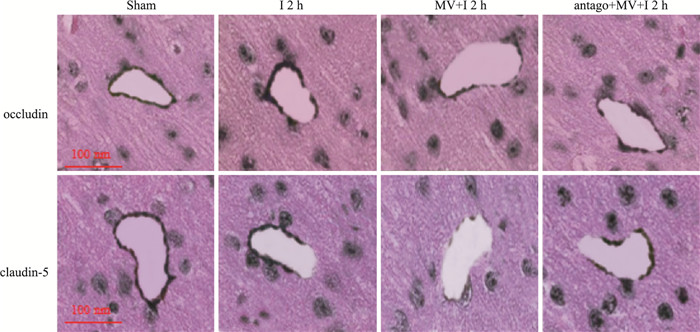
|
| Fig 3 Occludin and claudin-5 immunohistochemical expression in each group (×20) |
如Fig 4所示,与免疫组化结果一致,缺血脑组织中occludin和claudin-5蛋白表达降低,TLR4表达升高,NF-κB、p38蛋白的磷酸化表达增加。注射微囊泡后,occludin和claudin-5蛋白表达进一步降低,TLR4及NF-κB、p38蛋白的磷酸化表达持续增多,而给予阻断剂antagomiR-27a能够改善微囊泡对上述蛋白的作用。
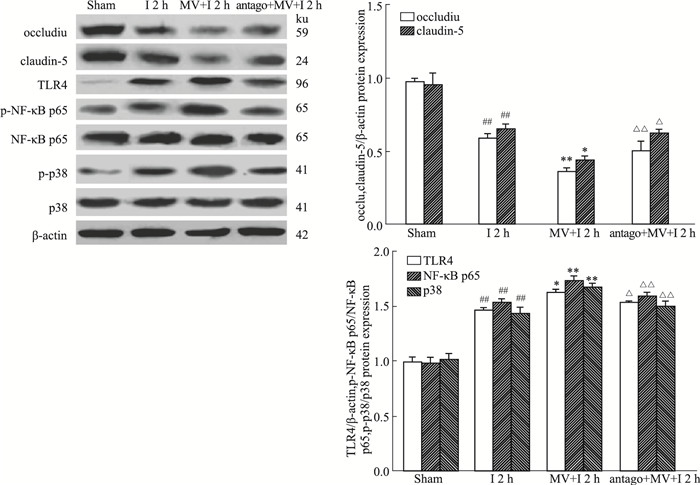
|
| Fig 4 The protein expression of occludin, claudin-5, TLR4, NF-κB and p38 via Western blot (x±s, n=6) ##P < 0.01 vs sham group; *P < 0.05, **P < 0.01 vs 2 h of ischemia group; △P < 0.05, △△P < 0.01 vs injection of MV and 2 h of ischemia group |
Tab 1结果显示,与假手术组相比,缺血脑组织中IL-1β和TNF-α释放量明显增多(P < 0.01);注射微囊泡miR-27a后,IL-1β和TNF-α释放量进一步增多,与缺血组相比差异具有显著性(P < 0.01);给予阻断剂antagomiR-27a能够拮抗这一作用,减少细胞因子的释放。
| Group | IL-1β/μmol·L-1 | TNF-α/μmol·L-1 |
| Sham | 10.66±0.51 | 11.49±0.31 |
| 2 h of ischemia | 16.28±0.37## | 14.65±0.19## |
| MV+2 h of ischemia | 21.06±0.75** | 23.58±0.66** |
| AntagomiR-27a+MV+2 h of ischemia | 17.15±0.22△△ | 18.99±0.24△△ |
| ##P < 0.01 vs sham; **P < 0.01 vs 2 h of ischemia; △△P < 0.01 vs injection of MV and 2 h of ischemia. | ||
血脑屏障是存在于血液和脑实质之间的具有选择通透性的动态交换界面,由脑血管内皮细胞、紧密连接、基膜、胶质细胞足突等组成,其中脑血管内皮细胞是血脑屏障功能发挥的结构基础。脑血管内皮细胞因其蛋白缺乏收缩性,使得大分子、亲水性药物难以进入中枢,确保中枢内环境稳定性。即血脑屏障有一定稳定性,对于进行中枢的物质具有很强的选择性,然而其通透性可随着病理过程而发生变化。脑缺血/再灌注后,缺血侧通透性于再灌注开始增加,再灌注达高峰,非缺血侧通透性未见明显变化,并且脑部自由基、一氧化氮、基质金属蛋白酶和炎症因子等表达异常增多,致血脑屏障通透性继续增加[6]。
血脑屏障的结构改变主要表现在脑血管内皮细胞变形,核染色质松散退变,通透性增加,胞质和间质水肿明显,突起肿胀等。内皮细胞之间的连接复合体由多蛋白体系构成,occludin、claudin-5、闭锁蛋白等是紧密连接的主要结构蛋白,其表达水平的变化与脑微血管通透性的改变及脑水肿的程度密切相关[7]。最新研究表明,紧密连接是血脑屏障调节通透性的中心环节,脑缺血性过程中,紧密连接功能和结构的破坏可直接导致脑水肿,是死亡的主要原因。咬合蛋白(occludin)和闭合蛋白(claudin)均构成复杂的跨膜结构,在大鼠局灶性脑缺血/再灌注模型血脑屏障超微结构和occludin变化的实验中发现,脑缺血/再灌注过程中,occludin沿血管的表达变得间断,同时occludin的蛋白表达水平下降,并且occludin表达在转录水平和翻译水平均受到抑制,紧密连接开放,血脑屏障完整性受损,提示occludin下降程度可作为血脑屏障损伤程度的标志[8]。claudin是紧密连接复合物的主要构成成分,参与维持紧密连接的选择渗透性和细胞极化。claudin-5是构成血脑屏障的主要跨膜蛋白,claudin蛋白被认为是脑血管内皮细胞通透性调节的最重要调节因子[9]。有研究发现,在再灌注晚期,claudin-5从内皮细胞间迁移到周围的星形胶质细胞中,进一步破坏血脑屏障[10]。在本研究中,不仅发现注射微囊泡后会加重缺血组织中脑梗死体积,还会降低occludin和claudin-5的阳性染色率和蛋白印迹表达,提示缺血组织中提取的微囊泡加重了缺血组织损伤,其本身的跨细胞通讯调控也可能是脑部缺血组织损伤的机制之一。
脑缺血或缺血/再灌注后诱导的炎症介质可被固有免疫系统识别。TLRs是固有免疫系统中的关键受体,其中TLR4是LPS诱导的中枢神经系统感染的主要识别受体,在脑缺血后激活一系列炎症分子分泌,是行使免疫功能和调节其功能的重要控制开关之一。我们前期工作中已证实,缺血/再灌注模型中,TLR4途径下可诱导MyD88、MAPK、NF-κB等信号通路,促进合成释放IL-1β、IL-6、TNF-α等炎症介质,并诱导细胞凋亡[11],且TLR4诱导的此炎症途径参与了缺血后血脑屏障紧密连接损伤机制[12],可致血脑屏障紧密连接蛋白occludin、claudin-5和ZO-1表达降低。目前很多研究,特别是药物或生物药物干预研究,尝试进一步探索调控TLR4途径,改善缺血后血脑屏障紧密连接损伤。
miR-27分为miR-27a和miR-27b,miR-27a属于基因间miRNA,miR-27b属于内含子型mi RNA。miR-27a/b高表达于多种细胞和血管丰富组织中,包括脂肪细胞、心肌细胞、内皮细胞、巨噬细胞等,均可参与调控糖脂代谢、血管生成、炎症因子表达等[13]。然而,以往的研究多集中于miR-27a/b在肿瘤调控中的作用,在脑血管疾病研究较少,深入探讨miR-27在缺血脑血管疾病中的作用和病理生理机制,对于脑缺血疾病的诊断、治疗和防治有重要意义。miR-27a参与调节紧密连接报道较少,仅有miR-27a参与调节肿瘤相关血管内皮钙黏蛋白调控的报道[14]。前期研究已证实,miR-27a参与调控LPS刺激小胶质细胞中TLR4/IRAK4途径,干扰miR-27a的表达可增加炎症因子的表达[4]。本研究发现,缺血组织中提取的微囊泡中miR-27a表达异常升高,提示缺血组织本身分泌的微囊泡可包含miR-27a信息,传递至缺血脑组织引起缺血组织损伤。细胞分泌的微囊泡可携带miRNAs、mRNA、蛋白质等信息,转移至细胞或组织中,通过细胞间通讯的方式调节靶细胞或组织[15]。在本研究中,注射miR-27a在缺血组织中释放并致脑损伤,诱导下游的NF-κB和p38信号因子表达持续升高,产生炎症级联反应,使得缺血脑组织中紧密连接损害加重。由于本研究中微囊泡是在缺血脑组织中分离的,具体微囊泡是从何种细胞中传递,作用于何种细胞仍需进一步研究。
( 致谢: 本实验在南昌大学第一附属医院实验室完成,对在实验过程中给予指导和帮助的老师表示感谢! )
| [1] | Prinz M, Priller J. The role of peripheral immune cells in the CNS in steady state and disease[J]. Nat Neurosci, 2017, 20(2): 136-44. |
| [2] | EL Andaloussi S, M~ger I, Breakefield X O, et al. Extracellular vesicles: biology and emerging therapeutic opportunities[J]. Nat Rev Drug Discov, 2013, 12(5): 347-57. doi:10.1038/nrd3978 |
| [3] | 刘芬, 李勇, 彭菲菲, 等. iPSC-MSC来源的外泌体对LPS刺激肺泡巨噬细胞产生炎性因子的影响[J]. 实验与检验医学, 2016, 34(1): 4-7. Liu F, Li Y, Peng F F, et al. The effect of exosomes derived from iPSC -MSC on secretion of inflammation factor from LPS treated alveolar macrophage[J]. Exp Laboratory Med, 2016, 34(1): 4-7. |
| [4] | Lv Y N, Ou-Yang A J, Fu L S. MicroRNA-27a negatively modulates the inflammatory response in lipopolysaccharide-stimulated microglia by targeting TLR4 and IRAK4[J]. Cell Mol Neurobiol, 2017, 37(2): 195-210. doi:10.1007/s10571-016-0361-4 |
| [5] | Ye X, Chopp M, Cui X, et al. Niaspan enhances vascular remodeling after stroke in type 1 diabetic rats[J]. Exp Neurol, 2011, 232(2): 299-308. doi:10.1016/j.expneurol.2011.09.022 |
| [6] | Li X Q, Chen F S, Tan W F, et al. Elevated microRNA-129-5p level ameliorates neuroinflammation and blood-spinal cord barrier damage after ischemia-reperfusion by inhibiting HMGB1 and the TLR3-cytokine pathway[J]. J Neuroinflammation, 2017, 14(1): 205. doi:10.1186/s12974-017-0977-4 |
| [7] | 李敏, 王斌, 曹慧, 等. 基于AQP-4、P-gp黄芩苷、栀子苷配伍对缺血/再灌注损伤大鼠血脑屏障保护机制研究[J]. 中国药理学通报, 2017, 33(3): 443-4. Li M, Wang B, Cao H, et al. Effect of baicalin and geniposide on blood brain barrier permeability in cerebral ischemia-reperfusion injury rats based on AQP-4, P-gp and its mechanism[J]. Chin Pharmacol Bull, 2017, 33(3): 443-4. |
| [8] | Zhang G S, Tian Y, Huang J Y, et al. The γ-secretase blocker DAPT reduces the permeability of the blood-brain barrier by decreasing the ubiquitination and degradation of occludin during permanent brain ischemia[J]. CNS Neurosci Ther, 2013, 19(1): 53-60. doi:10.1111/cns.2012.19.issue-1 |
| [9] | 方波, 张颖, 马虹. miR-122a对大鼠脊髓缺血/再灌注损伤后血-脊髓屏障的影响[J]. 中国药理学通报, 2017, 33(5): 703-6. Fang B, Zhang Y, Ma H. Effects of miR-122a on blood-spinal cord barrier after spinal cord ischemia-reperfusion injury in rats[J]. Chin Pharmacol Bull, 2017, 33(5): 703-6. |
| [10] | Miyamori H, Takino T, Kobayashi Y, et al. Claudin promotes activation of pro-matrix metalloproteinase-2 mediated by membrane-type matrix metalloproteinases[J]. Biol Chem, 2001, 276(30): 28204-11. |
| [11] | Lv Y, Qian Y, Fu L, et al. Hydroxysafflor yellow A exerts neuroprotective effects in cerebral ischemia/reperfusion-injured mice by suppressing the innate immune TLR4-inducing pathway[J]. Eur J Pharmacol, 2015, 769: 324-32. doi:10.1016/j.ejphar.2015.11.036 |
| [12] | Lv Y, Fu L. The potential mechanism for Hydroxysafflor yellow A attenuating blood-brain barrier dysfunction via tight junction signaling pathways excavated by an integrated serial affinity chromatography and shotgun proteomics analysis approach[J]. Neurochem Int, 2018, 112: 38-48. doi:10.1016/j.neuint.2017.10.012 |
| [13] | Chen W J, Yin K, Zhao G J, et al. The magic and mystery of microRNA-27 in atherosclerosis[J]. Atherosclerosis, 2012, 222(2): 314-23. doi:10.1016/j.atherosclerosis.2012.01.020 |
| [14] | Zhao Y, Ting K K, Li J, et al. Targeting vascular endothelial-cadherin in tumor-associated blood vessels promotes T-cell-mediated immunotherapy[J]. Cancer Res, 2017, 77(16): 4434-47. |
| [15] | Budnik V, Ruiz-Cañada C, Wendler F. Extracellular vesicles round off communication in the nervous system[J]. Nat Rev Neurosci, 2016, 17(3): 160-72. |

