

2. 天津市安定医院,天津 300222;
3. 济南大学、山东省医学科学院医学与生命科学学院,山东 济南 250022;
4. 山东省医学科学院山东省医药生物技术研究中心,山东 济南 250062
2. Tianjin Anding Hospital, Tianjin 300222, China;
3. School of Medical and Life Science, University of Jinan and Shandong Academy of Medical Science, Jinan 250022, China;
4. Medical Biotechnology Center, Shandong Academy of Medical Sciences, Jinan 250062, China
骨折固定的稳定性决定了骨折端的力学环境,力学环境是影响骨折愈合的重要因素之一。骨折断端绝对稳定并不利于骨折愈合,而在应力下骨折端适度的微动既能促进骨折愈合,又能恢复关节功能[1]。但是,骨断端的力学环境对骨折愈合产生影响的细胞和分子机制尚不清楚。在本课题组的前期研究[2]中,初步探索了在骨折愈合的早期,不同力学环境对间充质干细胞(mesenchymal stem cells,MSCs)在骨折断端的募集所产生的不同影响,印证了不同力学环境对骨折愈合的影响是与其影响MSCs的募集有关的。为进一步研究力学环境影响骨折愈合的相关机制,本实验以股骨骨折大鼠,以不同刚度系数的外固定架固定,进而使骨折端产生不同的力学环境,从MSCs分化的角度探索骨断端的力学环境对骨折愈合产生的影响。
1 材料与方法 1.1 材料 1.1.1 实验动物SD大鼠,♂,SPF级,体质量(280~300) g,购自山东鲁抗医药股份有限公司实验动物中心,实验动物生产许可证号:SCXK(鲁)2015-0017。
1.1.2 试剂RNase-free water(武汉博士德),One-step SYBR RT-PCR试剂盒(TaKaRa),TRIzol(Invitrogen),Runx2兔抗大鼠一抗(Cell Signaling Technology),Sox9兔抗大鼠一抗(Abcam)。
1.1.3 仪器TDL-40B台式离心机(飞鸽),WDW-5H生物力学测试机(济南华兴),KD-T53全自动脱水机、KD-BL冷冻包埋台、KD-BM石蜡包埋台、KD-P摊片机(浙江金华科迪),HM315切片机(Microm)。
1.2 动物模型的构建将大鼠随机分为低刚度外固定架组、高刚度外固定架组以及对照组(安装超高刚度外固定架),麻醉大鼠用腹腔注射戊巴比妥钠(30 mg·kg-1),腹面朝上固定于手术台,暴露股骨干,3组大鼠股骨分别安装超高、高、低刚度外固定架。外固定架(Fig 1)由4枚钢针和横梁组成,钢针的间距为5 mm,低、高、超高刚度固定架的钢针直径分别为0.5 mm、1.0 mm、1.2 mm。骨折区为小钢锯及剪刀制作的1 mm骨缺损,术后缝合肌肉、皮肤,并使大鼠自由活动。术后3 d内,注射头孢唑啉钠(30 mg·kg-1)防止感染发生,给予每日常规消毒。实验中所有大鼠均为右侧股骨单侧造模[2]。术后,对经外固定架固定的股骨进行生物力学测试,超高、高、低刚度外固定架轴向刚度系数平均值分别为60.6 N/mm(SD=0.9)、18.2 N/mm(SD=0.3)、8.5 N/mm(SD=0.1)(n=6,刚度系数的含义为单位时间内断端轴向活动1 mm所需力的大小),3组外固定架可对骨折区提供不同的力学环境。

|
| Fig 1 Representative structure of fractured femur (right) with external fixator |
对照组、高、低刚度组动物分别于术后当天、术后14 d拍摄X线片,观察股骨骨折愈合情况。
1.4 组织学检查观察骨折愈合情况术后6周分别取对照组、高、低刚度组的患侧股骨,对骨折的愈合情况做大体观察,并予以组织病理学检查,以观察3组间愈合情况的差异。
1.5 骨折断端MSCs的数目测定术后2、4、6、10 d取骨折端组织,分离有核细胞,流式细胞术检测CD29+CD90+细胞占有核细胞比例,并计算骨折端MSCs绝对数量[2]。
1.6 RT-qPCR检测Runx2、OSX和Sox9的表达术后2、6、10、14 d,3组动物于各时间点取材5只大鼠骨折股骨的骨痂组织,并提取RNA,冰上配制10 μL RT-qPCR反应体系:5 μL 2×Buffer,0.6 μL Taq HS Mix,0.2 μL RTase Mix,上、下游引物各0.4 μL (10 μmol·L-1),3.4 μL RNA、RNase free water。引物序列见Tab 1。实验采用一步法对RT-qPCR反应进行扩增,检测Runx2、OSX、Sox9的表达水平,每个样品重复3次。扩增条件:42℃预变性5 min,95℃变性15 s,60℃退火20 s,65℃延伸15 s,共42个循环。最后72℃延伸10 min,5℃终止反应。根据RT-qPCR反应的CT值,由2-△△CT法,计算最终结果。
| Gene | Primer sequence | Product/bp |
| Runx2 | F: 5′-TTCACAAATCCTCCCCAAG-3′ | 124 |
| R: 5′-GGCGGTCAGAGAACAAACT-3′ | ||
| Sox9 | F: 5′-CAGACCAGTACCCGCATC-3′ | 84 |
| R: 5′-TCTTCTCGCTCTCGTTCA-3′ | ||
| OSX | F: 5′-ACAAGGCGGGCATCCA-3′ | 193 |
| R: 5′-GCAAAGTCAGACGGGTAAGTAG-3′ | ||
| GAPDH | F: 5′-CATCCCAGAGCTGAACG-3′ | 181 |
| R: 5′-CTGGTCCTCAGTGTAGCC-3′ |
蛋白质免疫印迹法检测成骨、成软骨相关蛋白Runx2和Sox9的表达,分别于术后2、6、10、14 d处死大鼠,取骨折断端组织,液氮研磨,RIPA裂解液裂解,提取组织总蛋白,使用BCA法测定蛋白质浓度。SDS-PAGE电泳分离蛋白,PVDF膜电转移,含5%脱脂奶粉的TBST封闭,一抗(兔抗大鼠Runx2和Sox9)以及HRP标记的山羊抗兔IgG单克隆抗体过夜孵育。洗膜后,以LAS4000mini化学发光成像仪显影。
1.8 统计学分析应用SPSS 19.0统计软件进行数据处理,数据以x±s表示,组间差异比较采用方差分析及t检验。
2 结果 2.1 影像学结果术后当天和2周对对照组、高、低刚度外固定架组摄X线片。Fig 2结果显示,术后2周低刚度外固定架组骨痂量明显多于高刚度外固定架组,高刚度组骨痂量明显多于对照组。低刚度外固定架组骨折愈合速度较快。

|
| Fig 2 X ray on postoperative 0 day and 2 weeks after operation A, B, C: Sham group, high stiffness and low stiffness external fixator group on postoperative 0 day; D, E, F: Sham group, high stiffness and low stiffness external fixator group of 2 weeks after operation. |
如Fig 3所示,术后6周,对照组、高刚度组新生骨痂链接骨折断端,骨痂致密生长良好,骨细胞活跃;低刚度组大鼠组织学表现较为丰富,在股骨干增粗处均是新生骨,骨细胞较多且活跃,表现膜内成骨;骨折端软骨链接,软骨成骨活跃,形成了明显的肥大区和成骨区,在与正常骨组织接触处形成了软骨成骨的骨痂组织,骨折间隙有大量的软骨细胞和纤维组织。

|
| Fig 3 The pathological slices of callus tissues 6 weeks after operation(HE staining, ×40) A: Sham group; B: High stiffness group; C: Low stiffness group |
如Fig 4所示,术后2、4、6、10 d,高、低刚度组MSCs数量均明显高于对照组(P < 0.01,P < 0.05);术后2、4、6、10 d,低刚度组MSC数量明显高于高刚度组(P < 0.01,P < 0.05)。

|
| Fig 4 Number of MSCs in fracture bone end(n=4) *P < 0.05, **P < 0.01 vs sham group; #P < 0.05, ##P < 0.01 vs high stiffness group |
如Fig 5所示,对照组和模型组Runx2 mRNA的表达随时间变化均表现出增加趋势。6、10、14 d时与对照组相比,模型组表达均明显增加(P < 0.05或P < 0.01);与高刚度组比较,低刚度组增加更为明显(P < 0.01)。OSX mRNA表达水平,对照组和模型组随着愈合时间增加也呈现升高趋势,术后6 d内升高相对缓慢。2、6、10、14 d时,模型组与对照组比较增加明显(P < 0.05或P < 0.01);2、6 d时,两模型组差异不明显(P>0.05);10、14 d时,与高刚度组相比,低刚度组增加更为明显(10d,P < 0.05;14d,P < 0.01)。Sox9 mRNA表达水平,对照组和高刚度组10 d内呈增加趋势,14 d时有所下降,低刚度组则14 d内持续升高。同一时间点,模型组与对照组相比均明显增加(P < 0.05或P < 0.01),而6、10、14d低刚度组明显高于高刚度组(P < 0.05或P < 0.01)。
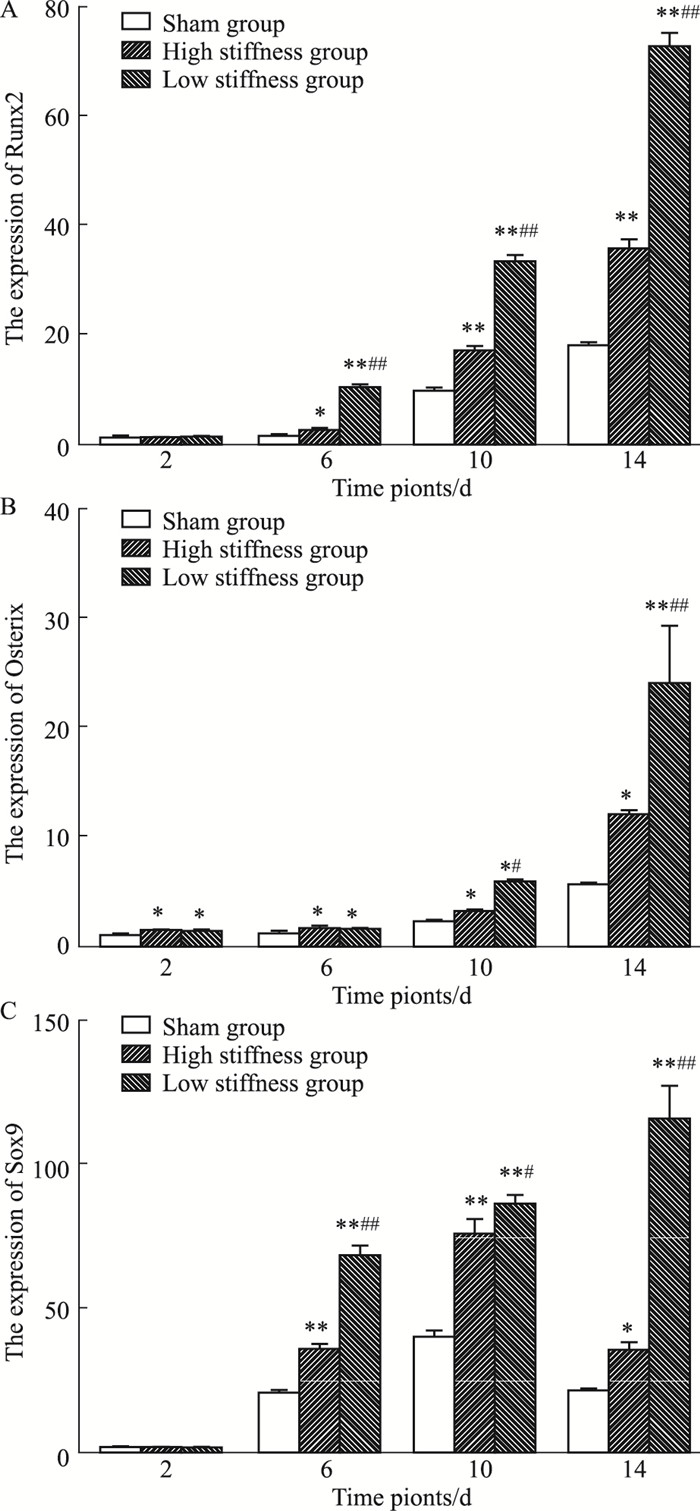
|
| Fig 5 Expression of Runx2(A), OSX(B), Sox9(C) in different groups(n=5) *P < 0.05, **P < 0.01 vs sham group; #P < 0.05, ##P < 0.01 vs high stiffness group |
低刚度组Runx2蛋白表达水平如Fig 6所示,2~14 d Runx2的表达呈现增加趋势,与RT-qPCR结果相一致。随着时间增加,各时间点对照组和模型组均有增加趋势(Fig 7)。2 d时,对照组表达量较低,高、低刚度组表达相对较多(P < 0.05);6 d时,低刚度组表达增加明显(P < 0.01 vs对照,P < 0.05 vs高刚度组);10 d时,低刚度组较其他两组表达增加且差异明显(P < 0.05);14 d时,模型组比对照组表达明显增加(低刚度组P < 0.01,高刚度组P < 0.05),低刚度组与高刚度组相比增加亦较明显(P < 0.05)。
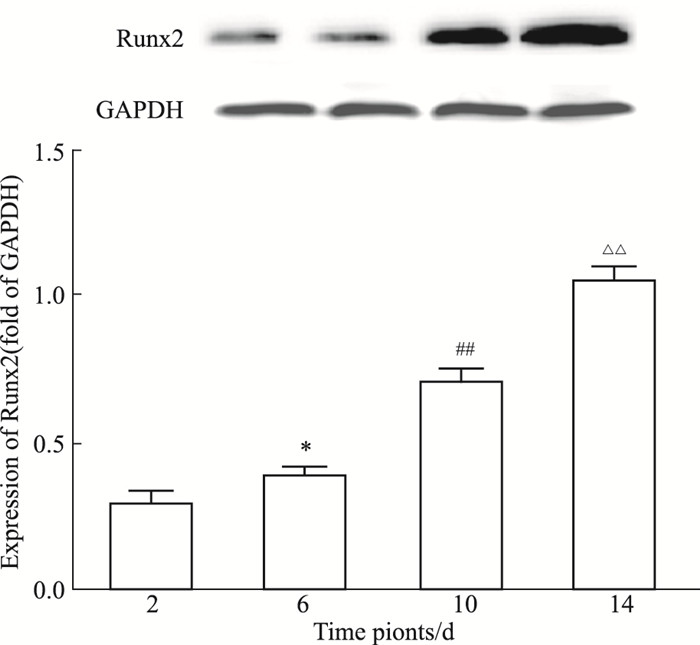
|
| Fig 6 Expression of Runx2 in low stiffness group(n=5) *P < 0.05 vs 2 d; ##P < 0.01 vs 6 d; △△P < 0.01 vs 10d |

|
| Fig 7 Expression of Runx2 at different time points(n=5) A: 2 d; B: 6 d; C: 10 d; D: 14 d. *P < 0.05, **P < 0.01 vs sham group; #P < 0.05 vs low stiffness group |
Sox9蛋白表达水平如Fig 8所示,低刚度组14 d内呈现增加趋势,高刚度组10 d内表达递增,14 d时有所下降。如Fig 9所示,2 d时,与其余两组相比,低刚度组的表达较高(P < 0.05);6 d时,低刚度组与对照组相比较,增加明显(P < 0.01),与高刚度组相比较,亦明显较高(P < 0.05);10 d时,模型组对比对照组均表达较高,差异有显著性(P < 0.05);14 d时,高刚度组相较于对照组表达较高(P < 0.05),低刚度组表达比高刚度组更高(P < 0.01)。
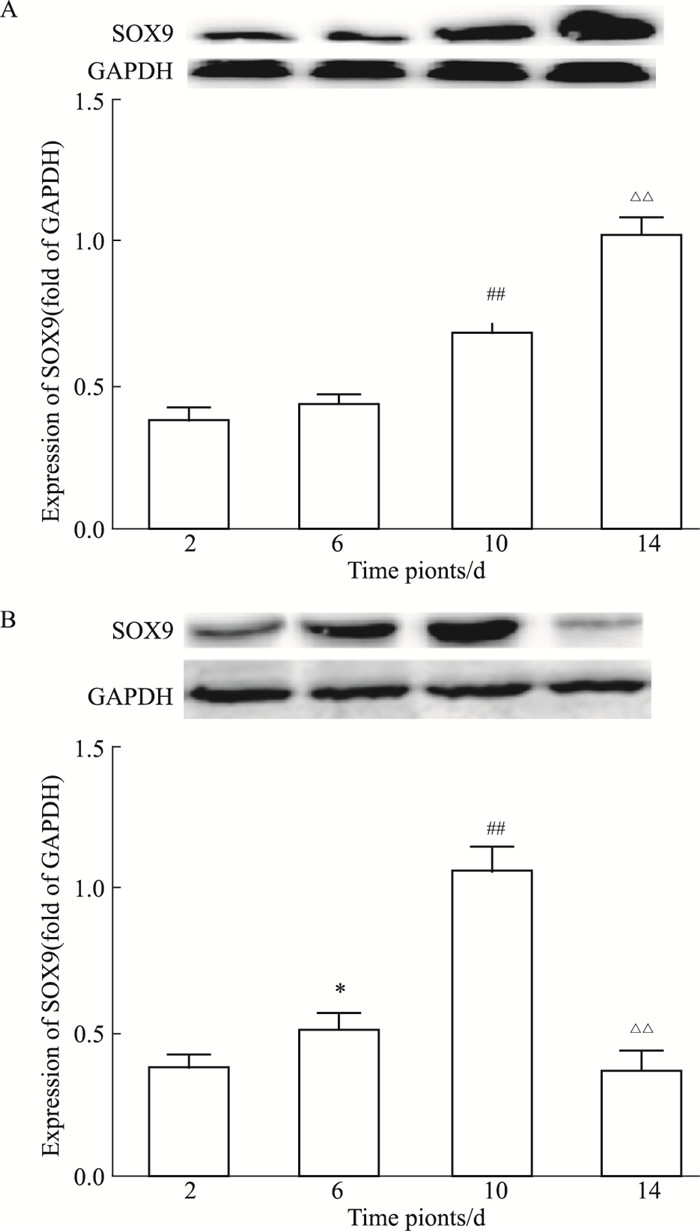
|
| Fig 8 Expression of Sox9 in low stiffness group(A) and high stiffness group(B) (n=5) *P < 0.05 vs 2 d; ##P < 0.01 vs 6 d; △△P < 0.01 vs 10 d |
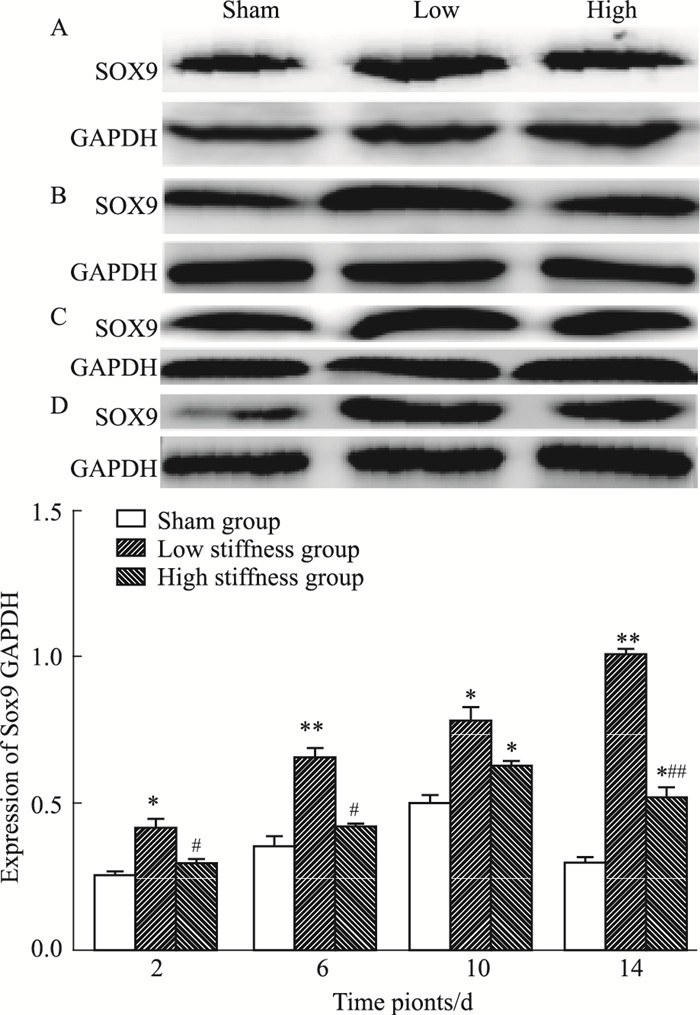
|
| Fig 9 Expression of Sox9 at different time points(n=5) A: 2 d; B: 6 d; C: 10 d; D: 14 d. *P < 0.05, **P < 0.01 vs sham group; #P < 0.05, ##P < 0.01 vs low stiffness group |
骨折端力学环境是影响骨折愈合重要因素之一。固定器刚度与肢体应力是影响骨折端力学环境最大的可变因素。因此量变固定器刚度与调节肢体应力都会影响骨折端的力学环境,而依靠动物体内环境产生力学刺激的方法,其优势在于能真实地模拟骨折时体内的力学环境。在研究定量应力影响骨折愈合的体内实验研究中,采用精准量变固定器刚度的间接方法的研究结果比调节大鼠肢体应力的结果可能更可靠、更准确。研究报道,大鼠行走时骨断端所受应力大小是可测的[2],本实验中所选用的大鼠股骨骨折模型,能够根据大鼠行走时其股骨上的应力数据值,进一步结合文献[2]有关微动大小、轴向压力值与骨折愈合的关系,更好地还原人骨折手术时骨折断端的微动状态。骨折愈合早期,骨折端所处力学环境的不同,会给骨折愈合的进度及预后带来不同的影响。我们发现,股骨骨折大鼠断端处于强度较高的力学固定时,2周后影像学检查发现,患处股骨生成的骨痂量明显少于处于低固定强度的骨折股骨;同时,先前研究[2]在骨折愈合早期,在低刚度组骨折断端募集的MSCs的数量,要远大于骨折断端给予高刚度固定者。这也验证了低刚度组的力学环境下,动物骨折断端存在的微动效应促进了骨痂的生长,促进了骨修复的速度,而不同的力学环境影响对骨折早期的愈合作用与骨断端MSCs的募集紧密相关的。
研究显示[4-5],Runx2、OSX是MSCs向成骨分化过程中极为重要的2个转录因子。其中,Runx2对于MSCs成骨分化属于控制基因[6],OSX在Runx2的下游对MSCs的成骨分化过程进行调控[7-8]。Sox9是MSCs向软骨细胞系转化的主控转录因子,对于软骨细胞谱系的生成及软骨特异性蛋白的表达是必不可少的[9]。所以,Runx2、OSX、Sox9的表达水平可以作为MSCs分化方向的直接参考[10]。在本实验中,RT-qPCR结果显示,在术后14 d内对照组及高、低固定刚度组大鼠,骨折断端组织中Runx2的表达随愈合时间延长而递增;6 d内OSX表达较少,10~14 d亦呈升高趋势。同一时间点3组间进行比较发现,减弱固定强度,即增加骨断端微动,Runx2、OSX表达量上升。Sox9的表达在对照组及高刚度组中,2~10 d递增,14 d略减少;而低刚度组则在14 d内呈现递增趋势。Western blot结果显示,Runx2的表达随愈合时间增加,3组均逐渐增多。术后同一时间点,模型组的表达均高于对照组,且低刚度组的表达高于高刚度组。与RT-qPCR结果基本相一致。Sox9的表达亦与RT-qPCR结果相一致,即对照组和高刚度组术后10 d内呈升高趋势,14 d时略有所下降,而低刚度组则在术后14 d内一直随愈合时间增加而升高。
随着固定强度减弱,骨折断端微动增多,成骨和成软骨基因Runx2、OSX的表达都较固定强度高者更为活跃,证明微动促进了骨折断端MSCs的成骨分化;而Sox9的表达水平的升高,证明微动加速了骨折股骨软骨内骨化的进度,激动了MSCs向软骨细胞系的分化。成骨细胞和软骨细胞的共同增殖及积累,在愈合进度上表现为骨结痂的大量生成。
综合RT-qPCR和Western blot的结果,可以看出,表明成骨和成软骨基因、蛋白的表达均存在固定刚度的差异,低刚度固定高于高刚度固定。在愈合进度上,大鼠骨折愈合早期,高刚度组10 d后成软骨表达减少,低刚度组表达仍增多,说明固定刚度低使得骨折处愈合速度加快,但另一方面,如若固定刚度过低可能会导致软骨细胞向成骨转化这一过程有所延迟,最终可能导致软骨链接的发生。这也在一定程度上解释了本实验中对低刚度组骨痂进行组织学检查,其结果出现软骨连接,而高刚度组6周后已完成骨性链接的原因。
综上,本研究从力学环境对骨断端MSCs分化的角度解释了骨断端力学环境对骨折愈合的影响——适量的量变应力促进骨折的愈合,这对临床上通过控制调节肢体应力促进骨折二期愈合、避免骨折并发症的发生提供了一定理论依据。
| [1] | 张俊忠, 卞泗善, 刘效敏. "动静平衡"在胫骨平台骨折术后功能康复中的应用[J]. 山东中医药大学学报, 2010, 34(4): 324-6. Zhang J Z, Ban S S, Liu X M. The application of '"balance of motion and immobility" infunction rehabilitation of fracture of tibial plateau[J]. J Shandong Univ Tradit Chin Med, 2010, 34(4): 324-6. |
| [2] | 李颖, 黎立, 李俊玲, 等. 力学环境对骨折早期骨折端间充质干细胞募集的影响[J]. 国际骨科学杂志, 2016, 37(3): 198-202. Li Y, Li L, Li J L, et al. Effect of mechanical environment on recruitment of mesenchymal stem cells at fracture site during early stage of fracture healing[J]. Int J Orthopaedics, 2016, 37(3): 198-202. |
| [3] | Weher T, Wolfram U, Henzler T, et al. Internal forces and moments in the femur in the femur of the rat during gait[J]. J Biomech, 2010, 43(13): 2473-9. doi:10.1016/j.jbiomech.2010.05.028 |
| [4] | Nishimura R, Nakamura E, Kida J, et al. Bone and stem cells. Regulation of chondrocyte differentiation from mesenchymal stem cells[J]. Clinical calcium, 2014, 24(4): 509-16. |
| [5] | Chen H, Ghori-Javed F Y, Rashid H, et al. Runx2 regulates endochondral ossification through control of chondrocyte proliferation and differentiation[J]. J Bone Miner Res, 2014, 29(12): 2653-65. doi:10.1002/jbmr.2287 |
| [6] | Nishio Y, Dong Y, Paris M, et al. Runx2-mediated regulation of the zinc finger Osterix/Sp7 gene[J]. Gene, 2006, 372: 62-70. doi:10.1016/j.gene.2005.12.022 |
| [7] | Nakashima K, Zhou X, Kunkel G, et al. The novel zinc finger-containing transcription factor osterix is required for osteoblast differentiation and bone formation[J]. Cell, 2002, 108(1): 17-29. doi:10.1016/S0092-8674(01)00622-5 |
| [8] | Kaback L A, Soung D Y, Naik A, et al. Osterix/Sp7 regulates mesenchymal stem cell mediated endochondral ossification[J]. J Cell Physiol, 2008, 214(1): 173-82. doi:10.1002/(ISSN)1097-4652 |
| [9] | Akiyama H. Control of chondrogenesis by the transcription factor Sox9[J]. Mod Rheumatol, 2008, 18(3): 213-9. doi:10.3109/s10165-008-0048-x |
| [10] | Carroll S H, Ravid K. Differentiation of mesenchymal stem cells to osteoblasts and chondrocytes: a focus on adenosine receptors[J]. Expert Rev Mol Med, 2013, 15(9): 118-24. |

