


2. 上海国宝企业发展中心,上海 201203
 ,
TANG Pei-chen2,
GU Xin-xia1,
ZHANG Xin2,
SUN Ying1,
YU Bo-cheng2,
ZHANG Xiao-yan1,
GE Xiao-qun1
,
TANG Pei-chen2,
GU Xin-xia1,
ZHANG Xin2,
SUN Ying1,
YU Bo-cheng2,
ZHANG Xiao-yan1,
GE Xiao-qun1

2. Shanghai Guobao Enterprise Development Center, Shanghai 201203, China
帕金森病(Parkinson’s disease,PD)是一种中枢神经系统退行性疾病,其主要特征是中脑黑质致密部(substantia nigra pars compacta,SNpc)多巴胺(dopamine,DA)能神经元变性死亡,最终导致DA含量降低[1]。其发病机制十分复杂,与细胞凋亡关系密切[2]。目前,临床治疗的药物主要缓解患者症状,难以从根本上抑制DA能神经元的渐进性丢失[3],因此,寻找能够阻止PD病程的神经保护剂意义重大。
虫草素(cordycepin,Cor)是从蛹虫草中分离的一种核苷类化合物,具有广泛的药理活性,然而,其对PD的影响报道甚少。Olatunji等[4]和本课题组[5-6]前期研究发现,Cor可抑制PD模型PC12细胞的损伤和凋亡。然而,Cor是通过何种信号转导通路介导了这一效应,以及能否在动物体内发挥对DA能神经元的保护作用,目前尚未见该方面的研究报道。
多条信号转导通路参与介导了PD黑质DA能神经元的凋亡[7],其中,丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPK)信号转导通路发挥了重要作用。体外研究发现,激活JNK通路可引起DA神经元凋亡[8],在PD患者脑组织中亦发现p38通路明显活化[9],中脑黑质部有p-ERK1/2的积聚[10]。为此,本研究利用1-甲基-4-苯基-1,2,3,6-四氢吡啶(1-methyl-4-phenyl-1, 2, 3, 6-tetrahydropyridine,MPTP)制备PD小鼠模型,观察Cor对中脑黑质DA能神经元及MAPK信号通路的影响,以进一步探讨其神经保护作用及机制,为探索PD治疗新靶点提供依据,为Cor作为神经保护剂的临床应用提供实验基础。
1 材料 1.1 实验动物50只C57BL/6小鼠,♂,体质量(20±2)g,购于扬州大学实验动物中心,实验动物生产许可证:SCXK(苏)2012-0004,使用许可证号:SYXK(苏)2012-0029。小鼠饲养于温度为(20±2)℃、相对湿度(60±10)%的动物房,自由进食水,12 h/12 h光照周期。
1.2 药物与试剂虫草素(纯度99%,上海国宝企业发展中心);MPTP(东京化成工业株式会社);DA、二羟苯乙酸(DOPAC)和高香草酸(HVA)标准品(美国Sigma公司);TUNEL法细胞凋亡检测试剂盒、HRP标记的二抗(博士德生物工程有限公司);抗TH、p-p38、p-ERK1/2抗体(美国Abcam公司);抗JNK1/2和p-JNK1/2抗体(上海生工生物工程有限公司);抗Bax、Bcl-2、Cleaved caspase-3、p38、ERK1/2、GAPDH抗体(万类生物科技有限公司);β-actin抗体(北京博奥森生物技术科技有限公司)。
1.3 仪器大小鼠转棒疲劳测试仪、旷场实验箱、Super Maze+高通量动物行为实验分析系统(上海欣软信息科技有限公司);Nikon80i正置显微镜(日本Nikon公司);Multiskan FC型酶标仪(美国Thermo公司);5415R型冷冻离心机(德国Eppendorf公司);电泳仪(美国Bio-Rad公司);Tanon 5200全自动化学发光成像系统(上海天能科技有限公司)。
2 方法 2.1 实验分组及给药50只小鼠,随机分为5组,每组10只。分别为:正常对照组、模型组(MPTP组)、Cor低、中、高剂量组(2.5、5.0、10.0 mg·kg-1)。Cor用生理盐水溶解,给药剂量由预实验确定,灌胃给药。MPTP(30 mg·kg-1)溶于生理盐水,腹腔注射给药[11]。对照组d 1~15灌胃生理盐水,d 4~8注射生理盐水;模型组d 1~15灌胃生理盐水,d 4~8注射MPTP;Cor组d 1~15分别灌胃不同浓度Cor,d 4~8注射MPTP。末次给药结束后,d 2进行小鼠行为学检测。
2.2 行为学检测 2.2.1 旷场实验实验前2 h,将小鼠从动物饲养室移至行为学检测实验室,让其适应实验室环境。实验开始时,将动物放于50 cm×50 cm × 25 cm的旷场内,让其自由活动10 min,记录小鼠的运动轨迹和运动距离。
2.2.2 转棒实验小鼠实验前训练3 d,疲劳转棒仪直径为3 cm,每只小鼠每天训练300 s。正式实验时转速设定300 s内,由4 r·min-1逐渐加速到40 r·min-1,记录小鼠从转轴上跌落的潜伏期。每只重复3次,每次间隔30 min,取平均值。
2.2.3 爬杆实验木杆长50 cm,直径1 cm,顶端固定有直径2.5 cm的木球,木杆缠纱布以防打滑,记录小鼠在球上停留的时间(T1), 以及小鼠从小球底端爬到杆的底部所需要的时间(T2)。每只重复3次,每次间隔3 min,取平均值。
2.3 HPLC-ECD法检测纹状体DA及其代谢产物含量行为学测定结束后,每组取6只小鼠,断头取脑,在冰上迅速取出同一侧纹状体称重,每1 mg组织加10 μL匀浆液,超声匀浆。于4℃、20 000 r·min-1离心20 min,取上清液,-80℃保存备用。HPLC-ECD检测纹状体组织中DA、DOPAC、HVA的含量。
2.4 免疫组织化学法检测TH阳性细胞行为学测定结束后,每组取3只小鼠,麻醉后用4%多聚甲醛心脏灌流,断头取脑,放入4%的多聚甲醛中继续固定,之后常规石蜡包埋。根据小鼠脑立体定位图谱进行冠状连续切片,片厚4 μm,切片分组收集。采用免疫组化SABC法,在光镜下对SNpc区域观察并拍照,每只小鼠重复观察3张切片,用Image plus 6.0图像分析软件,选择有清晰细胞轮廓带有明显核仁的神经元进行计数,定量分析SNpc区域TH阳性细胞。
2.5 TUNEL法检测细胞凋亡采用TUNEL法,按试剂盒方法操作。光镜下观察SNpc区域,每只小鼠重复观察3张切片,计数每张切片SNpc区5个高倍视野的阳性细胞,每只小鼠3张切片阳性细胞数的平均值为该只小鼠凋亡细胞数。
2.6 Western blot法检测相关蛋白的表达6只小鼠取出纹状体后,分离黑质组织,取其中3只小鼠的黑质组织, 按比例加入新鲜配制的RIPA裂解液进行匀浆,4℃、10 000 r·min-1离心15 min,收集上清于-80℃保存备用。BCA法进行蛋白含量测定。以30 μg蛋白进行SDS-PAGE凝胶电泳,转印,封闭,加入一抗(Bcl-2、Bax、Cleaved caspase-3、p38、p-p38、ERK 1/2、p-ERK 1/2、JNK 1/2、p-JNK 1/2)4℃过夜。TBST洗膜后,加入二抗4℃孵育4 h,洗膜后用ECL法显影,使用Image J软件进行灰度分析。
2.7 统计学分析实验结果以x±s表示,采用SPSS 20.0软件进行数据处理,应用单因素方差分析进行显著性检验,两组间比较采用t检验。
3 结果 3.1 Cor对PD小鼠运动功能的影响 3.1.1 旷场实验旷场实验是目前评价小鼠运动功能和精神状态最常用的方法之一。与对照组相比,模型组小鼠的运动总路程明显减少(P < 0.01);与模型组相比,除低剂量外,中、高剂量Cor预处理后,小鼠的运动总路程均明显增加(P < 0.01),自发活动能力得以改善(Fig 1A)。
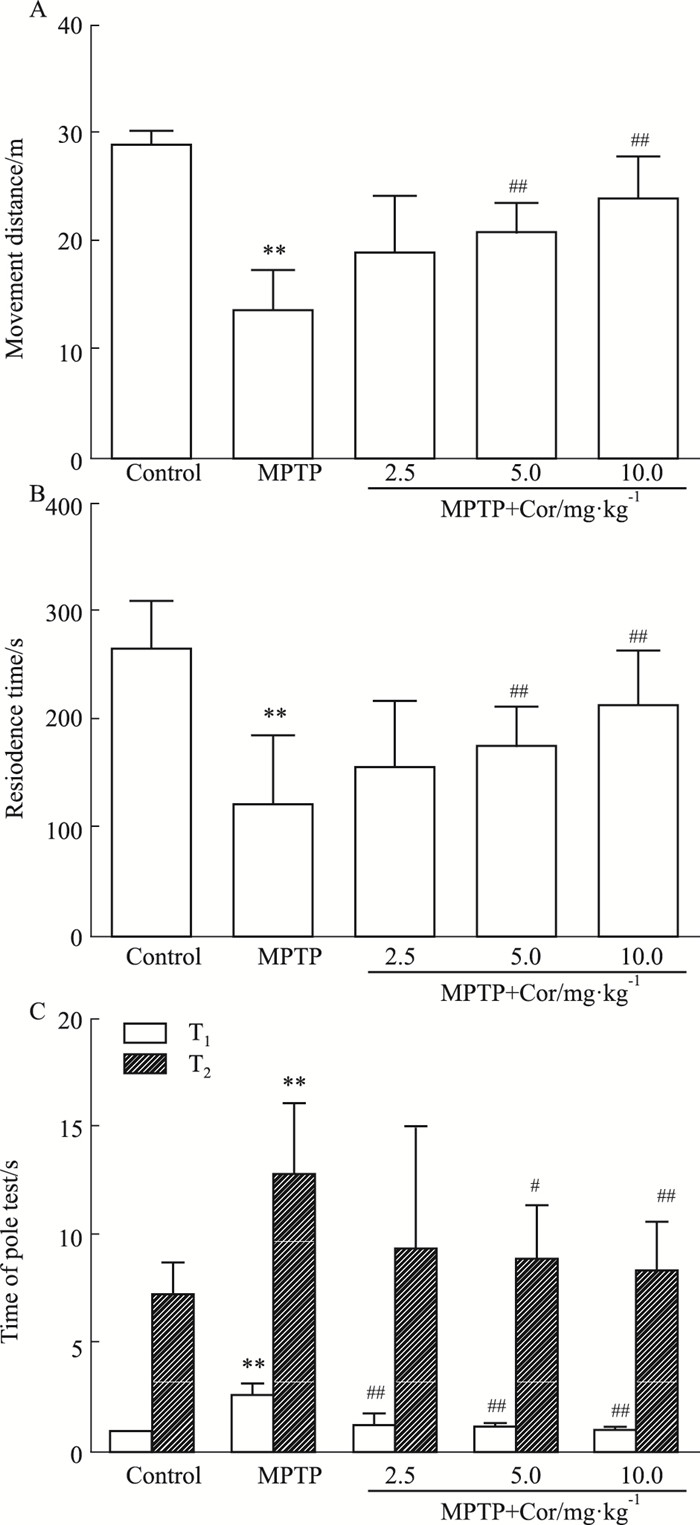
|
| Fig 1 Effects of cordycepin on motor functions of MPTP-induced mice (x±s, n=10) A: The movement distance of mice in the open-field; B: The retention time of mice on the rotating rod; C: Pole test of mice.**P < 0.01 vs control; #P < 0.05, ##P < 0.01 vs MPTP |
转棒实验主要用来观察小鼠的肌张力和平衡协调能力。与对照组相比,模型组小鼠在滚筒上滞留的时间明显缩短(P < 0.01),且出现肌肉无力、不喜运动等现象,说明小鼠运动平衡功能受损严重;与模型组相比,Cor组小鼠的滞留时间有延长的趋势,中、高剂量Cor组效果明显(P < 0.01),一定程度提高了小鼠的肌张力及运动平衡能力(Fig 1B)。
3.1.3 爬杆实验爬杆实验是常用的评价MPTP模型小鼠动作迟缓的方法,爬杆动作需要姿势调整及平衡协调能力的共同参与。模型组小鼠在球上停留的时间(T1)和爬完全杆的时间(T2)均较对照组明显延长(P < 0.01)。与模型组相比,不同剂量Cor干预后,T1均明显缩短(P < 0.01),T2与T1结果趋势相似,除Cor低剂量组差异无显著性,其余组均明显缩短(P < 0.05,P < 0.01),改善了小鼠运动迟缓,提高了身体协调性(Fig 1C)。
3.2 Cor对PD小鼠纹状体DA及其代谢产物含量的影响与对照组比较,模型组小鼠纹状体内DA含量明显降低(P < 0.01),其代谢产物DOPAC、HVA含量也出现明显下降(P < 0.01)。与模型组比较,各Cor组小鼠纹状体内DA、DOPAC、HVA含量均明显升高(P < 0.05,P < 0.01),见Tab 1。
| Group | Content /μg·g-1 | ||
| DA | DOPAC | HVA | |
| Control | 49.7±5.6 | 3.86±1.11 | 5.57±0.53 |
| MPTP | 13.1±9.3** | 1.31±0.35** | 2.58±1.01** |
| MPTP+Cor 2.5 mg·kg-1 | 25.9±7.0# | 1.75±0.26# | 3.39±0.37# |
| MPTP+Cor 5.0 mg·kg-1 | 28.1±2.2## | 1.90±0.28## | 3.45±0.29# |
| MPTP+Cor 10.0 mg·kg-1 | 30.8±4.5## | 2.36±0.41## | 3.85±0.52# |
| **P < 0.01 vs control; #P < 0.05, ##P < 0.01 vs MPTP. | |||
对照组小鼠SNpc区可见大量排列整齐的TH免疫阳性神经元,细胞饱满,呈梭形或锥体形,轴突和树突交织的网状结构清晰完整。与对照组相比,模型组小鼠SNpc区TH免疫阳性细胞明显减少(P < 0.01),神经元胞体皱缩,轴突和树突丢失严重;与模型组相比,Cor低、中、高剂量组小鼠SNpc区TH免疫阳性细胞丢失程度均明显减轻(P < 0.01),其中Cor低剂量组神经元皱缩情况有所改善,但轴突和树突丢失依然明显,Cor中、高剂量组神经元胞体较为饱满,轴突和树突的网状结构损伤不明显,以Cor高剂量组最为清晰完整(Fig 2、Tab 2)。
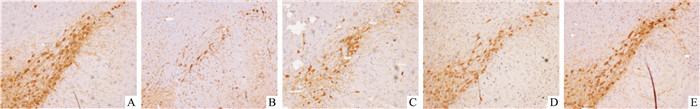
|
| Fig 2 Effects of cordycepin on TH-immunoreactive cells in SNpc of MPTP-induced mice (×100) A: Control group; B: 30 mg·kg-1 MPTP group; C: 2.5 mg·kg-1 Cor+MPTP group; D: 5.0 mg·kg-1 Cor +MPTP group; E: 10.0 mg·kg-1 Cor+MPTP group. |
| Group | Number of immunoreactive cells | |
| TH | TUNEL | |
| Control | 80.3±6.6 | 1.07±0.31 |
| MPTP | 18.2±9.8** | 33.91±3.70** |
| MPTP+Cor 2.5 mg·kg-1 | 37.6±5.1## | 12.40±2.51## |
| MPTP+Cor 5.0 mg·kg-1 | 53.1±2.5## | 6.02±1.17## |
| MPTP+Cor 10.0 mg·kg-1 | 68.7±5.2## | 4.29±0.50## |
| **P < 0.01 vs control; ##P < 0.01 vs MPTP | ||
对照组仅见极少量的TUNEL染色阳性细胞,而模型组可见大量棕黄色TUNEL染色阳性细胞,细胞核皱缩,形态不规则。Cor干预后,各组TUNEL染色阳性细胞较模型组均明显减少(P < 0.01),见Fig 3、Tab 2。
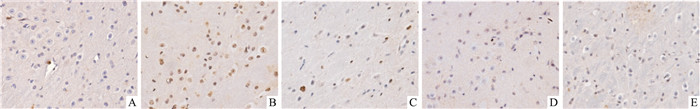
|
| Fig 3 Effects of cordycepin on apoptosis in SNpc of MPTP-induced mice (×400) A: Control group; B: 30 mg·kg-1 MPTP group; C: 2.5 mg·kg-1 Cor +MPTP group; D: 5.0 mg·kg-1 Cor +MPTP group; E: 10.0 mg·kg-1 Cor+MPTP group. |
如Fig 4所示,与对照组相比,MPTP模型小鼠SN中Bax和Cleaved caspase-3蛋白表达明显增加,Bcl-2蛋白表达和Bcl-2/Bax比值明显降低,且差异均具有显著性(P < 0.01);Cor干预后可以逆转上述现象,Bax和Cleaved caspase-3蛋白表达降低,Bcl-2蛋白表达和Bcl-2/Bax比值均升高,其中Cor中、高剂量组作用明显(P < 0.01)。
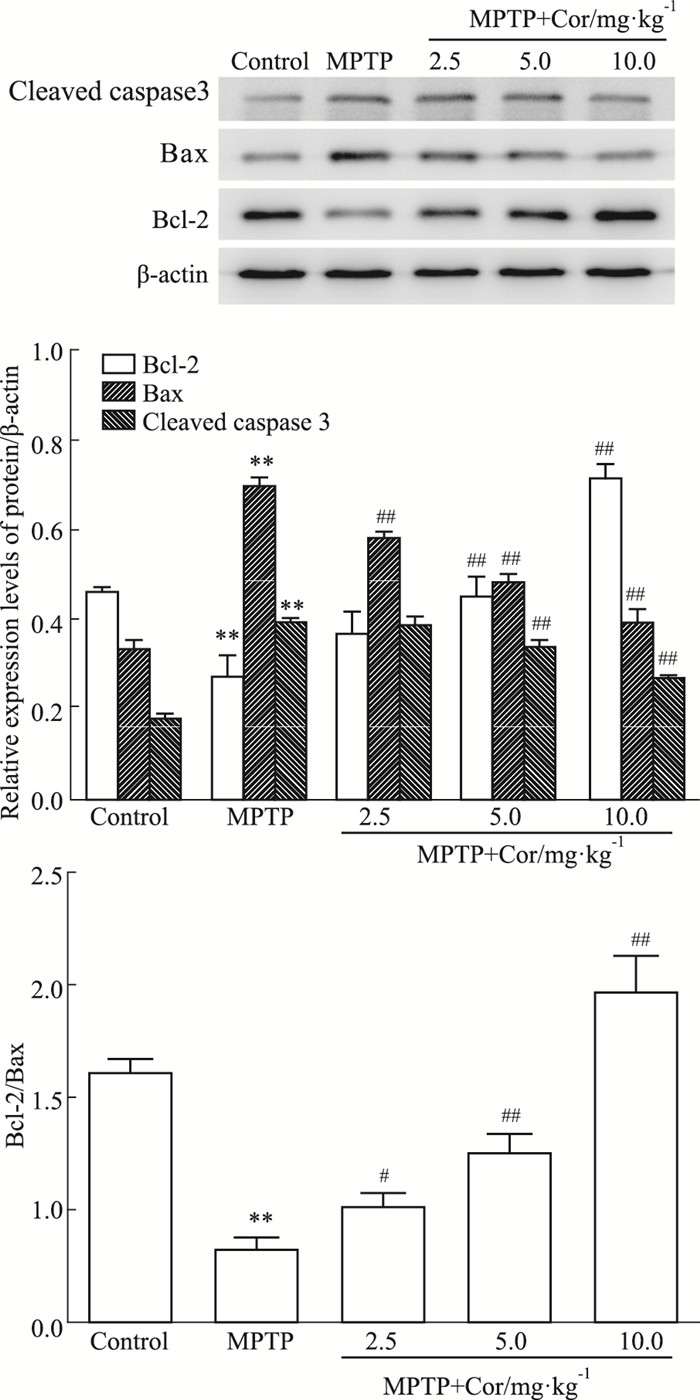
|
| Fig 4 Effects of cordycepin on protein expressions of apoptosis related proteins in SN of MPTP-induced mice(x±s, n=3) **P < 0.01 vs control; #P < 0.05, ##P < 0.01 vs MPTP |
如Fig 5所示,各组间p38、ERK1/2、JNK1/2蛋白表达均无明显变化。与对照组相比,模型组小鼠黑质中p-p38、p-ERK1/2及p-JNK1/2蛋白表达均明显增加(P < 0.01);与模型组相比,除Cor低剂量组p-p38和p-JNK表达无明显差异外,其他各组p-p38、p-ERK1/2、p-JNK1/2蛋白表达均明显减少(P < 0.05,P < 0.01)。
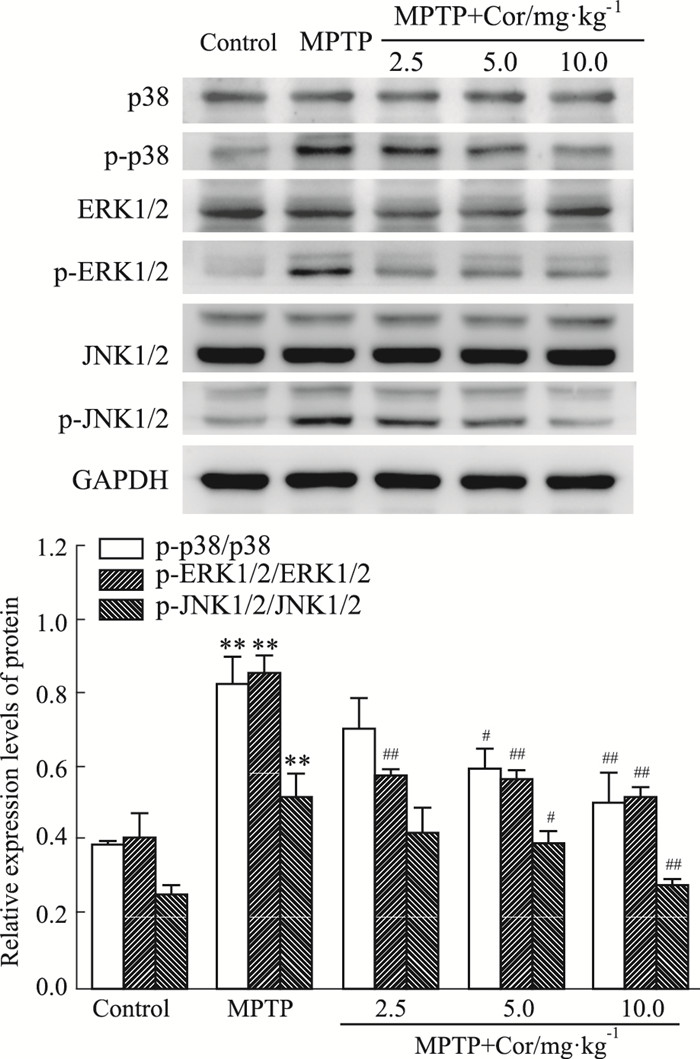
|
| Fig 5 Effects of cordycepin on protein expressions of MAPK signal in SN of MPTP-induced mice (x±s, n=3) **P < 0.01 vs control; #P < 0.05, ##P < 0.01 vs MPTP |
PD患者的临床症状以运动功能障碍为主,其原因是中脑SNpc区DA能神经元变性死亡,导致纹状体DA含量下降所致。本研究应用MPTP成功地模拟了上述变化,并观察到Cor能改善模型小鼠自主活动减少、运动迟缓和平衡协调能力下降的现象。同时,检测到小鼠SNpc区TH免疫阳性神经元丢失程度明显减轻,纹状体DA、DOPAC、HVA含量明显升高。有研究发现,爬杆实验结果与小鼠纹状体DA浓度高度相关[12],这在本实验中也得到证实。上述结果表明Cor能够抑制MPTP-PD小鼠DA能神经元损伤,显示了较好的神经保护作用。这一结果目前尚未见文献报道。
PD的发病与细胞凋亡关系密切。在我们前期的体外实验中,通过Hoechst 33258核染色、Annexin V-FITC/PI双染和电镜实验发现,Cor可以抑制鱼藤酮(rotenone,Rot)诱导的PC12细胞凋亡[5]。本实验显示,模型组小鼠黑质区出现大量TUNEL染色阳性细胞,Cor可以明显减少其阳性细胞数量,提示Cor在体内、体外均可抑制DA能神经元凋亡。细胞凋亡过程受到一系列凋亡蛋白的控制,其中Bcl-2家族和caspase家族最具代表性。Bcl-2家族中抗凋亡蛋白Bcl-2和促凋亡蛋白Bax是细胞凋亡的主要作用蛋白,Bcl-2/Bax比率直接决定了细胞的存亡。caspase-3是caspase家族中最重要的凋亡执行者之一,它的活化能够启动凋亡级联反应。本实验显示,Cor可以逆转MPTP引起的Bcl-2表达降低,Bax表达增加和caspase-3的活化,提高Bcl-2/Bax比值,发挥抗凋亡作用。
在哺乳动物体内,MAPK信号转导通路参与了细胞增殖、分化、凋亡和应激等病理生理过程,主要包括由p38、ERK、JNK介导的3条途径。本研究发现,MPTP可以使小鼠黑质中p-p38、p-ERK1/2、p-JNK1/2蛋白表达明显增加。Cor预处理后抑制了MPTP导致的p38、ERK1/2、JNK1/2蛋白的磷酸化,使其表达明显减少。既往研究表明,JNK信号通路参与了线粒体介导的细胞凋亡,促进线粒体释放细胞色素C到胞质,激活caspase级联反应[8],诱导DA能神经元凋亡。另一方面,p38活化后能通过Fas受体途径介导凋亡[13]。我们在Rot诱导的PC12细胞中发现,Cor能够明显提高线粒体膜电位,减少细胞色素C向胞质的释放,并能下调Fas蛋白的表达[13],推测Cor可能是通过抑制p38和JNK1/2的磷酸化,经内源性和外源性途径抑制细胞凋亡的。自由基能够激活ERK1/2,诱发下游细胞信号分子Bax的表达[14],并且可以启动caspase-3活化,导致DA能神经元变性丢失[15]。体外研究发现,Cor能提高PD细胞内超氧化物歧化酶、谷胱甘肽过氧化物酶等抗氧化酶活性,降低细胞内活性氧和丙二醛水平[4, 6],据此推测Cor可能通过清除自由基,减弱氧化应激反应而抑制ERK1/2的激活,最终减少DA能神经元凋亡。当然,本研究只是初步结果,还有待进一步实验证实。氧化应激诱导神经细胞凋亡的分子机制十分复杂,其调控途径还包括NF-κB通路、p53通路、PI3K/Akt通路、Nrf2通路等信号通路,Cor是否参与了这些信号通路的调控,还有待进一步研究。
综上所述,Cor对MPTP诱导的小鼠DA能神经元损伤具有保护作用,其机制可能是通过抑制MAPK的磷酸化水平,下调Bax表达,上调Bcl-2表达,以及抑制caspase-3活化,最终抑制DA能神经元凋亡。
( 致谢: 本实验在扬州大学医学院大型实验仪器平台和药学实验中心完成,感谢课题组全体老师和同学给予的指导和帮助,同时也感谢南京医科大学江苏省神经退行性疾病重点实验室为DA含量测定提供的帮助和支持 )
| [1] | Mosley R L, Benner E J, Kadiu I, et al. Neuroinflammation, oxidative stress and the pathogenesis of Parkinson's disease[J]. Clin Neurosci Res, 2006, 6(5): 261-81. |
| [2] | Hirsch E C, Jenner P, Przedborski S. Pathogenesis of Parkinson's disease[J]. Mov Disord, 2013, 28(1): 24-30. |
| [3] | 袁惠丽, 汪璇, 张丽娟, 等. 中药在防治帕金森病中的作用及研究进展[J]. 中国药理学通报, 2010, 26(7): 850-4. Yuan H L, Wang X, Zhang L J, et al. Mechanism and research progress of Chinese traditional medicine in the prevention and treatment of Parkinson's disease[J]. Chin Phamacol Bull, 2010, 26(7): 850-4. |
| [4] | Olatunji O J, Feng Y, Olatunji O O, et al. Cordycepin protects PC12 cells against 6-hydroxydopamine induced neurotoxicity via its antioxidant properties[J]. Biomed Pharmacother, 2016, 81: 7-14. |
| [5] | 陈琴, 姜新, 顾欣霞, 等. 虫草素对鱼藤酮诱导PC12细胞凋亡的保护作用[J]. 中国新药杂志, 2016, 25(8): 938-43. Chen Q, Jiang X, Gu X X, et al. Protective effect of cordycepin against PC12 cell apoptosis induced by rotenone[J]. Chin J New Drugs, 2016, 25(8): 938-43. |
| [6] | 姜新, 张鑫, 顾欣霞, 等. 虫草素抑制帕金森病细胞凋亡的caspase激活途径研究[J]. 沈阳药科大学学报, 2017, 34(10): 899-904. Jiang X, Zhang X, Gu X X, et al. Caspase activation pathway related to the anti-apoptosis effects on PD cells by cordycepin[J]. J Shenyang Pharm Univ, 2017, 34(10): 899-904. |
| [7] | 徐圆圆, 梁小凤, 朱雯婷, 等. 5-羟基-1-氢-吲唑对SH-SY5Y细胞的保护作用及其机制研究[J]. 中国药理学通报, 2016, 32(3): 378-84. Xu Y Y, Liang X F, Zhu W T, et al. The protective action and its mechanism of 5-hydroxy-1H-indazole in SH-SY5Y cells[J]. Chin Phamacol Bull, 2016, 32(3): 378-84. |
| [8] | Huang Q, Du X, He X, et al. JNK-mediated activation of ATF2 contributes todopaminergic neurodegeneration in the MPTP mousemodel of Parkinson's disease[J]. Exp Neurol, 2016, 277: 296-304. doi:10.1016/j.expneurol.2015.10.010 |
| [9] | Corti O, Hampe C, Koutnikova H, et al. The p38 subunit of the aminoacyl-tRNA synthetase complex is a Parkin substrate: linking protein biosynthesis and neurodegeneration[J]. Hum Mol Genet, 2003, 12(12): 1427-37. |
| [10] | Zhu J H, Kulich S M, Oury T D, Chu C T. Cytoplasmic aggregates of phosphorylated extracellular signal regulated protein kinases in Lewy body diseases[J]. Am J Pathol, 2002, 161(6): 2087-98. doi:10.1016/S0002-9440(10)64487-2 |
| [11] | 刘树民, 张琳, 丛树园, 于海龙. MPTP对小鼠帕金森病造模条件探讨[J]. 中国实验动物学报, 2007, 15(2): 146-50. Liu S M, Zhang L, Cong S Y, Yu H L. Exploration on the conditions of establishment of MPTP-Induced mouce model of Parkinson's disease[J]. Acta Lab Anim Sci Sin, 2007, 15(2): 146-50. |
| [12] | Matsuura K, Kabuto H, Makino H, Ogawa N. Pole test is a useful method for evaluating the mouse movement disorder caused by striatal dopamine depletion[J]. J Neurosci Methods, 1997, 73(1): 45-8. |
| [13] | 王茜, 张辉, 张作凤, 等. p38MAPK对帕金森病MPTP模型小鼠NF-κB和COX-2调控的研究[J]. 中国现代医学杂志, 2012, 22(28): 15-20. Wang Q, Zhang H, Zhang Z F, et al. Role of p38 MAPK in regulating expression of NF-κB and COX-2 in substantia-nigra of MPTP Parkinson's disease mice model[J]. Chin J Mod Med, 2012, 22(28): 15-20. doi:10.3969/j.issn.1005-8982.2012.28.004 |
| [14] | Sawe N, Steinberg G, Zhao H. Dual roles of the MAPK/ERK1/2 cell signaling pathway after stroke[J]. J Neurosci Res, 2008, 86(8): 1659-69. doi:10.1002/(ISSN)1097-4547 |
| [15] | 石冲, 张国彬, 张宇新, 张作凤. 磷酸化ERK1/2对帕金森病模型小鼠黑质半胱氨酸蛋白酶-3表达的影响[J]. 中国老年学杂志, 2015, 35(24): 7046-8. Shi C, Zhang G B, Zhang Y X, Zhang Z F. Effect of p-ERK1/2 on the expression of caspase-3 in Parkinson's disease mice model[J]. Chin J Gerontol, 2015, 35(24): 7046-8. doi:10.3969/j.issn.1005-9202.2015.24.035 |