

2. 贵州医科大学 民族药与中药开发应用教育部工程研究中心,贵州 贵阳 550004;
3. 贵州医科大学 药学院,贵州 贵阳 550004
 ,
QIN Xiao-li1,3,
XIA Tao1,3,
LI Yue-ting1,2,
GONG Zi-peng1,3,
LI Yong-jun1,2,3,
ZHENG Lin1,2
,
QIN Xiao-li1,3,
XIA Tao1,3,
LI Yue-ting1,2,
GONG Zi-peng1,3,
LI Yong-jun1,2,3,
ZHENG Lin1,2

2. Engineering Research Center for the Development and Application of Ethnic Medicine TCM(Ministry of Education);
3. School of Pharmacy, Guiyang Medical University, Guizhou 550004, China
荭草花为蓼科荭草Polygonum orientale L.的干燥花序,又名狗尾巴花、水荭花、何草花等,以其全株收载于2003版《贵州省中药、民族药质量标准》[1],具有行气消积、活血、止痛的功效,用于腹中痞积、头痛、心胃气痛等疾病的治疗[2]。课题组前期对荭草各部位药理筛选实验中发现,荭草花比其“全草”具有更为明显的抗心肌缺血作用,为荭草的主要药效部位[3]。目前,已从荭草花活性部位中提取并鉴定了槲皮素、山奈酚、槲皮苷、山柰素-3-O-β-D-葡萄糖苷、山柰素-3-O-α-L-鼠李糖苷5种成分[4]。在对荭草花进行药动学研究发现,如槲皮苷、山柰素-3-O-α-L-鼠李糖苷的绝对生物利用度低[5],限制其口服给药后药效的发挥。而关于荭草花提取物吸收特性尚未见报道。因此,研究其口服吸收机制及影响因素,为荭草花提取物的口服制剂研发和临床应用具有重要意义。在口服药物吸收特性的体外研究中,人结肠腺癌细胞系(Caco-2细胞系)已成为经典的细胞模型,具有类似于肠上皮细胞的特征,在形态学和生物化学方面与肠上皮细胞具有相似性。该模型重现性好,与肠道的吸收机制具有良好的相关性,常作为药物肠吸收和转运特征研究的体外模型[6-8]。因此,本实验利用Caco-2细胞模型作为一种中药吸收研究的筛选工具,并采用UPLC-MS/MS建立荭草花提取物中5个成分的分析方法,测定荭草花提取物在时间、浓度、温度、pH和P-gp抑制剂条件下对Caco-2细胞的吸收摄取影响,以阐明荭草花5种提取物的吸收机制,为初步评价荭草花提取物的体内吸收特性和荭草花提取物的口服制剂研发及临床应用奠定科学依据。
1 材料与方法 1.1 药品与试剂槲皮苷对照品(批号150702)、山奈酚对照品(批号150328)、槲皮素对照品(批号151222),均购自四川维克奇生物科技有限公司;荭草花有效组分(自制,批号20150915);荭草花药材购自贵州贵阳鹿冲关贵州省药用植物园种植基地,由贵州医科大学药学院生药学教研室龙庆德副教授鉴定;葛根素(批号110752-201514)购自中国食品药品检定研究院;山奈素-3-O-β-D-葡萄糖苷对照品、山奈素-3-O-α-L-鼠李糖苷对照品(自制)。Caco-2(American Type Culture Collection),30~50代;DMEM、FBS、Trypsin-EDTA均购于Thermo Fisher Scientific;RIPA、鼠尾Ⅰ型胶原蛋白均购于Aladdin Industrial Corporation;碱性磷酸酶(alkaline phosphatase,AKP)和乳酸脱氢酶(lactic dehydrogenase,LDH)试剂盒均购于南京建成科技有限公司;BCA蛋白测试试剂盒(Solarbio);荧光素钠(上海灵锦精细化工有限公司);MTS(Promega);甲醇、乙腈和甲酸为色谱纯;其余试剂均为分析纯。
1.2 仪器Allegra 64R低温高速离心机(Beckman Coulter);MTN-2800D氮吹仪(天津奥特塞恩斯仪器有限公司);超高效液相色谱-三重四级杆串联质谱仪(美国Waters公司);细胞培养箱(Thermo Fisher Scientific);TS-100F倒置显微镜和CCD照相机(Nikon);超净工作台(苏州净化设备总厂);Millicell培养皿和Millicell®-ERS Ⅱ电阻仪(Millipore)。
1.3 色谱条件Acquity® Waters BEH C18(2.1 mm×100 mm, 1.7 μm)色谱柱;0.1%甲酸乙腈-0.1%甲酸水梯度洗脱,梯度为0~1.0 min:5%~15%,1.0~3.8 min:15%~18%,3.8~4.0 min:18%~90%,4.0~5.0 min,90%~5%[9]进样体积:2 μL;柱温:45℃。
1.4 质谱条件Waters Acquity TQD质谱仪;毛细管电离电压:3 kV;电喷雾离子源(ESI);多反应离子监测;离子源温度:120℃;去溶剂N2温度:350℃,流速650 L·h-1;反吹气N2流速:50 L·h-1;碰撞气Ar流速:0.16 mL·min-1,数据分析:MassLynx V4.1工作站。离子对如下:山奈酚m/z(+)287.1→213.2、槲皮素m/z(+)303.2→153.1、槲皮苷m/z(+)449.1→303.2、山奈素-3-O-β-D-葡萄糖苷m/z(+)449.05→287.2、山奈素-3-O-α-L-鼠李糖苷m/z(+)433.1→287.2,葛根素(内标)m/z(-)417.0→267.0;锥孔电压分别为:45 V、45 V、20 V、25 V、20 V、40 V;碰撞电压分别为:30 V、40 V、10 V、10 V、10 V、30 V。
1.5 标准溶液的制备分别精密称取槲皮素等5种样品适量,用甲醇溶解并定容至10 mL。得槲皮素(1.22 g·L-1)、山奈酚(1.13 g·L-1)、槲皮苷(1.1 g·L-1)、山奈素-3-O-β-D-葡萄糖苷(1.1 g·L-1)、山奈素-3-O-α-L-鼠李糖苷(0.96 g·L-1)标准溶液。分别精密量取槲皮素等5种对照品储备液适量,37℃氮气吹干,按梯度稀释成所需浓度,得混合系列标准溶液。精密称维拉帕米和环孢菌素A适量,HBSS定容至10 mL,得维拉帕米(10 g·L-1),环孢菌素A (5 g·L-1)溶液,置温度为-20℃冰箱中保存,备用。
1.6 细胞裂解液的制备将已培养好的Caco-2用预热的HBSS液轻轻清洗细胞表面。然后将提取物按设定的组别溶解于HBSS,每孔添加1.5 mL,培养90 min,取出后,添加4℃的HBSS终止摄取,并用HBSS迅速冲洗3遍,加入500 μL RIPA,4℃条件下振荡,裂解细胞,取出,超声5 min,混匀,转移,得细胞混悬液[10]。
1.7 样品前处理取400 μL细胞裂解液和细胞混悬液,再取50 μL内标溶液和2 mL乙酸乙酯加入,涡混3 min,6 000 r·min-1离心,提取上清液2 μL进LC-MS分析。
1.8 Caco-2细胞模型的建立将Caco-2细胞株迅速复苏,接种于T-25斜颈培养瓶中,培养液为高糖DMEM培养基,培养基中含10%胎牛血清、1%双抗。置于5% CO2、37℃培养箱(相对湿度90%)培养。待培养的细胞90%融合时,用PBS洗净细胞表面杂质,再用37℃预热的胰酶-EDTA消化后,接种于6孔培养板,24 h后更换培养液,以后隔日换液,1周后每天换液,培养14 d后,待细胞生长均匀、边界清晰,成单层膜状态,测定细胞跨膜电阻值为300 Ω·cm2以上[9-10],可用于测定的荭草花提取物中各化合物在Caco-2细胞中的摄取特点。
1.9 Caco-2细胞摄取实验 1.9.1 不同浓度荭草花提取物对细胞的毒性将实验分为空白对照组和药物组,空白对照组添加100 μL的无血清DMEM;药物组用无血清DMEM将受试化合物配制成0.1、0.2、0.5、1.0、2.0、4.0、8.0、16.0、32.0 g·L-1的稀释液,每孔添加100 μL药液,置于95% O2、37℃培养箱中培养4 h后,用MTT法进行检测。每个浓度平行5孔,实验重复3次。考察不同浓度荭草花提取物对细胞的毒性。
1.9.2 浓度依赖性摄取实验取不同浓度(0.2、0.5、1.0、2.0、5.0 g·L-1)的荭草花提取物的HBSS溶液2 mL(n=3),置于Caco-2细胞中,在37℃下培养1 h,考察不同荭草花提取物浓度对细胞摄取的影响。
1.9.3 时间依赖性摄取实验将2 g·L-1荭草花提取物加入到培养好的细胞中,考察在不同摄取时间(30、60、90、120、180 min)条件下,荭草花提取物被Caco-2细胞摄取的变化。
1.9.4 不同pH对荭草花提取物摄取的影响将2 g·L-1荭草花提取物分别溶于不同pH(5.0、6.0、7.4)的HBSS缓冲液中,测定在加药90 min后不同pH值条件下,Caco-2细胞摄取的变化。
1.9.5 不同温度对荭草花提取物摄取的影响将2 g·L-1荭草花提取物溶于HBSS缓冲液中,于不同温度(4℃、25℃、37℃)条件下培养,在加药90 min后,分别测定在不同温度条件下,Caco-2细胞摄取的变化。
1.9.6 P-gp对荭草花提取物摄取的影响分别加入含环孢菌素A (10 mg·L-1)的荭草花提取物(2 g·L-1)溶液,维拉帕米(50 mg·L-1)的荭草花提取物(2 g·L-1)溶液,分别于给药90 min后,测定有无抑制剂时,Caco-2细胞对荭草花提取物摄取的影响。
1.10 统计学分析所得数据以x±s表示,组间差异比较用t检验。多组间比较用单因素方差分析。
2 结果 2.1 UPLC MS/MS分析方法的确证分别取空白细胞混悬液、混合标准溶液(内标为葛根素)以及进行摄取实验的细胞样品溶液,涡旋2 min,15 000 r·min-1离心10 min,分离上清液进样分析。实验表明,空白细胞混悬液中无杂质峰干扰,细胞混悬液中槲皮素等5种成分及内标葛根素分离完全,保留时间(Rt)分别为1.35、3.82、3.98、2.30、2.27、2.91 min。结果见Fig 1,图中以时间为横坐标,百分强度为纵坐标。
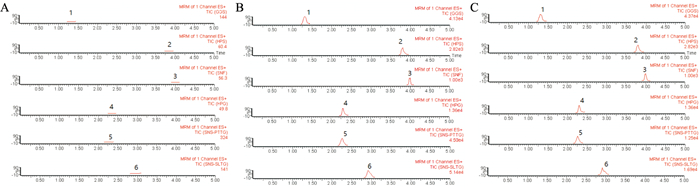
|
| Fig 1 UPLC-MS/MS chromatogram of all compounds in uptake test A: Blank solution; B: Blank solution spiked with standands; C: Real sample. 1: Puerarin; 2: Quercetin; 3: Kaempferol; 4: Quercetin-3-rhamnoside; 5: Kaempferide-3-O-β-D-lglucoside; 6: Kaempferide-3-O-α-L-rhamnoside |
以样品与内标的峰面积比和混合溶液中的药物浓度分别为纵坐标和横坐标,得到荭草花5种成分的工作曲线,其线性范围、回归方程如Tab 1所示。槲皮素等5种成分摄取转运实验标准曲线方程分别见Tab 1。各成分在0.05~72 mg·L-1范围线性关系良好(r≥0.999)。
| Compound | Concentration/mg·L-1 | Regression equation | r |
| Quercetin | 0.05~12.2 | Y=0.015 9X+0.000 4 | R2=0.999 8 |
| Kaempferol | 0.23~56.5 | Y=0.003 7X+0.001 3 | R2=0.999 7 |
| Quercetin-3-rhamnoside | 0.045~11 | Y=0.206 0X+0.000 5 | R2=0.9999 |
| Kaempferide-3-O-β-D-lglucoside | 0.09~22 | Y=0.250 5X-0.062 5 | R2=0.9992 |
| Kaempferide-3-O-α-L-rhamnoside | 0.29~72 | Y=0.319 4X-0.060 1 | R2=0.9999 |
根据“标准曲线”项,分别配制高,中,低3个浓度的山奈酚等5种成分的溶液作为质量控制样品,在所确定的质谱条件下分析,将测定的浓度与加入已知标液浓度浓度比较,求得回收率均大于90%,每个浓度再分别配制5份进行样本分析,连续测定3 d,日内精密度RSD%为1.12%~4.74%,日间精密度RSD%为1.14%~4.53%。
将上述质控样品,放置于室温,分别于1、2、3 d后取样处理分析,根据槲皮素等5种成分的色谱峰面积计算其RSD%,结果槲皮素等5种成分与零时比较,RSD值均小于3%。上述结果表明,此方法稳定、灵敏,重现性好。
2.2 Caco-2细胞摄取实验 2.2.1 不同浓度荭草花提取物对细胞的毒性如Fig 2所示,各给药组在所设计的浓度范围内,随着浓度的增加,荭草花提取物对Caco-2细胞生长无毒性作用,可以进行下一步摄取实验。
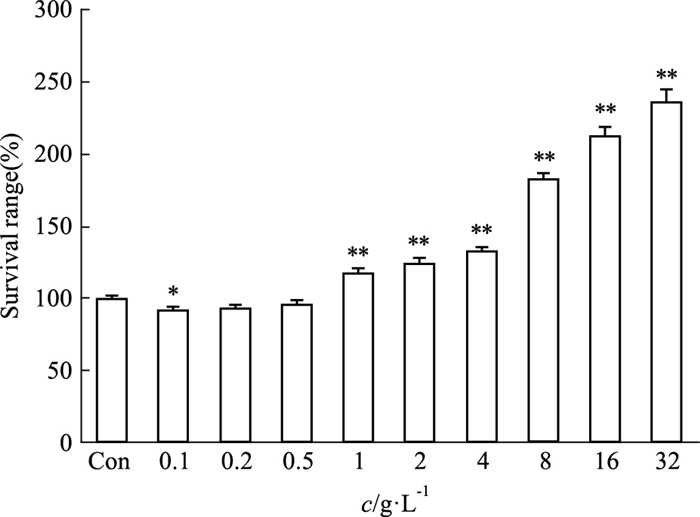
|
| Fig 2 Effect of Polygonum orientale L. Flower extract on cytotoxicity of Caco-2 cells(n=5) *P < 0.05, **P < 0.01 vs control group |
如Fig 3所示,槲皮素等5个成分的摄取量随浓度的增加而增加,表明荭草花中5个成分的摄取方式主要表现为被动扩散。
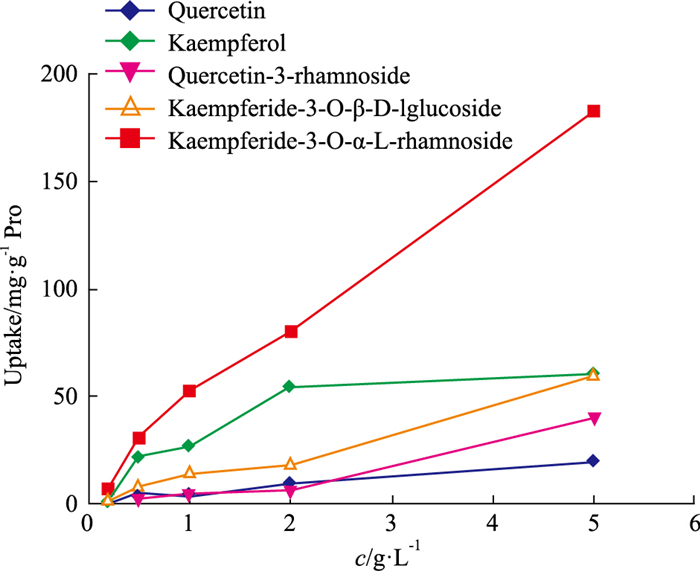
|
| Fig 3 Effect of different concentrations of Polygonum orientale L.Flower extract on Caco-2 cell uptake(x±s, n=6) |
Fig 4结果表明,槲皮素等5个成分的摄取量随时间的增加而降低,可能原因为中药成分复杂,各成分之间的吸收可能相互影响,也可能由于酶的水解和转运体的影响,导致槲皮素等5个成分的摄取量随时间的增加而降低。综合考虑,选择90 min作为最佳摄取时间来进行后续实验。
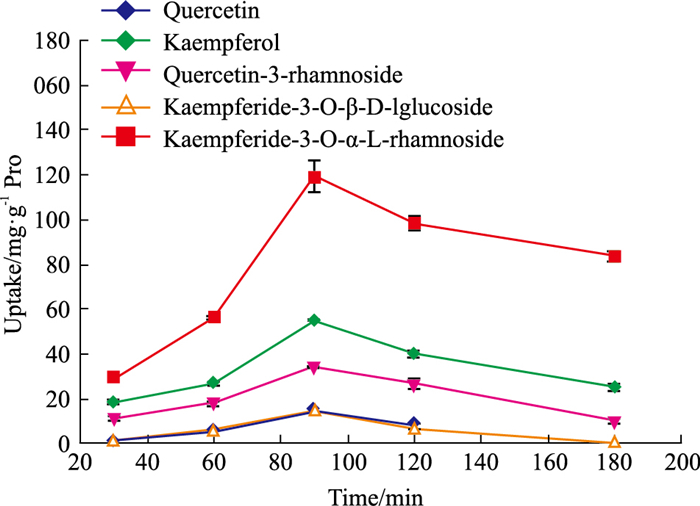
|
| Fig 4 Effect of different time of Polygonum orientale L. Flower extract on Caco-2 cell uptake(x±s, n=6) |
Tab 2结果表明,槲皮素等5个成分在pH 7.4和pH 5时吸收特性与pH 6时差异有显著性。除槲皮素外,其余4种成分在pH 6.0时,吸收大于pH 7.4和pH 5,差异具有显著性;槲皮素在pH 5时,吸收明显大于pH 6.0,可能原因为其本身为弱酸性化合物,在酸性条件下更易被吸收。
| pH | Uptake/mg·g-1 Pro | ||||
| Quercetin | Kaempferol | Quercetin-3-rhamnoside | Kaempferide-3-O-β-D-lglucoside | Kaempferide-3-O-α-L-rhamnoside | |
| 7.4 | 3.593±0.237** | 10.560±0.085** | 3.080±0.198** | 10.308±0.657** | 35.274±1.176** |
| 6 | 5.315±0.264 | 23.888±0.631 | 5.056±0.295 | 15.402±0.227 | 48.952±0.644 |
| 5 | 6.620±0.045** | 22.237±1.124* | 4.014±0.317** | 13.250±0.579** | 44.363±1.011** |
| *P < 0.05, **P < 0.01 vs pH=6 | |||||
Fig 5结果表明,槲皮素等5种成分在37℃的条件下,摄取量均大于4℃和25℃,并且摄取量随温度的增加而增加。
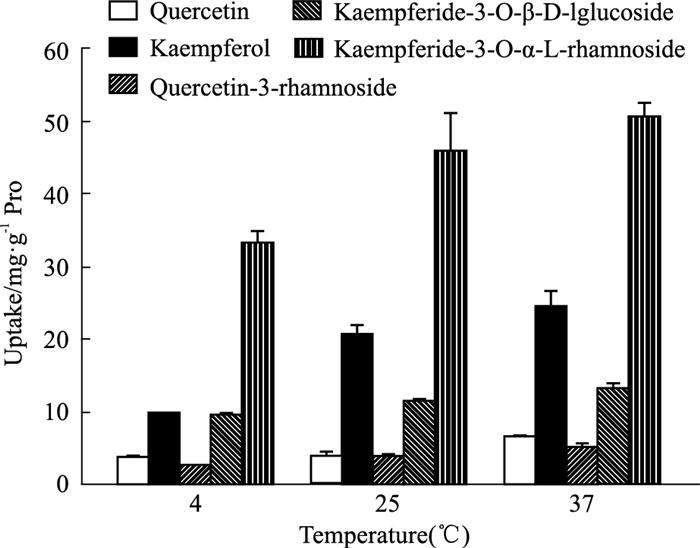
|
| Fig 5 Effect of different temperature of Polygonum orientale L.Flower extract on Caco-2 cell uptake(x±s, n=6) |
在以上实验所确定的pH为6,温度为37℃的摄取条件下进行实验,Tab 3结果表明,在合并维拉帕米或环孢菌素A条件下,荭草花中槲皮素和山奈酚摄取量明显增加,表明槲皮素和山奈酚可能是P-gp的底物。其余各成分的摄取不受抑制剂的影响。
| Polygonum orientale L. Flower compound | Uptake/mg·g -1 Pro | |
| Quercetin | Quercetin | 5.315±0.264 |
| Quercetin+Verapamil | 5.496±0.033 | |
| Quercetin+CsA | 6.075±0.172* | |
| Kaempferol | Kaempferol | 23.888±0.631 |
| Kaempferol+Verapamil | 28.79±1.274** | |
| Kaempferol+CsA | 24.808±0.992 | |
| Quercetin-3-rhamnoside | Quercetin-3-rhamnoside | 5.056±0.295 |
| Quercetin-3-rhamnoside+Verapamil | 5.188±0.397 | |
| Quercetin-3-rhamnoside+CsA | 4.852±0.069 | |
| Kaempferide-3-0-β-D-lglucoside | Kaempferide-3-0-β-D-lglucoside | 15.402±0.227 |
| Kaempferide-3-0-β-D-lglucoside+Verapamil | 15.322±0.766 | |
| Kaempferide-3-0-β-D-lglucoside+CsA | 15.193±0.984 | |
| Kaempferide-3-O-α-L-rhamnoside | Kaempferide-3-O-α-L-rhamnoside | 48.952±0.644 |
| Kaempferide-3-O-α-L-rhamnoside +Verapamil | 47.279±3.184 | |
| Kaempferide-3-O-α-L-rhamnoside +CsA | 48.847±1.603 | |
| *P < 0.05, **P < 0.01 vs Polygonum orientale L. Flower extract from control group | ||
Caco-2细胞模型具有较高的重现性,兼具快速、易于控制、干扰小、可连续检测和接近药物在人体内吸收的实际环境等优点,成为预测药物体内吸收、阐明药物吸收机制的良好工具,被国内外广泛用于药物吸收特性研究[11]。
研究表明,在0.2~5.0 g·L-1浓度范围内,细胞摄取表现为一级速率过程,表明其摄取方式主要为被动扩散。但摄取量随时间的增加而降低,提示药物在进入细胞后可能受到酶的水解和转运体的影响,导致其转运过程中摄取量随时间的增加而降低,在荭草花提取物的5种代表性成分中,除槲皮素和山奈酚外,其余都为苷类化合物,而苷类药物进入细胞后容易被水解。同时,由于受到转运体的外排作用,是导致摄取量随时间的增加而降低的可能原因。在维拉帕米参与的条件下,槲皮素和山奈酚摄取量明显增加,也进一步证实槲皮素和山奈酚的吸收受到P-gp的外排作用,降低了药物的吸收。
同时,胃肠道内的pH环境影响药物在体内的溶解性和吸收情况。实验结果表明,当pH为5时,槲皮素的摄取明显增加,这可能与其化合物本身含有酚羟基酸性基团有关。当化合物呈酸性时,在中性和偏碱性的环境中以电离形式存在,导致其提取物在细胞膜的渗透性降低。且由于温度对酶影响,使其提取物的细胞摄取量呈温度依赖性。
本实验初步阐明了荭草花5种提取物的细胞吸收机制及其影响因素,为其临床应用及口服制剂的研究开发提供细胞水平的实验基础和科学依据。但是,目前运用Caco-2细胞模型研究中药大多是单一的对中药化学成分的研究,而中药含多种成分,且成分复杂,只通过对单一成分的吸收机制来说明其中药的吸收机制具有片面性,容易忽视成分间的相互影响。所以,运用Caco-2细胞模型对中药多成分吸收特征及筛选研究,对中药复杂成分的吸收机制阐明具有参考意义。
| [1] | 贵州省药品监督管理局编. 贵州省中药民族药质量标准(2003年版)[S]. 贵阳: 贵州科技出版社, 2003: 267. Guizhou drug administration bureau. Guizhou Traditional Chinese Medicine Quality Standard (2003 edition)[S]. Guiyang: Guizhou Science and Technology Press, 2003: 267. |
| [2] | 郑林, 陈慧, 王爱民, 等. 超高效液相色谱测定大鼠口服荭草花后入血成分[J]. 中国医院药学杂志, 2012, 32(2): 91-3. Zheng L, Chen H, Wang A M, et al. Dtemine the blood component in flowers of the Polygonum Orientale after the orally by high HPLC[J]. Chin J Hosp Pharm, 2012, 32(2): 91-3. |
| [3] | 李月婷, 胡杰, 谢玉敏, 等. 荭草花不同制备工艺样品对犬急性心肌缺血的保护作用[J]. 中药材, 2015, 38(1): 115-8. Li Y T, Hu J, Xie Y M, et al. Protective effect of Polygonum Orientale flower extract with different preparation methods on acute myocardial ischemia in mongrel dogs[J]. Chin Herb Med, 2015, 38(1): 115-8. |
| [4] | 李勇军, 何迅, 刘志宝, 等. 荭草花化学成分的研究[J]. 中国中药杂志, 2009, 34(20): 2613-5. Li Y J, He X, Liu Z B, et al. Chemical constituents of flowers from Polygonum orientale[J]. China J Mater Med, 2009, 34(20): 2613-5. doi:10.3321/j.issn:1001-5302.2009.20.014 |
| [5] | 谢玉敏, 杨武, 陆苑, 等. 荭草花提取物中5种成分在大鼠体内的肠吸收动力学[J]. 中成药, 2016, 38(4): 770-6. Xie Y M, Yang W, Lu Y, et al. Intestine absorption kinetics for five constituents in Polygonum orientale flower extract in rats[J]. Chin Patent Med, 2016, 38(4): 770-6. |
| [6] | 费巧玲, 王建, 侯睿, 等. 厚朴水提物在Caco-2细胞模型中转运特征研究[J]. 中草药, 2016, 47(13): 2313-8. Fei Q L, Wang J, Hou R, et al. Transport research on water extract from Magnoliae Officinalis cortex across Caco-2 monolayer model[J]. Chin Tradit Herb Drugs, 2016, 47(13): 2313-8. doi:10.7501/j.issn.0253-2670.2016.13.018 |
| [7] | 胡婷婷, 黄成, 孟晓明, 等. 8-异丙胺亚甲基橙皮素(IPHP)在Caco-2细胞模型上跨膜转运的研究[J]. 中国药理学通报, 2015, 31(6): 769-74. Hu T T, Huang C, Meng X M. Transportation of 8-isopropylaminomethyl hesperitin(IPHP) across human intestional epithelial by using Caco-2 cells[J]. Chin Pharmacol Bull, 2015, 31(6): 769-74. |
| [8] | 候佳, 胡建春, 李月婷, 等. 辛芍提取物中5种主要成分在Caco-2细胞的吸收特性[J]. 中国中药杂志, 2016, 41(11): 2137-43. Hou J, Hu J C, Li Y T, et al. Absorption characteristics of 5 components of Xinshao extract in Caco-2 cells[J]. China J Mater Med, 2016, 41(11): 2137-43. |
| [9] | 胡杰, 侯佳, 李月婷, 等. 灯盏细辛提取物中3种活性成分在Caco-2细胞模型吸收机制的研究[J]. 中国药理学通报, 2016, 32(3): 373-7. Hu J, Hou J, Li Y T, et al. In vitro absorption mechanism of Erigeron breviscapus extract in Caco-2 cell monolayer model[J]. Chin Pharmacol Bull, 2016, 32(3): 373-7. |
| [10] | 兰燕宇, 刘跃, 曹旭, 等. 杜仲提取物中4种主要成分在Caco-2细胞的摄取特性研究[J]. 中国药理学通报, 2014, 30(9): 1306-11. Lan Y Y, Liu Y, Cao X, et al. Uptake of Eucommia ulmoides extract in Caco-2 cell monolayer[J]. Chin Pharmacol Bull, 2014, 30(9): 1306-11. |
| [11] | 牟永平, 吴刚, 周立社, 等. Caco-2细胞模型在药物研究中的应用[J]. 中国药理学通报, 2005, 21(5): 536-9. Mou Y P, Wu G, Zhou L S, et al. Application of Caco-2 cell model in drug research[J]. Chin Pharmacol Bull, 2005, 21(5): 536-9. |
| [12] | 吴安国, 曾宝, 王春玲, 等. HPLC考察小檗碱和黄连提取物中小檗碱在Caco-2细胞模型的转运[J]. 中国药理学通报, 2011, 27(7): 1007-11. Wu A G, Zeng B, Wang C L, et al. Transport of berberine as single compound and berberine in extract in Caco-2 cell model[J]. Chin Pharmacol Bull, 2011, 27(7): 1007-11. |