

2. 四川省眉山市心脑血管病医院药剂科,四川 眉山 620020
2. Dept of Pharmacy, Meishan Cardiovascular and Cerebrovascular Hospital, Meishan Sichuan 620020, China
吴茱萸碱(evodiamine, EDM)主要是从传统中药吴茱萸的成熟果实中提取获得,具有抗癌、减肥、镇痛、抗炎等众多药理功效的一种吲哚喹啉类生物碱[1-2]。据相关研究报道显示,EDM具有广谱的抑癌活性,尤其用于小细胞肺癌的治疗[3-4]。但由于EDM的水溶性极差、生物利用度极低的缺点[5],大大地限制了它在临床上的广泛应用。
大量研究证实,对前体药物进行结构修饰,是改善其理化性质的有效方法之一[6]。本文通过对EDM进行结构修饰,在N13位引入丁酰基,合成了水溶性更强的吴茱萸碱丁酰衍生物(evodiamine butyryl derivative, EBD)。本课题组前期体内外研究证实,EBD具有明显的抗肿瘤作用,但EBD对提高EDM的口服生物利用度有限。固体脂质纳米粒(solid lipid nanoparticles, SLN)是一种新型纳米递药系统,具有磷脂双分子层结构,能提高药物的口服生物利用度,降低毒副作用,尤其适用于难溶性抗肿瘤药物的靶向治疗[7]。所以,本研究对EDM进行结构修饰合成EBD(Fig 1)后,进一步制备了吴茱萸碱丁酰衍生物固体脂质纳米粒(evodiamine butyryl derivative-loaded solid lipid nanoparticles, EBDLN),通过结合结构修饰和纳米制剂的优势,最大限度地提高EDM的生物利用度。本文研究了EBDLN的体外释放和在体胃肠吸收过程,有助于EDM在临床的广泛应用。

|
| Fig 1 Chemical structural formulas of EDM and EBD |
SD大鼠,♂,体质量(250±20)g,由重庆医科大学实验动物中心提供,许可证号:SCXK渝2017-0001。
1.2 药品与试剂EDM(纯度>99%,武汉远城科技发展有限公司);单硬脂酸甘油酯(成都科龙化工试剂厂);注射用大豆卵磷脂(上海太伟药业有限公司);葡聚糖凝胶G-50型层析柱(中国医药上海化学试剂公司),其余试剂为分析纯。
1.3 仪器Agilent1100液相色谱仪(美国Agilent公司);RE-2000型旋转蒸发仪(上海亚荣有限公司);ZS90型激光粒度电位仪(英国马尔文公司)。
2 方法 2.1 EBD的制备采用一步合成法制备了EBD[8]。取适量EDM溶于15 mL N, N-二甲基甲酰胺(DMF)中,搅拌溶解后,加入少量氢化钠并搅拌0.5 h。滴加0.35 mL正丁酰氯,再缓慢升温至80℃,反应24 h后,在室温下往反应液中加入20 mL水,依次经过萃取、洗涤、干燥、过滤后,将滤液浓缩,用色谱柱分离并旋干溶剂,即得结晶状EBD淡黄色固体。
2.2 EBDLN的制备采用薄膜分散法制备EBDLN。称取适量EBD、单硬脂酸甘油酯以及卵磷脂于适量无水乙醇中,充分溶解后除去溶剂,形成均匀分布的薄膜。加入均匀分散至二次蒸馏水中的吐温-80溶液,超声至薄膜完全脱落并溶解,即得乳白色EBDLN混悬液。
2.3 粒径和Zeta电位的测定取0.4 mL的EBDLN,用超纯水稀释至4 mL,混匀并经0.45 μm滤膜过滤后,立即用马尔文激光粒度电位仪测定。
2.4 包封率和载药量的测定采用凝胶柱层析法测定EBDLN的包封率和载药量。将溶胀好的葡聚糖凝胶G-50装入直径1 cm高度为30 cm的玻璃柱,静置3 h。吸取EBDLN混悬液,过葡聚糖凝胶柱,用20%的乙醇溶液洗脱,收集EBDLN洗脱液,以空白的固体脂质纳米粒作为对照,按照“2.7.2”项下条件,采用HPLC法测定峰面积,计算EBDLN中包封EBD的含量(M1)。吸取等量未过层析柱的EBDLN混悬液,用无水乙醇稀释至相同倍数,按照“2.7.2”项下条件,采用HPLC法测定峰面积,计算EBDLN混悬液中EBD的总含量(M2)。做3次平行实验,且计算制备EBDLN所需材料的总量(M0),按以下公式计算包封率(EE%)和载药量(LE%)。
EE%=M1/M2×100%;LE%=M1/M0×100%。
2.5 体外释放实验采用动态透析法考察EBD和EBDLN在两种介质中的体外释药特征。分别以pH 1.20的HCl溶液和pH 6.80的PBS做为释放介质,将分别装有等量相同浓度EBD和EBDLN的密闭透析袋投入到上述两种释放介质中,并置于恒温水浴震荡器中搅拌(37℃,100 r·min-1)。分别于1、2、4、6、8、10、12、24、48、72、96、120、148 h取出1 mL释放介质, 同时补充等温、等体积的释放介质。测定取样中EBD和EBDLN的含量,并绘制体外释药曲线。
2.6 在体胃肠吸收实验18只SD ♂大鼠实验前14 h禁食(可饮水),分为3组,每组6只,用水合氯醛将大鼠麻醉并固定。沿大鼠腹中线打开腹部,在胃贲门处小心切合适长度并结扎,再将胃内容物用人工胃液清洗除净,用空气排净人工胃液后,从胃切口处注入药物溶液(EDM或EBD或EBDLN),结扎幽门[9]。2 h后收集胃内药液,再用剩余灌流液冲洗,合并流出的液体并定容[9]。依次找到十二指肠、空肠、回肠、结肠,每个肠段量取10 cm,分别在肠段的两端插管并结扎,并将伤口用蘸有生理盐水的脱脂棉覆盖保湿。先用预热的37℃生理盐水以1 mL·min-1流速灌流,以洗净肠内容物,随即用空气排净生理盐水。再用Krebs-Ringer液冲洗管道10 min,空气排净Krebs-Ringer液后,换用预热到37℃的含药循环液(EDM或EBD或EBDLN),灌流液进入肠段后立即计时,以0.2 mL·min-1流速灌流60 min后,用空气排出药液,并用Krebs-Ringer液冲洗管道数次。将灌流后的流出液、冲洗液及剩余灌流液合并后,用Krebs-Ringer液定容至25 mL。用HPLC方法测定EDM或EBD的质量浓度。实验结束后剪下各实验肠段,并测量各肠段长度与内径。药物在各肠段的有效渗透系数Papp和吸收速率常数Ka分别用以下公式计算[10]:Papp= Q·ln(Xin/Xout)/2πrL;Ka = (X0-Xt)/C0t。
2.7 EBD和EBDLN样品分析 2.7.1 样品处理精密量取100 μL经上述操作后得到的样品,加无水乙醇,涡旋,混匀,8 000 r·min-1离心10 min,吸取上清液进行分析测定。
2.7.2 色谱条件的建立色谱柱:Hypersil ODS C18(250 mm×4.6 mm,5 μm);流动相:甲醇-水(80:20),柱温30℃,检测波长为240 nm,流速1.0 mL·min-1,进样量20 μL。
2.7.3 标准曲线的绘制分别精密量取适量EBD溶液,用甲醇稀释,定容得到0.2、0.5、0.8、1.0、1.2、1.5、2.0 mg·L-1的系列浓度的标准溶液。按“2.7.2”的色谱条件进样,记录峰面积并制作标准曲线。
2.7.4 方法学验证分别配制低、中、高(0.8、1.0、1.2 mg·L-1)共3种不同浓度的EBD甲醇溶液,按“2.7.2”的色谱条件进样,计算日内、日间精密度和回收率。
2.8 EDM样品分析参照晏声蕾等[1]的方法,对EDM样品进行处理并分析。
2.9 统计学分析采用SPSS 17.0统计软件分析所有数据,检验方法为配对t检验(α=0.05),数据以x±s表示。
3 结果 3.1 EBDLN的粒径和Zeta电位测得的EBDLN的平均粒径为(245.00±3.50)nm,多分散性指数PDI为(0.24±0.015),Zeta电位为(-27.51±1.35)mV。
3.2 EBDLN的包封率和载药量制备了3批EBDLN,测定得到EBDLN的平均包封率为(86.31±0.32)%,平均载药量为(3.50±0.14)%。
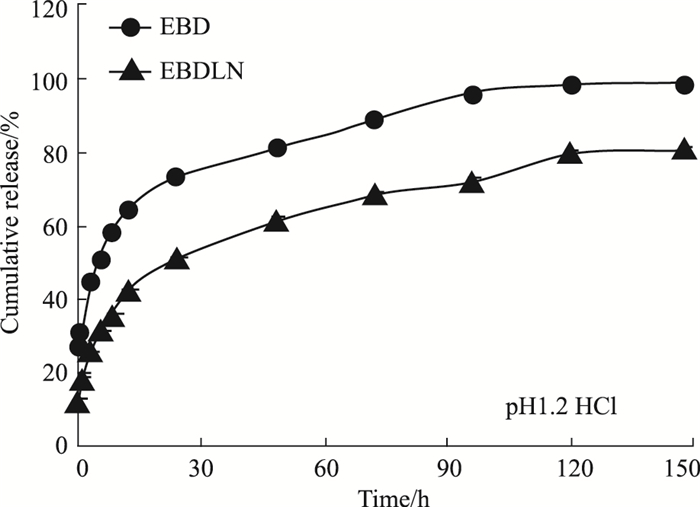
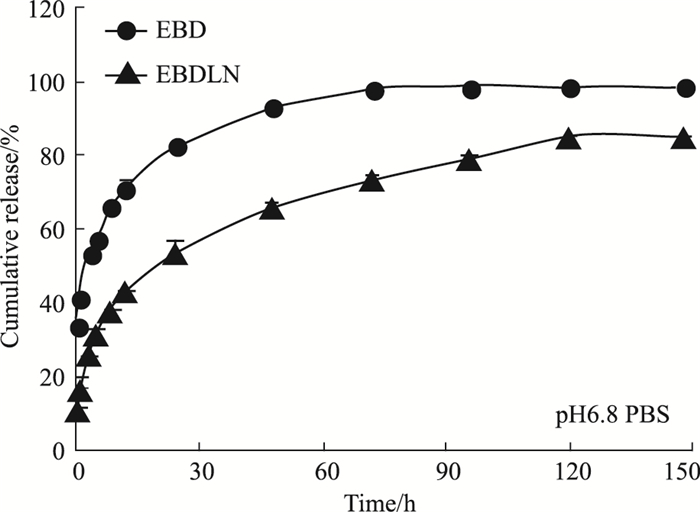
3.3 EBD和EBDLN的体外释放以药物的累积释放率为纵坐标,取样时间为横坐标,绘制体外释放曲线。EBD和EBDLN在同一介质释放时,它们的释药趋势完全一致,但EBD有明显的突释效应,而EBDLN相对于EBD而言其释药速度更慢。这表明EBDLN改变了药物的释放行为,显示出缓释效应。由Fig 2、3曲线可见,在两种释放介质(pH 1.20 HCl和pH 6.80 PBS)中,EBD前60 min的累积释放率分别为(81.26±1.96)%和(92.94±1.68)%,但EBDLN在相应时间段内的累积释放率分别为(61.37±1.31)%和(65.81±1.68)%。且在120 min时,在两种介质中的EBD已基本释放完全,但EBDLN仍有持续释放的迹象。
|
| Fig 2 In vitro release behaviors of free EBD and EBDLN in pH 1.2 HCl |
|
| Fig 3 In vitro release behaviors of free EBD and EBDLN in pH 6.8 PBS |
以EBD的色谱峰面积(A)和它的质量浓度(C)做线性回归,方程为A=897.95 C+10.867 3 (r=0.999 3),EBD浓度在0.2~2.0 mg·L-1的范围内线性良好。日内精密度RSD平均值为0.61%,日间精密度RSD平均值为0.82%,以上结果表明精密度符合分析要求。加样回收率平均值分别为99.72%、100.01%、99.89%,RSD为0.56%、0.43%、0.61%,实验结果表明回收率符合分析要求。
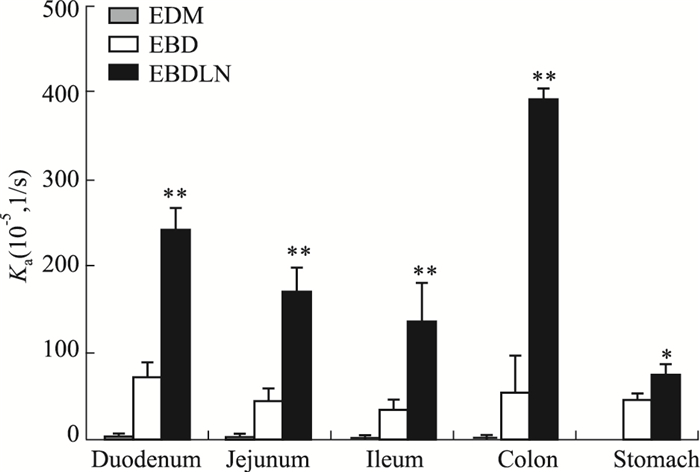
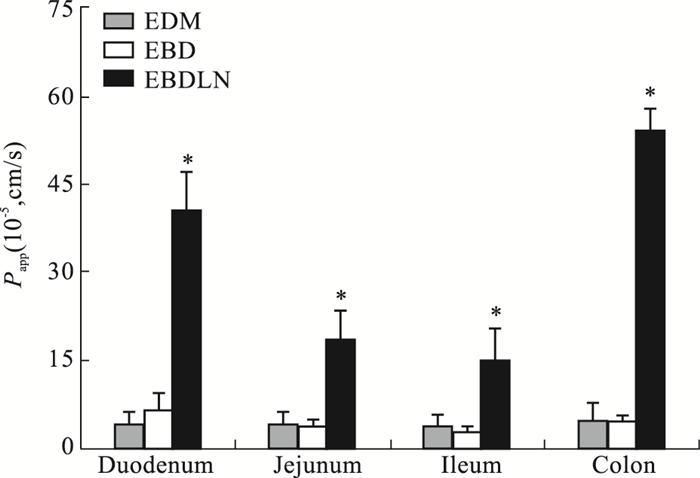
在体胃肠吸收实验结果表明,EBDLN明显增强了EDM和EBD在胃肠道的吸收。Fig 4、5结果显示,EBDLN在各个肠道的Ka值和Papp值均明显大于EDM和EBD。且EBDLN在胃、十二指肠、空肠、回肠、结肠共5个肠段中的Ka值分别为EDM的110.14、56.70、51.23、45.70、127.23倍,EBDLN在十二指肠、空肠、回肠、结肠共4个肠段中的Papp值分别为EDM的9.74、4.48、3.82、11.30倍。经样本配对t检验结果显示,EBDLN与EDM在4个肠段中的在体吸收情况差异具有统计学意义(P < 0.05)。在灌流的所有肠段中,EDM和EBD在十二指肠中表现出的Ka值和Papp值最大,结果表明EDM和EBD在十二指肠中吸收最好,其次为结肠、空肠、回肠,在胃内吸收最差。而EBDLN在结肠中表现出的Ka值和Papp值最大,结果表明EBDLN在结肠中吸收最好,其次为十二指肠、空肠、回肠,在胃内吸收最差。以上结果也充分表明EBDLN、EBD和EDM的吸收部位主要是在小肠段,而在胃内吸收较少。将EDM经结构修饰再经制剂方法制备成EBDLN后,改变了EDM在小肠段的最佳吸收部位,即由药物在十二指肠吸收最佳变为了在结肠吸收最佳。
|
| Fig 4 Absorption rate constant Ka of EBD and EBDLN in individual perfusion segments *P < 0.05, **P < 0.01 vs EDM |
|
| Fig 5 Apparent permeability coefficient Papp of EBD and EBDLN in individual perfusion segments *P < 0.05 vs EDM |
EDM具有低水溶性和低渗透性[5],导致胃肠吸收不佳,所以口服生物利用度极低。本文结合结构修饰和纳米制剂的优势,通过EDM合成EBD,并制备成了EBDLN,结果显示明显提高了药物的溶解性和渗透性,提高了EDM在吸收部位的渗透能力,以此达到增加口服生物利用度的目的。
SLN能将难溶性药物吸附或加载于脂质内核中,使其均匀分散在该纳米载体中,以达到增溶目的,形成粒径范围较宽的固体纳米给药体系,且生物机体能较好地容纳SLN,暂未见明显不良反应的报道[11]。与其他SLN的制备方法相比,薄膜超声法具有操作简单、快速可靠、包封率高,且辅料用量低的优点[12],因此,本文采用薄膜超声法来制备EBDLN。由粒径和粒径分布结果可知,应用此法制备得到的纳米粒子粒径较小,且大小分布均匀(PDI < 0.50),并能稳定存在,有效保证了抗癌的靶向性能,同时也能实现较高的药物包封率。由累积释放率结果可知,释放介质pH 6.80 PBS比pH 1.20 HCl更有利于EBD的释放,推测pH会影响药物的释放行为,且较大的pH环境可能有利于药物的释放。
EBDLN与晏声蕾等[1]制备的吴茱萸碱油包水型复合纳米乳WECNE的在体胃肠吸收情况相比较显示,EBDLN在各个肠道的Ka值和Papp值均明显大于WECNE。且EBDLN在胃、十二指肠、空肠、回肠、结肠共5个肠段中的Ka值分别为WECNE的72.38、19.86、13.51、11.48、35.18倍,EBDLN在十二指肠、空肠、结肠的Papp值分别为WECNE的1.56、1.02、1.51倍。EBDLN与晏声蕾等[13]制备的吴茱萸碱水包油型复合纳米乳OECNE的在体胃肠吸收情况相比较显示, EBDLN在各个肠道的Ka值和Papp值均明显大于OECNE。且EBDLN在胃、十二指肠、空肠、回肠、结肠共5个肠段中的Ka值分别为OECNE的47.50、20.67、15.23、11.05、46.45倍,EBDLN在十二指肠、空肠、结肠的Papp值分别为OECNE的2.09、1.20、3.09倍。以上结果说明EBDLN增强EDM的在体肠吸收能力远远大于WECNE[1]和OECNE[13]。EBDLN分别与胡江波等[14]制备的复方吴茱萸碱纳米乳和张雪等[15]制备的吴茱萸碱羟丙基-β-环糊精包合物相比较结果显示,EBDLN的Ka值和Papp值明显高于以上两个制剂,这也说明了在目前所能查到的所有关于EDM制剂的文献报道中,EBDLN在各肠段的在体吸收能力是最强的。
EBDLN表现出的高在体吸收能力的原因推测与以下几个因素有关:① EBD与EDM在化学结构上的差异。EBD比EDM多1个丁酰基团,从而使EBD整个分子的极性增大,这有助于化学药物水溶性的提高;②通过纳米制剂的技术,将EBD包载进入SLN后,由于纳米制剂的优越性能和所用各辅料的作用,如强脂溶性的单硬脂酸甘油酯和注射用大豆卵磷脂作为油相,且单硬脂酸甘油酯是非离子型的表面活性剂,在EBDLN这个制剂中作为乳化剂,使水相和油相能充分混合,形成完全均匀分散的乳浊液,进一步增强EBD的渗透性,使EBD更容易被肠道上皮细胞所吸收,且保持EBDLN的相对稳定性。
综上所述,本实验首次制备了EBDLN,并研究了它的体外释放和在体胃肠道吸收特征。研究发现EBDLN具有缓慢释药的特点,且明显提高了EDM和EBD在胃肠道的吸收,这有助于推广EDM在临床的使用。
( 致谢: 本实验在重庆医科大学药学院重庆高校药物工程研究中心完成,在此真诚感谢实验室的所有老师和同学。)
| [1] | 晏声蕾, 胡江波, 王薛, 等. 吴茱萸碱油包水型复合纳米乳的药代动力学和在体肠吸收[J]. 第二军医大学学报, 2017, 38(2): 249-52. Yan S L, Hu J B, Wang X, et al. Pharmacokinetics and in situ intestinal absorption of evodiamine eomplex water-in-oil nanoemulation[J]. Acad J Second Mil Med Univ, 2017, 38(2): 249-52. |
| [2] | 石海莲, 郑沁乐, 吴大正. 吴茱萸碱对肥胖并发血管肥厚的作用研究[J]. 中国药理学通报, 2011, 27(12): 1687-92. Shi H L, Zheng Q L, Wu D Z. The preventive effect of evodiamine on vascular hypertrophy in obese rats[J]. Chin Pharmacol Bull, 2011, 27(12): 1687-92. doi:10.3969/j.issn.1001-1978.2011.12.014 |
| [3] | Mohan V, Agarwal R, Singh R P. A novel alkaloid, evodiamine causes nuclear localization of cytochrome-C and induces apoptosis independent of p53 in human lung cancer cells[J]. Biochem Biophys Res Commun, 2016, 477(4): 1065-71. doi:10.1016/j.bbrc.2016.07.037 |
| [4] | Jiang J, Hu C. Evodiamine: a novel anti-cancer alkaloid from Evodia rutaecarpa[J]. Molecules, 2009, 14(5): 1852-9. doi:10.3390/molecules14051852 |
| [5] | Shyr M, Lin L, Lin T, et al. Determination and pharmacokinetics of evodiamine in the plasma and feces of conscious rats[J]. Anal Chim Acta, 2006, 558(1): 16-21. |
| [6] | Xu L, Zhang Y, Dai W, et al. Design, synthesis and SAR study of novel trisubstituted pyrimidine amide derivatives as CCR4 antagonists[J]. Molecules, 2014, 19(3): 3539-51. doi:10.3390/molecules19033539 |
| [7] | Kharaji M H, Doroud D, Taheri T, et al. Drug targeting to macrophages with solid lipid nanoparticles harboring paromomycin: an in vitro evaluation against L. major and L. tropica.[J]. AAPS PharmSciTech, 2016, 17(5): 1110-9. doi:10.1208/s12249-015-0439-1 |
| [8] | 万坤. 吴茱萸碱衍生物EVB的合成及其纳米粒的初步评价[D]. 重庆: 重庆医科大学, 2014. Wan K. The synthesis of evodiamine derivative and preliminary evaluation of EVB loaded with nanoparticles[D]. Chongqing: Medical University of Chongqing, 2014. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y2690774 |
| [9] | 袁誉铭, 陈学梁, 陈静, 等. 溴吡斯的明新型纳米乳体外释放和大鼠在体胃肠吸收[J]. 中国药理学通报, 2017, 33(2): 276-9. Yuan Y M, Chen X L, Chen J, et al. In vivo release and gastrointestinal absorption of novel pyridostigmine bromide nanoemulsion[J]. Chin Pharmacol Bull, 2017, 33(2): 276-9. |
| [10] | Shen Q, Li X, Li W, et al. Enhanced intestinal absorption of daidzein by borneol/menthol eutectic mixture and microemulsion[J]. AAPS PharmSciTech, 2011, 12(4): 1044-9. doi:10.1208/s12249-011-9672-4 |
| [11] | Muller R H, Mader K, Gohla S. Solid lipid nanoparticles(SLN) for controlled drug delivery—a review of the state of the art[J]. Eur J Pharm Biopharm, 2000, 50(1): 161-77. doi:10.1016/S0939-6411(00)00087-4 |
| [12] | 琚辉, 郝存江, 尹飞, 等. 姜黄素固体脂质纳米粒的制备及表征[J]. 药物评价研究, 2010, 33(6): 420-6. Ju H, Hao C J, Yin F, et al. Preparation and characterization of curcumin solid lipid nanoparticles[J]. Drug Eval Res, 2010, 33(6): 420-6. |
| [13] | 晏声蕾, 胡江波, 王薛, 等. 吴茱萸碱水包油型复合纳米乳的体外释放和在体吸收研究[J]. 重庆医科大学学报, 2018, 43(1): 135-8. Yan S L, Hu J B, Wang X, et al. Release profile and intestinal absorption of evodiamine complex oil-in-water nanoemulation[J]. J Chongqing Med Univ, 2018, 43(1): 135-8. |
| [14] | 胡江波, 何丹, 吴建勇, 等. 复方吴茱萸碱纳米乳的体外释放和大鼠在体肠吸收的研究[J]. 华西药学杂志, 2015, 30(4): 405-7. Hu J B, He D, Wu J Y, et al. Study on drug release in vitro and intestinal absorption of evodiamine nanoemulsion in the rats[J]. West China J Pharm Sci, 2015, 30(4): 405-7. |
| [15] | 张雪, 刘宏明, 雷婷婷, 等. 吴茱萸碱羟丙基-β-环糊精包合物大鼠在体肠吸收特征[J]. 第二军医大学学报, 2016, 37(11): 1387-91. Zhang X, Liu H M, Lei T T, et al. Intestinal absorption characteristics of evodiamine hydroxypropyl-β-cyclodextrin inclusion complex in rats[J]. Acad J Second Mil Med Univ, 2016, 37(11): 1387-91. |

