


2. 潍坊医学院 药学院,山东 潍坊 261053
 ,
ZHANG Long-xiang2,
LI Xiao-cheng1,
JIANG Bin1,
ZOU Si-yi1,
WANG Chen1,
MOU Wen-qing1,
LIAN Bo1,
WU Jing-liang1,
YU Wen-jing1
,
ZHANG Long-xiang2,
LI Xiao-cheng1,
JIANG Bin1,
ZOU Si-yi1,
WANG Chen1,
MOU Wen-qing1,
LIAN Bo1,
WU Jing-liang1,
YU Wen-jing1
 ,
GAO Zhi-qin1
,
GAO Zhi-qin1

2. School of Pharmacy, Weifang Medical University, Weifang Shandong 261053, China
肝细胞癌(hepatocellular carcinoma, HCC)是常见的恶性肿瘤之一[1-3],其发病率和死亡率呈逐年上升趋势,已成为仅次于胃癌和食道癌的第3大常见恶性肿瘤。目前,肿瘤分子靶向治疗与激素治疗、免疫治疗和细胞毒化疗药治疗,共同构成了现代肿瘤药物治疗的主要治疗手段。已上市的抗肿瘤药物虽然繁多,但是普遍存在选择性低、对正常组织毒副作用大、易产生耐药等缺点。对于一些多功能高分子聚合材料的设计,例如靶向给药系统(targeting drug delivery system, TDDS)已经成为目前研究的一大热点,这种纳米靶向给药系统与传统的游离分子给药相比,具有靶向性、病变组织药物的富集、提高药效、降低毒副反应等多种优势[4],为肿瘤分子靶向治疗的难题提供了解决的途径。
透明质酸(hyaluronic acid, HA)是一种由D-N-乙酰氨基葡萄糖和D-葡萄糖醛酸组成的双糖重复单元的酸性黏多糖[5],因其具有高度亲水性和靶向性,被广泛认为是一种具有前瞻性的纳米粒组成成分[6]。HA存在于大多数人体组织的细胞外基质和关节滑液中,具有良好的生物相容性、生物可降解性和生物低毒性[6],被广泛应用于生物医学方面。HA能与细胞表面CD44受体相结合[7-8],因此,广泛应用于抗癌药物治疗。目前,HA作为载体材料,与多柔比星[9]、紫杉醇[10-11]、丁酸和丝裂霉素C等抗癌药物结合,有很好的抗癌效果。
甘草次酸(glycyrrhetinic acid, GA)是五环三萜类化合物[12-13],为甘草根部的主要成分,无毒且廉价,在传统中药处方中的应用极其广泛。由于肝实质细胞表面存在大量的GA受体,使GA具有良好的肝组织分布特征,作为一种肝靶向小分子化学载体被广泛研究。在该实验中,将疏水基团GA连接到HA纳米骨架中得到双亲性聚合物GA-HA,在水溶液中自组装成纳米粒,包载脂溶性药物。
腺嘌呤(adenine, Ade)是核苷酸的碱性基团,其磷酸盐有刺激白细胞增生的作用,用于防治各种原因引起的白细胞减少症,特别是由于肿瘤化疗、放射治疗等所造成的白细胞减少症。经研究发现,Ade通过干扰核酸代谢的方式,阻止肿瘤细胞分裂和增殖,是临床用于升白细胞的药物,也可以抑制人肝癌细胞的增殖,并在一定程度上呈浓度与时间依赖性。但是,Ade不溶于水,且在体内代谢非常迅速,并且有肾毒性,也不适合口服和注射,因此在该实验中,将其包载进纳米粒疏水内核中,延长体内循环时间,蓄积于靶部位,提高药物治疗效果。
1 材料 1.1 细胞株与试剂人肝癌Bel-7402细胞购自武汉大学生命典藏中心。低分子透明质酸钠(华熙福瑞达生物医药有限公司,0.89×106 u,批号1604025);4-(4, 6-二甲氧基三嗪)-4-甲基吗啉盐酸盐(DMT-MM,上海共价化学科技有限公司);3-(4, 5-二甲基噻唑-2)-2, 5-二苯基四氮唑溴盐(MTT,北京索莱宝科技有限公司,批号1212U0518);RPMI 1640培养基(美国HyClone公司,批号AC10205751);胎牛血清(ExCell Bio公司,批号113E340);透析袋MD25(MWCO:3500,北京索莱宝科技有限公司,批号605A0201);其他试剂均为分析纯。
1.2 仪器DF-101S集热式恒温加热磁力搅拌器(巩义市予华仪器有限责任公司);Mercury-plus400核磁共振仪(美国Varian公司);Malvern Zetasizer Nano ZS 90激光粒度仪(英国Malvern公司);JEM1400透射电子显微镜(日本Jeol公司);TU-1810紫外/可见分光光度计(北京普析通用仪器有限责任公司);CHRIST冻干机(北京五洲东方科技发展有限公司);
2 方法 2.1 GA-HA、Ade/GA-HA纳米粒的制备 2.1.1 GA-HA纳米粒的制备 2.1.1.1 GA的活化将1.41 g GA与0.967 g DMT-MM在30 mL甲醇中室温搅拌1 h,TLC检测完全生成GA-ES,旋蒸,将所得固体缓慢加入30 mL乙二胺中室温搅拌反应过夜,TLC检测反应完毕后,柱层析获得纯净GA-NH2产物(Fig 1)。
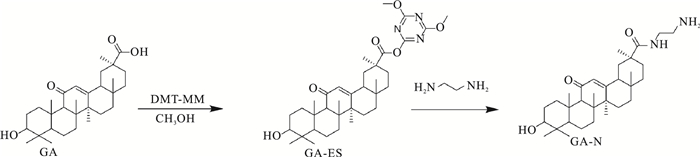
|
| Fig 1 Synthesis scheme of GA-NH2 |
向盛有10 mL蒸馏水的小玻璃瓶中加入60 mg(分子质量为0.89 × 106 u)HA,室温下磁力搅拌器搅拌至溶解,在溶解的HA溶液中加入GA-NH2 8.43 mg,同时滴加适量的无水乙醇,搅拌2 h,至澄清的浅黄色溶解液。向溶解液中加入DMT-MM缩合剂,室温搅拌过夜。TLC(乙酸乙酯:甲醇=2:1)检测反应情况(Fig 2)。将反应液装入经过预处理的透析袋中,使用2 L蒸馏水透析,将透析后溶液冷冻干燥,即得理论取代度为10% GA-HA纳米粒冻干品。
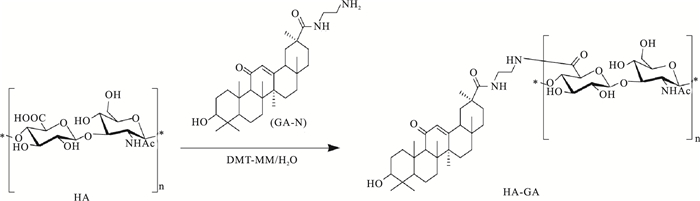
|
| Fig 2 Synthesis scheme of GA-HA nanoparticles |
精确称取GA-HA冻干品,溶于甲酰胺溶液中,配制成浓度为10 g·L-1的溶液;称取Ade溶于1, 2-丙二醇溶液中,配制成浓度为15 g·L-1的溶液。将上述两种溶液以3:1的体积比混合,室温搅拌过夜,然后将其装入经过预处理的透析袋中,用2 L蒸馏水透析,探头超声分散15 min,最后冷冻干燥制得Ade/GA-HA纳米粒。
2.2 纳米粒的表征 2.2.1 核磁共振表征、紫外/可见分光光度吸收分析精确称取样品HA、GA-HA、GA、GA-NH2分别溶解于D2O和CD3Cl中,浓度为30 g·L-1,用核磁共振仪分析样品的结构特征,得到各样品的核磁共振图谱;将GA-NH2、HA、GA-HA纳米粒分别溶解成一定浓度,利用紫外/可见分光光度计对这3种物质在190~500 nm波长范围内进行光度扫描。
2.2.2 GA取代度计算精确称取GA-HA冻干品,溶解于蒸馏水中,配制成终浓度为1 g·L-1的溶液。紫外/可见分光光度计测定GA-HA纳米粒溶液在260 nm波长处的吸光度值,利用GA的标准曲线计算GA-HA纳米粒中GA的含量,计算GA取代度。
2.2.3 纳米粒粒径、Zeta电位、粒度稳定性检测精确称取GA-HA、Ade/GA-HA冻干品,溶解成终浓度为1 g·L-1的水溶液,探头超声15 min,用0.22 μm微孔滤膜过滤,利用激光粒度仪检测纳米粒的粒径、Zeta电位。重复上述步骤,将制备好的1 g·L-1 GA-HA溶液37℃静置1周,利用激光粒度仪检测不同溶解时间下样品的粒径大小,检测GA-HA纳米粒粒度稳定性。
2.2.4 纳米粒形态学分析称取适量GA-HA、Ade/GA-HA冻干品,用蒸馏水稀释一定倍数,取1滴于专用铜网上,静置2 min后,用配制好的磷钨酸染色,自然晾干,用透射电子显微镜观察纳米粒的外观形态。
2.2.5 Ade/GA-HA纳米粒的载药量和包封率测定将载药纳米粒溶于1 mol·L-1 HCl中,用紫外/可见分光光度计测定300 nm波长处的吸光度值,利用Ade标准曲线计算出Ade的含量,计算出载药纳米粒的载药量;利用高效液相色谱仪绘制Ade标准曲线,并采用超速离心法,计算出包封率。
2.2.6 Ade/GA-HA纳米粒的体外释放分析取Ade/GA-HA冻干品溶于5 mL PBS,装在透析袋中,置于含50 mL PBS的锥形瓶中,在(37±1)℃、100 r·min-1条件下振荡释放,间隔一定时间取3 mL透析液,同时补充等量、等温PBS,于260 nm波长处检测吸光度值,计算累积释放百分率,并以时间为横坐标,累积释放百分率为纵坐标,绘制体外释放曲线。
2.2.7 Ade/GA-HA纳米粒的细胞毒性分析取指数生长期的Bel-7402细胞接种于96孔板中,于37℃、5% CO2恒温培养箱孵育过夜,待细胞贴壁后,将Ade、GA-HA、Ade/GA-HA用培养基稀释成一系列浓度,每孔加样100 μL,设置5个复孔,于恒温培养箱继续孵育24、48、72 h。在每孔中加入10 μL MTT溶液,继续孵育4 h后,弃上清,每孔加入150 μL DMSO,摇床震荡10 min后,置于酶标仪测定OD值,计算细胞抑制率。
2.3 统计学处理应用SPSS 17.0统计软件处理数据,实验数据用x±s表示,图表使用GraphPad Prism 5软件完成。
3 结果 3.1 核磁共振、紫外吸收表征GA-NH2使用了质谱和核磁表征,与文献比对无误(Fig 3A)。1H-NMR、紫外/可见吸收光谱证实GA-HA纳米粒已成功制备。1H-NMR结果表明,与HA的1H-NMR相比,GA在1.1~1.6 ppm处有特征性吸收峰(对应GA的甲基基团),出现在GA-HA的1H-NMR图谱中,证实GA-HA纳米粒制备成功(Fig 3B)。紫外/可见吸收光谱图结果表明,在256 nm波长处,GA-HA纳米粒的紫外/可见吸收光谱图中出现GA-NH2特征吸收峰(Fig 3C)。
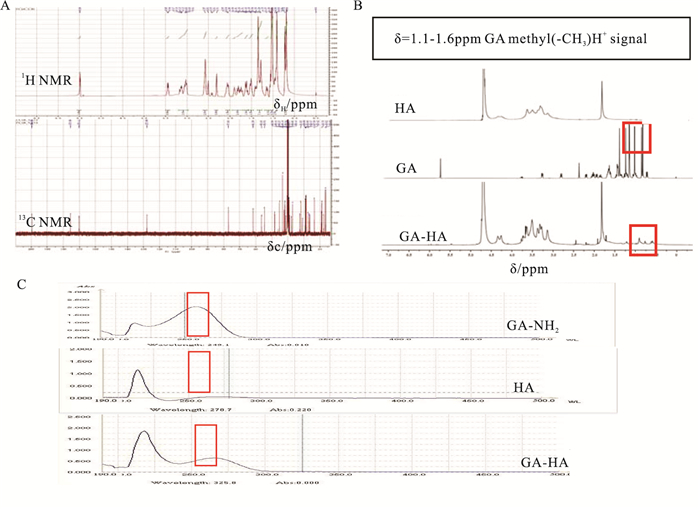
|
| Fig 3 Nuclear magnetic resonance (NMR) and UV-Vis absorption spectra A: 1H NMR and 13C NMR spectra of GA-NH2; B: 1H NMR spectra; C: The UV-Vis absorption spectra of HA, GA and GA-HA. |
利用GA在260 nm波长处的标准曲线(Y=15.45X+0.281 8,R2=0.999 5),计算出GA-HA纳米粒中GA的取代度为(3.80±1.26)%(Tab 1)。
| Sample | DLS/nm | PDI | Zeta potential/mV | DS/% |
| GA-HA | 398.10±41.09 | 0.231±0.018 | -34.20±3.04 | 3.80±1.26 |
| Ade/GA-HA | 176.52±7.98 | 0.269±0.029 | - | - |
检测结果表明,GA-HA平均粒径为(398.10±41.09) nm,PDI为(0.231±0.018),Zeta电位值为(-34.20±3.04) mV,呈负电,主要是由于纳米粒表面HA电离的羧基基团引起的,且电位值较大,说明纳米粒子间的静电斥力较大,物理稳定性较好;纳米粒包载模型药物Ade后,平均粒径为(176.52±7.98) nm,PDI为(0.269±0.029),粒径减小(Tab 1)。GA-HA纳米粒室温放置1周,粒度基本无变化,说明在水溶液中具有良好的热力学稳定性(Fig 4)。
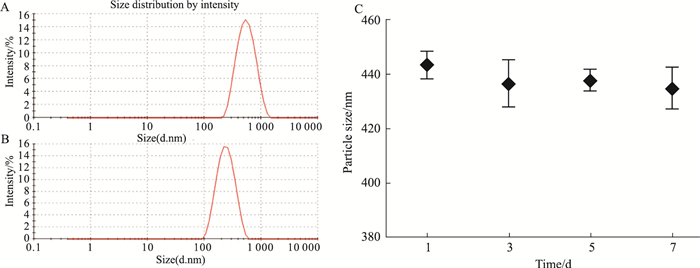
|
| Fig 4 Particle size measured by Malvern laser particle size analyzer Size distribution of GA-HA (A) and Ade/GA-HA (B); C: The stability of GA-HA nanoparticles at various incubation time(n=3). |
透射电镜观察结果表明,纳米粒分散良好,外观呈规则球形,粒子大小均一,与粒度分布图(Fig 4)相比,TEM观察到的纳米粒粒径小于DLS检测出的粒径,这是由于二者的样本制备技术不同,DLS检测结果是在溶液状态下所得,TEM图像是在样品干燥后所得,这时候纳米粒的亲水外壳会收缩(Fig 5)。

|
| Fig 5 Transmission electron microscopy of nanoparticles(×200 000) A: GA-HA; B: Ade/GA-HA |
紫外/可见分光光度法得出Ade在纳米粒中的载药量为(22.5 ± 5.8)%;根据Ade标准曲线(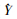
|
| Fig 6 The standard curve of adenine (HLPC) |
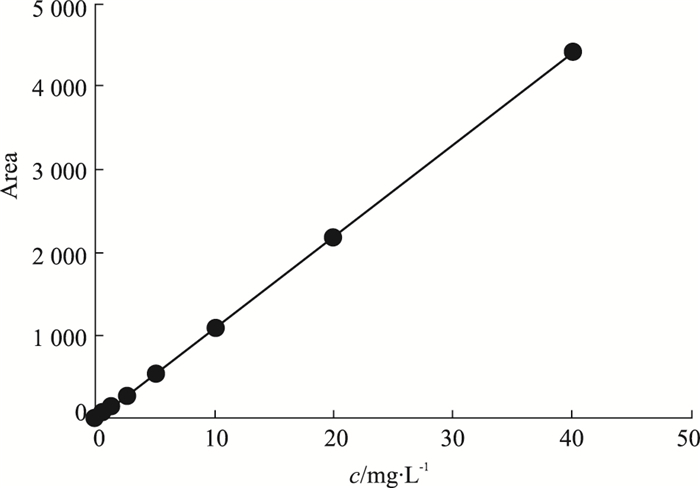
体外释放曲线表明,在前4 h内,Ade/GA-HA纳米粒存在突释现象,Ade的释放速度较快,累积释放率增加;4 h后,Ade/GA-HA纳米粒的累积释放曲线变得逐渐平稳,趋于零级释放,表现出缓释特性(Fig 7)。
|
| Fig 7 In vitro release curve of Ade/GA-HA nanoparticles |
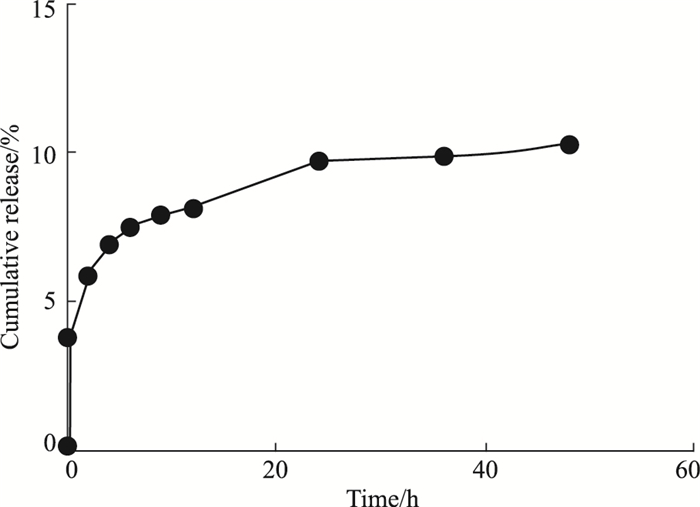
细胞毒性结果表明,空白GA-HA纳米粒对人肝癌Bel-7402细胞的抑制率在20%以下,远远低于Ade/GA-HA纳米粒和Ade组,表明空白GA-HA纳米粒对Bel-7402细胞未见明显毒性作用;而Ade/GA-HA纳米粒和Ade组对Bel-7402细胞的抑制率较高,且随着时间的延长和浓度的增加,均逐渐升高,表明载药纳米粒和Ade对Bel-7402细胞有抑制作用;且在相同的浓度和孵育时间下,Ade/GA-HA纳米粒组对Bel-7402细胞的抑制率均明显高于Ade组,差异有统计学意义(P < 0.05),表明载药纳米粒对人肝癌Bel-7402细胞的增殖有明显的抑制作用,且抑制作用最强(Fig 8)。
|
| Fig 8 The proliferatory effect of Bel-7402 cells treated with nanoparticles *P < 0.05, **P < 0.01 vs Ade group |
近年来,肝靶向给药系统的研究受到广泛关注。目前,受体介导的肝靶向给药系统的研究主要是设计与合成适合的药物载体,并将肝靶向配体与之结合,以期实现肝靶向给药的作用。由于肝实质细胞表面含丰富的半乳糖苷,因此,过去研究大多以抗体、半乳糖化合物为配体,以实现将药物靶向输送至肝脏。但是,大多数抗体是鼠源性的,存在生物安全性和生物相容性问题,而且抗体成本高,不经济。1991年,Negishi等[14]发现,鼠肝实质细胞表面存在大量GA结合位点,这些位点具有高度特异性。随后的一些研究结果表明,GA修饰的高分子载体材料具有肝靶向性[12-13]。研究发现,GA分子结构中的活性基团A环3-OH和E环30-COOH引入合适基团后,GA的抗炎、抗肿瘤、抗病毒活性均提高,且表现出良好的肝靶向性[15]。在本实验中,活化GA的E环30-COOH,以乙二胺作为连接臂结合到HA上,制备出水溶液中自组装双亲性共聚物。
双亲性共聚物GA-HA纳米粒中,GA作为疏水基团形成疏水内核,HA作为亲水链伸展在外侧形成纳米粒基本骨架,脂溶性药物Ade因疏水作用力而包裹于GA-HA纳米粒的疏水内核中,提高了Ade在纳米粒中的包封率和载药量。体外释放实验结果证明,GA-HA纳米粒能够延缓药物释放,最大限度延长药物浓度的有效作用时间,提高疗效。众所周知,肿瘤微环境pH值低于正常组织液,而GA-HA纳米粒中含有大量的酰胺键,在酸性环境中,酰胺键水解导致GA-HA纳米粒骨架结构破坏,使药物加快释放,我们有理由认为GA-HA纳米粒选择性地在肿瘤组织中释放药物,减少对正常组织的损害。
GA修饰的HA纳米粒对肝细胞的毒性较小,表明实验制备的GA-HA纳米粒靶向药物载体在一定程度上能应用于生物领域,这正是由于我们选择的高分子聚合纳米材料HA具有良好的生物学特性。与游离Ade相比,甘草次酸修饰的HA纳米粒包载的Ade对肝癌细胞的增殖有明显的抑制作用,说明经过甘草次酸修饰的HA纳米粒能延长药物作用时间,增强对肝癌组织的靶向作用,从而提高药物作用疗效。据研究,甘草次酸所表现出的靶向性可能是由于少部分甘草次酸存在于在纳米粒表面造成的,且甘草次酸也具有抗菌、抗病毒和抗肿瘤的作用。在实验过程中,发现Ade对人肝癌Bel-7402细胞的增殖具有抑制作用,且有时间和浓度依赖性,但是其抑制肝癌细胞增殖的发生机制尚未清楚,接下来我们将从分子生物学和动物学方面做进一步的研究。
( 致谢: 本实验在山东省高校“十三五”重点实验室——生物药物实验室完成,感谢中国海洋大学江涛教授对实验的技术支持,感谢秦进、崔德轩同学在实验过程中的帮助。)
| [1] | 朱磊, 沈维干, 许正新. 杨梅素对肝癌SMMC-7721细胞迁移及侵袭影响的研究[J]. 中国药理学通报, 2017, 33(6): 823-9. Zhu L, Shen W G, Xu Z X. Effect of myricetin on migation and invasion of hepatoma SMMC-7721 cells[J]. Chin Pharmacol Bull, 2017, 33(6): 823-9. |
| [2] | 孙嘉玲, 文彬, 孙海涛, 等. miRNAs与肝细胞癌的相关性研究进展[J]. 中国药理学通报, 2017, 33(4): 445-9. Sun J L, Wen B, Sun H T, et al. Research progress of relevance between miRNAs and hepatocellular carcinoma[J]. Chin Pharmacol Bull, 2017, 33(4): 445-9. |
| [3] | Ferlay J, Soerjomataram I, Dikshit R, et al. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012[J]. Int J Cancer, 2015, 136(5): E359-86. doi:10.1002/ijc.29210 |
| [4] | 汪雪峰, LiangTang, 王钧, 等. 纳米药物免疫调节治疗的研究进展[J]. 中国药理学通报, 2017, 33(2): 158-61. Wang X F, Liang T, Wang J, et al. The research progress of nanomedicine for immunomodulation therapy[J]. Chin Pharmacol Bull, 2017, 33(2): 158-61. |
| [5] | 柴文戍, 李颖, 张海林, 等. 灯盏花素对肺纤维化大鼠肺组织中TGF-β1及透明质酸含量的影响[J]. 中国药理学通报, 2010, 26(12): 1613-6. Chai W S, Li Y, Zhang H L, et al. Effect of breviscapine on TGF-β1 and hyaluronic acid of lung tissue in pulmonary fibrosis rats[J]. Chin Pharmacol Bull, 2010, 26(12): 1613-6. |
| [6] | Wang X, Gu X, Wang H, et al. Synthesis, characterization and liver targeting evaluation of self-assembled hyaluronic acid nanoparticles functionalized with glycyrrhetinic acid[J]. Eur J Pharm Sci, 2017, 96: 255-62. doi:10.1016/j.ejps.2016.09.036 |
| [7] | Rodríguez-Rodríguez L, Sancho-Torres I, Mesonero C, et al. The CD44 receptor is a molecular predictor of survival in ovarian cancer[J]. Med Oncol, 2003, 20(3): 255-63. doi:10.1385/MO:20:3 |
| [8] | Gao S, Wang J, Tian R, et al. Construction and evaluation of a targeted hyaluronic acid nanoparticle/photosensitizer complex for cancer photodynamic therapy[J]. ACS Appl Mater Interfaces, 2017, 9(38): 32509-19. doi:10.1021/acsami.7b09331 |
| [9] | Tian Q, Wang X H, Wang W, et al. Self-assembly and liver targeting of sulfated chitosan nanoparticles functionalized with glycyrrhetinic acid[J]. Nanomedicine, 2012, 8(6): 870-9. doi:10.1016/j.nano.2011.11.002 |
| [10] | Wang L, Jia E. Ovarian cancer targeted hyaluronic acid-based nanoparticle system for paclitaxel delivery to overcome drug resistance[J]. Drug Deliv, 2016, 23(5): 1810-7. doi:10.3109/10717544.2015.1101792 |
| [11] | Tran B N, Nguyen H T, Kim J O, et al. Combination of a chemopreventive agent and paclitaxel in CD44-targeted hybrid nanoparticles for breast cancer treatment[J]. Arch Pharm Res, 2017, 40(12): 1420-32. doi:10.1007/s12272-017-0968-0 |
| [12] | Cai Y, Xu Y, Chan H F, et al. Glycyrrhetinic acid mediated drug delivery carriers for hepatocellular carcinoma therapy[J]. Mol Pharm, 2016, 13(3): 699-709. doi:10.1021/acs.molpharmaceut.5b00677 |
| [13] | Lv Y, Li J, Chen H, et al. Glycyrrhetinic acid-functionalized mesoporous silica nanoparticles as hepatocellular carcinoma-targeted drug carrier[J]. Int J Nanomedicine, 2017, 12: 4361-70. doi:10.2147/IJN |
| [14] | Negishi M, Irie A, Nagata N, et al. Specific binding of glycyrrhetinic acid to the rat liver membrane[J]. Biochim Biophys Acta, 1991, 1066(1): 77-82. doi:10.1016/0005-2736(91)90253-5 |
| [15] | 王梦弟, 平欲晖. 肝靶向载体甘草次酸结构修饰及纳米制剂的研究进展[J]. 中南药学, 2016, 14(8): 841-6. Wang M D, Ping Y H. Research progress in structural modification and nano preparation of glycyrrhetinic acid as a liver targeting carrier[J]. Cent South Pharm, 2016, 14(8): 841-6. |