


2. 广西医科大学第一附属医院 结直肠肛门外科,广西 南宁 530021
 ,
XU Cheng-fei2,
LI Wan-ting1,
PAN Xiao-hang2,
HUANG Dao-hang1,
GAN Jia-liang2,
TANG Shuang-yi1
,
XU Cheng-fei2,
LI Wan-ting1,
PAN Xiao-hang2,
HUANG Dao-hang1,
GAN Jia-liang2,
TANG Shuang-yi1

2. Dept of Colorectal and Anal Surgery, the First Affiliated Hospital of Guangxi Medical University, Nanning 530021, China
乳腺癌是导致妇女死亡的主要癌症之一,其中三阴性乳腺癌具有侵袭力强、转移性大、预后不良等生物学特点,三阴性乳腺癌约占所有乳腺癌的15%~20%[1]。全身化疗是治疗三阴乳腺癌的主要方法,但其副作用大,预后并不是很理想。临床上,中药治疗恶性肿瘤已经有了明显的疗效[2]。金雀异黄酮(genistein)化学名称为5, 7, 4′-三羟基异黄酮,是许多中药重要的天然活性成分之一,广泛分布于大豆、三叶草、葛根、染料木(金雀花)、广豆根等豆科植物中,研究表明,金雀异黄酮具有抗癌及其他广泛的药理活性[3]。Phillip等[4]报道,金雀异黄酮能协同组蛋白去乙酰化酶抑制剂,诱导前列腺癌细胞死亡。我们前期研究表明,EGFR/PI3K/Akt通路参与金雀异黄酮诱导乳腺癌MDA-MB-231细胞凋亡的信号传导[5],但细胞凋亡信号传递相当复杂,其中有许多不同通路参与,并互有交叉与对话。本次研究拟进一步探讨NF-κB和MAPK通路是否参与乳腺癌MDA-MB-231细胞凋亡的信号传导。
1 材料与方法 1.1 细胞与试剂人乳腺癌MDA-MB-231细胞株购于中国科学院上海细胞库。DMEM高糖培养基购自美国Corning公司;金雀异黄酮、磷酸酶抑制剂(Cocktail)、噻唑蓝(MTT)、结晶紫购自美国Sigma公司;胎牛血清购自澳大利亚Excellbio公司;GAPDH、Bax、Bcl-2抗体购自美国ABclonal公司;NF-κB、caspase-3、ERK、p-ERK、JNK、p-JNK兔抗人单克隆抗体购自美国Cell Signaling Technology公司;荧光二抗购于EarthOx Life Science公司;SDS-PAGE凝胶配制试剂盒、BCA蛋白浓度测定试剂盒(加强型)、蛋白酶抑制剂PMSF购自中国碧云天生物技术有限公司。
1.2 细胞培养及药品储存液配制人乳腺癌MDA-MB-231细胞用含10%胎牛血清高糖DMEM培养基,常规培养于37℃、5% CO2饱和湿度的细胞培养箱中,每2~3 d传代。金雀异黄酮用DMSO配制成100 mmol·L-1的储存液,避光储存于-20℃冰箱中,实验时用DMEM培养基稀释成需要的浓度(DMSO终体积分数不超过0.1%)。
1.3 MTT实验将MDA-MB-231细胞以4 000个/孔接种于96孔板中,置于培养箱中培养12 h使细胞贴壁,吸弃培养基,每孔加入200 μL含有金雀异黄酮(0、12.5、25、50、100、150 μmol·L-1)的培养基,每组设置3个复孔,分别孵育24、36、48 h,加入20 μL 5 g·L-1的MTT,置于细胞培养箱中避光孵育4 h后,吸出孔内的液体,加入150 μL DMSO溶解结晶,在震荡器上避光震荡10 min使结晶充分溶解,在492 nm用酶标仪测定各孔的吸光度(A值)。细胞生长抑制率=(1-A给药组/A正常对照组)×100%。
1.4 细胞克隆实验将MDA-MB-231细胞以500个/孔接种到6孔板中,置于细胞培养箱中培养24 h,使细胞贴壁,吸弃孔内培养基,加入2 mL含有金雀异黄酮(0、25、50、100 μmol·L-1)的培养基,置于细胞培养箱中孵育36 h,吸弃孔内培养基,更换新鲜的含有10%胎牛血清的培养基继续培养12 d(每3 d换1次液),弃去孔内培养基,用PBS洗3遍,加入4%多聚甲醛室温固定20 min,再用PBS洗3遍,加入结晶紫室温染色20 min,再用PBS洗3遍,拍照计算集落形成抑制率。集落形成抑制率=[1-(集落数/种殖细胞数)]×100%。
1.5 Western blot实验将MDA-MB-231细胞接种于25 cm2的培养瓶中,置于细胞培养箱中培养至80%汇合时,加入含有金雀异黄酮(0、25、50、100 μmol·L-1)的培养基,于细胞培养箱中孵育36 h,收集培养瓶内所有细胞,用PBS洗3遍,加入细胞裂解液(RIPA :PMSF :Cocktail=100 :1 :1)200 μL重悬细胞,静置于冰上裂解30 min,4℃、12 000 r·min-1离心30 min,提取上清液,用BCA法检测蛋白浓度。加入适量的上样蛋白缓冲液充分混匀,100℃高温7 min使蛋白质变性,取50 μg蛋白质,经10% SDS-PAGE电泳分离后,使蛋白转移至NC膜上,用5% BSA室温封闭60 min,一抗冰上孵育12 h,二抗室温孵育60 min,最后用双色红外荧光扫描成像系统扫膜采集图像,并分析灰度值。每组实验重复3次。
1.6 统计学分析实验结果以x±s表示,数据用SPSS 21.0软件进行统计分析,两组以上均数比较使用单因素方差分析,组间采用SNK法进行两两比较。
2 结果 2.1 金雀异黄酮对乳腺癌MDA-MB-231细胞增殖的影响如Fig 1所示,随着药物浓度和作用时间的增加,金雀异黄酮对细胞生长的抑制率逐渐增加。金雀异黄酮干预MDA-MB-231细胞24、36、48 h的IC50值分别为(78.73± 0.98)、(61.74 ± 1.07)、(58.37±1.48)μmol·L-1。
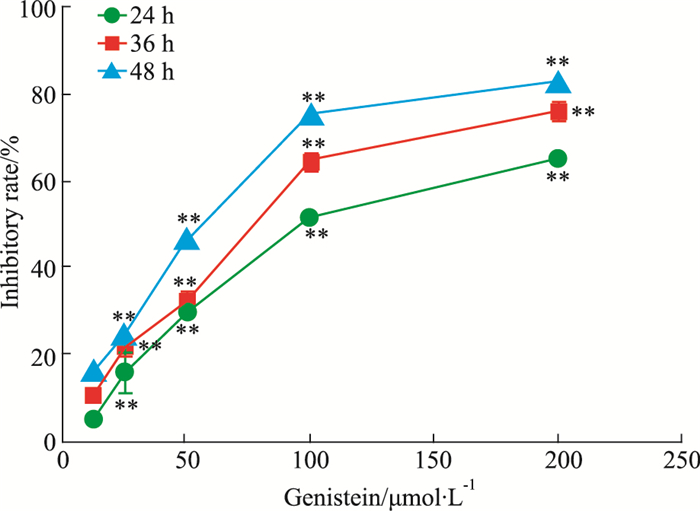
|
| Fig 1 The inhibitory effect of different concentrations of genistein on MDA-MB-231 cells proliferation (x±s, n=3) **P < 0.01 vs control (0 μmol·L-1) |
如Fig 2所示,不同浓度的金雀异黄酮(0、25、50、100 μmol·L-1)干预MDA-MB-231细胞36 h后,再培育12 d,与对照组相比,随着金雀异黄酮浓度升高,细胞的集落数明显降低,并呈现量效趋势(P<0.01)。提示金雀异黄酮可以抑制乳腺癌MDA-MB-231细胞的集落形成能力。
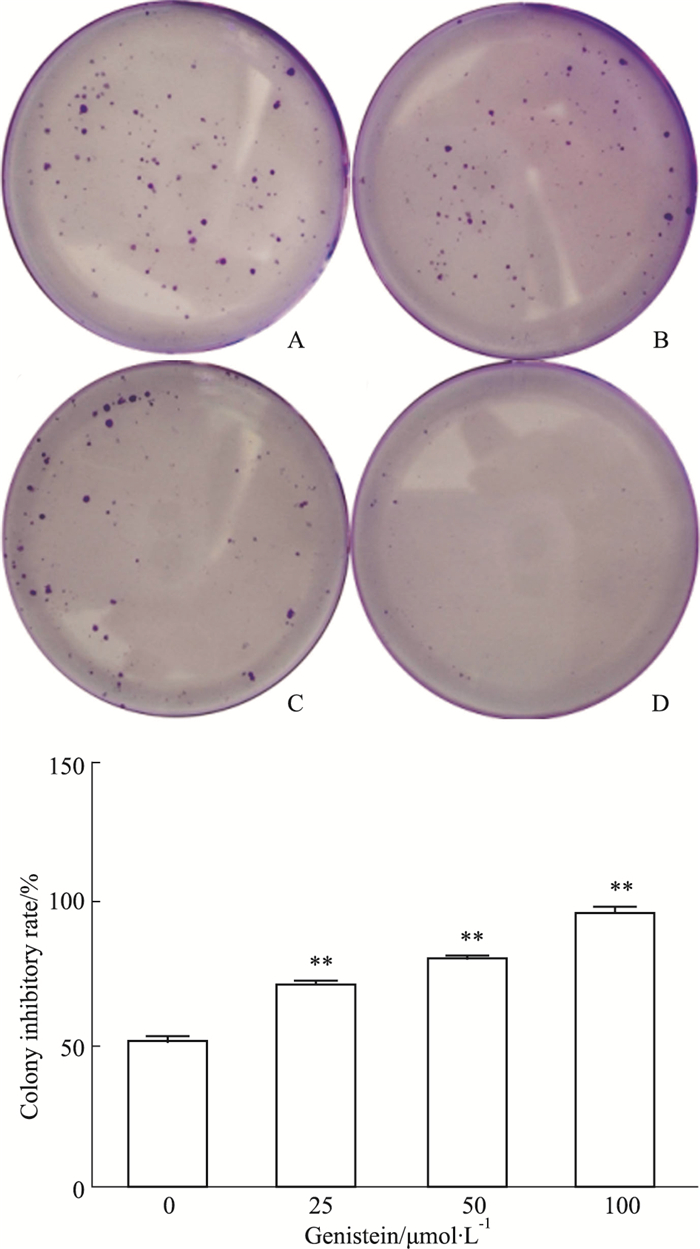
|
| Fig 2 Effect of genistein on colon formation of MDA-MB-231 cells and histogram of colony inhibitory rate (x±s, n=3) A: Control group; B: 25 μmol·L-1 genistein; C: 50 μmol·L-1 genistein; D: 100 μmol·L-1 genistein. **P < 0.01 vs control (0 μmol·L-1). |
如Fig 3所示,与对照组相比,金雀异黄酮干预MDA-MB-231细胞36 h后,Bcl-2蛋白表达明显下调(P<0.01),Bax、caspase-3蛋白表达明显上调(P<0.01)。提示金雀异黄酮对凋亡相关蛋白Bax及caspase-3具有明显的诱导作用。
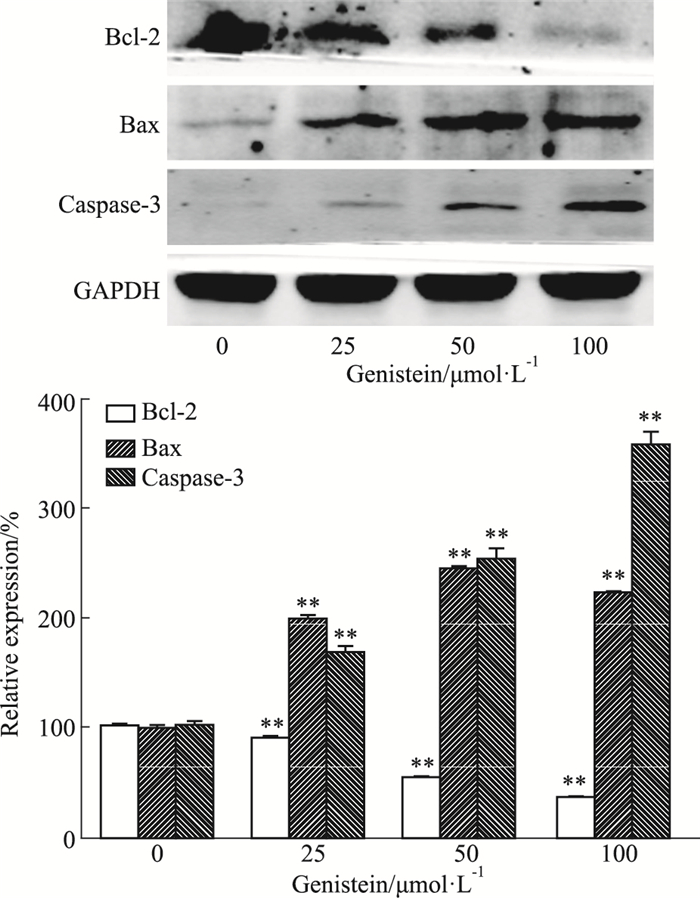
|
| Fig 3 Effect of genistein on expression of apoptosis related proteins in MDA-MB-231 cells by Western blot x±s, n=3) **P < 0.01 vs control (0 μmol·L-1) |
如Fig 4所示,与对照组相比,金雀异黄酮呈浓度依赖性下调NF-κB (p65)和p-ERK蛋白的表达(P<0.01),而上调p-JNK蛋白的表达。提示金雀异黄酮诱导MDA-MB-231细胞凋亡可能与抑制NF-κB、ERK,激活JNK信号转导通路相关。
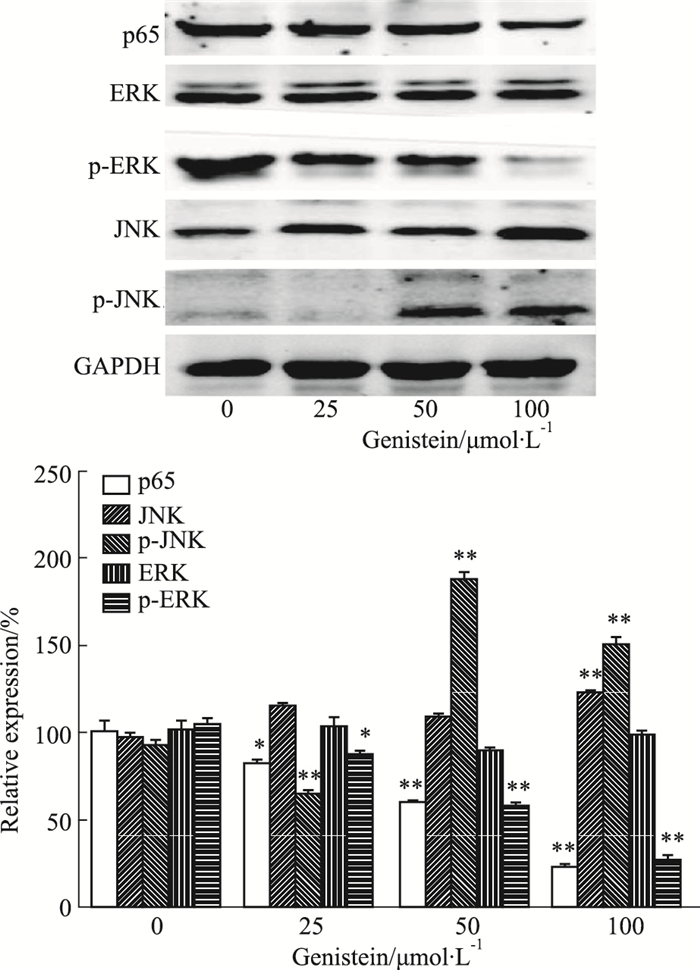
|
| Fig 4 Effect of genistein on expression of NF-κB (p65), ERK, p-ERK, JNK and p-JNK proteins in MDA-MB-231 cells by Western blot (x±s, n=3) *P < 0.05, **P < 0.01 vs control (0 μmol·L-1) |
细胞凋亡是由基因控制的细胞自主有序的主动死亡过程,目前研究发现的细胞凋亡途径主要有3条,分别为线粒体通路、内质网通路和死亡受体通路[6]。抗肿瘤药物诱导细胞凋亡是其发挥药理作用的重要机制之一。本研究中,MTT和集落形成实验显示,金雀异黄酮能明显抑制人乳腺癌MDA-MB-231细胞的增殖。我们进一步从蛋白水平探讨,Western blot检测显示,抑制凋亡的Bcl-2蛋白表达水平明显减少,而促凋亡的Bax蛋白表达水平明显提高。这些结果提示金雀异黄酮能明显抑制人三阴乳腺癌MDA-MB-231细胞增殖,并诱导其凋亡,再次证实了我们既往的研究结果。
NF-κB是研究最多的转录因子之一,p65是其中一个重要的亚型转录因子。被活化的p65可以通过核转位参与机体免疫、组织损伤修复、胚胎发育等生理和病理过程的基因调控[7]。有研究表明,NF-κB与多种凋亡相关基因的易感性与耐药性密切相关,在细胞存活与凋亡过程中有着双向的作用。胞外各种刺激,如TNF-α、IL-6、IL-1、LPS等化学性或紫外线等物理性应激物,可通过细胞表面受体激活信号转导通路,从而激活NF-κB途径,促进细胞生长、恶性转化、耐药、肿瘤的转移等[8]。王晓南等[9]曾报道,雷公藤红素能诱导U937细胞凋亡,其机制可能与下调Notch1信号通路以及NF-κB蛋白表达有关。因此,抑制NF-κB活性可以抑制肿瘤细胞增殖、促进凋亡、抑制化疗耐药、抑制炎症、减少肿瘤血管生成、抑制肿瘤细胞转移等生物学效应[10]。本研究中,金雀异黄酮可以明显抑制NF-κB (p65)蛋白表达水平,提示金雀异黄酮可以明显抑制NF-κB通路的信号传导。
MAPK包括JNK、p38和ERK。JNK静息状态位于细胞质中,当受到信号刺激活化后,JNK发生磷酸化成为p-JNK,部分p-JNK转入核内,通过磷酸化级联反应调控核内转录因子及基因表达,发挥相应的生物学效应。进一步研究发现,p-JNK也能活化p53和c-Myc2等核内转录因子[11]。某些胞质内的成分,如Bcl-2、Bcl-xL和Bim等也可以被JNK活化,表明JNK通路不仅可以调节核内基因转录,还可以直接作用于胞质底物而快速发挥生物学效应[12]。我们的研究显示,金雀异黄酮干预MDA-MB-231细胞后,JNK、p-JNK明显上调,提示金雀异黄酮可能通过激活JNK/MAPK通路,参与细胞凋亡信号传递。
ERK是Ras-Raf-MAPK通路中的一种下游蛋白激酶,ERK1和ERK2是ERK通路中最重要的两个成员[13]。未激活的ERK1/2都位于胞质内,ERK1/2一旦被激活则被磷酸化形成p-ERK1/2移位至细胞核,然后通过调节多种转录因子,如c-Myc、c-jun、NF-κB等的活性,最终影响细胞代谢和功能,并产生特定的生物学效应[14]。ERK在细胞的增殖、分化和凋亡中起着重要作用,ERK一方面能诱导Bcl-2等抗凋亡基因的表达发挥抗凋亡作用,另一方面,p-ERK1/2升高又能激活凋亡相关基因caspase-3等而发挥促凋亡作用[15]。我们的研究也显示,金雀异黄酮干预MDA-MB-231细胞后,p-ERK的表达明显降低,提示金雀异黄酮可能通过抑制ERK通路,诱导MDA-MB-231细胞凋亡。
综上所述,本研究显示NF-κB、JNK和ERK信号通路可能参与了金雀异黄酮诱导MDA-MB-231细胞凋亡信号的转导,结合既往研究,提示金雀异黄酮呈多通路发挥抗肿瘤效应。
( 致谢: 本实验于广西医科大学医学科学实验中心完成,感谢实验室老师和同学的指导和帮助!)
| [1] | Palma G, Frasci G, Chirico A, et al. Triple negative breast cancer: looking for the missing link between biology and treatments[J]. Oncotarget, 2015, 6(29): 26560-74. |
| [2] | Ning W, Feng Y. Elaborating the role of natural products-induced autophagy in cancer treatment: achievements and artifacts in the state of the art[J]. Biomed Res Int, 2015, 2015(4): 934207. |
| [3] | 郭瑞霞, 秦芳, 李力更, 等. 金雀异黄酮糖苷化修饰研究进展[J]. 中草药, 2014, 45(6): 874-82. Guo R X, Qin F, Li L G, et al. Research progress on glycosidation modification of genistein[J]. Chin Tradit Herb Drugs, 2014, 45(6): 874-82. |
| [4] | Phillip C J, Giardina C K, Bilir B, et al. Genistein cooperates with the histone deacetylase inhibitor vorinostat to induce cell death in prostate cancer cells[J]. BMC Cancer, 2012, 12(1): 145. doi:10.1186/1471-2407-12-145 |
| [5] | 韦立群, 李婉婷, 李通, 等. 金雀异黄酮对三阴乳腺癌MDA-MB-231细胞凋亡及EGFR/PI3K/Akt通路的影响[J]. 中国药理学通报, 2017, 33(10): 1376-81. Wei L Q, Li W T, Li T, et al. Effects of genistein on apoptosis and EGFR/PI3K/Akt signal transduction pathway in triple-negative breast cancer MDA-MB-231 cells[J]. Chin Pharmacol Bull, 2017, 33(10): 1376-81. doi:10.3969/j.issn.1001-1978.2017.10.010 |
| [6] | Daniel P T. Dissecting the pathways to death[J]. Leukemia, 2000, 14(12): 2035. doi:10.1038/sj.leu.2401940 |
| [7] | Xia Y, Shen S, Verma I M. NF-κB, an active player in human cancers[J]. Cancer Immunol Res, 2014, 2(9): 823. doi:10.1158/2326-6066.CIR-14-0112 |
| [8] | Hoesel B, Schmid J A. The complexity of NF-kappa B signaling in inflammation and cancer[J]. Mol Cancer, 2013, 12(1): 86. doi:10.1186/1476-4598-12-86 |
| [9] | 王晓南, 吴青, 杨旭, 等. 雷公藤红素对U937细胞Notch 1、NF-κB信号蛋白通路的调控作用[J]. 癌症, 2010, 29(4): 422-8. Wang X N, Wu Q, Yang X, et al. Effects of celastrol on growth inhibition of U937 leukemia cells through the regulation of the Notch1/NF-κB signaling pathway in vitro[J]. Chin J Cancer, 2010, 29(4): 422-8. |
| [10] | Karin M. Nuclear factor-kappaB in cancer development and progression[J]. Nature, 2006, 441(7092): 431-6. doi:10.1038/nature04870 |
| [11] | Chang L, Karin M. Mammalian MAP kinase signalling cascades[J]. Nature, 2001, 410(6824): 37-40. doi:10.1038/35065000 |
| [12] | Yu C, Minemoto Y, Zhang J, et al. JNK suppresses apoptosis via phosphorylation of the proapoptotic Bcl-2 family protein BAD[J]. Mol Cell, 2004, 13(3): 329-40. doi:10.1016/S1097-2765(04)00028-0 |
| [13] | Zhang X, Ma L, Qi J, et al. MAPK/ERK signaling pathway-induced hyper-O-GlcNAcylation enhances cancer malignancy[J]. Mol Cell Biochem, 2015, 410(1-2): 101-10. doi:10.1007/s11010-015-2542-8 |
| [14] | 张丰, 李楠. ERK/MAPK信号传导途径在乳腺肿瘤治疗中的意义[J]. 中国肿瘤生物治疗杂志, 2007, 14(5): 497-500. Zhang X, Ma L, Qi J, et al. MAPK/ERK signaling pathway-induced hyper-O-GlcNAcylation enhances cancer malignancy[J]. Mol Cell Biochem, 2015, 410(1-2): 101-10. http://med.wanfangdata.com.cn/Paper/Detail?id=PeriodicalPaper_zgzlswzlzz200705020 |
| [15] | Luanpitpong S, Chanvorachote P, Stehlik C, et al. Regulation of apoptosis by Bcl-2 cysteine oxidation in human lung epithelial cells[J]. Mol Biol Cell, 2013, 24(6): 858-69. doi:10.1091/mbc.E12-10-0747 |