

2. 中国科学技术大学生命科学学院,中国科学院脑功能与脑疾病重点实验室,安徽 合肥 230027
2. School of Life Sciences, University of Science and Technology of China, Key Lab of Brain Function and Disease, Chinese Academy of Sciences, Hefei 230027, China
心肌缺血/再灌注损伤(ischemia/reperfusion injury, IRI)常见于心肌梗死后溶栓或冠脉介入治疗,也可见于体外循环下的心脏手术、心脏骤停后的心肺复苏等,导致缺血后心肌损伤和功能障碍进一步加重,严重威胁患者的生命安全[1]。阿片类药物是心脏手术麻醉中广泛应用的镇痛药,椎管内给药是其常用的给药方式。前期研究表明,鞘内吗啡预处理(morphine preconditioning, MPC)可明显减轻心肌IRI[2],但其具体机制仍不明确。心肌缺血/再灌注过程中,局部产生的大量代谢产物如酸性物质、缓激肽、腺苷等,可激活心脏感觉传入神经元上的辣椒素受体(transient receptor potential vanilloid 1, TRPV1),将伤害性感受信号经背根神经节(dorsal root ganglion, DRG)上传至脊髓和上级中枢[3]。有研究发现,鞘内MPC可抑制心肌缺血后脊髓背角神经元兴奋性[4],并降低DRG组织中神经生长因子(nerve growth factor, NGF)表达水平[5]。NGF是一种典型的神经营养因子,其除了营养神经的作用以外,还可通过敏化TRPV1通道,增加初级传入神经元对伤害性刺激的敏感性[6]。因此,本课题在前期研究基础上,进一步利用体外DRG神经元和PC12神经细胞系,探讨MPC对NGF诱导TRPV1通道电流的调控作用及其信号机制,以期阐明鞘内MPC发挥心肌保护作用的神经机制。
1 材料与方法 1.1 材料 1.1.1 细胞株大鼠嗜铬瘤细胞株PC12细胞购自中科院上海细胞库。
1.1.2 药物与试剂MEM、neurobasal-A、高糖DMEM培养基、B27、胎牛血清、青、链霉素购自美国Invitrogen公司; 多聚赖氨酸、胰蛋白酶、Ⅰ型胶原酶、5-氟-2′脱氧尿苷、尿苷购自美国Sigma公司; 辣椒素购自美国Cayman公司; 盐酸吗啡注射液(1 mL :10 mg, 批号:120412.2)购自沈阳第一制药厂; 细胞外液(mmol·L-1):NaCl 140.0、KCl 5.0、CaCl2 1.8、MgCl2 1.2、葡萄糖5.0、HEPES 10.0,NaOH调pH值至7.4;电极内液(mmol·L-1):CsCl 120.0、MgCl2 4.0、EGTA 10.0、HEPES 10.0、Na-GTP 0.5、Mg-ATP 2.0,CsOH调pH值至7.2。电极内液和电极外液中所有试剂均购自美国Sigma公司; 鼠抗神经元特异性烯醇化酶(neuronal specific enolase, NSE)抗体购自美国Proteintech公司; 鼠抗TRPV1抗体、兔抗磷酸化TRPV1(phosphorylated TRPV1, p-TRPV1)抗体购自美国Abnova公司; 兔抗细胞外信号调节激酶(extracellular signal regulated kinase, ERK)抗体和兔抗p-ERK抗体购自美国Cell Signaling公司; 鼠抗β-actin抗体购自美国Santa Cruz公司; Alexa594标记的山羊抗鼠荧光抗体和HRP标记的山羊抗兔、山羊抗鼠抗体购自北京中杉金桥生物有限公司; ECL发光试剂盒购自美国Thermo公司。
1.1.3 仪器玻璃电极购自武汉微探科学仪器有限公司,Axopatch 200B型膜片钳放大器购自美国Axon公司,凝胶成像系统购自上海天能科技公司。
1.2 DRG细胞分离与培养10日龄健康SD大鼠,♀♂不拘,由安徽医科大学实验动物中心提供。大鼠乙醇浸泡后断头处死、纵行剖开胸段T2-T8脊柱。于解剖显微镜下分离出两侧椎间孔内圆形透亮神经节,转入4℃含有10%胎牛血清、1%青、链霉素的MEM培养基中。使用眼科剪将神经节上被膜剥离干净,再将其移入加有质量分数为0.025%胰蛋白酶和质量分数为0.1%的Ⅰ型胶原酶的离心管中,37℃水浴消化40 min。使用含有胎牛血清的MEN培养基洗酶3次后,使用抛光玻璃滴管吹打至单细胞悬液,接种于事先包被多聚赖氨酸的24孔板中,于37℃培养箱中培养。
1.3 DRG神经元纯化及鉴定DRG神经元完成贴壁后,全量换液为含有2% B27、50 μg·L-1 NGF、50 μmol·L-1 5-氟-2′脱氧尿苷及150 μmol·L-1尿苷的neurobasal-A培养基培养纯化。细胞培养24 h后,用预热的PBS洗10 min×3次; 0.1% Triton X-100通透5 min,PBS洗10 min×3次; 2%山羊血清封闭1 h,并加入抗NSE鼠抗(1 :100)4℃孵育过夜。次日用PBS洗10 min×3次,加入Alexa594标记的山羊抗鼠荧光抗体(1 :500),室温避光孵育1 h,DAPI染核; PBS漂洗后,加入荧光封片剂封片,于荧光显微镜下观察。
1.4 DRG细胞分组与处理原代培养48 h后的DRG神经元采用随机数字表法分为5组(n=10):对照组(C组)、NGF刺激组(NGF组)、3个吗啡预处理组(MPC 0.3、1.0、3.0 μmol·L-1组)。C组细胞正常培养,NGF组细胞给予含NGF 100 μg·L-1的neurobasal-A培养基培养1 h,MPC组细胞于NGF培养前分别给予终浓度为0.3、1.0、3.0 μmol·L-1的含吗啡neurobasal-A培养液,孵育10 min后,换用无吗啡培养基培养30 min。上述处理后,各组DRG神经元给予100 nmol·L-1辣椒素刺激,即刻采用单细胞膜片钳技术检测辣椒素诱发电流。
1.5 全细胞膜片钳记录玻璃电极使用P-1000电极拉制仪拉制,尖端直径1.5 μm,入液电阻3~5 MΩ,微电极内充灌电极内液。高倍镜下选取边界清晰、表面光整、反光明显、有较强光晕及完整突起的神经元进行实验。当电极贴近细胞后,予以负压吸引细胞膜,形成高阻封接(>1 GΩ),后给予脉冲式负压吸破细胞膜,形成全细胞记录模式,钳制电压-60 mV。待基线稳定,采用电压钳模式,通过微操纵给药系统给予辣椒素(终浓度100 nmol·L-1),观察全细胞电流变化,并经过Axopatch 200B型膜片钳放大器及Clampfit10.6软件采集分析后,输入计算机储存。
1.6 大鼠嗜铬瘤细胞PC12细胞培养与分组处理PC12细胞用含10%胎牛血清、1%青链霉素的高糖DMEM培养基,于37℃培养箱中培养。当细胞融合率达到80%~90%时,用质量分数为0.025%的胰酶消化细胞,吹打均匀并1 :3传代。正常培养的PC12细胞,接种于6孔板中,当细胞融合率达到80%~90%时,采用随机数字表法分为5组(n=3):对照组(C组)、NGF刺激组(NGF组)、3个吗啡预处理组(MPC 0.3、1.0、3.0 μmol·L-1组)。C组细胞正常培养,NGF组细胞加入100 μg·L-1 NGF孵育1 h,MPC组细胞于NGF培养前分别给予终浓度为0.3、1.0、3.0 μmol·L-1的含吗啡高糖DMEM培养液,孵育10 min后,再换为无吗啡的培养基培养30 min。培养结束前,各组PC12细胞均加入100 nmol·L-1辣椒素刺激30 min后,收集细胞用于Western blot检测。
1.7 Western blot检测TRPV1、p-TRPV1及p-ERK的相对表达量上述各组PC12细胞处理结束后,弃去培养基,4℃ PBS清洗细胞后加入蛋白裂解液,冰上静置裂解30 min后,15 000 r·min-1、4℃离心10 min后,取上清,BCA定量法检测样品蛋白含量后,于-80 ℃保存。每组取20 μg蛋白行SDS-PAGE电泳后,将蛋白湿转至PVDF膜,置于含5%牛奶TBST溶液中封闭1 h后,分别置于鼠抗TRPV1(1 :250)、兔抗p-TRPV1(1 :250)、兔抗ERK(1 :1 000)、兔抗p-ERK(1 :1 000)和鼠抗β-actin(1 :500)抗体中,4℃摇床孵育过夜。次日TBST洗膜5 min×4次,再置于HRP标记的二抗(1 :10 000)中室温孵育1 h,TBST洗膜5 min×4次。使用ECL发光试剂盒,在凝胶成像系统中曝光采集图像,并分析条带光密度。分别以目的蛋白与β-actin蛋白灰度值的比值反映蛋白的相对表达水平。
1.8 统计学处理采用SPSS 10.0统计软件进行数据处理,计量资料以x±s表示,组间比较采用单因素方差分析。
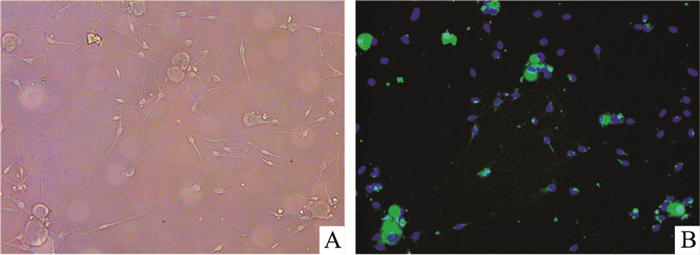
2 结果 2.1 DRG神经元鉴定结果倒置相差显微镜下可见,DRG神经元胞体呈椭圆形,具有折光性,周围有明显光晕,神经元轴突之间交织成密集纤维网(Fig 1A)。NSE为神经细胞所特有,可以作为神经元区别于其他细胞的标记物。免疫荧光染色结果显示,DRG神经元胞质和轴突呈绿色,胞核复染呈蓝色,为NSE阳性; 而施万细胞及成纤维细胞等杂细胞仅有细胞核被染成蓝色。说明DRG神经元培养成功(Fig 1B)。
|
| Fig 1 Identification of DRG neurons (scale bar=200 μm) A:The morphology of DRG neurons; B: The NSE immunofluorescence of DRG neurons. Blue marker is cell nucleus. Green colour is NSE fluorescence coloration. |
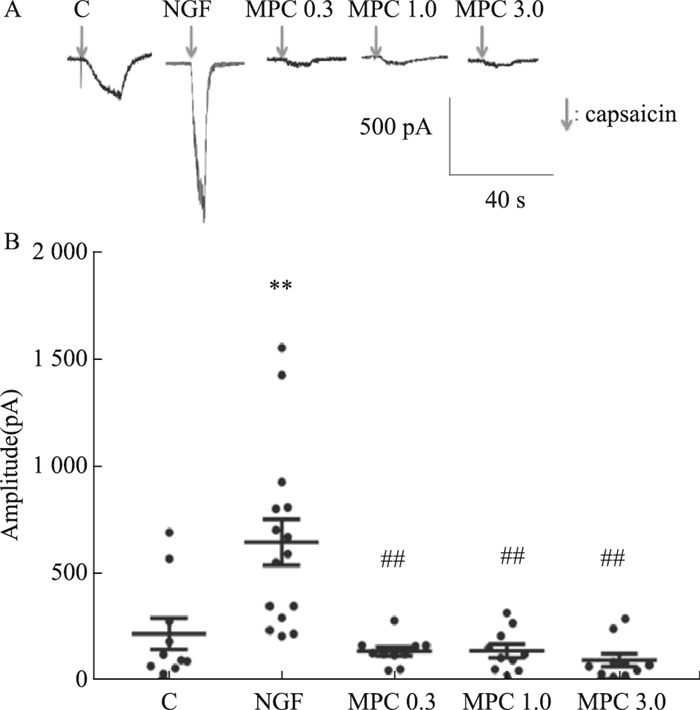
Fig 2的膜片钳结果显示,与C组比较,NGF组DRG神经元的辣椒素诱发内向电流增强(P < 0.01);与NGF组相比,各MPC组DRG神经元内向电流明显降低(P < 0.01),提示NGF对DRG神经元辣椒素诱发电流具有敏化作用,而MPC对敏化具有明显的抑制作用。
|
| Fig 2 The inhibitory effects of morphine preconditioning on capsaicin triggered inward current in DRG cells A: Whole-cell currents on DRG neurons; B: The data points of capsaicin amplitude (C, n=11 from 4 rats; NGF, n=15 from 4 rats; MPC 0.3, n=10 from 4 rats; MPC 1.0, n=10 from 4 rats; MPC 3.0, n=10 from 4 rats). **P < 0.01 vs C group; ##P < 0.01 vs NGF group. |
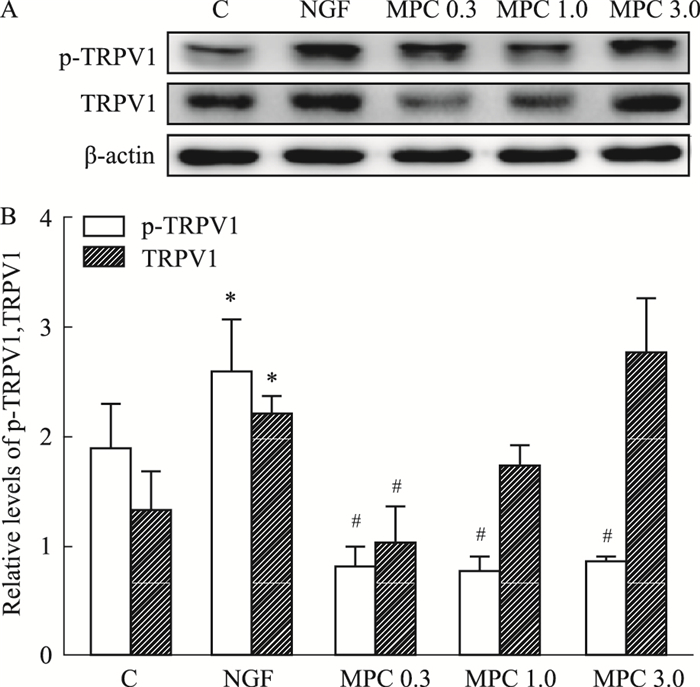
Fig 3的Western blot结果显示,与C组比较,NGF组PC12细胞的TRPV1及p-TRPV1蛋白相对表达量明显上调(P < 0.05);与NGF组相比,各MPC组p-TRPV1蛋白相对表达量下调(P < 0.05),其中,MPC 0.3组TRPV1蛋白相对表达量下调具有统计学意义(P < 0.05)。
|
| Fig 3 Effects of morphine preconditioning on expression of p-TRPV1 and TRPV1 A: Representative immune blot band of p-TRPV1, TRPV1 and β-actin protein in each group; B: The relative expression of p-TRPV1, TRPV1. *P < 0.05 vs C group; #P < 0.05 vs NGF group. |
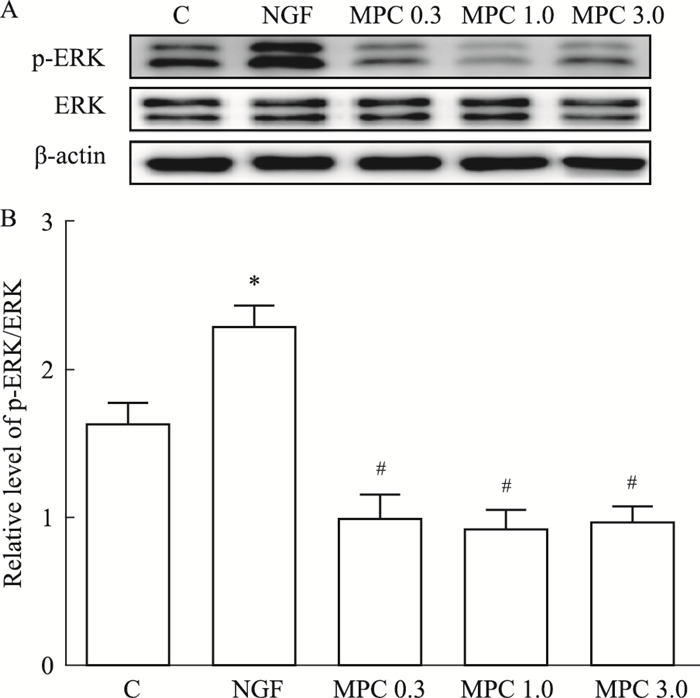
Fig 4的Western blot结果显示,与C组比较,NGF组PC12细胞的p-ERK蛋白相对表达量明显上调(P < 0.05);与NGF组相比,各MPC组p-ERK蛋白相对表达量下调(P < 0.05)。
|
| Fig 4 Effects of morphine preconditioning on expression of p-ERK A: Representative immune blot band of p-ERK, ERK and β-actin protein in each group; B:The relative level of p-ERK/ERK. *P < 0.05 vs C group; #P < 0.05 vs NGF group. |
IRI是常见的心脏手术围术期并发症,严重影响患者术后恢复,甚至威胁患者生命安全[1]。有研究表明,鞘内MPC可减轻心肌IRI[2],并同时抑制脊髓神经元兴奋性[4],降低DRG组织中NGF水平[5]。在此基础上,本研究通过体外培养DRG神经元及PC12细胞系,模拟心肌缺血/再灌注损伤中T2-T8节段DRG神经元状态,阐明了MPC可能通过抑制NGF对DRG神经元ERK蛋白活化,从而减轻TRPV1通道敏化,进一步产生心肌保护作用。
DRG神经元在伤害感受信号传导过程中起十分重要的作用,采用单细胞膜片钳技术记录DRG神经元全细胞电流,是研究神经元兴奋性和离子通道电流变化的重要手段[7]。参考文献[8-9]的方法,分离培养大鼠T2-T8节段DRG神经元,所得细胞NSE染色阳性,状态良好,膜表面光滑、完整。电极接触细胞膜表面,易于形成高阻封接,封接电阻大于1 GΩ。
DRG神经元上分布大量TRPV1受体,该受体通道是一种非选择性阳离子通道[10],激活后诱发神经元内向电流,在伤害性刺激的感知、传递和调节中发挥重要作用[11]。辣椒素为TRPV1通道的特异性激动剂[12],因此,利用外源性辣椒素诱发T2-T8节段DRG神经元内向电流,可以模拟心肌缺血刺激诱导的TRPV1通道活化。NGF是神经元存活和维持所必需的营养因子,其与受体结合后可诱导TRPV1敏化,增强神经元放电,参与炎症或损伤诱导的痛觉过敏[13]。心肌梗死后,局部缺血心肌及DRG组织内NGF表达水平均升高,但其是否通过致敏TRPV1通道,参与心肌缺血伤害刺激信号的传递过程,尚不清楚。本实验利用外源性NGF刺激DRG神经元,模拟体内DRG神经元所处的环境。膜片钳结果显示,NGF刺激可以增强辣椒素诱发的DRG神经元内向电流,表明NGF对TRPV1通道具有敏化作用。在给予0.3、1.0、3.0 μmol·L-1的吗啡进行预处理时,再以NGF刺激TRPV1通道活化,结果发现MPC可以明显减弱DRG神经元的内向电流,表明MPC可抑制NGF刺激引起TRPV1通道敏化。以上结果提示,鞘内MPC的心肌保护作用可能与其调控NGF诱导的DRG神经元TRPV1通道敏化有关。
PC12细胞是一种常用的神经细胞株,来源于可移植的大鼠肾上腺嗜铬细胞瘤,其细胞膜表面表达NGF受体,常被用于NGF作用分子机制的研究[14]。Western blot结果表明,NGF孵育可明显升高PC12细胞内辣椒素诱导的TRPV1蛋白表达水平,以及TRPV1、ERK蛋白磷酸化水平,而MPC可以抑制该表达上调。ERK信号通路是丝裂原活化蛋白激酶家族中的重要亚族,参与调控神经细胞的增殖、分化,并在NGF致敏TRPV1的过程中发挥重要作用[15]。因此,MPC抑制NGF诱导的TRPV1通道敏化,可能是通过抑制TRPV1蛋白本身表达量及其磷酸化而实现的,并且与抑制神经细胞内ERK信号蛋白活化相关。
综上所述,本实验证实,MPC可以通过调节TRPV1蛋白本身表达量及其磷酸化水平,减弱NGF诱导的神经细胞TRPV1通道敏化,且这一过程可能与抑制神经细胞内ERK蛋白磷酸化相关,为鞘内MPC发挥心肌保护作用的神经机制研究提供了理论依据。
( 致谢: 感谢安徽医科大学第二附属医院中心实验室及中国科学院脑功能与脑疾病重点实验室为本课题研究提供仪器设备和技术支持。)
| [1] | Yellon D M, Hausenloy D J. Myocardial reperfusion injury[J]. N Engl J Med, 2007, 357(11): 1121-35. doi:10.1056/NEJMra071667 |
| [2] | Li R, Wong G T, Wong T M, et al. Intrathecal morphine preconditioning induces cardioprotection via activation of delta, kappa, and mu opioid receptors in rats[J]. Anesth Analg, 2009, 108(1): 23-9. doi:10.1213/ane.0b013e3181884ba6 |
| [3] | Peart J N, Gross E R, Gross G J. Opioid-induced preconditioning: recent advances and future perspectives[J]. Vascul Pharmacol, 2005, 42(5-6): 211-8. doi:10.1016/j.vph.2005.02.003 |
| [4] | 黄成, 何淑芳, 许世进, 等. 鞘内吗啡预处理对心肌缺血再灌注大鼠脊髓背角SG区神经元兴奋性的影响[J]. 中华麻醉学, 2016, 36(7): 771-5. Huang C, He S F, Xu S J, et al. Effect of inthathecal morphine preconditioning on excitability of substantia gelatinosa neurons in dorsal horn of spinal cord in a rat model of myocardial ischemia-reperfusion[J]. Chin J Anesthesiol, 2016, 36(7): 771-5. |
| [5] | 许世进, 何淑芳, 胡军, 等. 鞘内吗啡预处理对心肌缺血再灌注大鼠背根神经节神经生长因子表达的影响[J]. 中华麻醉学, 2016, 36(6): 666-9. Xu S J, He S F, Hu J, et al. Effect of intrathecal morphine preconditioning on expression of nerve growth factor in dorsal root ganglia in a rat model of myocardial ischemia-reperfusion[J]. Chin J Anesthesiol, 2016, 36(6): 666-9. |
| [6] | Ieda M, Kanazawa H, Ieda Y, et al. Nerve growth factor is critical for cardiac sensory innervation and rescues neuropathy in diabetic hearts[J]. Circulation, 2006, 114(22): 2351-63. doi:10.1161/CIRCULATIONAHA.106.627588 |
| [7] | 蔡捷, 方东, 李松, 等. 膜片钳技术在慢性痛大鼠背根神经节神经元电生理学特性改变中的应用[J]. 中国疼痛医学杂志, 2017, 23(1): 25-8. Cai J, Fang D, Li S, et al. The application of patch-clamo recordings in the change of dorsal root ganglion neurons electrophysiological properties of chronic bone cancer pain[J]. Chin J Pain Med, 2017, 23(1): 25-8. |
| [8] | Newberry K, Wang S, Hoque N, et al. Development of a spontaneously active dorsal root ganglia assay using multiwell multielectrode arrays[J]. J Neurophysiol, 2016, 115(6): 3217-28. doi:10.1152/jn.01122.2015 |
| [9] | 张成标, 喻晓路, 潘志强, 等. 一种适合膜片钳单通道记录的大鼠DRG神经元急性分离方法[J]. 中国应用生理学杂志, 2011, 27(4): 510-2. Zhang C B, Yu X L, Pan Z Q, et al. A method of acutely isolating rat dorsal root ganglion neurons for patch-clamp study of single channel[J]. Chin J Appl Physiol, 2011, 27(4): 510-2. |
| [10] | Caterina M J, Schumacher M A, Tominaga M, et al. The capsaicin receptor: a heat-activated ion channel in the pain pathway[J]. Nature, 1997, 389(6653): 816-24. doi:10.1038/39807 |
| [11] | Liu D L, Wang T W, Xing J L, et al. Research progress in transient receptor vanilloid 1 of sensory nervous system[J]. Neurosci Bull, 2009, 25(4): 221-7. doi:10.1007/s12264-009-0506-2 |
| [12] | Yang F, Xiao X, Cheng W, et al. Structural mechanism underlying capsaicin binding and activation of the TRPV1 ion channel[J]. Nat Chem Biol, 2015, 11(7): 518-24. doi:10.1038/nchembio.1835 |
| [13] | Priestley J V, Michael G J, Averill S, et al. Regulation of nociceptive neurons by nerve growth factor and glial cell line derived neurotrophic factor[J]. Can J Physiol Pharmacol, 2002, 80(5): 495-505. doi:10.1139/y02-034 |
| [14] | 窦梦云, 何淑芳, 黄成, 等. 慢病毒介导的NGF基因沉默对PC12细胞分化的影响[J]. 中国药理学通报, 2016, 32(8): 1153-8. Dou M Y, He S F, Huang C, et al. Lentivirus-mediated NGF gene silencing inhibited differentiation of PC12 Cells[J]. Chin Pharmacol Bull, 2016, 32(8): 1153-8. |
| [15] | Zhuang Z Y, Xu H, Clapham D E, et al. Phosphatidylinositol 3-kinase activates ERK in primary sensory neurons and mediates inflammatory heat hyperalgesia through TRPV1 sensitization[J]. J Neurosci, 2004, 24(38): 8300-9. doi:10.1523/JNEUROSCI.2893-04.2004 |

