


2. 广东省人民医院(广东省医学科学院)医学研究部,广东省心血管病研究所,广东 广州 510080
 ,
KUANG Su-juan2,
YANG Hui2,
RAO Fang2,
ZHANG Meng-zhen2,
MAI Li-ping2,
LIN Qiu-xiong2,
SHAN Zhi-xin2,
YANG Min2,
DENG Chun-yu1,2
,
KUANG Su-juan2,
YANG Hui2,
RAO Fang2,
ZHANG Meng-zhen2,
MAI Li-ping2,
LIN Qiu-xiong2,
SHAN Zhi-xin2,
YANG Min2,
DENG Chun-yu1,2

2. Medical Research Center of Guangdong General Hospital; Guangdong Cardiovascular Institute, Guangdong Academy of Medical Sciences, Guangzhou 510080, China
血管平滑肌细胞(vascular smooth muscle cells, VSMCs)具有维持和调节血管张力以及血管损伤修复等功能[1]。尽管整个血管系统具有相似的结构特征,但基于所供给的器官不同,其平滑肌细胞可能具有不同的特征。不同器官的VSMCs特征具有异质性,可表现在结构、代谢、功能、抗原表达等方面,它与组织、器官的功能有着密切的关系,在一些病理、生理过程中具有重要的作用[2]。以前的研究主要关注对VSMCs生物学特性以及病理变化方面[1, 3],而从收缩反应异质性的角度研究相对较少。
血管张力受到机体内源性的活性物质调节,如5-羟色胺(5-hydroxy tryptamine,5-HT)、前列腺素(prostaglandin,PG)、去甲肾上腺素(norepinephrine,NE)等,通过平滑肌细胞上其相应的受体,偶联G蛋白信号通路,介导血管收缩。Ca2+内流是VSMCs收缩的必要条件,L-型钙通道是平滑肌细胞Ca2+内流的重要通道[4]。本研究主要探讨胸主动脉、肾内动脉和冠状动脉对不同的收缩剂,如苯肾上腺素(phenylephrine,Phe)、5-HT、血栓素A2类似物(9,11-dideoxy-11α,9α-epoxymethanoprostaglandin,U46619)的反应性差异,并且进一步通过使用L-型钙通道阻断剂硝苯地平,探讨L-型钙通道在血管收缩反应的调控差异。总之,通过此实验旨在探究大鼠不同部位动脉血管对同一血管收缩剂的反应性,以及L-型钙通道参与收缩部分的差异性。
1 材料 1.1 实验药物苯肾上腺素、5-HT、血栓素A2类似物、乙酰胆碱(acetylcholine,ACh)、硝苯地平(nifedipine)均购于Sigma公司,其余试剂均为国产分析纯。
1.2 实验动物瘦型Zucker(fa/+)大鼠,♂,体质量300~350 g,共18只,购于维通利华实验动物技术有限公司,许可证号: SCXK(京)2016-0011。
1.3 仪器610 M型多通道血管张力测定仪(丹麦DMT公司);PowerLab 8/30生物信号采集处理系统(澳大利亚AD公司);DK-8D型电热恒温水槽(上海医用恒温设备厂);Stemi DV4型体视显微镜(德国ZEISS公司)。
2 方法 2.1 动脉血管环的制备正常瘦型Zucker(fa/+)大鼠,采用颈椎脱臼法处死,迅速打开腹腔,取下胸主动脉、肾脏或心脏,放入4℃预冷、混合气(含95% O2+5% CO2)饱和过的K-H液中,K-H液成分为(mmol·L-1):NaCl 119、NaHCO3 25、MgCl2·6H2O 1、KCl 4.7、KH2PO4 1.2、CaCl2 2.5、D-glucose 11.1。洗净胸主动脉、肾脏或心脏的残余血液及血块,在冰浴条件下,借助体视显微操作分离出胸主动脉、肾内动脉或冠状动脉,去除血管外周的脂肪或结缔组织,把血管剪成1.8~2.0 mm的血管条。将胸主动脉血管条直接固定于610M血管张力测定仪浴槽内的针式固定架上,肾内动脉或冠状动脉用两根直径为40 μm的不锈钢丝穿过管腔,分别固定于620M血管张力测定仪浴槽内的两个钳夹上,其中一个钳夹连接调整脉管周长的螺旋测微器,另一个钳夹连接内置的高灵敏度张力传感器。血管平衡30 min后,分别给予胸主动脉、肾内动脉和冠状动脉基础张力15、2、2 mN,每隔15 min换液1次,并使张力分别维持在15、2、2 mN,平衡60 min后,在浴槽中加入药物进行实验。血管对药物反应的张力变化信号会通过张力传感器再经过数模转换器输入计算机,并在计算机程序控制下完成记录。实验全程持续通以混合气到浴槽内的溶液中,保持温度在(37±0.5)℃[5-6]。
2.2 药物对血管张力作用检测首先用高钾(KCl 60 mmol·L-1)刺激血管,以检测血管的反应性。用高钾的K-H液(mmol·L-1)(KCl 60、NaCl 63.7、NaHCO3 25、MgCl2·6H2O 1、KCl 4.7、KH2PO4 1.2、CaCl2 2.5、D-glucose 11.1)替换浴槽内的K-H液。高钾使血管条产生收缩反应,待达到最大收缩反应性且稳定后,用K-H液置换浴槽内溶液,间隔30 min后,重复上述实验。前后两次高钾刺激使得血管收缩的幅度相差不超过10%,可以用于进行下一步实验。其次检测血管内皮的功能性,重新平衡血管条30 min,用血管收缩剂1 μmol·L-1 Phe收缩胸主动脉和肾内动脉,用2 μmol·L-1 5-HT收缩冠状动脉,待血管产生持续性收缩并达到最大收缩幅度后,加入血管舒张剂1 μmol·L-1 ACh舒张血管,若舒张幅度大于60%视为内皮完整,若舒张程度小于10%或不舒张视为内皮去除完全。
对血管功能性检测合格的血管条,采用累积浓度给药的方法,在浴槽中分别加入各浓度梯度的血管收缩剂Phe(0.001~30 μmol·L-1)、5-HT(0.001~10 μmol·L-1)、U46619(0.001~1 μmol·L-1),观察激动剂浓度和收缩效应关系,当收缩效应达到最大后,用K-H液洗脱4次,并给予1 μmol·L-1硝苯地平孵育30 min,再次重复以上Phe、5-HT、U46619累积浓度给药,观察硝苯地平对血管收缩的量效曲线影响。
2.3 数据分析与统计学处理以连续两次高钾诱发收缩张力的均值作为标准值100%,Emax用各收缩剂/标准值的百分比来表示;EC50表示产生50%最大收缩效应时的药物浓度,pEC50为产生最大效应的50%时激动剂摩尔浓度的负对数,pEC50=-lg(EC50)。所有数据以x±s表示,采用Sigma Plot 10.0软件对数据进行曲线拟合,绘制收缩曲线,并根据Equation 1求得logEC50和最大收缩百分比的变化值(Emax)。本文数据均应用SPSS 19.0软件进行统计分析,两组数据之间用t检验进行显著性检验,两组以上数据之间的比较用One-Way ANOVA分析项下的Bonferroni检验方式进行显著性检验。
3 结果 3.1 Phe诱导大鼠胸主动脉、肾内动脉和冠状动脉收缩反应性差异Fig 1、Tab 1结果显示,Phe对冠状动脉张力无明显作用,但可诱导胸主动脉和肾内动脉产生明显的浓度依赖性收缩反应,两者量效曲线的Emax无明显差异(P > 0.05),胸主动脉的pEC50明显大于肾内动脉(P < 0.05)。给予1 μmol·L-1硝苯地平孵育30 min后,胸主动脉和肾内动脉收缩的量效曲线右移,且对胸主动脉收缩反应的抑制幅度(77.89±3.40)%,明显大于肾内动脉(40.87±2.48)%(P < 0.05)。以上结果提示,在这3种动脉中,冠状动脉对Phe引起的血管收缩反应不敏感;胸主动脉对Phe的收缩反应最敏感;相较于肾内动脉,L-型钙通道在Phe引起的胸主动脉收缩反应中可能发挥更大的作用。
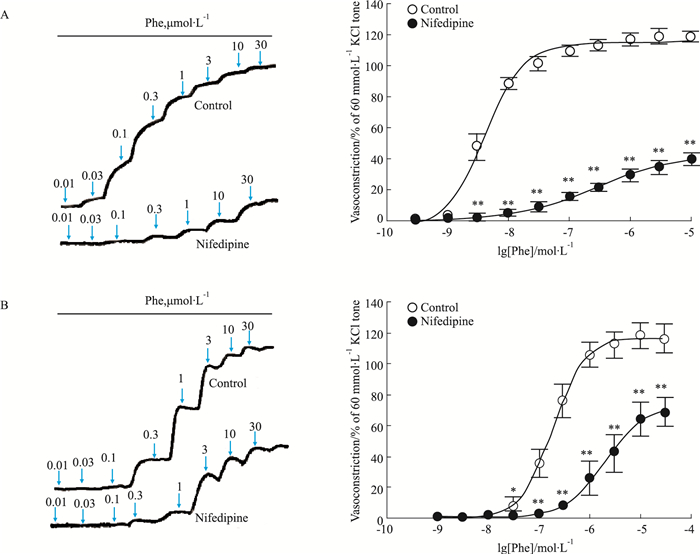
|
| Fig 1 Effect of nifedipine on concentration-dependent vasoconstriction induced by Phe in endothelium-denudedt thoracic aortic rings and intrarenal arterial rings Left panel: Representative recording of Phe-evoked concentration-dependent contraction in endothelium-denuded thoracic aortas (A), intrarenal arteries (B) of rats. Right panel: Effect of nifedipine (1 μmol·L-1) on concentration-dependent vasoconstriction induced by Phe in endothelium-denuded thoracic aortic rings (A, n=6) and intrarenal arterial rings (B, n=8) in rats. *P < 0.05, **P < 0.01 vs control. |
| Treatment | n | pEC50 | Emax/% |
| Phe | |||
| Thoracic aorta | 6 | 8.72±0.09 | 115.73±1.83 |
| Intrarenal artery | 8 | 6.73±0.06* | 121.1±3.53 |
| Nifedipine+Phe | |||
| Thoracic aorta | 6 | 6.70±0.10 | 37.59±2.05 |
| Intrarenal artery | 8 | 5.56±0.15* | 80.23±4.13* |
| 5-HT | |||
| Intrarenal artery | 6 | 6.69±0.04 | 119.91±3.96 |
| Coronary artery | 6 | 6.67±0.07 | 127.93±2.47 |
| Nifedipine+5-HT | |||
| Intrarenal artery | 6 | 6.17±0.02 | 103.38±4.42 |
| Coronary artery | 6 | 5.89±0.20 | 45.07±4.74# |
| U46619 | |||
| Thoracic aorta | 6 | 10.27±0.66 | 123.64±1.72 |
| Intrarenal artery | 8 | 7.85±0.13* | 67.53±2.95* |
| Coronary artery | 7 | 8.01±0.15* | 134.26±4.67# |
| Nifedipine+U46619 | |||
| Thoracic aorta | 6 | 7.80±0.09 | 87.07±1.27 |
| Intrarenal artery | 8 | 7.40±0.10* | 21.04±2.16* |
| Coronary artery | 7 | 6.71±0.11*# | 44.25±5.70*# |
| *P < 0.05 vs thoracic aorta; #P < 0.05 vs intrarenal artery | |||
Fig 2、Tab 1结果显示,胸主动脉对5-HT的收缩反应不明显,只是在较高浓度(3 μmol·L-1)才能诱导收缩反应,但5-HT可浓度依赖性诱导肾内动脉和冠状动脉收缩反应,且Emax和pEC50无差异(P > 0.05)。给予1 μmol·L-1硝苯地平孵育后,胸主动脉、肾内动脉和冠状动脉收缩的量效曲线均右移,且对冠状动脉收缩反应的抑制幅度(84.53±1.17)%明显大于肾内动脉(30.77±0.85)%(P < 0.05)。以上结果提示,在这3种动脉中,胸主动脉对5-HT反应不敏感;相较于肾内动脉,L-型钙通道在5-HT诱导的冠状动脉收缩反应中可能发挥更大的作用。
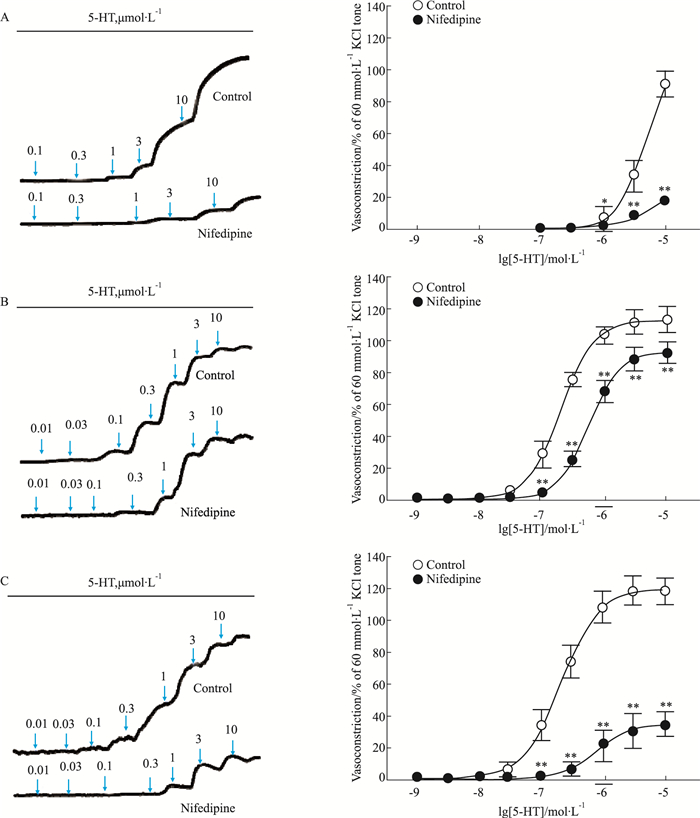
|
| Fig 2 Effect of nifedipine on concentration-dependent vasoconstriction induced by 5-HT in endothelium-denudedt thoracic aortic rings, intrarenal arterial rings and coronary arterial rings Left panel: Representative recording of 5-HT-evoked concentration-dependent contraction in endothelium-denuded thoracic aortas (A), intrarenal arteries (B) and coronary arteries (C) of rats. Right panel: Effect of nifedipine (1 μmol·L-1) on concentration-dependent vasoconstriction induced by 5-HT in endothelium-denuded thoracic aortic rings (A, n=12), intrarenal arterial rings (B, n=6) and coronary arterial rings (C, n=6) in rats.*P < 0.05, **P < 0.01 vs control. |
Fig 3、Tab 1结果显示,胸主动脉、肾内动脉和冠状动脉对U46619均产生明显的浓度依赖性收缩反应,胸主动脉与冠状动脉Emax无统计差异(P > 0.05),但均大于肾内动脉(P < 0.05);胸主动脉收缩量效曲线pEC50最大(P < 0.05),肾内动脉与冠状动脉之间无差异(P > 0.05)。1 μmol·L-1硝苯地平对U46619诱导胸主动脉、肾内动脉和冠状动脉收缩反应均有明显抑制作用,其抑制幅度分别为(38.88±1.73)%、(46.49±3.00)%、(94.18±3.54)%,对冠状动脉收缩反应的抑制幅度最大(P < 0.05),对胸主动脉和肾内动脉的抑制幅度无显著性差异(P > 0.05)。以上结果提示,在这3种动脉对U46619诱导的收缩反应性中,胸主动脉反应最敏感,肾内动脉收缩强度最弱,L-型钙通道在冠状动脉收缩反应中占明显优势。
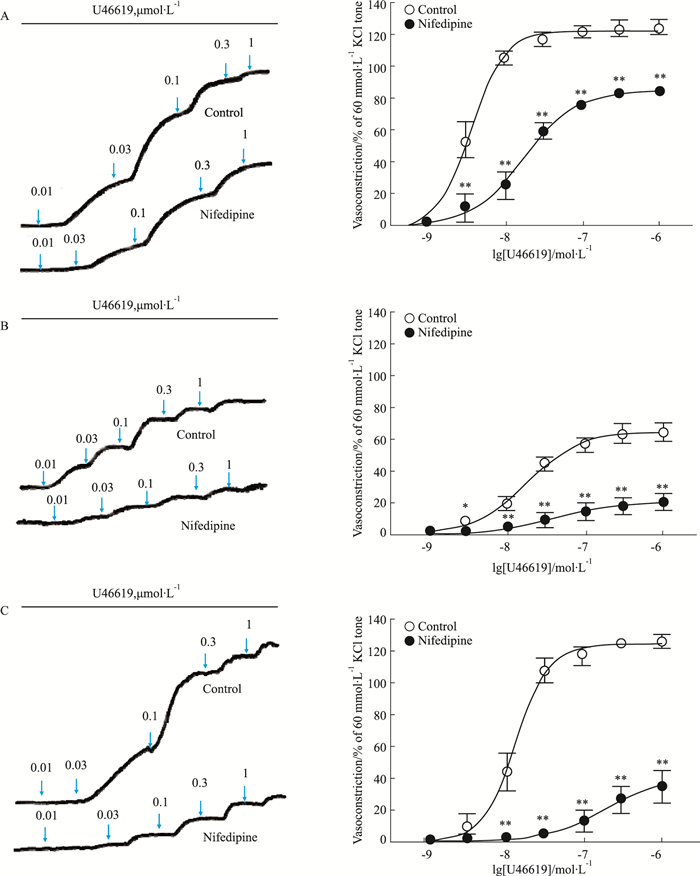
|
| Fig 3 Effect of nifedipine on concentration-dependent vasoconstriction induced by U46619 in endothelium-denuded thoracic aortic rings, intrarenal arterial rings and coronary arterial rings Left panel: Representative recording of U46619-evoked concentration-dependent contraction in endothelium-denuded thoracic aortas (A), intrarenal arteries (B) and coronary arteries (C) of rats. Right panel: Effect of nifedipine (1 μmol·L-1) on concentration-dependent vasoconstriction induced by U46619 in endothelium-denuded thoracic aortic rings (A, n=6), intrarenal arterial rings (B, n=8) and coronary arterial rings (C, n=7) in rats. *P < 0.05, **P < 0.01 vs control. |
L-型钙通道调控细胞内钙浓度在VSMCs收缩中至关重要。血管激动剂(Phe、5-HT、U46619)与VSMCs细胞膜上相应受体结合后,一方面激活磷脂酰肌醇特异性磷脂酶C(PI-PLC),使磷脂酰肌醇二膦酸(PIP2)水解,产生三磷酸肌醇(IP3)和二酯酰甘油(DAG),DAG可激活蛋白激酶C(PKC)。另一方面,激活Rho激酶,进而激活PKC。PKC被激活后,会进一步激活L-型钙通道,使其开放,外钙内流。细胞内钙离子与钙调蛋白结合形成钙-钙调蛋白复合物,进而激活肌球蛋白轻链激酶(MLCK),促进肌球蛋白轻链磷酸化,导致肌动蛋白和肌球蛋白相互作用,引起血管收缩[7]。
本课题组已研究报道,L-型钙通道在收缩剂诱导冠状动脉平滑肌收缩中具有种鼠差异性[8],还有众多研究探究病理状态下或衰老状态下动脉血管的功能改变及其机制[9],以及某药对不同部位动脉的影响[10],但是对于不同部位动脉收缩反应异质性及其机制探究相对较少。又因为血管平滑肌的收缩主要与激动剂诱导和细胞内外刺激引起的细胞内钙浓度增加有关,L-型钙通道广泛存在于VSMCs,在血管平滑肌收缩过程中,钙离子内流主要通过L-型钙通道[4]。所以L-型钙通道在内生性血管收缩剂诱导的动脉血管收缩与舒张中发挥着重要作用。因此,我们主要探究在有或无L-型钙通道参与下大鼠不同部位动脉的收缩差异性。血管收缩药物Phe、5-HT、U46619可分别模拟内源性活性物质Phe、5-HT和血栓素A2作用于血管平滑肌上α肾上腺素受体、5-HT受体和血栓素A2受体诱导血管平滑肌收缩,从而有助于在离体状态下观察血管在不同情况下的反应性[11]。
胸主动脉为大血管,主要作用是储存和运输血液;肾内动脉和冠脉为中型血管,后者用于供给心脏血液,前者一方面营养肾组织,另一方面参与尿液的生成。然而,具有功能性差异的三者之间是否存在异质性及其机制如何未知,因此,我们针对以上问题进行了探究。
本实验采用瘦型Zucker(fa/+)大鼠,它是一种正常大鼠,与常规动物无明显区别,常被用来研究代谢性疾病,如糖尿病、肥胖等,是模型Zucker(fa/fa)大鼠的对照鼠。本实验发现:(1)在Phe诱导的动脉血管收缩反应中,1 μmol·L-1硝苯地平对胸主动脉收缩反应的抑制幅度明显大于肾内动脉,提示相较肾内动脉L-型钙通道介导的钙内流在胸主动脉中占优势;胸主动脉对Phe的收缩敏感性大于肾内动脉,提示胸主动脉平滑肌上的α-肾上腺素受体的数量或敏感性较高。同时,发现大鼠冠状动脉对Phe无明显的收缩反应。也有研究报道猪冠状动脉上存在微量的α受体,以β受体占优势[12]。提示,冠状动脉对Phe无反应可能是由于大鼠冠状动脉上微量α受体不足以引起血管收缩,或是冠状动脉受非内皮机制舒张作用抵消了其收缩作用,此机制需要进一步探究。(2)5-HT可浓度依赖性诱导肾内动脉和冠状动脉收缩,两者Emax和pEC50均无明显差异,但是相较于肾内动脉,L-型钙通道介导的钙内流在冠状动脉中占优势,非L-型钙通道介导的钙内流在肾内动脉中占优势。同时发现胸主动脉在所给药物剂量范围内对5-HT量效曲线不明显,且未达最大收缩强度,此结果与Ibarra等[13]用5-HT对WKY大鼠实验的现象相似,但与自发性高血压大鼠实验的结果有差别。(3)在U46619诱导的动脉血管收缩反应中,胸主动脉、肾内动脉和冠状动脉对U46619均产生明显的浓度依赖性收缩反应,且胸主动脉反应最敏感,肾内动脉收缩强度最弱,L-型钙通道介导的钙内流在U46619诱导冠状动脉收缩反应中占明显优势。
目前临床所用的L-型钙通道阻断剂可用于治疗高血压、心绞痛、肥厚性心肌病、脑血管疾病、心律失常等。由于血管收缩剂诱导不同部位动脉血管收缩差异与L-型钙通道有关,因此,提示在治疗不同部位(如心脏和肾脏)疾病时,可根据病人情况,酌情给予相应的药物剂量,以降低药物带来的副作用。
总之,本研究发现大鼠不同部位动脉血管对血管收缩剂(Phe、5-HT或U46619)的收缩反应性存在明显差异,即大鼠不同部位动脉存在异质性,并且不仅与动脉VSMCs上的L-型钙通道有着密切的关系,还与其非L-型钙通道有关,但是具体涉及哪些非L-型钙通道,如钙库操纵性钙通道、非选择性阳离子通道等,需要进一步探究。另外,实验结果也显示针对不同的血管收缩剂,硝苯地平即使在同一血管上的收缩抑制效应也不同,这可能由于受体种类不同,也可能涉及其他因素或因子参与大鼠动脉收缩反应的异质性,具体是什么原因仍需进一步探究。
( 致谢: 本实验在广东省冠心病重点实验室完成,感谢各位老师和同学在实验过程中的帮助。)
| [1] | Matchkov V V, Kudryavtseva O, Aalkjaer C, et al. Intracellular Ca2+ signalling and phenotype of vascular smooth muscle cells[J]. Basic Clin Pharmacol Toxicol, 2012, 110(1): 42-8. doi:10.1111/pto.2011.110.issue-1 |
| [2] | 刘海伟, 韩雅玲. 血管平滑肌细胞异质性的研究进展[J]. 国外医学(心血管疾病分册), 2004, 31(6): 323-5. Liu H W, Han Y L. Advances in heterogeneity of vascular smooth muscle cells[J]. Foreign Med Sci (Section Cardiovasc Dis), 2004, 31(6): 323-5. |
| [3] | Owens G K, Kumar M, Wamhoff B R, et al. Molecular regulation of vascular smooth muscle cell differentiation in development and disease[J]. Physiol Rev, 2004, 84(3): 767-801. doi:10.1152/physrev.00041.2003 |
| [4] | Wamhoff B R, Bowles D K, Mcdonald O G, et al. L-type voltage-gated Ca2+ channels modulate expression of smooth muscle differentiation marker genes via a Rho kinase/myocardin/SRF-dependent mechanism[J]. Circ Res, 2004, 95(4): 406-14. doi:10.1161/01.RES.0000138582.36921.9e |
| [5] | 邝素娟, 邓春玉, 张光燕, 等. 二烯丙基三硫化物对大鼠离体肾内动脉血管张力的影响[J]. 中国药理学通报, 2011, 27(10): 1409-13. Kuang S J, Deng C Y, Zhang G Y, et al. Effect of diallyl trisulfide on rat intrarenal arteries in vitro[J]. Chin Pharmacol Bull, 2011, 27(10): 1409-13. doi:10.3969/j.issn.1001-1978.2011.10.018 |
| [6] | 邝素娟, 邓春玉, 杨慧, 等. 离体大鼠冠状动脉的分离培养及张力测定技术[J]. 中国药理学通报, 2014, 30(3): 433-7. Kuang S J, Deng C Y, Yang H, et al. Measurement techniques of isolation, organ culture and isometric tension of rat coronary artery in vivo[J]. Chin Pharmacol Bull, 2014, 30(3): 433-7. |
| [7] | Bolotina V M. Orai1, STIM1, and iPLA2β determine arterial vasoconstriction[J]. Arterioscler Thromb Vasc Biol, 2012, 32(5): 1066-7. doi:10.1161/ATVBAHA.112.245449 |
| [8] | Yang H, Kuang S, Rao F, et al. Species-specific differences in the role of L-type Ca2+ channels in the regulation of coronary arterial smooth muscle contraction[J]. Naunyn Schmiedebergs Arch Pharmacol, 2016, 389(2): 151-7. doi:10.1007/s00210-015-1173-7 |
| [9] | 姜平, 黎健. 血管衰老及其机制[J]. 生物化学与生物物理进展, 2014, 41(3): 295-304. Jiang P, L J. Vascular aging and the corresponding mechanisms[J]. Prog Biochem Biophysics, 2014, 41(3): 295-304. |
| [10] | Bopp C, Auger C, Diemunsch P, et al. The effect of urapidil, an alpha-1 adrenoceptor antagonist and a 5-HT1A agonist on the vascular tone of the porcine coronary and pulmonary arteries, the rat aorta and the human pulmonary artery[J]. Eur J Pharmacol, 2016, 15(774): 53-8. doi:10.1016/j.ejphar.2016.03.012 |
| [11] | Zhang D, Lin S, Lau C W, et al. Anemoside A3-induced relaxation in rat renal arteries: role of endothelium and Ca2+ channel inhibition[J]. Planta Med, 2010, 76(16): 1814-9. doi:10.1055/s-0030-1250003 |
| [12] | 张冬慧, 廖明琪, 徐培涵, 等. 去甲肾上腺素和异丙肾上腺素对猪冠状动脉的舒张作用及机制研究[J]. 中国药师, 2012, 15(8): 1073-6. Zhang D H, Liao M Q, Xu P H, et al. Study on relaxation and underlying mechanisms of isoprenaline and norepinephrine on porcine coronary artery[J]. China Pharm, 2012, 15(8): 1073-6. |
| [13] | Ibarra M, Lopezguerrero J J, Mejiazepeda R, et al. Endothelium-dependent inhibition of the contractile response is decreased in aorta from aged and spontaneously hypertensive rats[J]. Arch Med Res, 2006, 37(3): 334-41. doi:10.1016/j.arcmed.2005.06.015 |