


2. 温州医科大学附属第一人民医院药剂科,浙江 温州 325000;
3. 第二军医大学药学院,上海 200433;
4. 温州大学生命科学研究院,浙江 温州 325035
 ,
HUI Qi1,
CAO Gao-zhong2,
LIU Jian-guo3,
DU Xiao-xiao1,
LI Xiao-kun1,4,
WANG Xiao-jie1
,
HUI Qi1,
CAO Gao-zhong2,
LIU Jian-guo3,
DU Xiao-xiao1,
LI Xiao-kun1,4,
WANG Xiao-jie1

2. the First People's Hospital of Wenzhou Medical University, Wenzhou Zhejiang 325000, China;
3. School of Pharmacy, Second Military Medical University, Shanghai 200433, China;
4. Institute of Biological Sciences, Wenzhou University, Wenzhou Zhejiang 325035, China
糖尿病足部溃疡(diabetic foot ulcer,DFC)是糖尿病的慢性并发症之一,是导致截肢的重要原因,不仅给患者带来巨大的精神压力、严重地影响生活质量,同时也给患者造成了繁重的经济负担[1-2]。随着现代生活水平的提高,糖尿病患者逐年增多,因此,迫切需要开发合适的治疗药物加速糖尿溃疡创面修复速度、提高愈合质量。
酸性成纤维细胞生长因子(acidic fibroblast growth factor,aFGF)具有营养和保护神经元、促进损伤修复等功能,可加速损伤愈合[3-6]。课题组所在团队前期开发的aFGF一类新药于2006年经FDA批准上市,商品名“艾夫吉夫”,在深Ⅱ度灼伤等急性创面的治疗中显示出明显促愈合、提高修复质量的功效[7]。然而,aFGF应用于糖尿病等慢性溃疡创面,效果不理想。据报道,强生公司开展了一项应用aFGF裸质粒治疗下肢缺血性溃疡的Ⅲ期临床试验,来自30个国家171个医院的525个重型肢端缺血溃疡患者参与的临床试验,以没有统计学差异而告终[8]。aFGF裸质粒Ⅲ期临床失败的主要原因与糖尿病等慢性溃疡创面微环境改变,造成缺血区aFGF基因转录表达能力下降,aFGF很快被细胞外环境蛋白酶降解有关。在糖尿病等慢性溃疡创面,高糖或者压力等外界刺激诱导产生活性氧族(reactive oxygen species,ROS)激活炎症细胞,产生过量的炎性因子,导致炎症反应延长,炎性渗出物累积破坏创面微环境,造成细胞损伤[9]。然而,糖尿病足经药物治疗后,附近微环境改善有助于减少减轻炎症刺激, 可提高干细胞移植后血管新生[10]。成纤维细胞、血管内皮细胞过度凋亡阻碍了肉芽组织生成,影响表皮细胞的移行及上皮化[11]。糖尿病等慢性溃疡创面,还存在基质金属蛋白酶过量表达,降解多种细胞外基质成分,同时糖基化终末产物的堆积使细胞外基质、胶原糖基化,阻止创面胶原的正常合成,破坏组织修复细胞的迁移环境[8]。糖尿病慢性溃疡创面上述微环境改变直接影响损伤愈合进程,造成损伤创面的迁延不愈。
水凝胶类工程材料具有诱导组织再生,调节细胞生长、分化,且无排斥反应。生长因子和合适的载体材料组合可以防止蛋白酶水解,有效保护和缓慢释放生长因子[12],有望成为治疗慢性溃疡和弥漫性皮肤创伤的新方法。卡波姆是丙烯酸键合烯丙基蔗糖或季戊四醇烯丙醚的高分子聚合物,是一类重要的药物递送材料[13-14]。本研究前期以卡波姆940为载体,制备加载rh-aFGF的卡波姆940凝胶,本研究以链脲佐菌素(streptozotocin,STZ)诱导制备SD大鼠糖尿病模型,研究rh-aFGF卡波姆940凝胶对糖尿病SD大鼠全层皮肤切除和烫伤两种模型的修复作用。
1 材料与方法 1.1 材料 1.1.1 实验动物♂ SD大鼠,体质量180~220 g,合格证号:20070000301262,购自上海Sippr-BK实验动物有限公司。
1.1.2 试剂rh-aFGF卡波姆940凝胶由浙江省生物技术制药工程重点实验室提供;STZ购自Sigma公司。
1.1.3 仪器手持血糖仪及试纸购自强生公司,YLS-5Q型烫伤仪购自济南益廷科技发展有限公司,石蜡包埋机(EG1150H)和石蜡切片机(RM2235)购自Leica公司(德国),ECLPSE 80i正置显微镜购自Nikon公司。
1.2 方法 1.2.1 1型糖尿病SD大鼠模型和皮肤创伤模型制备及分组所有大鼠实验均在第二军医大学实验动物中心(上海市)SPF级动物房完成。用0.1 mol·L-1柠檬酸(pH=4.5)缓冲液配制浓度为70 g·L-1的STZ溶液,按体质量1.0 mL·kg-1的剂量对SD大鼠进行尾静脉注射,每天1次,连续2 d,每次配制的STZ注射液在30 min内注射完毕。自第1次注射72 h后检查血糖,血糖≥11.1 mmol·L-1为合格模型。符合血糖条件的大鼠随机编号,用戊巴比妥钠按照体质量45 mg·kg-1进行腹腔注射麻醉,背部用脱毛剂脱毛。全层皮肤切除模型在背部一侧做1个直径1.8 cm圆形标记,用碘伏消毒皮肤后沿标记线将全层皮肤切除,创面按压止血;皮肤烫伤模型用YLS5Q型烫伤仪在背部烫出直径为1.8 cm的深Ⅱ度烫伤创面,烫伤条件为:烫头温度85℃,压力0.5 kg,时间为10 s。
两种皮肤损伤模型中的所有大鼠分为对照组(Control组)、赋形剂组(Vehicle组)和rh-aFGF卡波姆940凝胶低、高剂量组(Gel 90 AU组和Gel 270 AU组),每组8只。对照组每日仅用0.2 mL生理盐水处理,赋形剂组每日用未加载rh-aFGF卡波姆940凝胶0.2 mL处理,rh-aFGF卡波姆940凝胶低、高剂量组分别以90 AU·cm-2或270 AU·cm-2的剂量进行治疗。
1.2.2 糖尿病SD大鼠创面治疗及愈合速度研究创面形成后当天开始治疗,每天给药1次。治疗前用双氧水、生理盐水冲洗伤口,并用碘伏消毒创面,然后给予相应药物,并用棉签涂抹均匀,连续治疗21 d;每天观察每只动物伤口愈合情况,在相同条件下于0、7、14、21 d拍摄创面。伤口面积用Image Pro plus 6.0软件计算,伤口愈合速率以愈合百分比计算,计算公式如下:Pi=(Ao-Ai)·Ao-1,其中Ao为0 d伤口面积;Ai为创伤拍摄当天的面积。
1.2.3 HE染色及病理学评分连续给药21 d后,每组随机选择3只SD大鼠用10%的水合氯醛按体质量4.0 mL·kg-1腹膜内深度麻醉。将伤口周围的皮肤组织切下,在预冷4%多聚甲醛中固定过夜,石蜡包埋,切片,苏木精和伊红(HE)染色,用于组织病理学评估。使用正置显微镜以400的倍数观察成纤维细胞、肌成纤维细胞、毛细血管增殖和胶原纤维表达情况。使用半定量评分,无增殖(0分),轻度增殖(1分),显著增殖(2分),明显增生(3分)。
1.2.4 统计学分析通过GraphPad Prism 5.0软件进行t检验和ANOVA分析进行可量化结果的统计分析。等级资料用Radit分析。
2 结果 2.1 rh-aFGF卡波姆940凝胶提高糖尿病SD大鼠皮肤创面愈合速度如Fig 1A和Fig 2A所示,所有实验动物从创面形成当天到治疗结束,伤口表面干燥无渗出,无化脓溃烂现象。rh-aFGF卡波姆940凝胶对1型糖尿病大鼠全层皮肤切除和烫伤模型均有较好的治疗效果,从创面形成(0 d)后开始,随着治疗时间的延长,各组伤口面积均逐渐缩小,但缩小程度以治疗组最明显。
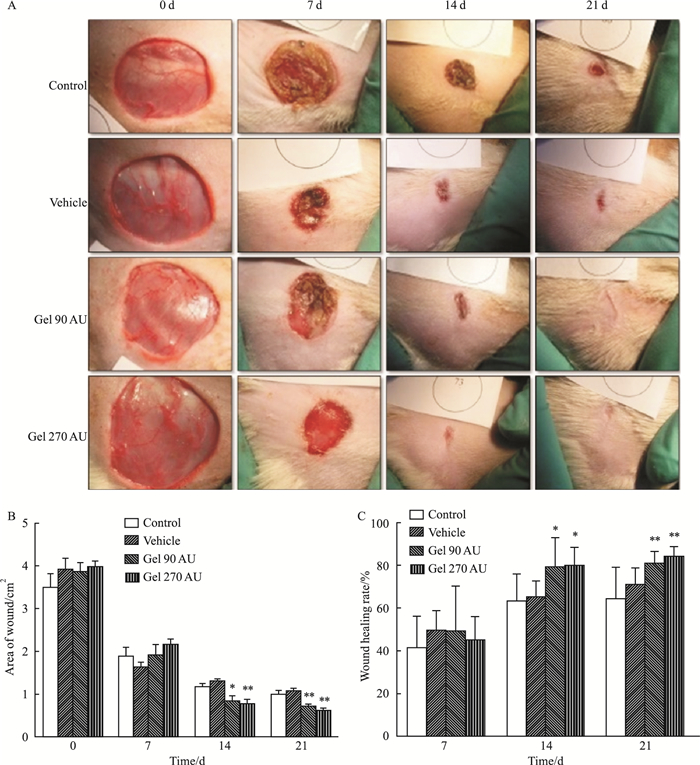
|
| Fig 1 Effect of rh-aFGF-carbomer gel on healing rate of full-thickness wound model (n=8) A:Photographs of wound; B:Area of wound; C:Wound healing rate. *P < 0.05, **P < 0.01 vs control |
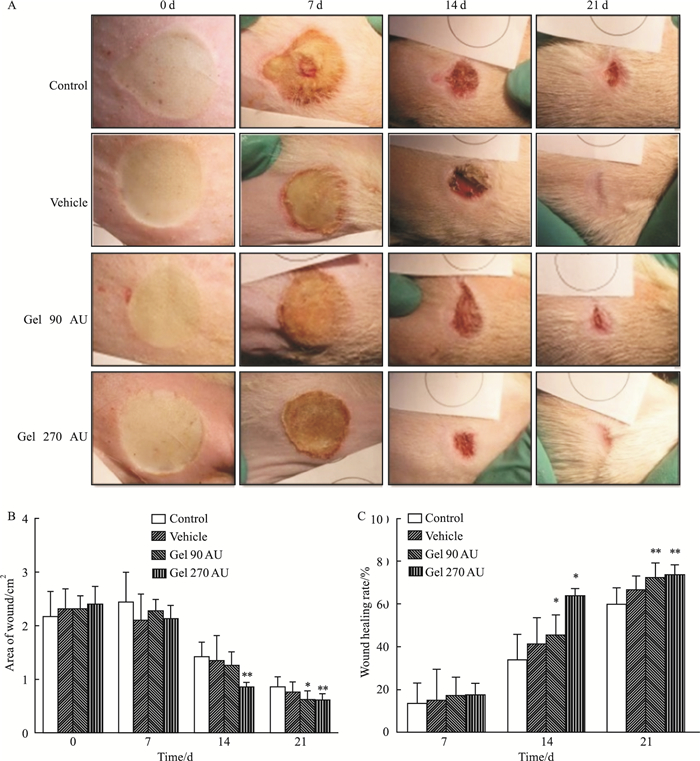
|
| Fig 2 Effect of rh-aFGF-carbomer gel on healing rate of scalded skin (n=8) A:Photographs of skin wound; B:Area of wound; C:Wound healing rate. *P < 0.05, **P < 0.01 vs control. |
全层皮肤切除模型:如Fig 1B所示,经21 d治疗,对照组的伤口面积为(1.00±0.24)cm2,赋形剂组为(1.08±0.17)cm2,说明赋形剂组对创面愈合无影响,差异无统计学意义。rh-aFGF卡波姆940凝胶低、高剂量组伤口面积缩小分别为(0.72±0.14)cm2和(0.62±0.18)cm2,与对照组比较差异明显(P < 0.01)。如Fig 1C所示,创面面积缩小百分率:对照组平均为(64.6±14.80)%,rh-aFGF卡波姆凝胶低、高剂量组分别是(81.40±5.48)%和(84.20±4.82)%,与对照组比较差异具有统计学意义(P < 0.01)。
烫伤模型:如Fig 2B所示,空白对照组经21 d治疗烫伤面积缩小为(0.86±0.19)cm2;rh-aFGF卡波姆940凝胶低、高剂量组烫伤面积缩小分别为(0.63±0.16)cm2和(0.62±0.11)cm2,与对照组比较差异明显(P < 0.05, P < 0.01)。如Fig 2C所示,创面面积缩小百分率:对照组为(60.30±7.78)%,而rh-aFGF卡波姆940凝胶剂低、高剂量治疗组分别为(72.80±6.89)%和(74.20±4.56)%,与对照组相比差异均具有统计学意义(P < 0.01)。
2.2 rh-aFGF卡波姆940凝胶提高创伤皮肤病理学评分如Fig 3所示,每组动物在实验结束选取3只做皮肤HE病理切片检查,重点观察成纤维细胞、肌成纤维细胞细胞、毛细血管和胶原纤维增殖情况,采用半定量化评分。如Fig 3B、3D所示,rh-aFGF卡波姆940凝胶明显促进两种皮肤创伤模型的成纤维细胞增殖(P < 0.05)。并且从Fig 3D可知,rh-aFGF卡波姆940凝胶能明显促进烫伤模型胶原纤维生成(P < 0.05)。
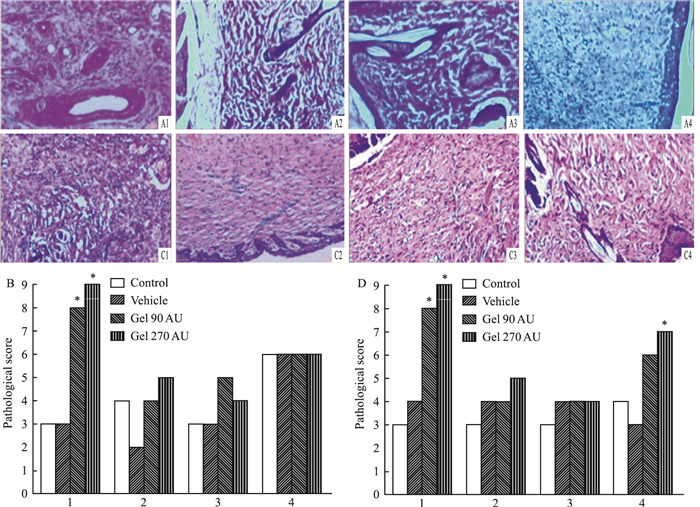
|
| Fig 3 Results of HE staining of rh-aFGF-carbomer gel on skin wound model (n=3) A.HE staining in 21 days of full-thickness model(A1:Control、A2:Vehicle; A3:Gel 90AU; A4:Gel 270AU); B.Total pathological evaluation of HE staining of full-thickness model(1:Fibroblast; 2:Fibrocyte; 3:Capillary Vessel; 4:Collagen Fibers); C:HE staining in 21 days of scalded model(C1:Control、C2:Vehicle; C3:Gel 90AU; C4:Gel 270AU); D:Total pathological evaluation of HE staining of full-thickness model(1:Fibroblast; 2:Fibrocyte; 3:Capillary Vessel; 4:Collagen Fibers).*P < 0.05 vs control. |
糖尿病溃疡创面微环境改变,导致组织生长因子及其受体表达下调,是糖尿病溃疡难愈合的重要原因之一[11]。aFGF在创面愈合中的作用已得到广泛认可,但是在炎症因子介导的慢性溃疡创面,aFGF很容易被细胞外蛋白酶降解而丧失药理作用[15],因此,aFGF应用在糖尿病等慢性溃疡创面其效果受到极大影响。
本研究利用STZ诱导产生1型糖尿病,制备SD大鼠全层皮肤切除和烫伤模型,模拟糖尿病患者急性损伤和慢性损伤的修复过程,研究rh-aFGF卡波姆940凝胶对糖尿病损伤的修复作用。实验结果显示,rh-aFGF卡波姆940凝胶对1型糖尿病SD大鼠全层皮肤切除和烫伤创面有非常明显的促进愈合作用,创面面积经14 d治疗后明显缩小。在全层皮肤切除模型和烫伤模型的增殖评分中,对照组四项指标评分指数总和分别为16和13,赋形剂组指数总和分别为14和16,两者较为接近。rh-aFGF卡波姆凝胶高、低剂量组均显示较高纤维细胞指数和新血管指数,指数总和均大于23,从病理学评分综合显示较好治疗效果。有文献报道,皮肤疖痈溃疡修复疗效与抗菌活性和免疫增强作用可能有关[16]。本研究中,水凝胶rh-aFGF卡波姆940凝胶疗效作用可能与改善创面微环境,提高抑菌能力和降低炎症反应有关,其疗效在全层皮肤切除模型更加明显。以卡波姆940加载rh-aFGF制备的水凝胶,对水和气体具有双向通透性;具有良好屏障功能,有效抵御细菌入侵,防止感染;使创面始终处于湿润的微环境中,不仅利于伤口愈合且可浸润暴露的末梢神经;有效吸收伤口分泌物,避免黏连;与皮肤溃疡面有较好接触性能;呈透明状,有利于对伤口愈合情况的观察。
上述实验结果提示,rh-aFGF卡波姆940凝胶能明显促进糖尿病SD大鼠皮肤创伤愈合过程,有望成为一种治疗糖尿病溃疡的新制剂。
( 致谢: 感谢温州医科大学浙江省生物技术制药工程重点实验室和第二军医大学药学院及实验动物中心为本研究提供科研场所。感谢在实验过程中给予帮助的老师和同学!)
| [1] | Chammas N K, Hill R L, Edmonds M E. Increased mortality in diabetic foot ulcer patients:the significance of ulcer type[J]. J Diabetes Res, 2016, 2016: 2879809. |
| [2] | Danmusa U M, Terhile I, Nasir I A, et al. Prevalence and healthcare costs associated with the management of diabetic foot ulcer in patients attending Ahmadu Bello University Teaching Hospital, Nigeria[J]. Int J Health Sci (Qassim), 2016, 10(2): 219-28. |
| [3] | Kobielak A, Zakrzewska M, Kostas M, et al. Protease resistant variants of FGF1 with prolonged biological activity[J]. Protein Pept Lett, 2014, 21(5): 434-43. doi:10.2174/0929866520666131203102315 |
| [4] | Perry R J, Lee S, Ma L, et al. FGF1 and FGF19 reverse diabetes by suppression of the hypothalamic-pituitary-adrenal axis[J]. Nat Commun, 2015, 286(6): 6980. |
| [5] | Suh J M, Jonker J W, Ahmadian M, et al. Endocrinization of FGF1 produces a neomorphic and potent insulin sensitizer[J]. Nature, 2014, 513(7518): 436-9. doi:10.1038/nature13540 |
| [6] | Sun K, Scherer P E. The PPARγ-FGF1 axis:an unexpected mediator of adipose tissue homeostasis[J]. Cell Res, 2012, 22(10): 1416-8. doi:10.1038/cr.2012.94 |
| [7] | 孙瑞朋, 赵连魁, 孙静, 等. 外用冻干重组人酸性成纤维细胞生长因子治疗浅Ⅱ度烧伤效果观察[J]. 中国乡村医药, 2015, 22(9): 11-2. Sun R P, Zhao L K, Sun J, et al. Observation on the effect of external use lyophilized recombinant human acidic fibroblast growth factor in the treatment of shallow 2 degree burn[J]. Chin J Rural Med Pharm, 2015, 22(9): 11-2. |
| [8] | Chen X, Ward S C, Cederbaum A I, et al. Alcoholic fatty liver is enhanced in CYP2A5 knockout mice:The role of the PPARα-FGF21 axis[J]. Toxicology, 2017, 379: 12-21. doi:10.1016/j.tox.2017.01.016 |
| [9] | BonDurant L D, Ameka M, Naber M C, et al. FGF21 regulates metabolism through adipose-dependent and -independent mechanisms[J]. Cell Metab, 2017, 25(4): 935-44. doi:10.1016/j.cmet.2017.03.005 |
| [10] | 郭勇英, 常丽萍, 张军芳, 等. 通心络对糖尿病足大鼠缺血下肢移植外周血间充质干细胞的微环境影响[J]. 中国药理学通报, 2017, 33(7): 1032-3. Guo Y Y, Chang L P, Zhang J F, et al. Effect of Tongxinluo on microenvironment of peripheral blood derived mesenchymal stem cells transplantation in diabetic foot rat[J]. Chin Pharmacol Bull, 2017, 33(7): 1032-3. |
| [11] | Blakytny R, Jude E. The molecular biology of chronic wounds and delayed healing in diabetes[J]. Diabet Med, 2006, 23(6): 594-608. doi:10.1111/dme.2006.23.issue-6 |
| [12] | Wu J, Zhu J, He C, et al. Comparative study of heparin-poloxamer hydrogel modified bFGF and aFGF for in vivo wound healing efficiency[J]. ACS Appl Mater Interfaces, 2016, 8(29): 18710-21. doi:10.1021/acsami.6b06047 |
| [13] | Lund R G, Silva A F, Piva E, et al. Clinical evaluation of two desensitizing treatments in southern Brazil:a 3-month follow-up[J]. Acta Odontol Scand, 2013, 71(6): 1469-74. doi:10.3109/00016357.2013.770919 |
| [14] | Xu M, Sun M, Qiao H, et al. Preparation and evaluation of colon adhesive pellets of 5-aminosalicylic acid[J]. Int J Pharm, 2014, 468(1-2): 165-71. doi:10.1016/j.ijpharm.2014.04.040 |
| [15] | Zhao Y Y, Huang X Y, Chen Z W. Daintain/AIF-1 (allograft inflammatory factor-1) accelerates type 1 diabetes in NOD mice[J]. Biochem Biophys Res Commun, 2012, 427(3): 513-7. doi:10.1016/j.bbrc.2012.09.087 |
| [16] | 姜霁洋, 徐涵, 白雪婷, 等. 朱槿花苞提取物治疗皮肤疖痈溃疡及其机制研究[J]. 中国药理学通报, 2015, 31(8): 1085-91. Jiang J Y, Xu H, Bai X T, et al. Research in skin healing and repair function and mechanism of Hibiscus rosa-sinensis Linn bud extract[J]. Chin Pharmacol Bull, 2015, 31(8): 1085-91. |