

脑胶质瘤是中枢神经系统最常见的原发性的恶性肿瘤,呈侵袭性生长、复发率高的特点,其预后较差。脑胶质瘤的本质上是一种多基因异常疾病,其分子机制可能是由于抑癌基因的突变缺失及原癌基因的过表达,导致胶质瘤细胞逃避了正常的调控机制,故胶质瘤相关的异常基因及其作用机制仍为当前的研究热点[1]。
miRNA是20~25个核苷酸大小的非编码蛋白的小分子RNA,miRNA可互补结合靶mRNA 3′非编码区(untranslated region, UTR)端,导致靶mRNA的降解或翻译抑制,其在转录后的水平对靶基因表达形成负调控[2],影响细胞增殖和凋亡等生物学行为[3-4]。miRNA-99b属于miRNA-99基因簇,该基因簇的多个成员被证实与肿瘤的发生、发展密切相关[5-7]。哺乳动物雷帕霉素靶分子(mammalian target of rapamycin,mTOR)是一种非典型丝氨酸/苏氨酸蛋白激酶,其表达异常与肿瘤细胞的迁移、侵袭以及肿瘤的复发和耐药相关[8]。最新研究表明[9],miRNA-99b在脑胶质瘤中表达降低,可能与脑胶质瘤发生、发展有关,但其在脑胶质瘤中具体靶点尚不明确。本实验通过前期预实验及文献支持,推测miRNA-99b对脑胶质瘤的作用可能是通过靶向调控mTOR。故本研究旨在探讨miRNA-99b对脑胶质瘤U251细胞侵袭的影响及调控mTOR作用机制,以期为胶质瘤的治疗寻找新的分子靶点。
1 材料与方法 1.1 材料 1.1.1 临床标本收集新乡医学院第一附属医院自2010年1月至2015年12月手术切除,术后病理证实为脑胶质瘤的标本共36例,其中23例男性,13例女性,年龄18~60岁,平均45.9岁。根据WHO 2007对神经系统肿瘤分类标准进行分级,其中13例低级别脑胶质瘤:包括9例WHOⅠ~Ⅱ级低级别星形细胞瘤和WHO Ⅱ级4例少突胶质细胞瘤;23例高级别胶质瘤:包括11例WHO Ⅲ级间变性星形细胞瘤和12例WHO Ⅳ级胶质母细胞瘤。正常对照组:8例正常脑组织(颅脑外伤手术切除)。
1.1.2 细胞与试剂脑胶质瘤U251细胞为本实验室保存。胎牛血清和DMEM培养基购自美国HyClone公司;逆转录、real-time PCR试剂盒购自日本TaKaRa公司;miRNA-99b引物、miRNA-99b模拟物(5′-CACCCGUAGAACCGACCUUGCG-3′)、Lipofectamine 2000转染试剂,购自上海吉凯生物科技公司;mTOR引物、质粒及其内参β-actin由武汉博士德公司合成;mTOR及内参一抗购自美国CST公司;含铺有Matrigel基质胶的Transwell小室购自美国Corning公司;mTOR野生型及突变型PsiCHECK荧光报告载体购自广州锐博生物科技公司。
1.1.3 仪器CO2细胞培养箱、低温高速离心机、转膜仪、生物安全柜(美国Thermo公司),荧光定量PCR仪器(美国Life公司),激光共聚焦显微镜(日本OLYMPUS公司),倒置相差显微镜(日本Nikon公司),超净工作台(苏州安泰空气技术有限公司),精密电子天平(德国Sartorious公司)。
1.2 方法 1.2.1 细胞培养及转染用含10%胎牛血清的DMEM培养基培养脑胶质瘤U251细胞,选取对数期生长的活力较好的细胞种板,按Lipo2000说明书进行转染。miRNA-99b mimics转染实验分3组:空白对照组(Blank)、阴性对照组(mimics control)和miRNA-99b mimics组;mTOR质粒转染实验分为3组:空白对照组(Blank)、阴性对照组(negative control)和mTOR PsiCHECK组。
1.2.2 real-time PCR检测脑胶质瘤组织及细胞中相关mRNA的表达TRIzol法提取组织、细胞的总RNA,用逆转录试剂盒将RNA逆转录成cDNA,扩增体系:SYBR Premix Ex Taq 10 μL,cDNA模板1μL,上、下游引物各0.5 μL,加无核酶水补充至20 μL,于95℃ 30s,95℃ 5s、60℃ 30s,进行35次循环。采用2-⊿⊿Ct法计算miRNA-99b、mTOR mRNA的表达水平。靶基因miRNA-99b的引物:上游5′-GTGCAGGGTCCGAGGT-3′,下游5′-TCACCCGTAGAACCGACCTT-3′,及其内参U6的引物:上游5′-CGCAAGGATGACACG-3′,下游5′-GAGCAGGCTGGAGAA-3′。靶基因mTOR的引物:上游5′-GCGAACCTCAGGGCAAGAT-3′,下游5′-TGACTCATCTCTCGGAGTTCCA-3′,其内参β-actin的引物:上游5′-CACCTTCTACAATGAGCTGCGTGTG-3′,下游5′-ATAGCACAGCCTGGATAGCAACGTAC-3′。
1.2.3 Transwell实验检测转染后U251细胞侵袭能力的变化预热铺有Matrigel胶的Transwell小室至37℃,下室中加入600 μL含10%胎牛血清的培养液。上室中加入含1×105个U251细胞的单细胞悬液,培养24 h后弃上室液体,用棉签擦去上室面未穿过膜的细胞,固定风干后用0.1 %的结晶紫染色20 min。400倍下计数5个视野中黏附细胞数的平均值,每组设4个复孔。
1.2.4 荧光素酶报告基因检测系统检测miRNA-99b对mTOR的调控取对数生长期的U251细胞,按5×104个细胞/孔接种于6孔板中。用含10%胎牛血清的DMEM培养液培养,待细胞融合度为70%左右时,按转染试剂说明书分别将miRNA-99b mimics和wt mTOR 3′-UTR、mimics control和wt mTOR 3′-UTR、miRNA-99b mimics和mut mTOR 3′-UTR、mimics control和mut mTOR 3′-UTR共转染至U251细胞。转染48 h后,按试剂盒说明书提供的方法检测上述细胞的相对荧光强度值。
1.2.5 Western blot法检测转染后U251细胞中mTOR蛋白的表达水平将蛋白提取缓冲液加入转染后的U251脑胶质瘤细胞中,反应后测定裂解液的蛋白浓度,根据浓度进行每孔上样,于10% SDS-PAGE的胶中进行电泳,转膜,将膜放置于5%脱脂奶粉封闭液中封闭,加入mTOR一抗、二抗依次孵育,暗室进行显影、定影。
1.2.6 预后随访全部胶质瘤术后患者,随访时间:12~53个月。随访后记录患者总生存期(overall survival,OS),观察脑胶质瘤患者miRNA-99b表达水平与OS的关系。
1.2.7 统计学处理所有实验数据均经SPSS 20.0统计软件分析。计量资料表示以x±s表示,组织分析采用两独立样本的t检验,多组数据比较采用单因素方差分析,进一步两两比较采用SNK-q检验。
2 结果 2.1 脑胶质瘤组织中miRNA-99b及mTOR的相对表达水平Real-time PCR检测高、低级别脑胶质瘤及正常脑组织中miRNA-99b和mTOR的表达水平。如Fig 1所示,miRNA-99b mRNA随胶质瘤恶性程度的增高而表达明显减少(F=836.3,P < 0.05);而高级别脑胶质瘤中mTOR mRNA表达水平较对照组明显增高,随胶质瘤恶性程度的增高而表达增高(F=136.4,P < 0.05)。
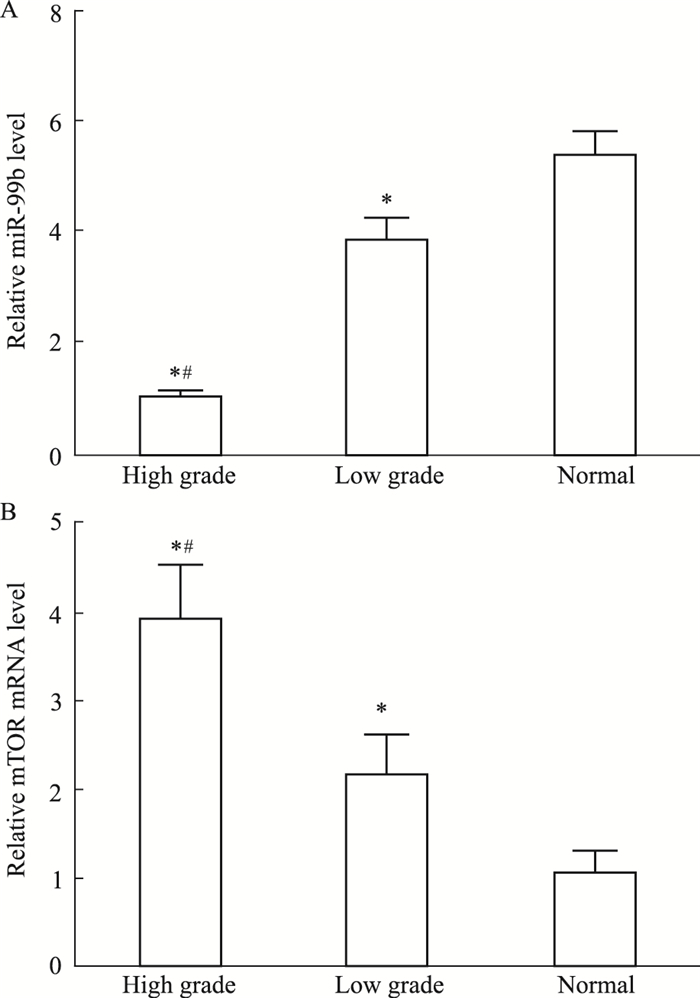
|
| Fig 1 Expressions of miRNA-99b (A) and mTOR mRNA(B) in glioma tissues and normal brain tissues *P < 0.05 vs normal; #P < 0.05 vs low grade |
Fig 2的real-time PCR检测结果显示,与Blank组和mimics control组比较,miRNA-99b mimics组细胞miRNA-99b的表达水平明显升高,差异有统计学意义(F=19.85,P < 0.01)。
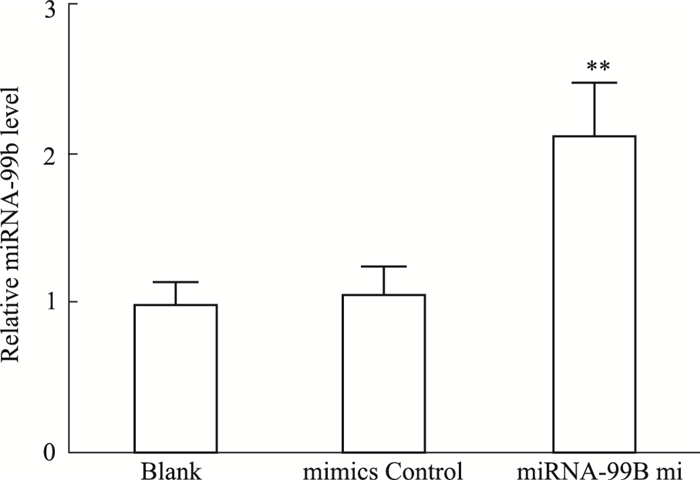
|
| Fig 2 Expression levels of miRNA-99b in U251 cells after transfection with miRNA-99b mimics **P < 0.01 vs blank group |
Fig 3的Transwell实验结果显示,与对照组比较,miRNA-99b mimics组的穿膜细胞数明显减少,差异有统计学意义(F=52.75,P < 0.01)。
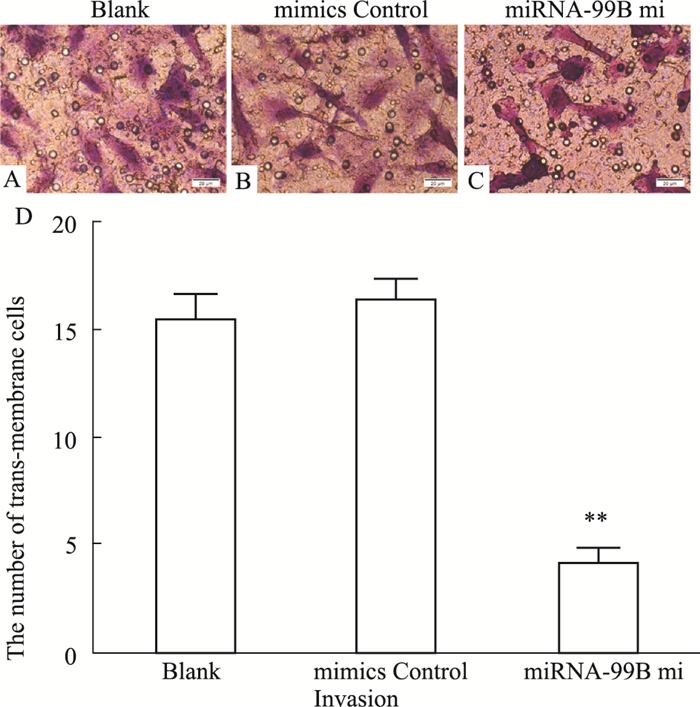
|
| Fig 3 Effects of transfection after miRNA-99b mimics on invasion of U251 cells (×400) A: U251 cells without any transfection; B: U251 cells were transfected with mimics control; C: U251 cells were transfected with miRNA-99b mimics; D: miRNA-99b mimics inhibited U251 cells invasion. **P < 0.01 vs blank group |
分别将miRNA-99b mimics和wt-mTOR 3′-UTR、mimics control和wt-mTOR 3′-UTR、miRNA-99b mimics和mut-mTOR 3′-UTR、mimics control和mut-mTOR 3′-UTR共转染至U251细胞后,应用荧光素酶报告基因检测试剂盒进行检测。Fig 4结果显示,miRNA-99b mimics和wt-mTOR 3′-UTR共转染组的荧光强度值明显低于mimics control和wt-mTOR 3′-UTR共转染组(P < 0.05),而miRNA-99b mimics和mut-mTOR 3′-UTR共转染组与mimics control和mut-mTOR 3′-UTR共转染组荧光强度值之间比较无统计学意义。这一结果说明,miRNA-99b可调控mTOR的表达。
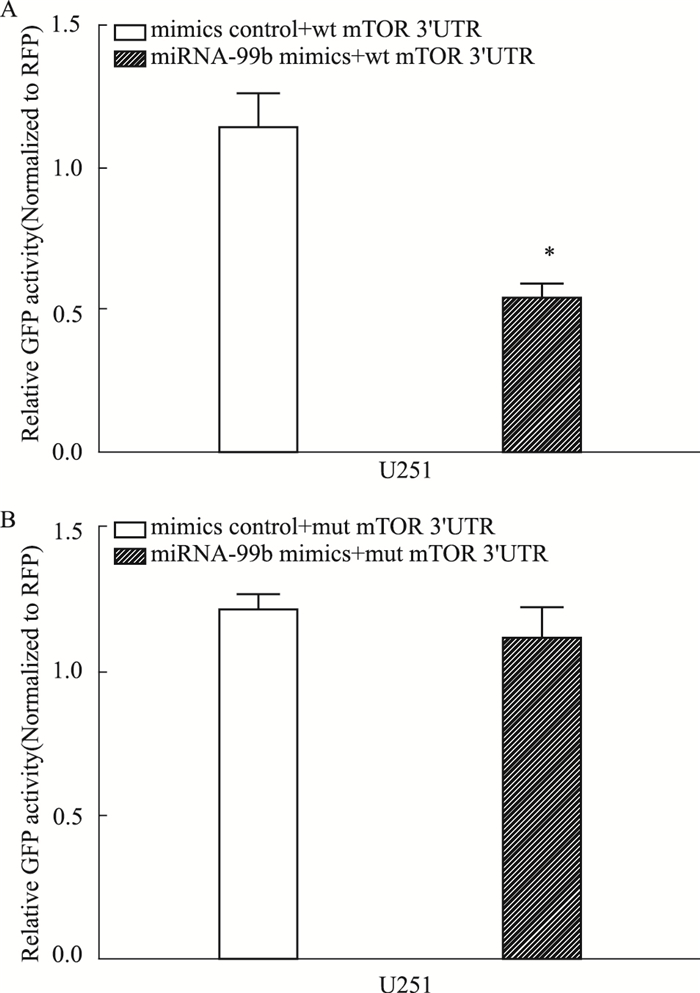
|
| Fig 4 U251 cells co-transfected with miRNA-99b mimics and wild-type(A) or mutant(B) mTOR 3′-UTR, and GFP intensity measured by the EGFP reporter assay *P < 0.05 vs mimics control+wt-mTOR 3′-UTR group |
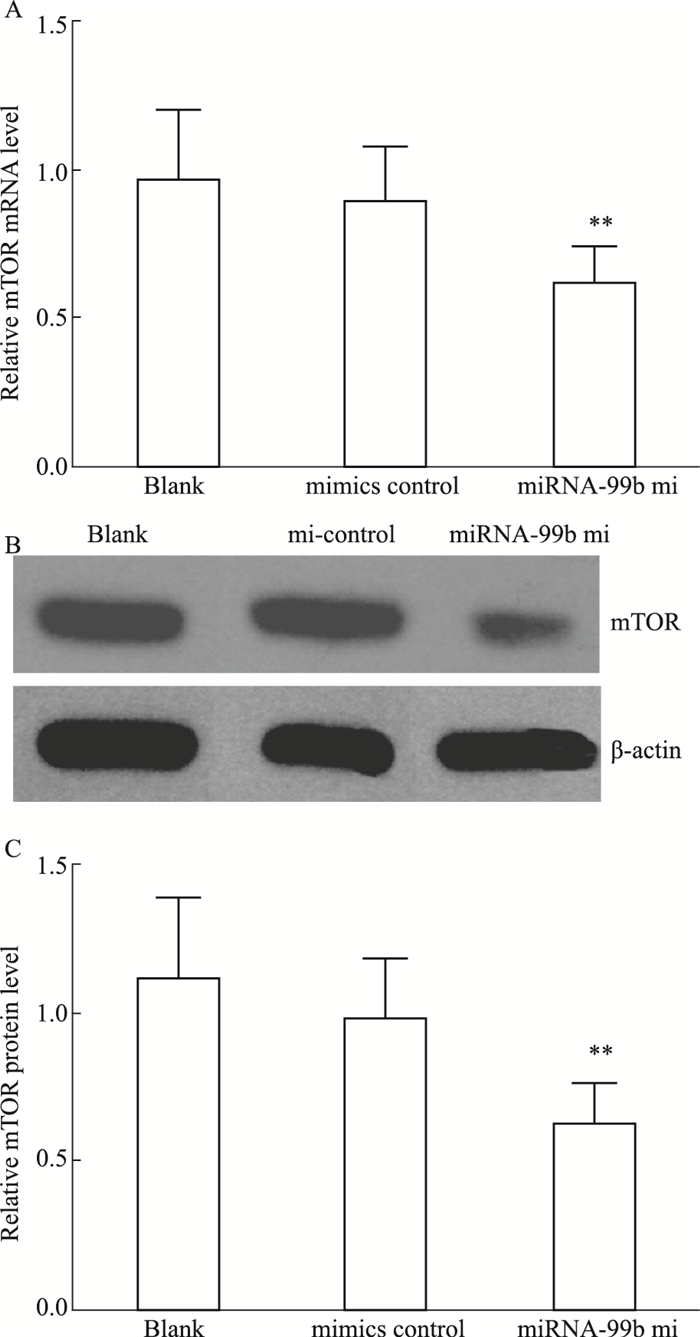
Fig 5A的real-time PCR检测结果显示,与Blank组和mimics control组比较,miRNA-99b mimics组细胞中mTOR mRNA的表达水平明显降低,差异有统计学意义(F=11.95,P < 0.01)。Fig 5B的Western blot结果显示,转染miRNA-99b mimics组mTOR蛋白表达水平较mimics control组和Blank组明显降低(F=5.44,P < 0.01),Blank组与miRNA control组相比差异无统计学意义。
|
| Fig 5 The expression levels of mTOR mRNA(A)and protein(B) in U251 cells after transfection with miRNA-99b mimics **P < 0.01 vs blank group |
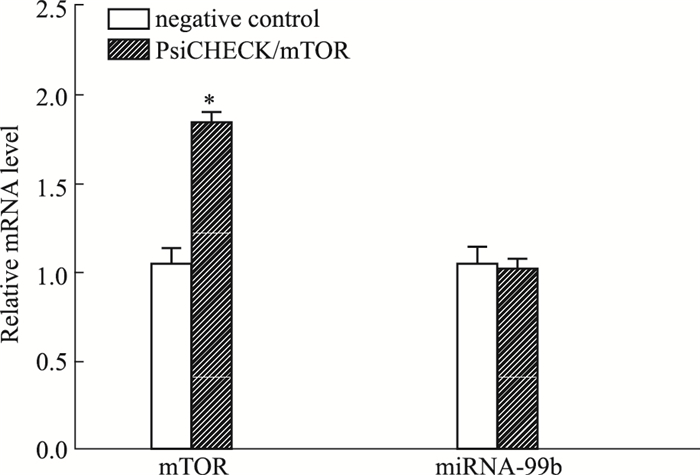
Fig 6的real-time PCR结果显示,转染mTOR表达质粒后,mTOR mRNA表达明显升高,两组间差异有统计学意义(P < 0.05);但miRNA-99b表达水平不受mTOR变化的影响,两组差异无统计学意义。
|
| Fig 6 The expression levels of mTOR mRNA and miRNA-99b evaluated by real-time PCR in U251 cells after transfected with PsiCHECK/mTOR *P < 0.05 vs mimics control group |
如Fig 7所示,脑胶质瘤U251细胞转染miRNA-99b mi+ PsiCHECK/mTOR后,与对照组比较,其脑胶质瘤U251细胞的侵袭能力明显升高(P < 0.01),表明恢复mTOR表达后,mTOR能明显恢复因miRNA-99b抑制的细胞侵袭能力。

|
| Fig 7 Cell invasion ability in U251 cells after transfected with PsiCHECK /mTOR showed by Transwell assay A: U251 cells were transfected with miRNA-99b and PsiCHECK /mTOR; B: U251 cells were transfected with miRNA-99b and PsiCHECK control; C: mTOR mimics restore U251 cells invasion. **P < 0.01 vs PsiCHECK/mTOR group |
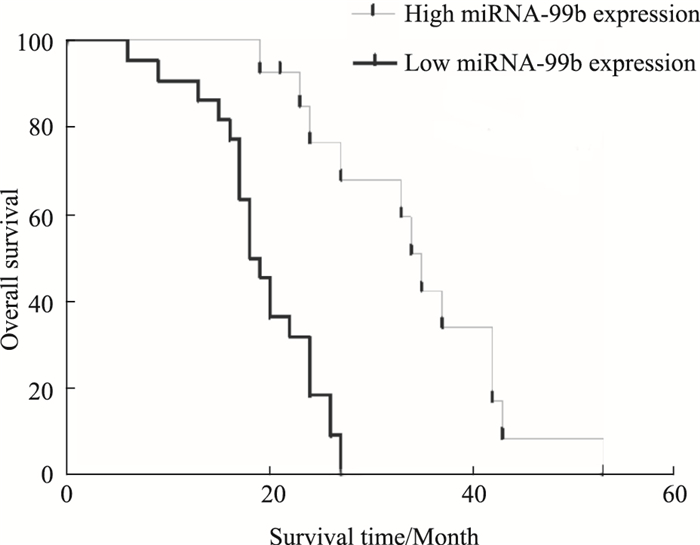
Fig 8 Kaplan-Meier生存分析显示,低表达miRNA-99b的胶质瘤患者的平均总生存期为18.5月,而高表达组miRNA-99b的胶质瘤患者平均总生存期为35.0月,miRNA-99b的单变量分析显示, miRNA-99低表达患者的总生存期明显低于高表达组,两组差异有统计学意义(P < 0.01)。
|
| Fig 8 Comparison of OS between miRNA-99b high expression group and low expression group in human gliomas |
脑胶质瘤恶性程度高,手术联合术后的放化疗后胶质瘤的预后仍较差,而目前找寻基因水平的治疗靶点是脑胶质瘤研究的主要方向。miRNA具有广泛的基因调节功能,许多研究发现,miRNA在脑胶质瘤中表达异常,认为脑胶质瘤的发生、发展可能与miRNA关系密切[3, 10]。
miR-99家族是miRNA家族中进化最原始的一组miRNA,它们调控的靶基因多参与细胞的增殖、分化、转移和凋亡[11]。研究发现,miRNA-99b在多种肿瘤中表达水平下调[9],提示其在肿瘤中可能起到抑癌基因的作用,调控肿瘤的发生和发展。研究发现[6],在乳腺癌细胞中,miRNA-99b通过下调转化生长因子β的表达,导致乳腺癌上皮间质转化,并可以明显抑制乳腺癌细胞的增殖和侵袭能力。上调miRNA-99b表达可影响DNA的修复,从而增加肿瘤细胞对放疗的敏感性[12]。以上研究表明,miRNA-99b对肿瘤的发生发展、预后可能起到非常重要的作用。miRNA-99b在脑胶质瘤中表达较正常脑组织低[9],但miRNA-99b对脑胶质瘤的影响及相关下游机制尚不清楚,需要进一步验证。
本研究首先发现脑胶质瘤组织中miRNA-99b的表达水平较其癌旁正常组织明显降低,得出miRNA-99b在脑胶质瘤组织中呈低表达,并且通过进一步实验将miRNA-99b mimics转染入脑胶质瘤U251细胞中,经real-time PCR实验证实U251细胞中的miRNA-99b表达水平明显升高,表明转染成功。Transwell侵袭实验结果显示,miRNA-99b的表达水平上调后,U251细胞的细胞侵袭能力明显受抑制。Kaplan-Meier生存分析显示,miRNA-99b高表达的胶质瘤患者的平均总生存期明显高于低表达miRNA-99b患者。综上表明miRNA-99b对脑胶质瘤的发展有重要的作用。
为了进一步探讨miRNA-99b对脑胶质瘤细胞的作用及其机制,首先生物信息学预测发现,mTOR在脑胶质瘤中可能作为miRNA-99b的靶基因,我们进一步通过荧光素酶实验验证。结果表明,转染miRNA-99b模拟物后,mTOR-MUT报告载体的荧光强度基本不受影响,而mTOR-WT报告载体的荧光强度受到明显影响,表明mTOR mRNA的3′UTR上存在miRNA-99b的结合位点,说明mTOR是miRNA-99b下游靶基因。
mTOR是1个保守的丝氨酸苏氨酸蛋白激酶,其信号转导通路失去正常功能可诱发各种疾病及肿瘤的产生,目前研究表明,mTOR信号通路在肿瘤细胞的恶性生物学表型中起重要作用。其发挥作用可能的主要方式包括:在细胞的生长增殖凋亡等过程中发挥着重要功能,参与细胞内的某些重要的信号转导过程等[13]。研究发现mTOR与肺癌、乳腺癌等多种肿瘤的发生、发展、预后密切相关[14],而mTOR在脑胶质瘤作用的具体调控机制尚不清楚。本研究检测在脑胶质瘤组织中行real-time PCR实验,在脑胶质瘤组织中mTOR的表达水平较其正常脑组织明显升高,进一步上调miRNA-99b的表达水平发现,脑胶质瘤U251细胞中mTOR的mRNA及蛋白表达水平明显下降。我们研究发现上调mTOR的表达,不影响miRNA-99b的表达水平,表明miRNA-99b对mTOR的调控作用是单向的,而上调mTOR的表达后,被miRNA-99b抑制的胶质瘤细胞的侵袭能力明显恢复。综上表明,上调miRNA-99b可能是通过抑制mTOR,进而抑制脑胶质瘤细胞的侵袭能力。
综上所述,在脑胶质瘤组织中miRNA-99b呈低表达,miRNA-99b过表达明显抑制脑胶质瘤U251细胞侵袭,并可能是通过介导mTOR实现的。因此,在脑胶质瘤中miRNA-99b可能作为一种抑癌基因,并可能为脑胶质瘤的基因治疗提供了新的思路靶点。
( 致谢: 本实验主要在新乡医学院第一附属医院河南省神经病学研究所完成,感谢实验室全体工作人员对本实验的大力协助。)
| [1] | 李业如, 庞祥媚, 李敏, 等. Cx43对脑胶质瘤C6细胞增殖的影响及机制[J]. 中国药理学通报, 2017, 33(7): 1008-13. Li Y R, Pang X M, Li M, et al. Effect of Cx43 on proliferation of C6 glioma cells and its mechanisms[J]. Chin Pharmacol Bull, 2017, 33(7): 1008-13. |
| [2] | Fan Y H, Ye M H, Wu L, et al. Overexpression of miR-98 inhibits cell invasion in glioma cell lines via downregulation of IKKepsilon[J]. Eur Rev Med Pharmacol Sci, 2015, 19(19): 3593-604. |
| [3] | Zeng Y. Principles of micro-RNA production and maturation[J]. Oncogene, 2006, 25(46): 6156-62. doi:10.1038/sj.onc.1209908 |
| [4] | 毛玉娣, 丁西平, 王华. 微小RNA与胃癌关系的研究进展[J]. 中国药理学通报, 2016, 32(6): 756-60. Mao Y D, Ding X P, Wang H. Research progress on relationship between microRNA and gastric cancer[J]. Chin Pharmacol Bull, 2016, 32(6): 756-60. |
| [5] | Kang J, Lee S Y, Lee S Y, et al. microRNA-99b acts as a tumor suppressor in non-small cell lung cancer by directly targeting fibroblast growth factor receptor 3[J]. Exp Ther Med, 2012, 3(1): 149-53. doi:10.3892/etm.2011.366 |
| [6] | Turcatel G, Rubin N, El-Hashash A, et al. miR-99a and miR-99b modulate TGF-beta induced epithelial to mesenchymal plasticity in normal murine mammary gland cells[J]. PLoS One, 2012, 7(1): e31032. doi:10.1371/journal.pone.0031032 |
| [7] | Wei F, Liu Y, Guo Y, et al. miR-99b-targeted mTOR induction contributes to irradiation resistance in pancreatic cancer[J]. Mol Cancer, 2013, 12(1): 81. doi:10.1186/1476-4598-12-81 |
| [8] | Porstmann T, Santos C R, Griffiths B, et al. SREBP activity is regulated by mTORC1 and contributes to Akt-dependent cell growth[J]. Cell Metab, 2008, 8(3): 224-36. doi:10.1016/j.cmet.2008.07.007 |
| [9] | Zhang M, Guo Y, Wu J, et al. Roles of microRNA-99 family in human glioma[J]. Onco Targets Ther, 2016, 9(1): 3613-9. |
| [10] | Wang J, Xu X, Mo S, et al. Involvement of microRNA-1297, a new regulator of HMGA1, in the regulation of glioma cell growth in vivo and in vitro[J]. Am J Transl Res, 2016, 8(5): 2149-58. |
| [11] | Chen Z, Jin Y, Yu D, et al. Down-regulation of the microRNA-99 family members in head and neck squamous cell carcinoma[J]. Oral Oncol, 2012, 48(8): 686-91. doi:10.1016/j.oraloncology.2012.02.020 |
| [12] | Mueller A C, Sun D, Dutta A. The miR-99 family regulates the DNA damage response through its target SNF2H[J]. Oncogene, 2013, 32(9): 1164-72. doi:10.1038/onc.2012.131 |
| [13] | Cheaib B, Auguste A, Leary A. The PI3K/Akt/mTOR pathway in ovarian cancer: therapeutic opportunities and challenges[J]. Chin J Cancer, 2015, 34(1): 4-16. doi:10.5732/cjc.014.10289 |
| [14] | Zhao X, Yang Y, Yao F, et al. Unfolded protein response promotes doxorubicin-induced nonsmall cell lung cancer cells apoptosis via the mTOR pathway inhibition[J]. Cancer Biother Radiopharm, 2016, 31(10): 347-51. doi:10.1089/cbr.2016.2079 |

