

2. 武汉工程大学化工与制药学院,湖北 武汉 430205;
3. 人福医药集团光谷生物城园区科福新药公司,湖北 武汉 430074
2. College of Chemical Engineering & Pharmacy, Wuhan Institute of Technology, Wuhan 430205, China;
3. Humanwell Healthcare (Group) Co., Ltd, Biolake Park, Wuhan 430074, China
查尔酮是广泛存在于自然界中一种黄酮类化合物,具有多种生物活性[1]。相对于黄酮的A/B环之间的吡喃酮的连接方式,查尔酮的A/B环之间以丙烯酮连接,在分子结构上具有较大的柔性,因此,能与不同的受体结合,具有广泛靶点效应[2]。而多靶点的化合物容易产生过于广泛的效应[3],查尔酮作为一个最小能级构型为长链结构的化合物,3个结构单元为2个苯环和1个丙烯酮。增加1个分子单元,使得药物分子的分子链长度变为原来的4/3,增加了化合物所占有的空间位置,从而增强其特异性。同时引入官能团能够加强其对于特定靶点的作用力。
本研究的先导化合物TSAHC(Fig 1)为近羰基端的磺酰胺化的长链查耳酮,被报道具有抑制肿瘤细胞侵袭的能力[4],是通过抑制基质金属蛋白酶(matrix metalloprotein, MMP)-2/9蛋白发挥作用[5]。本文以噻吩基团为主要的近羰基端衍生结构,通过Claisen-Schmidt缩合得到6个新的长链类查耳酮化合物。通过抗肿瘤细胞增殖实验确定作用浓度,采用Transwell实验评估其抗肿瘤迁移的能力,同时评估其对MMP-2蛋白的表达情况[6]。最后,通过SYBYL-X1.2进行基于受体模式的分子对接预测。
|
| Fig 1 Chemical reaction process and structure of TSAHC |
细胞外基质(extracellular matrix, ECM)是一种维持细胞正常形态,保持细胞间正常接触的重要物质,广泛分布于细胞中。相互交错并形成水样的胶状物[7]。肿瘤细胞从原发部位脱落,侵入ECM,分泌各种降解酶类,破坏ECM并进入血管,并渗到其他部位,形成转移灶。一般认为,转移度高的肿瘤细胞与其破坏ECM的能力密切相关[8]。多种酶被证实参与了侵袭的行为,而MMPs与ECM的降解被认为是肿瘤细胞侵袭和转移的关键因素,在多种恶性肿瘤均可见MMPs表达水平的增高[9]。本研究基于先导化合物和抗肿瘤侵袭靶点MMP-2而进行,结合分子药理学与计算机辅助设计,共同探究所得化合物的作用机制与构效关系。
1 材料与方法 1.1 化合物合成 1.1.1 仪器与试剂由linux平台支撑的SYBYL-X1.2软件工作站;予华YRE-301型旋转蒸发仪;予华X-5型显微熔点测定仪;AVANCE Ⅲ HD 400 MHz超导核磁共振谱仪(Bruker公司);LCMS-2010液质联用(Shimadzu公司)。氘代溶剂为DMSO-D6,CDCl3或MeOD,内标为TMS。TSAHC由人福医药集团-科福新药公司合成并提供,HPLC-DAD检测纯度>98%。起始化合物如无特别描述,均购自阿拉丁试剂。有机溶剂均为国药试剂分析纯或化学纯。
1.1.2 合成路线首先采用酰化反应和酯化反应,得到3个中间产物,然后将3个中间产物分别与邻羟基苯甲醛和对甲氧基苯甲醛进行羟醛缩合反应,得到了6个新的近羰基端延长的查耳酮类化合物,并进行表征。反应过程见Fig 1。
1.1.3 酰胺和磺酰胺苯乙酮的合成取10 mmol的2-噻吩甲酸/2-噻吩磺酸与50 mmol的二氯亚砜混合置于圆底烧瓶中持续搅拌,室温反应过夜后,蒸掉多余的二氯亚砜,得到具有反应活性的酰氯。向其中加入二氯甲烷溶解。而后将其滴加入含有10 mmol的4-氨基苯乙酮二氯甲烷溶液和5 mmol吡啶的混合溶液的圆底烧瓶中,冰浴反应2 h,旋干多余溶剂,饱和NaHCO3溶液洗涤残留物,最后用乙酸乙酯萃取饱和NaHCO3层3次,回收乙酸乙酯得到目标苯乙酮。
1.1.4 查尔酮的合成将三氟化硼乙醚溶液滴入含有1 mmol苯乙酮和1 mmol苯甲醛和10 mL二氧六环的圆底烧瓶中。80℃反应14~24 h,旋干二氧六环,而后用乙酸乙酯萃取残留物,然后依次用10% HCl溶液、蒸馏水、盐水洗涤萃取液,再用无水Na2SO4干燥,真空浓缩,残渣进行柱层析(正己烷:乙酸乙酯=3:1~1:1)纯化,最后得到产物为黄色固体。
1.2 抗肿瘤侵袭活性评估 1.2.1 细胞培养材料二甲基亚砜(DMSO)、噻唑蓝(MTT)为Sigma公司产品;人源乳腺癌细胞(MDA-MB-231)由郑州大学第一附属医院提供;胰蛋白酶:美国Gibco公司;新生小牛血清:杭州四季青公司;DMEM培养基:奥浦迈公司;Transwell小室:美国Costar公司;Matrigel胶:美国BD公司。
1.2.2 细胞培养人源乳腺癌细胞(MDA-MB-231)培养于添加了10%胎牛血清以及100 kU·L-1青霉素-链霉素的DMEM高糖培养基中;培养条件为37℃、5% CO2,每隔2~3 d传代1次,使细胞数目保持在1×108·L-1~1×109·L-1左右,生长代数在30代以前,且台盼蓝检测存活率大于95%的细胞方可用于实验。
1.2.3 抗肿瘤细胞增殖实验待MDA-MB-231细胞长至70%~80%融合度时,将其接种至96孔板内,接种密度为5×107·L-1,培养12 h,以不同浓度(0.05、0.5、1.0、2.5、5.0、10.0、20.0、50.0 μmol·L-1)的6种查耳酮化合物与TSAHC对照品,分别作用于MDA-MB-231细胞24 h。采用MTT细胞增殖检测法测定供试化合物对肿瘤细胞株的抑制作用。用酶标仪检测,检测波长570 nm。以0.1% DMSO为空白对照。存活率=(加药组OD值/对照组OD值)×100%,实验重复3次。
1.2.4 抗肿瘤细胞侵袭实验Transwell法评价所制备查耳酮化合物对MDA-MB-231细胞侵袭能力的影响。当MDA-MB-231细胞长至70%~80%融合度时,取上述实验中所得的IC50值为培养浓度,共培养24 h。取200 μL不同剂量组细胞移至装有8 μm孔径的聚碳酸酯膜,直径为13 mm的Transwell小室上室(含2% FBS,1×105/室),上室预铺制20 μL Matrigel胶,下室加入含10% FBS的DMEM高糖培养基,作用12 h后结晶紫染色,并对每组取3个不同的视野拍照。
1.2.5 MMP-2蛋白表达的检测将化合物1~6与阳性对照TSAHC,同0.1% DMSO的空白对照组与细胞共培养后,胰酶消化,用预冷至4℃的裂解缓冲液加入到经PBS漂洗的培养细胞中,冰上一段时间后离心,上清液保存于-20℃。采用Bradford法测定蛋白质浓度,SDS-PAGE凝胶电泳分离。通过电转移法将蛋白质从SDS-PAGE凝胶转移至硝酸纤维素膜,后者在含5%脱脂奶粉的TTBS中37℃封闭,加入MMP-2一抗(Santa Cruz, CA) 4℃孵育过夜,TTBS充分漂洗,加入二抗37℃作用,TTBS充分漂洗,ECL显色分析结果。
1.3 分子对接实验首先采用分子力学程序,对待测目标化合物1~6进行能量优化,加载Gasteiger-MMFF94电荷,以Powell能量梯度法优化得各个分子的低能稳定构象,保存入数据库。而后根据文献,从Protein Data Bank中选取MMP-2蛋白模型,加氢去水,修复残基等操作确立适合对接的蛋白凹陷或残基。采用SYBYL-X1.2软件的DOCKING模块,以Surflex-Dock GeomX模式进行对接,并同时计算出LogP值。
1.4 统计学方法应用SPSS 16.0统计软件进行统计学处理,计量资料用x±s表示,多组间比较采用方差分析,组内比较用t检验。
2 结果 2.1 NMR谱图分析(以活性最高的化合物2.3为例)从Fig 2A, 2B共有的信号中,可以看出查耳酮化合物所特有高耦合常数的双键dd峰,和噻吩环上的氢数目为1的两个d峰和一个t峰。Fig 2A采用MeDO作为氘代溶剂,可以从图中分辨出两个苯环上的氢原子,其中一个苯环上具有典型的氢数目为4的dd峰,原子个数符合结构式。但是由于MeDO的离子交换作用,在谱上找不到酰胺和间位羟基的氢信号。Fig 2B采用DMSO作为氘代溶剂,也可以从图中分辨出两个苯环上的氢原子,原子个数符合结构式,其中在8.2左右可以明显看出苯环上的dd峰,并可在低场找到两个数目为1的氢信号,分别为磺酰胺和间位羟基的氢信号,化合物结构的详细信息如下:
|
| Fig 2 NMR of compound 2(A) and 3(B) |
化合物1淡黄色固体,产率31%,熔点: (209~212)℃ 1H NMR (400 MHz, DMSO) δ 9.63 (s, 1H), 8.26 (d, J=8.7 Hz, 2H), 8.10 (dd, J=23.1, 4.4 Hz, 3H), 7.88 (d, J=15.6 Hz, 1H), 7.67 (d, J=15.6 Hz, 1H), 7.50 (d, J=8.7 Hz, 2H), 7.32 (d, J=20.1 Hz, 2H), 7.30~7.19 (m, 2H), 6.88 (d, J=7.9 Hz, 1H)。MS(ES, m/z): 348.8 (ES-)。
化合物2淡黄色固体,产率36%,熔点: 209~162℃ 1H NMR (400 MHz, MeOD) δ 8.01 (d, J=8.8 Hz, 2H), 7.74 (d, J=5.0 Hz, 1H), 7.65 (t, J=5.9 Hz, 3H), 7.34 (d, J=8.8 Hz, 2H), 7.28~7.17 (m, 2H), 7.13 (s, 1H), 7.10~7.05 (m, 1H), 6.87 (d, J=9.0 Hz, 1H). MS(ES, m/z): 347.8 (ES-)。
化合物3淡黄色固体,产率32%,熔点: (159~162)℃ 1H NMR (400 MHz, DMSO) δ 10.55 (s, 1H), 9.63 (s, 1H), 8.20 (d, J=8.6 Hz, 2H), 8.10 (d, J=3.5 Hz, 2H), 8.02~7.79 (m, 4H), 7.64 (d, J=15.7 Hz, 1H), 7.29 (dd, J=20.5, 6.2 Hz, 3H), 6.88 (d, J=7.7 Hz, 1H). MS(ES, m/z): 383.8 (ES-)。
化合物4淡黄色固体,产率28%,熔点: (159~162) ℃ 1H NMR (400 MHz, CDCl3) δ 7.99 (d, J=8.5 Hz, 2H), 7.81 (d, J=15.6 Hz, 1H), 7.61(dd, J=11.2, 4.4 Hz, 4H), 7.39 (d, J=15.6 Hz, 1H), 7.29 (d, J=7.5 Hz, 2H), 7.07~7.01 (m, 1H), 6.96 (d, J=8.6 Hz, 2H), 3.88 (s, 3H)。MS(ES, m/z): 362.1 (ES-)。
化合物5淡黄色固体,产率29%,熔点: (159~162) ℃ 1H NMR (400 MHz, CDCl3) δ 8.08 (d, J=8.7 Hz, 2H), 7.97 (s, 1H), 7.86~7.78 (m, 3H), 7.71 (d, J=3.5 Hz, 1H), 7.62 (t, J=6.3 Hz, 3H), 7.46 (d, J=15.6 Hz, 1H), 7.20~7.14 (m, 1H), 6.96 (d, J=8.7 Hz, 2H), 3.88 (s, 3H)。MS(ES, m/z): 361.9 (ES-)。
化合物6淡黄色固体,产率35%,熔点: (159~162) ℃ 1H NMR (400 MHz, CDCl3) δ 8.08 (d, J=15.8 Hz, 2H), 8.01 (d, J=3.7 Hz, 1H), 7.81 (d, J=15.6 Hz, 1H), 7.70 (d, J=4.9 Hz, 1H), 7.62 (d, J=8.7 Hz, 2H), 7.39 (t, J=11.8 Hz, 3H), 7.23~7.15 (m, 1H), 6.95 (d, J=8.7 Hz, 2H), 3.86 (s, 3H)。MS(ES, m/z): 397.8 (ES-)。
2.2 抗肿瘤细胞增殖和侵袭结果 2.2.1 抗肿瘤细胞增殖采用MTT比色法评估所得化合物对于MDA-MB-231存活率的影响。化合物1~6与阳性对照TSAHC对于MDA-MB-231的IC50依次为18.53、6.32、4.72>20>20、5.89、1.98 μmol·L-1。其中化合物2、3、6与阳性对照表现较好,该结果为后续实验提供了给药浓度。
2.2.2 抗肿瘤细胞侵袭如Fig 3所示,相较于空白对照组(0.1% DMSO),以IC50为作用浓度,化合物2、3与TSAHC表现出了良好的抑制肿瘤侵袭的能力,这与抗增殖实验中的趋势十分吻合。其他化合物则没有显示出太多区别,尤其是化合物6,虽然可以有效抑制肿瘤细胞的增殖,但对肿瘤细胞的侵袭行为并没有影响。鉴于Matrigel被用作ECM的模拟物,因此,可以推断化合物2、3可以抑制肿瘤细胞MDA-MB-231对ECM的降解,而化合物6却没有这种能力。该结论为下一步的实验指明了方向。
|
| Fig 3 Inhibition of tumor invasion by Transwell assay in MDA-MB-231(n=3) A~F: Groups treated by compounds 1~6; G, 7: TSAHC; H, 8: Blank group; I: Bar graph for the group A~H. *P < 0.05 vs blank group |
如Fig 4所示,化合物2、3可以有效抑制MMP-2蛋白的表达,MMP-2的表达水平与表观学实验中所得结论基本一致。
|
| Fig 4 Expression of MMP-2 in each group (n=3) A: The expression of MMP-2; B: The expression bar graph of MMP-2. 1-6: Groups treated by compounds 1~6; 7: Blank control; 8:TSAHC. *P < 0.05 vs blank group |
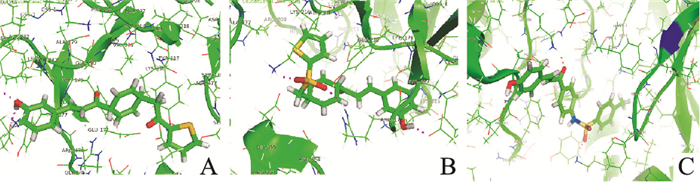
以MMP-2为靶蛋白,对化合物1~6进行分子对接。结果显示,化合物2、3与MMP-2蛋白模型有着良好的作用,对接得分见Tab 1,化合物2、3的3D-QSAR见Fig 5。
| Name | 1 | 2 | 3 | 4 | 5 | 6 | TSAHC |
| Score | 4.2624 | 5.2146 | 5.0203 | 3.1544 | 3.1056 | 2.8564 | 4.8472 |
| Log P | 4.66 | 3.72 | 3.98 | 4.92 | 3.98 | 4.25 | 3.01 |
|
| Fig 5 Molecular docking graph of compound 2(A), 3 (B) and TSAHC(C) |
肿瘤细胞随血液流动离开原发灶,分泌蛋白酶,侵蚀基底膜,并发生随血流的迁徙行为是肿瘤发生重要环节。本实验中我们采用的是膜孔径为8 μm的Transwell小室来评价所得查耳酮对于对MDA-MB-231细胞侵袭能力的影响。肿瘤细胞在上层的饥饿条件以及下层的血清诱导的情况下,穿过碳酸酯膜并发生迁移,同时通过在Transwell的上室铺上Matrigel胶来模拟ECM,从而达到模拟侵袭的目的。Matrigel是从EHS小鼠肉瘤得到的可溶性的基底膜类似物,此种肉瘤富含ECM蛋白,有利于在体外研究细胞侵染的过程[10]。
随后我们在蛋白水平上,针对降解ECM的核心MMPs进行了评价。MMPs是一类金属离子Zn依赖的蛋白水解酶超家族,主要功能为降解多种ECM成分[11]。MMP-2和MMP-9是MMPs家族中研究较为透彻的两个因子,其表达量的多少与ECM的数量息息相关[12]。MMP-2广泛存在于细胞和组织之中。研究显示,MMP-2的含量长期处于一个动态平衡,主要受到ERK/MAPK和JAK-STAT信号通路的调控[13]。其在酶解ECM Ⅳ型胶原中有“钻头”的作用[14],且通过Western blot实验发现,所得到的化合物2、3可以有效抑制MMP-2蛋白的表达,而其他化合物对于MMP-2蛋白的抑制作用较有限,提示化合物2、3的抗肿瘤侵袭作用应该是通过干扰MMP-2表达而实现的,且可以达到阳性对照TSAHC的效果。但化合物是直接作用于MMP-2靶蛋白,还是作用于上下游信号通路则需进一步研究。分子对接结果显示,化合物2与MMP-2形成了2根氢键,而化合物3与目标蛋白则形成了4根氢键,多出的两根氢键为磺酰基的贡献。结果显示,查耳酮结构右侧的间位酚羟基对于MMP-2靶点而言是必需的。磺酰胺键和酰胺键对于整个化合物的得分具有正效应。先导化合物TSAHC的羰基端为一甲苯结构,在本项目中被置换为噻吩结构,在噻吩中杂原子的电负性和分散正电荷的能力较苯要强许多,且杂五元环的芳香性较苯而言要小。因此,被认为更可能与氨基酸残基形成氢键,或者引发拉电子效应,强化旁边磺酰胺的氢键强度,形成更好的靶点效应,得分也更高。
综上所述,本研究基于天然产物衍生的大方向而展开,基于先导化合物TSAHC,丰富了该化合物构效关系研究。以噻吩为衍生基团,得到了6个新的近羰基端延长的新的查耳酮类化合物,通过MTT实验得出了初步的抗增殖结果。通过体外肿瘤侵袭实验,筛选得到了具有抑制肿瘤侵袭的两个化合物2、3,并采用Western blot法对肿瘤侵袭中的核心蛋白MMP-2做了表达评估,结合分子对接,初步结果阐明了目的化合物与MMP-2蛋白之间的构效关系,丰富了TSAHC系列化合物的研究。
( 致谢: 本实验化学合成部分完成于武汉工程大学化工与制药学院,活性评价部分完成于郑州大学第一附属医院药学部。感谢武汉工程大学硕士研究生王国祥,郑大一附院药学部研究生吴炜、陈琪等同学的工作。)
| [1] | 张爽, 刘新泳. 查耳酮衍生物的结构修饰及生物活性研究进展[J]. 药学进展, 2012, 36(6): 241-51. Zhang S, Liu X Y. Recent advances in research on structural modifications and bio-activities of chalcone derivatives[J]. Prog Pharm Sci, 2012, 36(6): 241-51. |
| [2] | Rodrigues J, Abramjuk C L., Asquez V, et al. New 4-maleamic acid and 4-maleamide peptidyl chalcones as potential multitarget drugs for human prostate cancer[J]. Pharm Res, 2011, 28(4): 907-19. doi:10.1007/s11095-010-0347-8 |
| [3] | Mahapatra D K, Bharti S K, Asati V. Anti-cancer chalcones: structural and molecular target perspectives[J]. Eur J Med Chem, 2015, 98(6): 69-114. |
| [4] | Park K H, Lee J W, Ryu Y B, et al. Method for screening anti-cancer compounds inhibiting function of TM4SF5 and anti-cancer composition containing chalcone compounds[P]. 2012, US20120282619. |
| [5] | 樊睿, 班树荣, 方莲花, 等. 新型查耳酮衍生物的合成及其初步抗蛋白酪氨酸激酶(PTKs)活性研究[J]. 中国药物化学杂志, 2011, 21(3): 178-82. Fan R, Ban S R, Fang L H, et al. Synthesis of new chalcone derivatives and the in vitro PTKs inhibitory activity[J]. Chin J Med Chem, 2011, 21(3): 178-82. |
| [6] | 谭娟. 查耳酮类化合物合成及抗乳腺癌活性研究[J]. 中国现代应用药学, 2016, 33(3): 318-25. Tan J. Synthesis of chalcone derivatives and anti-breast cancer activity research[J]. Chin J Mod Appl Pharm, 2016, 33(3): 318-25. |
| [7] | Delassus G S, Cho H, Park J, et al. New pathway links from cancer progression determinants to gene expression of matrix metalloproteinases in breast cancer cells[J]. J Cell Physiol, 2008, 217(3): 739-44. doi:10.1002/jcp.v217:3 |
| [8] | 汤国辉, 谢远杰, 刘丽兵, 等. ERK1/2与MMP2在结肠癌中的表达及意义[J]. 诊断病理学杂志, 2016, 23(10): 784-8. Tang G H, Xie Y J, Liu L B, et al. Expression and significance of ERK1/2 and MMP2 in colon cancer[J]. Chin J Diagn Pathol, 2016, 23(10): 784-8. doi:10.3969/j.issn.1007-8096.2016.10.018 |
| [9] | 赵若琳, 周坤福, 张旭, 等. 桔梗皂苷-D抑制非小细胞肺癌H460和A549细胞黏附、侵袭和迁移的作用机制研究[J]. 中国药理学通报, 2015, 31(2): 241-7. Zhao R L, Zhou K F, Zhang X, et al. Research on mechanisms of PD-induced inhibition of adhesion, invasion and migration in non-small cell lung cancer H460 and A549 cells[J]. Chin Pharmacol Bull, 2015, 31(2): 241-7. |
| [10] | Kleinman H K, Martin G R. Matrigel: basement membrane matrix with biological activity[J]. Semin Cancer Biol, 2005, 15(5): 378-86. doi:10.1016/j.semcancer.2005.05.004 |
| [11] | 陈锡强, 刘可春, 王思锋, 等. 天然产物抗血管生成的研究进展[J]. 山东科学, 2010, 23(6): 33-8. Chen X Q, Liu K C, Wang S F, et al. Research advances of natural products anti-agiogenesis[J]. Shandong Sci, 2010, 23(6): 33-8. |
| [12] | Cheng W, Li Y, Liu Z G, et al. Effect of Liuweibuqi capsule, a Chinese patent medicine, on the JAK1/STAT3 pathway and MMP9/TIMP1 in a chronic obstructive pulmonary disease rat model[J]. J Tradit Chin Med, 2015, 35(1): 54-62. doi:10.1016/S0254-6272(15)30009-1 |
| [13] | 田红艳, 陈萍萍, 李笑, 等. Gab2通过PI3K/Akt/ARK5/MMP途径影响乳腺癌的侵袭和转移[J]. 中国药理学通报, 2015, 31(7): 1014-8. Tian H Y, Chen P P, Li X, et al. Gab2 effects the invasion and metastasis of breast carcinoma through PI3 K/Akt/ARK5/MMP signal pathway[J]. Chin Pharmacol Bull, 2015, 31(7): 1014-8. |
| [14] | Patterson M L, Atkinson S J, Knauper V, et al. Specific collagenolysis by gelatinase A, MMP-2, is determined by the hemopexin domain and not the fibronectin-like domain[J]. FEBS Lett, 2001, 503(2): 158-62. |

