


糖尿病是一种以高血糖为特点,由胰岛素分泌不全或功能缺陷所引发的内分泌代谢性疾病[1]。糖尿病肾病是糖尿病引发的微血管并发症之一,也是糖尿病患者致死的主要原因之一[2]。糖尿病肾病发生及发展是多种因素相互作用的结果,其确切的发病机制至今尚未明了[3]。
墨旱莲为菊科鳢肠属植物鳢肠的干燥地上部分,具有抗蛇毒[4]、抗高血脂[5]、抗肿瘤[6]、抗真菌活性[7]。Xi等[8]采用体外α-淀粉酶和二肽基肽酶IV(dipeptidyl peptidase IV, DPP-IV)对墨旱莲的有效降糖部位进行了筛选,结果表明墨旱莲对DPP-IV酶的抑制活性主要集中在石油醚部位。但该提取物对糖尿病大鼠血清中与糖脂代谢相关的生化指标以及糖尿病肾病的影响,国内外鲜有报道。本研究利
用链脲佐菌素(streptozotocin,STZ)建立2型糖尿病大鼠模型,探究墨旱莲石油醚提取物(petroleum ether extract of Eclipta prostrata,PEEEP)对STZ诱导的糖尿病大鼠血清中血糖、胰岛素、甘油三酯(total glycerides, TG)、胆固醇(total cholesterol,TC)、肌酐(creatinine,CRE)、尿素(urea nitrogen, BUN)、尿酸(uric acid,UA)等生化指标以及肾组织病理学的影响,为进一步开发利用墨旱莲这一传统的药食两用中草药提供理论依据。
1 材料与方法 1.1 药物墨旱莲(购于陕西西安,经中国中医科学院商洛中药材GAP科研工程中心李筱玲讲师鉴定为墨旱莲)全草300 g,以2倍量体积80%乙醇回流提取3次, 每次2 h, 合并提取液, 减压除去乙醇, 得浓缩液。采用2倍量浓缩液体积的40%石油醚萃取,减压浓缩, 干燥, 称重, 得PEEEP干粉25 g, 4℃冷藏保存。临用前,用蒸馏水将干粉配制成1、2、4 kg·L-1的药液备用。盐酸二甲双胍片购自中美上海施贵宝制药有限公司,批号: 1307093。
1.2 动物SD大鼠,♂,体质量(125±6)g,购于第四军医大学动物中心,动物生产许可证号:SCXK(军)2007-007。饲养于商洛学院动物实验室。
1.3 试剂STZ(美国Sigma公司); 肝素(酷尔化学科技有限公司); TNF-α抗体(上海瑞奇生物科技有限公司); 胰岛素、TC、TG、CRE、BUN、UA测定试剂盒,均为长春汇力生物技术有限公司产品。
1.4 仪器血糖仪(三诺); 7080全自动分析仪(日本日立公司); 显微镜及拍照系统(日本Olympus公司)。
1.5 动物模型的制备及分组将♂ SD大鼠60只,适应性喂养1周后,随机分为正常对照组(10只)和造模组(50只)。正常对照组大鼠给予普通饲料喂养,造模组大鼠给予高能饲料喂养8周后,隔夜禁食不禁水12 h,腹腔注射STZ(溶于预冷的0.1 mL pH为4.5的磷酸缓冲液)30 mg·kg-1,3 d后尾尖取血,利用血糖仪测其空腹血糖,空腹血糖值≥11.1 mmol·L-1视为造模成功[9]。将造模成功的大鼠随机分为模型组、二甲双胍组及PEEEP低、中、高剂量组(100、200、400 mg·kg-1),每组9只。盐酸二甲双胍组给予剂量为400 mg·kg-1,正常组和模型组给予等量的蒸馏水。每天早、晚灌胃2次,连续4周。实验期间大鼠自由摄食饮水。
1.6 相关指标检测给药4周后,大鼠禁食不禁水12~16 h,乙醚麻醉,心脏取血5 mL,3 500 r·min-1离心10 min分离血清,利用相应试剂盒分别测定大鼠血清中血糖、胰岛素、TG、TC、CRE、BUN、UA含量。
1.7 肾脏HE病理学检测实验4周后处死动物,肾脏用10%福尔马林固定后,石蜡包埋,常规切片,HE染色,光学显微镜下观察肾脏的病理学变化。
1.8 Western blot检测采用Western blot法,对各组大鼠肾组织中TNF-α的蛋白表达水平进行检测。提取肾组织中总蛋白,用半干法电泳转移至PVDF膜,用脱脂奶粉封闭,加入TNF-α和β-actin一抗,然后加入相应的二抗,用化学发光法显影。对条带进行扫描,分析条带中吸光度值,以目的蛋白TNF-α和β-actin内参照的吸光度值比值进行统计分析。
1.9 统计学分析实验数据采用x±s表示,运用SPSS 19.0统计软件进行统计分析,组间均值采用单因素方差分析(One-way ANOVA)。
2 结果 2.1 PEEEP对糖尿病大鼠相关生化指标的影响由Tab 1可见,与正常组相比,糖尿病模型大鼠血糖明显升高(P < 0.01);与模型组比较,各给药组的血糖均有下降的趋势,PEEEP大剂量组对大鼠空腹血糖的降低趋势尤为明显(P < 0.01)。表明PEEEP对2型糖尿病大鼠有良好的降糖效果。与正常对照组比较,模型组胰岛素含量明显降低(P < 0.05);与模型组相比,PEEEP低、中、高剂量组胰岛素均有不同程度的提高,提高率分别为7.9%、13.2%、21.1%,表明PEEEP能够明显促进胰岛素的分泌。
| Group | Dose/mg·kg-1 | Blood glucose/mmol·L-1 | Insulin/mIU·L-1 | TG/mmol·L-1 | TC/mmol·L-1 |
| Normal | - | 6.5±0.7** | 5.2±0.9* | 0.7±0.5** | 2.2±0.6** |
| Model | - | 21.1±5.1 | 3.8±0.3 | 2.1±0.2 | 3.6±0.5 |
| Metformin | 400 | 13.8±5.9** | 4.7±0.4** | 1.2±0.2** | 2.4±0.4** |
| PEEEP | 100 | 19.6±4.2 | 4.1±0.3* | 1.7±0.8 | 3.4±0.5 |
| 200 | 17.3±3.2* | 4.3±0.4* | 1.5±0.9* | 2.9±0.2 | |
| 400 | 14.8±2.5** | 4.6±0.4** | 1.3±0.3** | 2.7±0.7* | |
| *P < 0.05, **P < 0.01 vs model | |||||
TG和TC是高血脂症的重要指标[10]。由Tab 1可见,模型组大鼠TC、TG含量明显高于正常对照组,高剂量PEEEP组TC、TG含量明显低于模型组(P < 0.05,P < 0.01)。表明PEEEP对糖尿病所引起的血脂代谢紊乱有一定的改善作用,且高剂量组的改善效果尤为明显(P<0.05,P<0.01)。
2.2 PEEEP对2型糖尿病肾病的影响由Tab 2可见,与正常对照组相比,模型组大鼠的CRE、BUN、UA水平明显升高(P < 0.01);与模型组比较,PEEEP实验组大鼠的CRE、BUN、UA含量均低于模型组,且随着PEEEP浓度的增加而降低,但PEEEP低、中剂量组大鼠BUN水平无统计学意义。与模型组比较,阳性对照组和PEEEP高剂量组大鼠的肾脏指数明显降低(P < 0.01,P < 0.05),PEEEP中、低剂量组也有一定的降低作用,但没有统计学意义。以上结果表明,PEEEP对STZ诱导的糖尿病肾病的肾脏损伤有一定的保护作用。
| Group | Dose/mg·kg-1 | CRE/mmol·L-1 | BUN/mmol·L-1 | UA/mmol·L-1 | Kidney index/mg·g-1body weight |
| Normal | - | 45.7±5.7** | 6.0±1.2** | 154.7±40.4** | 4.7±0.3** |
| Model | - | 71.4±10.9 | 17.5±1.2 | 366.5±35.8 | 12.6±0.8 |
| Metformin | 400 | 52.2±2.7 | 11.7±1.3 | 196.6±24.7 | 5.8±0.5** |
| PEEEP | 100 | 76.6±5.8* | 17.0±0.3 | 295.1±50.9* | 9.2±0.2 |
| 200 | 68.7±1.4* | 15.4±1.0 | 284.4±29.7* | 8.1±0.8 | |
| 400 | 55.1±3.4** | 13.3±0.8* | 242.5±56.9** | 7.4±0.3* | |
| *P < 0.05, **P < 0.01 vs model | |||||
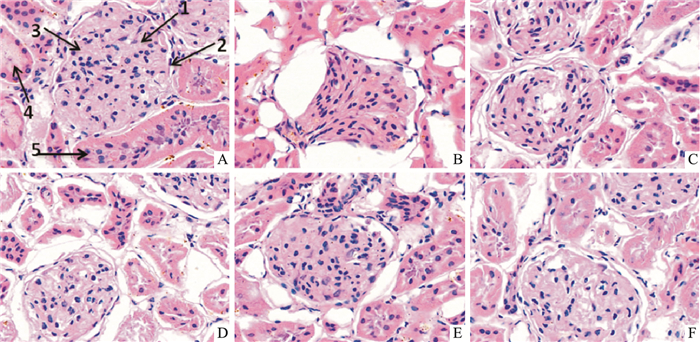
经HE染色,光镜观察,肾组织病理形态如Fig 1所示。正常大鼠肾小球形态规则,肾小管排列整齐紧密,管腔刷状缘清晰(Fig 1A); 模型大鼠肾小球明显肿胀,体积增大,毛细血管袢损伤,基底膜增厚,系膜基质增多,肾小囊变窄,肾小管上皮细胞有不同程度水肿浸润、空泡变性以及坏死,肾小管内可见脱落的细胞碎片(Fig 1B); 与模型组比较,盐酸二甲双胍组肾小球肿胀明显改善,肾小囊有所恢复,肾小管结构趋于清晰(Fig 1C); PEEEP高剂量组肾小球和肾小管水肿明显减轻,肾小囊逐渐变窄,肾间质炎性细胞减少,刷状缘逐渐清晰(Fig 1F); PEEEP中剂量组肾小球肿胀明显减轻,管腔变窄,肾小管管腔逐渐清晰,刷状缘可见(Fig 1E); PEEEP低剂量组肾小球肿胀有所缓解,肾小管结构也较模型组清晰(Fig 1D)。总之,PEEEP各剂量组与模型组相比较,肾小球和肾小管结构均趋于正常,且与药物剂量呈一定的量效关系,即剂量越大,肾脏组织病变程度也愈轻。
|
| Fig 1 Effects of PEEEP on kidney in STZ induced diabetic rats(HE staining, ×200) A: Normal; B: Model; C: Metformin 400 mg·kg-1; D: PEEEP 100 mg·kg-1; E: PEEEP 200 mg·kg-1; F: PEEEP 400 mg·kg-1. 1: Glomeruli; 2: Renal capsules; 3: Glomerular capillary loop; 4: Proximal convoluted tubule; 5: Distal convoluted tubule. |
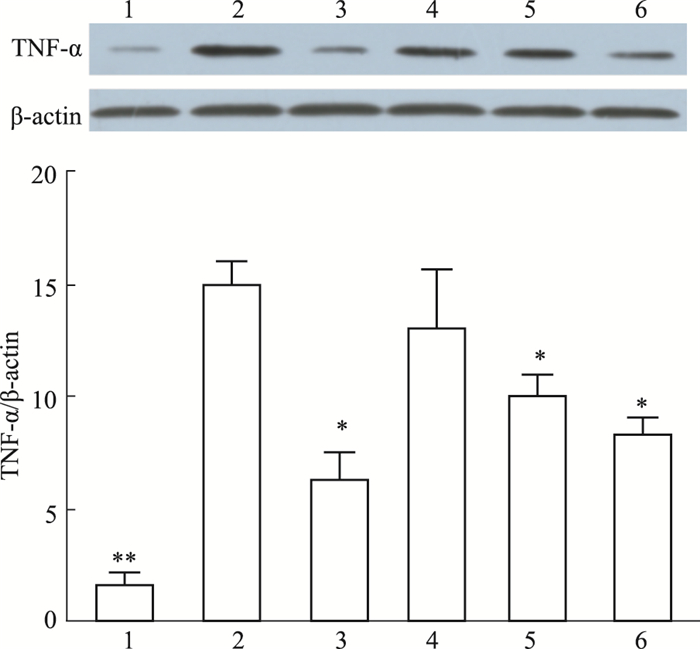
Western blot检测各组大鼠肾脏组织中TNF-α蛋白的表达,如Fig 2所示,与正常组相比,模型组大鼠TNF-α蛋白表达明显增加,PEEEP各剂量组和阳性对照组均能不同程度地下调TNF-α蛋白的表达,且PEEEP高、中剂量组效果明显(P < 0.05)。
|
| Fig 2 Effects of PEEEP on expression of TNF-α protein in STZ induced diabetic rats kidney 1: Normal; 2: Model; 3: Metformin 400 mg·kg-1; 4:PEEEP 100 mg·kg-1; 5: PEEEP 200 mg·kg-1; 6: PEEEP 400 mg·kg-1. *P<0.05, **P<0.01 vs model |
胰岛素是胰岛β细胞分泌的唯一能够降低血糖的激素。本研究结果表明,糖尿病大鼠血清中胰岛素含量随PEEEP给药浓度的增加而升高,表明PEEEP能够促进胰岛素分泌,可能是其有效降低血糖的作用机制之一。Hu等[12]研究显示,高水平的甘油三酯和胆固醇是糖尿病诱发动脉粥样硬化和冠心病的首要因素。Zhao等[5]和Kim等[11]研究表明,墨旱莲提取物能够有效降低低密度胆固醇,同时提高高密度胆固醇。本研究表明,PEEEP能明显降低STZ诱导的2型糖尿病大鼠的甘油三酯和胆固醇水平。由此可见,PEEEP具有改善糖尿病患者血脂异常,降低患动脉粥样硬化和冠心病风险的潜力。
本研究结果显示,PEEEP高剂量能够明显降低肾功能指标尿酸和肌酐水平。糖尿病肾病是糖尿病并发症之一,本实验发现PEEEP除了能够降低血糖、血脂,升高胰岛素含量外,对糖尿病模型大鼠的肾脏具有一定保护作用,高剂量组效果尤为明显。尿酸是人体嘌呤代谢途径的最后代谢产物,血液中高尿酸是高尿酸血症的特征,降低尿酸水平是预防和治疗痛风的有效途径之一[13]。本实验中模型组大鼠尿酸水平明显高于正常组,该结果与Yuan等[14]的研究结果一致,而PEEEP各剂量组均能够明显降低尿酸水平,高剂量效果尤为明显, 表明PEEEP对痛风有一定的改善作用。
宋霖等[15]研究表明,TNF-α是体内重要的、具有广泛生物活性的细胞因子,TNF-α在2型糖尿病血清中明显升高,并随着肾脏损伤出现进一步升高。本研究中,模型组大鼠肾脏组织中TNF-α表达增加,而PEEEP各剂量组TNF-α表达下降,表明PEEEP可能通过抑制模型大鼠肾脏组织中TNF-α的表达,从而发挥肾脏保护作用。本研究首次评价PEEEP对STZ糖尿病大鼠的生化指标以及肾组织病理学的影响,其毒性以及有效成分有待进一步分析。
综上所述,本研究通过建立的糖尿病肾病大鼠模型,证实PEEEP可降低糖尿病大鼠血糖、血脂、尿素、尿酸、肌酐含量,提高胰岛素含量,同时对肾脏有一定的保护作用,为墨旱莲的进一步开发利用提供了理论依据。
( 致谢: 本实验主要在商洛学院动物实验室完成,感谢课题组所有成员对实验的指导与帮助。)
| [1] | 张婷, 李慧芳, 吕博, 等. 新疆两色金鸡菊提取物抗脂质过氧化及对糖尿病小鼠的保护作用[J]. 中国药理学通报, 2016, 32(9): 1272-8. Zhang T, Li H F, Lyu B, et al. Inhibition of lipid peroxidation and protective effects on diabetic mice of extracts from Coreopsis tinctoria Nutt. in Xinjiang[J]. Chin Phamacol Bull, 2016, 32(9): 1272-8. |
| [2] | 郭福团, 许雄伟, 潘建峰, 等. 桑枝多糖对糖尿病肾病小鼠肾皮质氧化应激作用的影响[J]. 中国药理学通报, 2016, 32(8): 1148-52. Guo F T, Xu X W, Pan J F, et al. The anti-oxidative effect of Ramulus mori polysaccharides on diabetic nephropathy mice[J]. Chin Phamacol Bull, 2016, 32(8): 1148-52. |
| [3] | 赵辛元, 柯志强, 徐魁, 等. 舒血宁对糖尿病肾病大鼠肾脏保护作用的研究[J]. 中国糖尿病杂志, 2017, 25(5): 454-7. Zhao X Y, Ke Z Q, Xu K, et al. Protective effect of Shuxuening on kidney in rats with diabetic nephropathy[J]. Chin J Diabetes, 2017, 25(5): 454-7. |
| [4] | Pithayanukul P, Laovachirasuwan S, Bavovada R, et al. Anti-venom potential of butanolic extract of Eclipta prostrata against Malayan pit viper venom[J]. J Ethnopharmacol, 2004, 90: 347-52. doi:10.1016/j.jep.2003.10.014 |
| [5] | Zhao Y, Peng L, Lu W, et al. Effect of Eclipta prostrata on lipid metabolism in hyperlipidemic animals[J]. Exp Geronto, 2015, 62: 37-44. |
| [6] | Liu Q, Zhao H, Zhong X, et al. Eclipta prostrata L. phytochemicals: isolation, structure elucidation, and their antitumor activity[J]. Food Chem Toxicol, 2012, 50: 4016-22. doi:10.1016/j.fct.2012.08.007 |
| [7] | Nagabhushan, Raveesha K A, Shrisha D L. Antidermatophytic activity of Eclipta prostrata L[J]. Int J Chem Anal Sci, 2013, 4: 136-8. doi:10.1016/j.ijcas.2013.05.003 |
| [8] | Xi F M, Li C T, Han J, et al. Thiophenes, polyacetylenes and terpenes from the aerial parts of Eclipata prostrata[J]. Bioorgan Med Chem, 2014, 22: 6515-22. doi:10.1016/j.bmc.2014.06.051 |
| [9] | Wang Q, Jiang C, Fang S, et al. Antihyperglycemic, antihyperlipidemic and antioxidant effects of ethanol and aqueous extracts of Cyclocarya paliurus leaves in type 2 diabetic rats[J]. J Ethnopharmacol, 2013, 150(3): 1119-27. |
| [10] | 陈春娟, 朱振元, 陈璐, 等. 低分子量蛹虫草多糖降血糖活性研究[J]. 现代食品科学, 2017, 33(4): 1-7. Chen C J, Zhu Z Y, Chen L. Study of the hypoglycemic activity of low molecular weight polysaccharides from Cordyceps militaris[J]. Mod Food Sci Technol, 2017, 33(4): 1-7. |
| [11] | Kim D, Lee S, Choi J, et al. The butanol fraction of Eclipta prostrata (Linn) effectively reduces serum lipid levels and improves antioxidant activities in CD rats[J]. Nutr Res, 2008, 28: 550-4. doi:10.1016/j.nutres.2008.05.003 |
| [12] | Hu X S, Cheng D L, Zhang Z Y, et al. Antidiabetic activity of Helicter angustifolia root[J]. Pharm Biol, 2016, 54(6): 938-44. doi:10.3109/13880209.2015.1077871 |
| [13] | 普菁莹, 牛艳芬, 高丽辉, 等. 3, 5, 2', 4'-四羟基查尔酮对尿酸诱导高尿酸血症小鼠尿酸排泄的影响研究[J]. 中国药理学通报, 2015, 31(8): 1091-5. Pu J Y, Niu Y F, Gao L H, et al. Effects of 3, 5, 2', 4'-tetrahydroxychalcone on urate excretion in hyperuricemic mice[J]. Chin Phamacol Bull, 2015, 31(8): 1091-5. |
| [14] | Yuan X, Hu X S, Liu Y, et al. In vitro and in vivo anti-diabetic activity of extracts from Actinidia kolomikta[J]. Int J Biol, 2014, 6(3): 1-10. |
| [15] | 宋霖, 张宁. 糖尿病肾病患者尿液白细胞介素-6与肿瘤坏死因子-α检测的临床意义[J]. 检验医学与临床, 2017, 4(3): 348-9. Song L, Zhang N. Clinical significance of urinary IL-6 and TNF-α in patients with diabetic nephropathy[J]. Lab Med Clin, 2017, 4(3): 348-9. |

