


2. 山西医科大学 公共卫生学院环境卫生学教研室,山西 太原 030001;
3. 山西医科大学 基础医学院药理学教研室,山西 太原 030001
2. School of Public Health, Shanxi Medical University, Taiyuan 030001, China;
3. School of Basic Medical Sciences, Shanxi Medical University, Taiyuan 030001, China
血管平滑肌细胞(vascular smooth muscle cells,VSMCs)主要存在于血管中膜,是构成血管中膜并执行相应生理功能的物质基础。近年来研究证实,VSMCs异常增殖是血管内膜增生、动脉粥样硬化、血管介入治疗后再狭窄等血管增殖性疾病共有的环节[1-3]。因此,抑制VSMCs过度增殖是防治血管增殖性疾病的重要策略。
杜鹃素(Farrerol)天然存在于杜鹃花科植物兴安杜鹃(Rhododendron dauricum L.满山红)的叶中,是一种天然的二氢黄酮类活性物质。本课题组前期研究表明,杜鹃素可抑制胎牛血清(fetal bovine serum, FBS)诱导的VSMCs体外增殖[4]。除了FBS外,还有多种生理或病理因素可诱导VSMCs增殖,如血管紧张素Ⅱ(angiotensinⅡ, AngⅡ)、氧化磷脂衍生物棕榈酰、细胞生长因子PDGF-BB等[5]。目前普遍认为Ang Ⅱ是动脉粥样硬化的重要诱因,它不仅是强烈的血管收缩物质,而且是强有力的生长因子,可刺激VSMCs增殖和迁移[6-7]。本研究以AngⅡ诱导增殖的VSMCs为模型,观察了杜鹃素对VSMCs增殖能力的影响,有助于进一步研究杜鹃素对血管增殖性疾病的防治作用。
缝隙连接(gap junction,GJ)是细胞间直接通讯的基本结构,可用于细胞间交换离子、第二信使、小分子代谢物等,从而调控细胞增殖分化和新陈代谢等活动。VSMCs的缝隙连接主要由缝隙连接蛋白(connexin,Cx)构成,Cx依分子量大小分别命名为Cx26-Cx56[8]。哺乳动物的多数大中动脉的中层VSMCs只表达Cx43,而Cx43的异常表达与心血管疾病密切相关[9]。研究表明,Cx43参与调节VSMCs的增殖、迁移、表型转换等过程[10]。在不同原因造成的VSMCs增殖过程中,Cx43的表达均有增加[11]; 而且在VSMCs由收缩型转变为合成型的过程中,Cx43表达也增高[12]。本实验拟研究杜鹃素是否通过调控Cx43表达水平,从而抑制VSMCs增殖,为杜鹃素防治血管增殖性相关疾病提供理论依据。
1 材料 1.1 实验动物健康♂SD大鼠,体质量(150±10)g,SPF级,购自山西医科大学实验动物中心,实验动物许可证:SCXK(晋) 2015-0001。
1.2 试剂杜鹃素由山西医科大学药物合成实验室自制(纯度≥99%); AngⅡ(上海吉尔); CCK-8细胞活力检测试剂盒(武汉博士德); EdU细胞增殖检测试剂盒(广州锐博); 细胞周期试剂盒(碧云天); SYBR Premix Ex TaqTM、PrimeScript RT reagent Kit(日本TaKaRa); Cx43 siRNA(上海吉凯); Cx43、β-actin抗体(BBI Life Sciences); α平滑肌肌动蛋白(α-smooth muscle actin, α-SMA)抗体(武汉博士德)。
1.3 仪器倒置荧光显微镜(日本Olympus),FACS Calibur流式细胞仪(美国贝克曼),酶标仪、CFX-96型Real-time PCR仪、凝胶成像系统(美国Bio-Rad)。
2 方法 2.1 VSMCs的培养和鉴定大鼠经腹腔麻醉后,在无菌条件下取出胸主动脉,采用组织块贴壁法培养VSMCs,待细胞融合达80%~90 %后进行传代培养。VSMCs为梭形,呈典型的“峰谷状”生长。免疫细胞化学法检测α-SMA的表达,90%以上的VSMCs胞质着棕色则证明细胞为VSMCs,否则应用差速贴壁法进行纯化。实验用第4~6代细胞。
2.2 CCK-8法检测细胞活力已有研究表明在0~100 μmol·L-1范围内,杜鹃素对VSMCs无明显毒性[4]。
2.2.1 AngⅡ对VSMCs增殖的影响将细胞以3×1010·L-1密度接种于96孔板,每组设5个复孔。于37℃、5 % CO2培养箱中培养过夜,换无血清培养基饥饿培养12 h使之同步化。分别加入25、50、100、200 nmol·L-1 AngⅡ,对照组加含3% FBS培养液,于培养箱中培养24 h。每孔加入10 μL CCK-8溶液,在培养箱中孵育1 h,用酶标仪在450 nm波长读取OD值。
2.2.2 杜鹃素对AngⅡ刺激的VSMCs增殖的影响按“2.2.1 ”所述方法接种细胞并同步化,随机分组:(1)对照组:用1% DMSO预处理24 h,更换为100 nmol·L-1 AngⅡ继续培养24 h; (2)模型组:用100 nmol·L-1 AngⅡ培养24 h; (3)给药组:分别用15、30、60、120 μmol·L-1杜鹃素预处理24 h,更换为100 nmol·L-1 AngⅡ继续培养24 h。每孔加入10 μL CCK-8溶液,在培养箱中孵育1 h,用酶标仪在450 nm波长读取OD值。
2.3 EdU检测细胞增殖将细胞以3×1010·L-1密度接种于6孔板并同步化,按“2.2.2”所述随机分组处理。在培养基中加入50 μmol·L-1 EdU,置于培养箱中孵育2 h,再用4%多聚甲醛固定细胞。根据EdU细胞增殖检测试剂盒说明书,用Alexa Fluor 488染色反应液与EdU结合,用Hoechst 33342染色反应液复染细胞核。最后用荧光显微镜观察并计数。
2.4 细胞周期检测将细胞以3×1010·L-1密度接种于6 cm培养皿中并同步化,按“2.2.2”所述随机分组处理。收集细胞,PBS洗2次,再用75%冷乙醇4℃固定过夜。1 000 r·min-1离心5 min,弃去乙醇,再用PBS洗1次。取1 mL 40 mg·L-1碘化丙啶(PI)染色液重悬细胞,37℃孵育1 h。用流式细胞仪分析细胞周期,每个样本至少计数10 000个细胞,各期细胞分布以百分数(%)表示。
2.5 Real-time PCR检测Cx43 mRNA表达水平冰上收集并裂解细胞,提取总RNA,用分光光度计测定RNA浓度。Cx43引物序列为正义:5′-TCAAGCCTACTCAACTGCTGG-3′,反义:5′-TGTTACAACGAAAGGCAGACTG-3′; 以GAPDH为内参照,GAPDH引物序列为正义: 5′-CGGAGTCAACGGATTTGGTCGTAT-3′,反义: 5′-AGCCTTCTCCATGGTGGTGAAGAC-3′。按照反转录试剂盒说明书加入反转录反应体系,室温放置10 min,放入反转录仪中。42 ℃保持15 min,95℃保持5 min,反转录得到1 μg cDNA模板。再按照RNA扩增试剂盒说明书,加入扩增反应体系后扩增,每个循环的反应条件为:95℃变性45 s,60 ℃退火45 s,72 ℃延长1 min,共进行35个循环。最后于72℃保持5 min。以GAPDH为内参基因,计算Cx43 mRNA的相对表达量变化倍数。
2.6 Western blot法检测蛋白表达冰上收集并裂解细胞,提取蛋白质,用BCA法进行定量。取40 μg蛋白质经10% SDS-PAGE凝胶电泳分离,然后恒压电转到硝酸纤维素膜(NC)上。5%脱脂牛奶室温封闭3 h,用TBST洗膜3次,将NC膜放入适当稀释的一抗溶液中(Cx43稀释比例为1 :1 000,GAPDH稀释比例为1 :4 000),4℃孵育过夜。用TBST洗膜3次,将NC膜放入HRP标记的二抗(1 :4 000稀释),室温孵育2 h,再用TBST洗膜3次。在NC膜上滴加新鲜配制的ECL显色液400 μL封入保鲜膜中,覆盖感光胶片进行显影。扫描条带并用Image J计算灰度值。独立重复实验3次。
2.7 siRNA干扰Cx43的表达Cx43siRNA序列如下:正义:5′-CCUAGUCCAUCAGAUCAUGTT-3′,反义:5′-CAUGAUCUGAUGGACUAGGTC-3′。对照siRNA:正义:5′-UUCUCCGAACGUGUCACGUdTdT-3′,反义:5′-ACGUGACACGUUCGGAGAAdTdT-3′。将VSMCs接种于6孔板,培养过夜,使细胞的汇合度达到30%~40%。按照Lipofectamine 2000使用说明配制siRNA-Lipofectamine 2000复合物,并加入到包含细胞和培养基的孔中,轻轻摇匀后置于培养箱孵育72 h。分别按照“2.3”和“2.4”所述操作,对转染siRNA后的VSMCs进行EdU细胞增殖检测和细胞周期检测。
2.8 统计学分析用SPSS 17.0软件对数据进行分析,组间比较用单因素方差分析(one-way ANOVA),结果以x±s表示。
3 结果 3.1 杜鹃素抑制AngⅡ引起的VSMCs增殖CCK-8实验结果表明,AngⅡ可促进VSMCs增殖。如Fig 1A所示,在25~100 nmol·L-1浓度范围内,随着AngⅡ浓度的增加,VSMCs增殖效率升高,100 nmol·L-1AngⅡ作用的VSMCs增殖率升高最为明显(P < 0.05)。而200 nmol·L-1 AngⅡ对VSMCs有毒性,可明显抑制VSMCs增殖。从而确定造模条件为100 nmol·L-1 AngⅡ作用24 h。杜鹃素可抑制AngⅡ引起的VSMCs增殖。如Fig 1B所示,在15~60 μmol·L-1浓度范围内,随着杜鹃素浓度的增加,对VSMCs增殖的抑制作用逐渐增强,60 μmol·L-1杜鹃素的抑制作用最强(P < 0.05)。而120 μmol·L-1杜鹃素的抑制作用下降。从而确定最佳作用条件为60 μmol·L-1杜鹃素作用24 h。
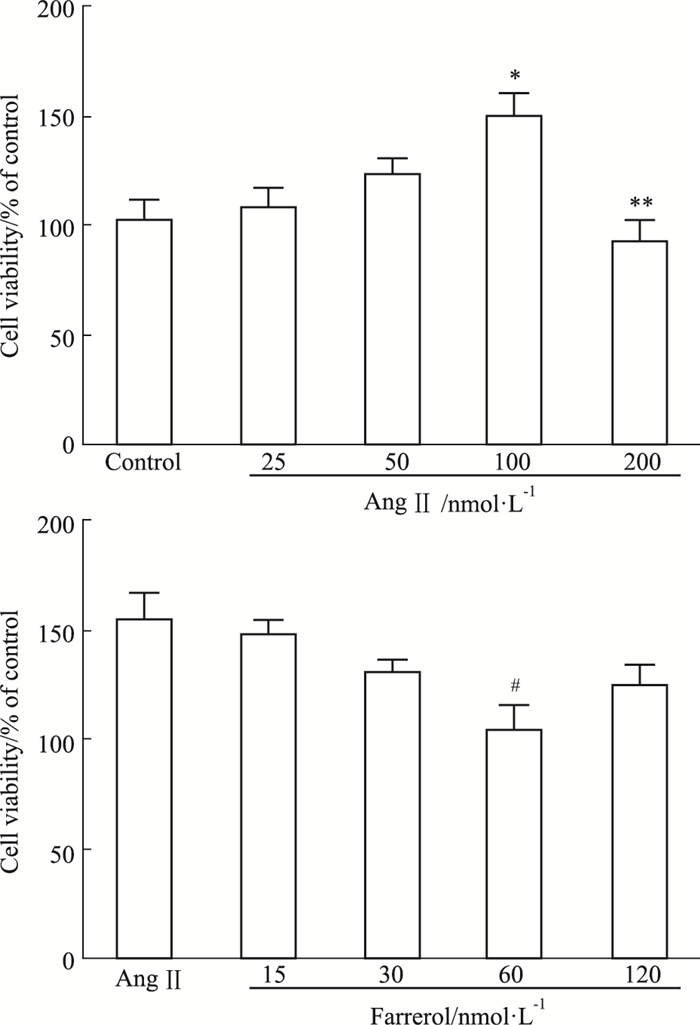
|
| Fig 1 Effect of AngⅡ and farrerol on cell viability of VSMCs A: AngⅡcaused a dose-dependent promotion on VSMCs viability. *P < 0.05, **P < 0.01 vs control; B: Farrerol caused a dose-dependent suppression on VSMCs viability. #P < 0.05 vs AngⅡ. |
Fig 2A、2B的EdU细胞增殖检测结果显示,与对照组比较,100 nmol·L-1AngⅡ作用24 h后,VSMCs的EdU结合明显升高(P < 0.05);用60 μmol·L-1杜鹃素预处理24 h后,VSMCs的EdU比模型组明显降低(P < 0.01)。表明60 μmol·L-1杜鹃素可抑制AngⅡ引起的VSMCs增殖。Fig 2C、2D的细胞周期结果显示,与对照组比较,100 nmol·L-1 AngⅡ作用24 h后,G0/G1期细胞明显减少, 而S期细胞明显增加(P < 0.05);与模型组相比,60 μmol·L-1杜鹃素预处理24 h后G0/G1期细胞明显增加,而S期细胞明显减少(P < 0.05)。表明60 μmol·L-1杜鹃素可抑制VSMCs有丝分裂,使其停滞于G0/G1期。
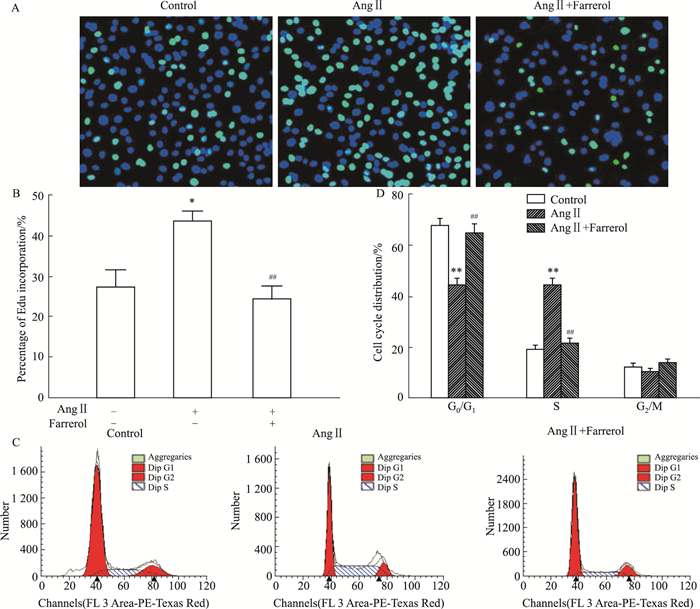
|
| Fig 2 Inhibition of AngⅡ-induced VSMCs proliferation by farrerol A: Proliferous cells detected by staining of EdU(×100). In each image, blue represents nuclei stain, and green represents EdU stain; B: The percentages of EdU-positive cells were quantified; C: Analysis of cell cycle distribution by flow cytometry; D: The histograms represent the percentages of each phase in cell cycle. Treatment with AngⅡ caused a marked increase in proliferation, which was attenuated by pretreatment with farrerol. *P < 0.05, **P < 0.0 vs control; ##P < 0.01 vs AngⅡ. |
已有研究表明,AngⅡ可刺激VSMCs中Cx43的表达,而Cx43表达与VSMCs的增殖密切相关,所以我们研究杜鹃素对AngⅡ刺激的VSMCs中Cx43表达的影响。用60 μmol·L-1杜鹃素预处理VSMCs 24 h,换100 nmol·L-1 AngⅡ继续培养24 h,real-time PCR法检测Cx43 mRNA表达水平(Fig 3A),Western blot法检测Cx43蛋白表达水平(Fig 3B)。结果显示,与对照组比较,AngⅡ作用后Cx43表达明显增加(P < 0.01);与模型组比较,杜鹃素预处理后Cx43表达量明显降低(P < 0.05)。
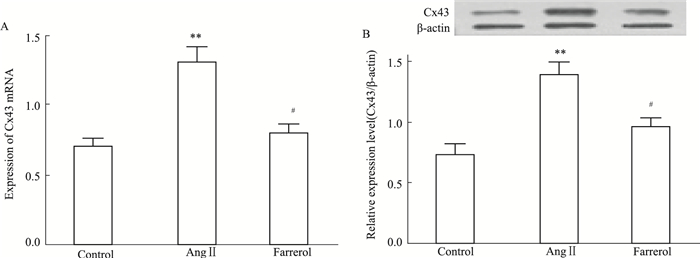
|
| Fig 3 Inhibition of AngⅡ-induced Cx43 expression of VSMCs by farrerol A: Analysis for mRNA of Cx43 by real-time PCR; B: Analysis for protein of Cx43 by Western blot. Treatment with AngⅡ caused a marked increase in Cx43 expression, which was attenuated by pretreatment with farrerol. **P < 0.01 vs control; #P < 0.05 vs AngⅡ. |
用siRNA干扰Cx43的表达后,检测杜鹃素对细胞增殖和细胞周期的影响。Fig 4A的EdU细胞增殖检测结果显示,与siRNA组比较,siRNA+AngⅡ组VSMCs的EdU结合率明显增大(P < 0.05);与siRNA+AngⅡ组比较,siRNA+AngⅡ+Farrerol组VSMCs的EdU结合率无明显变化。Fig 4B细胞周期检测结果显示,与siRNA组比较,siRNA+AngⅡ组G0/G1期细胞明显减少(P < 0.05),而S期细胞明显增加(P < 0.05);与siRNA+AngⅡ组比较,siRNA+AngⅡ+Farrerol组G0/G1期细胞和S期细胞无明显变化。以上结果表明,干扰Cx43的表达后,AngⅡ依然能刺激VSMCs的增殖,而杜鹃素对VSMCs增殖的抑制作用明显减弱。

|
| Fig 4 Effect of farrerol on AngⅡ-induced VSMCs proliferation after transfection of siRNA A: Proliferous cells detected by staining of EdU(×100); B: The percentages of EdU-positive cells were quantified; C: Analysis of cell cycle distribution by flow cytometry; D: The histograms represent the percentages of each phase in cell cycle. Treatment with AngⅡ caused a marked increase in proliferation, which was not attenuated by pretreatment with farrerol. *P < 0.05, **P < 0.01 vs siRNA. |
心血管疾病是威胁人类健康的重要疾病,VSMCs异常增殖是血管病变的一个重要环节。Cx43作为VSMCs中最具代表性的缝隙连接蛋白,在血管增生性疾病的发生、发展过程中扮演重要角色。在动脉粥样硬化的斑块形成早期,VSMCs的Cx43表达升高[13],这表明Cx43可能通过促进VSMCs的增殖,促进动脉粥样硬化的发展。有研究表明,VSMCs的异常增殖与Cx43的异常表达密切相关。正常VSMCs的Cx43表达量较低,而异常增殖的VSMCs Cx43表达水平是正常细胞的6倍。多项研究表明,上调Cx43的表达可促进VSMCs增殖,而降低Cx43表达则可抑制Ang Ⅱ诱导的VSMCs增殖[12]。
天然活性物质防治心血管疾病一直是药物研究的热点。如白藜芦醇可抑制氧化磷脂POVPC诱导的VSMCs增殖[14],槲皮素可保护糖尿病所致大鼠冠状动脉的损伤[15],吴茱萸碱可抑制氧化修饰的低密度脂蛋白(Ox-LDL)诱导的VSMCs增殖[16],并与抑制Cx43表达有关。本课题组前期研究表明,天然活性物质杜鹃素可抑制FBS诱导的VSMCs体外增殖,但杜鹃素对于Ang Ⅱ引起的VSMCs增殖的影响尚未见报道。
前期研究表明,15~100 μmol·L-1杜鹃素对VSMCs无毒性作用[4],这表明杜鹃素抑制VSMCs增殖的作用并不是由于其细胞毒性。CCK-8细胞活性检测结果和EdU细胞增殖检测结果表明,杜鹃素可抑制Ang Ⅱ诱导的VSMCs增殖,且随着杜鹃素浓度的增加,其相应的抑制作用逐渐增强,60 μmol·L-1杜鹃素可明显抑制VSMCs的DNA合成。细胞周期的结果表明,AngⅡ可减少G0/G1期细胞比例,并增加S期细胞的比例,而杜鹃素处理后的VSMCs则可逆转AngⅡ的作用,即阻止细胞由G0/G1期向S期转化。综上所述,Ang Ⅱ能刺激VSMCs增殖,导致动脉粥样硬化等疾病,杜鹃素可明显抑制Ang Ⅱ诱导的VSMCs增殖,从而发挥心血管保护作用。
Western blot法检测杜鹃素对AngⅡ刺激的VSMCs中Cx43表达的影响,结果显示,AngⅡ刺激的VSMCs中Cx43表达上调,而杜鹃素可明显抑制该作用。表明Cx43表达的上调可能是杜鹃素抑制VSMCs增殖的潜在机制。为了进一步研究二者之间的关系,我们用siRNA干扰Cx43的表达,结果表明siRNA干扰Cx43后,杜鹃素抑制增殖的作用减弱。提示杜鹃素抑制AngⅡ诱导的VSMCs增殖的机制可能与其抑制Cx43的表达有关。
综上所述,本研究发现Ang Ⅱ可刺激VSMCs的增殖以及Cx43的表达,天然活性物质杜鹃素可抑制Ang Ⅱ诱导的VSMCs增殖,其作用机制可能与抑制Cx43的表达有关。本实验结果为进一步研究杜鹃素防治心血管疾病的作用提供了一定的基础理论依据。
( 致谢: 本实验由山西医科大学药学院药物化学实验室李青山老师课题组独立完成,感谢在实验过程中给予指导和帮助的老师和同学。)
| [1] | Uryga A K, Bennett M R. Ageing induced vascular smooth muscle cell senescence in atherosclerosis[J]. J Physiol, 2016, 594(8): 2115-24. doi:10.1113/JP270923 |
| [2] | Chistiakov D A, Orekhov A N, Bobryshev Y V. Vascular smooth muscle cell in atherosclerosis[J]. Acta Physiol (Oxf), 2015, 214(1): 33-50. doi:10.1111/apha.2015.214.issue-1 |
| [3] | Bennett M R, Sinha S, Owens G K. Vascular smooth muscle cells in atherosclerosis[J]. Circ Res, 2016, 118(4): 692-702. doi:10.1161/CIRCRESAHA.115.306361 |
| [4] | 刘恩荔. 杜鹃素新结构衍生物djs-f抑制大鼠血管内膜增生作用及其机制[D]. 太原: 山西医科大学, 2016. Liu E L. The inhibitory effect and action mechanism of DJS-F, a new structure derivative of farrerol, on balloon-induced intima hyperplasia in rat common carotid artery[D]. Taiyuan: Shanxi Medical University, 2016. |
| [5] | Johnstone S R, Ross J, Rizzo M J, et al. Oxidized phospholipid species promote in vivo differential cx43 phosphorylation and vascular smooth muscle cell proliferation[J]. Am J Pathol, 2009, 175(2): 916-24. doi:10.2353/ajpath.2009.090160 |
| [6] | Jia G, Cheng G, Gangahar D M, et al. Involvement of connexin 43 in angiotensin Ⅱ-induced migration and proliferation of saphenous vein smooth muscle cells via the MAPK-AP-1 signaling pathway[J]. J Mol Cell Cardiol, 2008, 44(5): 882-90. doi:10.1016/j.yjmcc.2008.03.002 |
| [7] | Alonso F, Krattinger N, Mazzolai L, et al. An angiotensin Ⅱ-and NF-κB-dependent mechanism increases connexin 43 in murine arteries targeted by renin-dependent hypertension[J]. Cardiovasc Res, 2010, 87(1): 166-76. doi:10.1093/cvr/cvq031 |
| [8] | Morel S. Multiple roles of connexins in atherosclerosis-and restenosis-induced vascular remodelling[J]. J Vasc Res, 2014, 51(2): 149-61. doi:10.1159/000362122 |
| [9] | 王光宇, 毕亚光, 刘向东, 等. 二甲双胍对高糖培养H9c2细胞connexin43表达的影响[J]. 中国药理学通报, 2016, 32(7): 920-4. Wang G Y, Bi Y G, Liu X D, et al. Effect of metformin on connexin43 expression in H9c2 cells cultured with high glucose[J]. Chin Pharmacol Bull, 2016, 32(7): 920-4. |
| [10] | Matsushita T, Rama A, Charolidi N, et al. Relationship of connexin43 expression to phenotypic modulation in cultured human aortic smooth muscle cells[J]. Eur J Cell Biol, 2007, 86(10): 617-28. doi:10.1016/j.ejcb.2007.06.005 |
| [11] | Johnstone S R, Kroncke B M, Straub A C, et al. MAPK phosphorylation of connexin 43 promotes binding of cyclin E and smooth muscle cell proliferation[J]. Circ Res, 2012, 111(2): 201-11. doi:10.1161/CIRCRESAHA.112.272302 |
| [12] | Song M, Yu X, Cui X, et al. Blockade of connexin 43 hemichannels reduces neointima formation after vascular injury by inhibiting proliferation and phenotypic modulation of smooth muscle cells[J]. Exp Biol Med (Maywood, NJ), 2009, 234(10): 1192-200. doi:10.3181/0902-RM-80 |
| [13] | Kwak B R, Veillard N, Pelli G, et al. Reduced connexin43 expression inhibits atherosclerotic lesion formation in low-density lipoprotein receptor-deficient mice[J]. Circulation, 2003, 107(7): 1033-9. doi:10.1161/01.CIR.0000051364.70064.D1 |
| [14] | Shi Y, Hou X, Zhang X, et al. Inhibition of oxidized-phospholipid-induced vascular smooth muscle cell proliferation by resveratrol is associated with reducing Cx43 phosphorylation[J]. J Agric Food Chem, 2013, 61(44): 10534-41. doi:10.1021/jf4036723 |
| [15] | 侯晓敏, 秦小江. 槲皮素通过激活kv1.5保护糖尿病大鼠冠脉损伤[J]. 中国药理学通报, 2017, 33(10): 1442-5. Hou X M, Qin X J. Quercetin protects coronary artery from injury induced by diabetes in rats by activating Kvl. 5[J]. Chin Pharmacol Bull, 2017, 33(10): 1442-5. |
| [16] | Liu Y, Fu Y Q, Peng W J, et al. Rutaecarpine reverses the altered connexin expression pattern induced by oxidized low-density lipoprotein in monocytes[J]. J Cardiovasc Pharmacol, 2016, 67(6): 519-25. doi:10.1097/FJC.0000000000000372 |

