


2. 福建省天然药物药理学重点实验室,福建 福州350108;
3. 厦门市仙岳医院药学部,福建 厦门 361012;
4. 厦门大学生命科学学院,福建 厦门 361005
2. Fuijan Provincial Key Lab of Natural Medicine Pharmacology, Fuzhou 350108, China;
3. Dept of Pharmacy, Xiamen Xianyue Hospital, Xiamen Fujian 361012, China;
4. School of Life Sciences, Xiamen University, Xiamen Fujian 361005, China
热休克蛋白90 (heat shock protein 90, Hsp90)是人类细胞中含量最丰富的分子伴侣蛋白之一。Hsp90与多种辅伴侣(co-chaperone)蛋白共同组成分子伴侣复合物,在肿瘤的发生、发展过程中发挥重要作用。许多癌蛋白都需要在Hsp90分子伴侣复合物的协助下才能形成成熟的构象,获得足够的稳定性与活性,参与肿瘤细胞增殖、对抗凋亡等重要过程。这些蛋白质被称作Hsp90的“客户蛋白”(client protein)。Hsp90分子伴侣功能的发挥不仅依赖ATP,还需要Hsp70、HOP、P23、亲免素等辅分子伴侣的参与。在肿瘤细胞模型中,人们发现Hsp90功能抑制剂能引起与细胞增殖、细胞周期调节、细胞凋亡有关的重要信号蛋白选择性降解,进而研发特异性抑制Hsp90功能的药物,其中有些已经进入临床试验。通过抑制Hsp90的功能可能导致信号转导途径中的激酶分子和突变蛋白质被蛋白水解酶降解,达到抗肿瘤的作用[1]。
姜黄素(curcumin, Cur)是从姜黄中提取的多酚类化合物,近年国内外研究表明,姜黄素对多种癌细胞有抑制作用,且姜黄素下调p210bcr/abl蛋白含量是通过干扰Hsp90的分子伴侣功能实现的。虽然姜黄素有较强的抗肿瘤作用,但其水溶性差,水溶液易水解,尤其在中性至碱性pH值条件下更不稳定,且姜黄素口服首过消除现象明显,生物利用度低。本实验室通过化学结构修饰合成了一系列姜黄素衍生物,通过体外活性筛选,发现C1209可明显抑制慢性粒细胞白血病(chronic myeloid leukemia, CML)细胞的增殖,但具体的作用机制不明。因此,课题组致力于通过研究C1209抑制CML细胞增殖与阻断Hsp90伴侣功能的关系,探讨其抑制CML细胞增殖的作用机制,为合成活性更强、更稳定的姜黄素衍生物提供理论依据。本实验运用荧光光谱法、孔雀绿磷钼酸铵-无机磷检测法、MTT法、CFSE染色法、蛋白免疫印迹法等体外实验,研究C1209抑制CML细胞增殖与阻断Hsp90伴侣功能的关系。
1 材料与方法 1.1 材料 1.1.1 菌株与质粒重组质粒(Hsp90-PET28a、NHsp90-PET28a、MHsp90-PET28a、CHsp90-PET28a),大肠杆菌BL21(DE3)由厦门大学生命科学学院微生物药物实验室提供。
1.1.2 仪器与试剂Varioskan Flash酶标仪(美国Thermo Scientific公司);Cary Eclipse荧光分光光度计(安捷伦公司);ZHWY-200H全温型多振幅轨道摇床(上海智城分析仪器制造有限公司);FACSCantoII流式细胞仪(美国BD公司);免疫印迹成像系统(Carestream公司);稳压稳流电泳仪(美国Bio-Rad公司)。姜黄素衍生物C1209由本实验室合成,经HPLC及薄层层析分析鉴定,纯度为95%以上;格尔徳霉素(geldanamycin, GA)购自上海生工生物工程有限公司,Lot:XP0806132012J;ATP、四甲基偶氮唑盐(MTT)均购自Sigma公司;硫酸卡那霉素、异丙基-β-D-硫代半乳糖苷(IPTG)、钼酸铵四水、孔雀石绿、聚乙烯醇、咪唑等试剂购自上海生工生物工程有限公司;CFSE染料(日本Dojindo产品);β-actin单克隆抗体(美国Santa Cruz公司);抗Hsp90、Hsp70、HOP等一抗均购自美国CST公司;ECL化学发光显影液(GE healthy公司)。
1.1.3 细胞株及培养条件人CML细胞株K562,由福建医科大学新药研究所冻存提供。耐伊马替尼(imatinib, IM)的白血病细胞株K562/G01由福建医科大学附属协和医院惠赠,于福建医科大学药学院新药研究所保存。K562和K562/G01培养于含10%胎牛血清、青霉素100 kU·L-1、链霉素100 mg·L-1的RPMI 1640培养液中,K562/G01还需加入4 μmol·L-1的IM保持其耐药性。置37℃、5% CO2饱和湿度培养箱中培养,取对数生长期细胞用于实验。
1.2 方法 1.2.1 Hsp90的诱导表达及纯化Hsp90融合蛋白全长、NHsp90、MHsp90和CHsp90的诱导、表达及纯化参见文献[2-5]。
1.2.2 荧光滴定反应体系为5 μmol·L-1 Hsp90或其不同片段的PBS稀释液2 mL,加入不同体积的C1209,充分混匀后,置于293 K、303 K、310 K的环境下,于荧光分光光度计中,激发波长为280 nm,记录290~510 nm的荧光光谱。抑制剂的溶度变化为0、5、10、15、20、25、30、35、40、45、50 μmol·L-1;同时记录△λ=15 nm和△λ=60 nm的同步荧光光谱,测定时荧光激发和发射狭缝均为5 nm;重复测定3次[6]。
1.2.3 Hsp90 ATPase活性抑制剂IC50确定以已知的Hsp90抑制剂GA为阳性对照, 2% DMSO为阴性对照, 空白对照为反应体系不加Hsp90。反应体系:不同浓度GA(0.125、0.25、0.5、1 μmol·L-1)和C1209(1.5、4、10、25、50、75 μmol·L-1)溶于2% DMSO中;Hsp90终浓度为0.4 μmol·L-1, ATP终浓度为1 mmol·L-1, 以上试剂均溶于缓冲液(6 mmol·L-1 MgCl2、20 mmol·L-1 KCl、100 mmol·L-1 Tris-HCl, pH 7.4),反应体系为100 μL。37℃反应3 h, 每组数据3次平行,加入80 μL检测液[0.812 g·L-1的孔雀绿、23.2 g·L-1的聚乙烯醇、57.2 g·L-1的钼酸铵(含6 mol·L-1 HCl)和超纯水以体积比2 :1 :1 :2比例混合],震荡反应后,用酶标仪检测620 nm处的吸光度(OD620)值[5]。根据吸光度值,计算各抑制剂的IC50值。其中OD620是3组平行实验测定的OD620平均值,由软件计算出各抑制剂的IC50[2-5]。
抑制率=(OD阴性对照-OD实验组)/(OD阴性对照-OD空白对照)×100%
1.2.4 MTT法测定姜黄素衍生物C1209对白血病细胞K562和K562/G01增殖抑制作用取对数生长期的白血病细胞K562和K562/G01,按5×107·L-1接种于96孔培养板中,每孔180 μL。实验组分别加入不同浓度的药物20 μL,C1209浓度为0.1、0.2、0.4、0.8、1.6、3.2、6.4 μmol·L-1,对照组不加药,另设背景对照不加药物和细胞,每组设3个平行孔,37℃培养24 h。每孔加入5 g·L-1的MTT溶液20 μL,继续培养4 h后,离心弃上清,加入150 μL DMSO,微量振荡仪振荡10 min,立即用酶标仪在570 nm波长处测吸光度(OD值)。根据吸光度计算细胞生长抑制率:细胞生长抑制率=(OD对照组-OD实验组)/OD对照组×100%。用Logit法计算IC50值,实验重复3次,取平均值。以药物浓度为横轴,抑制率值为纵轴,绘制细胞增殖抑制量效关系曲线。
1.2.5 CFSE染色法测定姜黄素衍生物C1209对白血病细胞K562和K562/G01增殖能力的抑制作用取对数生长期的白血病细胞K562和K562/G01,细胞计数后,1 000 r·min-1,离心10 min。弃上清,加入0.1% FBS/PBS液体重悬,洗涤1次,再用合适体积的0.1% FBS/PBS重悬,得到4×109·L-1的细胞液;用0.1% FBS/PBS稀释CFSE储存液至5 μmol·L-1;各取0.25 mL的细胞悬液和CFSE稀释液,轻轻混匀;37℃放置10 min;加入冰冷的含有10% FBS的RPMI 1640培养液洗涤2次。用适量的培养基重悬,使得细胞最终浓度为3×108·L-1;设置对照组不加药,实验组分别加入不同浓度的药物,C1209对K562的处理浓度为0.8、1.6、3.2 μmol·L-1,对K562/G01的处理浓度为0.4、0.8、1.6 μmol·L-1,37℃、5% CO2饱和湿度培养箱中避光培养72 h;细胞吹打均匀,收集细胞,用PBS洗涤2次,转移入流式管中,4℃避光,冰上保存,24 h内在流式细胞仪上检测,用Modfit软件进行分析。
1.2.6 蛋白免疫印迹法检测Hsp90客户蛋白及其下游蛋白、Hsp90分子伴侣的表达取对数生长期的白血病细胞K562和K562/G01,设置对照组不加药及不同浓度的药物处理组,C1209对K562的处理浓度为0.8、1.6、3.2 μmol·L-1,对K562/G01的处理浓度为0.4、0.8、1.6 μmol·L-1;GA对K562和K562/G01处理浓度均为1 μmol·L-1;放于37℃培养箱,作用24 h,收集细胞,裂解,BCA蛋白定量,98℃蛋白变性,SDS聚丙烯酰胺凝胶电泳、转膜、封闭,相应一抗4℃孵育过夜,室温下孵育二抗1 h,在Image station 4000MM成像系统进行显影。
1.2.7 统计学分析采用GraphPad Prism软件和Origin8.5软件进行One-way analysis of variance实验数据分析,结果采用x±s表示。
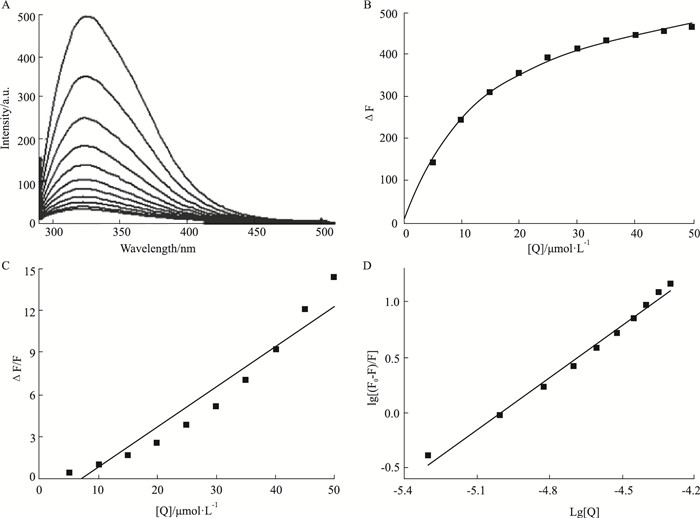
2 结果 2.1 C1209与Hsp90的相互作用 2.1.1 C1209对Hsp90内源荧光的淬灭作用采用荧光光谱法分析C1209对Hsp90内源荧光的淬灭作用,Hsp90的最大荧光发射峰在324 nm。随着C1209浓度的增加,Hsp90的内源性荧光强度发生有规律的减弱,表示两者间可能发生相互作用(Fig 1A)。Hsp90的浓度为5 μmol·L-1,Hsp90与药物的浓度比例从1 :1变化到1 :10。
|
| Fig 1 C1209 physically binds to Hsp90 A: Quenching effect of C1209 on Hsp90 endogenous fluorescent; B: 324 nm, change trend of Hsp90 fluorescence intensity with C1209 concentration; C: Stern-Volmer plot for binding of C1209 with Hsp90; D: Lineweaver-Burk plot for binding of C1209 with Hsp90. |
C1209对Hsp90的解离常数KD可由关系式:ΔF=F0-F= △Fmax [Q] / KD + [Q]得到;式中△Fmax为理想状态下,Hsp90被C1209饱和后在324 nm处的荧光强度最大改变值,F0和F分别是不存在和存在C1209时Hsp90溶液的荧光强度,[Q]是体系中C1209的总浓度代替游离浓度,KD为解离常数。由Origin8.5软件对数据进行非线性拟合,结果见Fig 1B。相关参数Fmax =610.02±10.28,KD =(14.73±0.71)μmol·L-1,R2 =0.999。由结果可知,C1209与Hsp90间具有较强的相互作用。
2.1.2 C1209对Hsp90的淬灭常数荧光淬灭过程运用Stern-Volmer方程:F0/F=1+KSV[Q]分析,式中F0、F、[Q]如“2.1.1”表述,KSV是Stern-Volmer猝灭常数,由下式定义:KSV=Kq×τ0, Kq是双分子淬灭过程速率常数。τ0是生物大分子内源性荧光寿命值,为10-8 s。由Origin8.5软件对数据进行拟合,结果见Fig 1C。相关参数Kq=(2.85±0.26)×1013 L·mol-1·s-1,KSV=(2.85±0.26)×105 L·mol-1,R2=0.920。各类猝灭剂对生物大分子的最大动态猝灭速率常数Kq为2.0×1010 L·mol-1·s-1,而C1209对Hsp90的Kq数量级在1013,说明C1209对Hsp90的猝灭过程是由于形成复合物引起的静态猝灭。
2.1.3 C1209与Hsp90结合常数与结合位点数静态淬灭过程符合Lineweaver-Burk双倒数方程:lgF0-F/F=lgKA+nlg[Q],式中F0、F、[Q]如“2.1.1”表述,KA是结合常数,n是结合位点数。数据用Origin8.5软件进行分析,结果见Fig 1D。相关参数KA=7.81×107 L·mol-1,n=1.57±0.06,R2=0.988。由C1209与Hsp90的结合常数KA和结合位点数n,可知C1209与Hsp90之间具有较强的结合作用。
2.1.4 C1209与Hsp90作用力类型的确定当温度变化不大时,反应的焓变ΔHθ与ΔSθ可以看作一个常数,有公式:lnKD1/KD2=ΔHθ(1/Tl-1/T2)/R;ΔGθ=ΔHθ-TΔSθ=RTlnKD。其中R是热力学气体常数,取值为8.314 J·mol-1·k-1;T是热力学温度;KD是不同温度下对应的解离常数;ΔGθ是吉布斯自由能。根据两个温度下的热力学常数值,可以计算出C1209与Hsp90相互作用的热力学函数值,相关参数见Tab 1。据Ross等[7]提出的理论,当ΔHθ < 0,ΔSθ>0时,生物大分子与生物小分子的结合性质表现为静电作用力。由结果可知,该体系中C1209与Hsp90之间的主要作用力是静电作用力。为了进一步确定两者的作用力类型,运用同步荧光法研究C1209对Hsp90构象的影响。
| Compounds | T/K | KD /μmol·L-1 | R2 | ΔGθ/kJ·mol-1 | ΔHθ/kJ·mol-1 | ΔSθ/J·mol-1·k-1 |
| C1209 | 293 | 12.26±0.40 | 0.999 | -27.55±0.07 | ||
| 303 | 13.95±0.70 | 0.998 | -28.16±0.12 | -7.60±1.79 | 68.08±5.91 | |
| 310 | 14.73±0.71 | 0.998 | -28.67±0.12 |
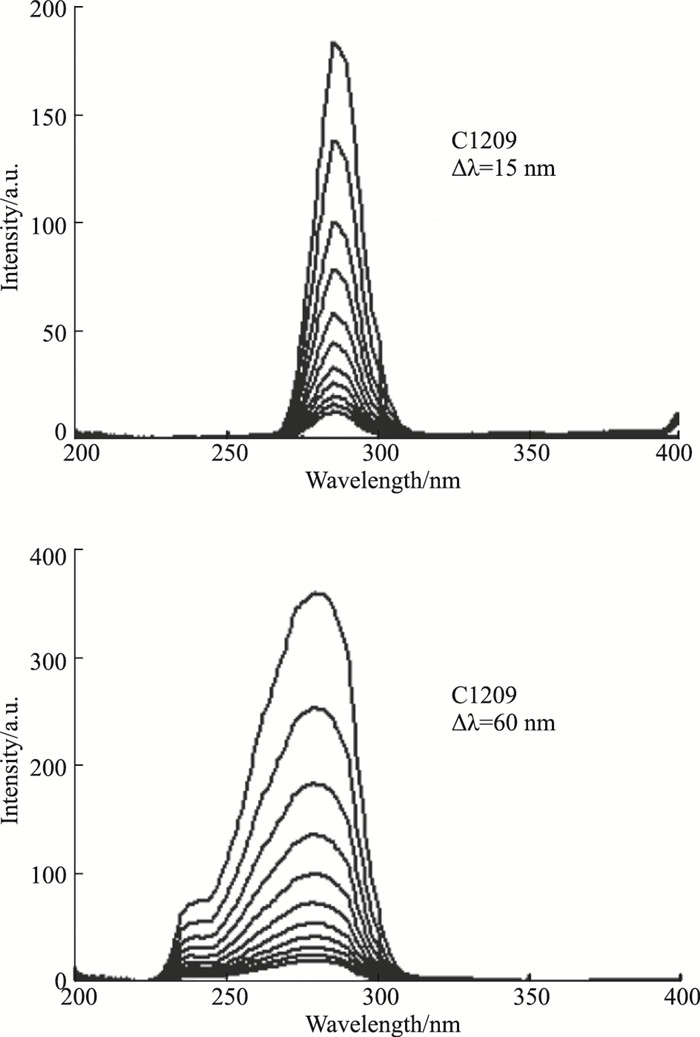
酪氨酸、色氨酸残基是蛋白质荧光的主要来源,因此常用于同步荧光的研究。当Δλ=15 nm时,表现的是Hsp90中酪氨酸残基的同步荧光的光谱特性;当Δλ=60 nm时,表现的是Hsp90中色氨酸残基的同步荧光的光谱特性。由Fig 2可知,随着C1209的加入,Hsp90中酪氨酸残基、色氨酸残基的同步荧光最大荧光发射波长基本不变,说明酪氨酸残基和色氨酸残基周围微环境没有发生明显改变,且未明显降低其所处的微环境疏水性,没有明显改变肽链伸展程度。这表明增加C1209的浓度并没有使Hsp90中的酪氨酸、色氨酸残基的构象发生变化。这也就进一步确定了C1209与Hsp90之间的主要作用力为静电作用力。
|
| Fig 2 Synchronous fluorescence spectra of C1209 with Hsp90 |
为确定C1209与Hsp90的结合区域,通过荧光滴定实验分析C1209与3个功能域(NHsp90、MHsp90、CHsp90)的结合情况,通过Origin8.5软件对数据进行拟合,相关参数见Tab 2。结果表明,相同实验条件下,C1209与Hsp90的C端片段结合能力最强。
| Compounds | Fmax | KD /μmol·L-1 | R2 |
| N-Hsp90-C1209 | 273.19±5.86 | 18.64±1.02 | 0.998 |
| M-Hsp90-C1209 | 114.17±0.56 | 8.19±0.16 | 0.999 |
| C-Hsp90-C1209 | 51.93±0.23 | 4.87±0.11 | 0.999 |
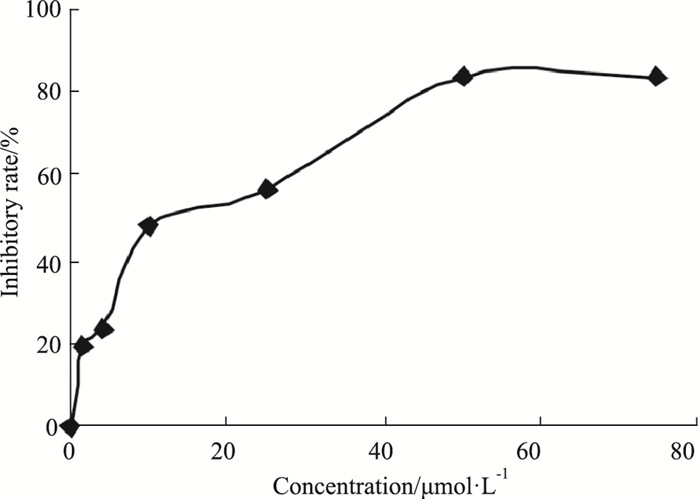
孔雀绿·磷钼酸铵无机磷检测法检测C1209对Hsp90作用的量效关系。如Fig 3所示,随着药物浓度的增加,抑制率逐渐升高,当ATP的浓度为1 mmol·L-1时,IC50值为11.40 μmol·L-1。
|
| Fig 3 The inhibitory rate of Hsp90 ATPase activity under different concentrations of C1209 |
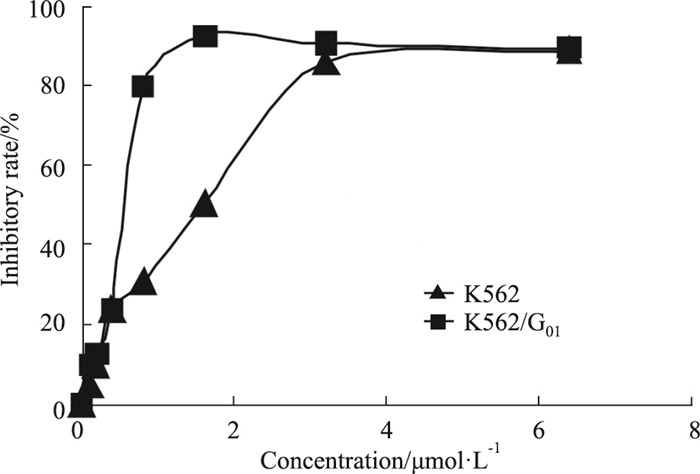
Fig 4 MTT结果表明,随着药物浓度的增加,抑制率逐渐升高,呈现明显剂量依赖性。药物作用K562细胞24 h时的IC50为1.14 μmol·L-1;作用K562/G01细胞24 h时IC50为0.56 μmol·L-1。C1209对K562/G01细胞的作用明显强于K562细胞。
|
| Fig 4 The inhibitory rate of imatinib-sensitive or imatinib-resistant CML cells under different concentrations of C1209 |
CFSE是一种能够轻易穿透细胞膜并对细胞无毒性作用的荧光染料。在细胞分裂增殖过程中,标记荧光可平均分配至子代细胞中,荧光强度会随着细胞的分裂而逐级递减,因此可用于细胞增殖、细胞周期的估算及检测细胞分裂等情况[8]。Fig 5 CFSE染色实验结果表明,C1209能够减少白血病细胞的增殖分裂代数,使细胞增殖停滞,与未加药组相比较,C1209有明显的抑制细胞增殖的能力,随着药物浓度的增加抑制作用更加明显。

|
| Fig 5 Inhibitory effects of C1209 on proliferation ability of imatinib-sensitive or imatinib-resistant CML cells |
不同浓度的C1209处理细胞24 h后,提取白血病细胞蛋白,用蛋白免疫印迹的方法检测Hsp90客户蛋白的表达。如Fig 6所示,C1209抑制Hsp90的分子伴侣功能,下调Hsp90客户蛋白。Hsp70随着药物浓度的增加而增加,P23和HOP含量无明显变化。Hsp90客户蛋白Akt、MEK、ERK、c-Raf及其相应磷酸化蛋白p-Akt、p-MEK、p-ERK等,随着药物浓度的增加,降解程度逐渐增强。

|
| Fig 6 C1209 affected molecular chaperone functions of Hsp90 (A) and down-regulated client proteins level of Hsp90(B) in imatinib-sensitive or imatinib-resistant CML cells |
IM是目前治疗CML的靶点药物,也是临床上的一线药物,随着治疗的不断进行,出现了IM耐药的现象。因此,寻找新的药物,减少耐药和复发是非常有必要的。在前期工作中,发现姜黄素能够特异性抑制K562和K562/G01细胞的增殖,姜黄素并不影响Hsp90的表达,但可抑制Hsp90与客户蛋白P210bcr/abl的相互作用,导致P210bcr/abl蛋白降解,P210bcr/abl为引起CML对多种化疗药物耐药的CML特征性的蛋白[9]。本实验探究了姜黄素衍生物C1209对K562及耐IM的K562/G01细胞的增殖抑制作用与阻断Hsp90伴侣功能的关系。
C1209对白血病细胞K562和K562/G01细胞均表现出较强的杀伤作用。在MTT和CFSE染色的结果中,C1209能够抑制K562和K562/G01细胞的增殖,相比阳性药物IM抑制作用更加明显。本实验进一步探究C1209对白血病细胞的增殖抑制作用的机制。
Hsp90抑制剂通常可以引起其下游客户蛋白的泛素化降解,进而诱导细胞凋亡。GA作为一个早期开发的Hsp90抑制剂,在细胞内表现尤为明显。在低浓度时就可以引起Hsp90许多下游客户蛋白降解,这是Hsp90抑制剂的重要标志。Hsp90抑制剂可以影响客户蛋白的折叠,干扰客户蛋白的功能。本实验研究结果显示,C1209分别处理K562和K562/G01细胞24 h,细胞中Bcr/Abl、Akt、MEK、ERK、c-Raf及其相应磷酸化蛋白p-Akt、p-MEK、p-ERK等蛋白含量均有下调。在与肿瘤细胞生长和增殖密切相关的信号转导通路中,这些蛋白都担负着重要的作用。Raf/MEK/ERK途径是最先被鉴定的促分裂原活化蛋白激酶通路,该通路涉及多个激酶和转录因子家族,由蛋白磷酸化修饰激活或失活,磷酸化激活的ERK由胞质转位到核内,进而介导c-Myc、NF-κB、Ap-l、c-Fos、c-Jun、CREB等的转录活化,参与细胞增殖与分化、细胞凋亡、细胞的恶变、血管生成等多种生物学反应[10]。研究证实,Raf-1主要位于胞质中的Hsp90复合体内,Hsp90与Raf-1结合,显示出Hsp90是维持Raf-1活性所需要的。Hsp90通过维持Raf-1的活性,间接调控Raf-1/MEK/ERK通路,最终影响了细胞的增殖、分化、恶变以及细胞的存活[11]。Bcr/Abl、Akt、MEK、ERK、c-Raf及其相应磷酸化蛋白p-Akt、p-MEK、p-ERK等均是Hsp90的客户蛋白。因而我们推测,Hsp90可能是C1209抗瘤作用的特异性的分子靶点,C1209可能通过干扰Hsp90分子伴侣功能而发挥抗肿瘤作用。
Hsp90并不是独自完成其分子伴侣功能,其功能的发挥还需要Hsp70、HOP、P23及亲免素(immunophilins,IP)等至少12个以上辅分子伴侣的参与[12]。Hsp90以多伴侣复合物的形式发挥其功能。本课题组前期研究发现,Cur在使Hsp90/p23与P210bcr/abl结合减少,引发P210bcr/abl的快速降解的同时,Hsp70/P60Hop与P210bcr/abl的结合增加,这个特征与Hsp90的N端抑制剂GA很相似。提示Cur下调P210bcr/abl蛋白含量是通过干扰Hsp90的分子伴侣功能实现的[9]。
本实验中,我们以Hsp90的N端抑制剂GA为阳性对照,研究了C1209对K562和K562/G01两种人白血病细胞中Hsp90分子伴侣功能的影响。结果表明,C1209分别处理K562和K562/G01细胞24 h后,均可上调细胞中Hsp70的含量,但对P23和P60Hop的蛋白含量无明显影响。对这两种细胞中Hsp70、P23和P60Hop蛋白含量的影响,C1209的作用趋势与阳性对照GA一致。C1209对两种细胞中Hsp90的含量无明显影响,作用趋势也与阳性对照GA一致。实验结果提示,C1209可能与Hsp90的N端抑制剂GA类似,它们可以阻断Hsp90和P23之间的结合,同时增加Hsp90和Hsp70之间的结合。Hsp90和Hsp70之间的结合增多,更多的客户蛋白与Hsp90/Hsp70结合形成中间复合物。同时,Hsp90和P23之间的结合减少,不利于客户蛋白与Hsp90结合形成稳定的终末复合物。Hsp90可能是C1209抗瘤作用的特异性的分子靶点。肿瘤细胞中Hsp90的表达比正常细胞高出2~10倍,这是肿瘤细胞在各种恶劣环境中继续维持蛋白质内环境的稳态而长期生存的适应性表现。在Hsp90众多的客户蛋白中,有许多是与细胞增殖和细胞凋亡有关的信号蛋白。C1209处理细胞后,各种与肿瘤细胞增殖和凋亡相关的信号分子含量的下调也可能是通过干扰Hsp90的分子伴侣功能而实现的。C1209可能通过干扰Hsp90分子伴侣功能,导致其客户蛋白失稳定而沿着泛素-蛋白酶体途径降解。
在Hsp90的分子伴侣循环中,Hsp90通过结合和水解ATP而调节自身构象和功能[13]。Hsp90伴侣功能依赖于其ATPase活性,如果C1209能影响Hsp90伴侣功能,就很有可能抑制其ATPase活性。实验中我们发现,C1209可抑制Hsp90的ATPase活性,且其与Hsp90具有较强的结合作用,导致Hsp90内源荧光发生有规律的静态淬灭,即形成了静态复合物[14]。热力学常数和同步荧光表明,稳定C1209-Hsp90静态复合物的主要作用力为静电作用力,C1209与CHsp90片段的结合能力最强。
综上所述,姜黄素衍生物C1209是Hsp90抑制剂,对K562和耐IM的白血病细胞K562/G01具有明显的增殖抑制作用,这些作用可能与其抑制Hsp90的分子伴侣功能,下调Hsp90客户蛋白有关。
( 致谢: 本文实验在福建省天然药物药理学重点实验室完成,在此对实验室老师和实验参与人员表示感谢!)
| [1] | 罗红霞, 邓华瑜, 郑维萍. Hsp90的抑制剂Geldanamycin对乳腺癌细胞侵袭、转移能力的影响[J]. 重庆医科大学学报, 2006, 31(1): 55-73. Luo H X, Deng H Y, Zheng W P. Effect of Hsp90 inhibins geldanamycin on invasion and metastasis of human breast cancer cell line[J]. J Chongqing Med Univ, 2006, 31(1): 55-73. |
| [2] | 陈俊杰, 郭秋菊, 贺晓萌, 等. 基于Hsp90ATPase活性的抑制剂筛选模型研究[J]. 厦门大学学报(自然科学版), 2010, 9(5): 711-6. Chen J J, Guo Q J, He X M, et al. Study on a screening model for inhibitor of Hsp90 ATPase activity[J]. J Xiamen Univ, 2010, 9(5): 711-6. |
| [3] | 范莹娟, 许建华. 姜黄素与Hsp90相互作用以及对Hsp90ATPase活性的影响[J]. 中国药理学通报, 2013, 29(10): 1426-31. Fan Y J, Xu J H. Interactions between curcumin and Hsp90 and effects of curcumin on Hsp90 ATPase activity[J]. Chin Pharmacol Bull, 2013, 29(10): 1426-31. |
| [4] | 范莹娟, 张连茹, 刘洋, 等. 姜黄素衍生物C085与Hsp90及其不同片段相互作用以及对Hsp90 ATPase活性的影响[J]. 中国药理学通报, 2014, 30(10): 1408-13. Fan Y J, Zhang L R, Liu Y, et al. Interactions between curcumin derivatives C085 and various constructs of Hsp90 and effects of C085 on Hsp90 ATPase activity[J]. Chin Pharmacol Bull, 2014, 30(10): 1408-13. |
| [5] | Fan Y J, Liu Y, Zhang L R, et al. C0818, a novel curcumin derivative, interacts with Hsp90 and inhibits Hsp90 ATPase activity[J]. Acta Pharm Sin B, 2017, 7(1): 91-6. doi:10.1016/j.apsb.2016.05.014 |
| [6] | 高平章, 吴洪, 郭婧, 许亚妹. 荧光光谱法研究灯盏花素与牛血清白蛋白相互作用[J]. 中国现代应用药学, 2012, 29(2): 106-9. Gao P Z, Wu H, Guo J, Xu Y M. Study on the interaction between breviscapinum and bovine serum albumin by fluorescence spectrometry[J]. Chin JMAP, 2012, 29(2): 106-9. |
| [7] | Ross P D, Subramaning S. Thermodynamics of protein association reactions: forces contributing to stability[J]. Biochemistry, 1981, 20(11): 3096-102. doi:10.1021/bi00514a017 |
| [8] | 黄立森, 陈显凌, 柯方, 等. 新生霉素通过诱导DNA损伤抑制慢粒白血病细胞增殖[J]. 中国药理学通报, 2014, 30(3): 365-72. Huang L S, Chen X L, Ke F, et al. Novobiocin inhibits CML cells proliferation by inducing DNA damage[J]. Chin Pharmacol Bull, 2014, 30(3): 365-72. |
| [9] | Wu L X, Xu J H, Huang X W, et al. Down-regulation of P210bcr/abl by curcumin involves disrupting the molecular chaperone functions of Hsp90[J]. Acta Pharmacol Sin, 2006, 27(6): 694-9. doi:10.1111/aphs.2006.27.issue-6 |
| [10] | Rinehart J, Adjei A A, Lorusso P M, et al. Multicenter phase Ⅱ study of the oral MEK inhibitor, CI-l040, in patients with advanced non-small-cell lung, breast, colon, and pancreatic cancer[J]. J Clin Oncol, 2004, 22(22): 4456-62. doi:10.1200/JCO.2004.01.185 |
| [11] | Hahn M, Li W, Yu C, et al. Rapamycin and UCN-01 synergistically induce apoptosis in human leukemia cells through a process that is regulated by the Raf-1/MEK/ERK, Akt, and JNK signal transduction pathways[J]. Mol Cancer Ther, 2005, 4(3): 457-70. |
| [12] | Janin Y L. ATPase inhibitors of heat-shock protein 90, second season[J]. Drug Discov Today, 2010, 15(9-10): 342-53. doi:10.1016/j.drudis.2010.03.002 |
| [13] | Sullivan W P, Owen B A, Toft D O. The influence of ATP and p23 on the conformation of Hsp90[J]. J Biol Chem, 2002, 277(48): 45942-8. doi:10.1074/jbc.M207754200 |
| [14] | Pastukhov A V, Levchenko L A, Sadkov A P. Spectroscopic study on binding of rutin to human serum albumin[J]. Mol Struc, 2007, 842(1): 60-6. |

