


2. 浙江大学医学院,浙江 杭州 310058
2. Zhejiang Respiratory Drugs Research Lab, School of Basic Medical Sciences, Zhejiang University, Hangzhou 310058, China
急性肺损伤(acute lung injury, ALI)是由多种因素引起的肺泡毛细血管弥漫性损伤,导致肺水肿和肺不张,临床表现为急性呼吸窘迫和难治性低氧血症,也是全身失控性炎症反应导致的多器官功能障碍综合征的肺部表现。严重的ALI被称为急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS),死亡率高,目前不论是国内还是国外都没有治疗ALI的有效手段[1]。莰醇又称龙脑,是中药冰片的主要成分。临床中冰片广泛应用于各科,冰片除了具有抗炎、抗菌、止痛的功效外,还具有促进其他药物透过血脑屏障、保护脑缺血、诱导肝微粒体酶等作用[2]。莰醇较少单独应用,常用作“引药及佐药”,中成药中有较多的配伍应用,在临床上可用于普通外科感染、皮肤病、宫颈糜烂等,在心脑血管病治疗中应用尤其广泛,但是莰醇在呼吸系统方面的研究较少,其对ALI/ARDS是否有治疗作用,目前尚没有直接证据支持。本研究旨在探索莰醇对ALI的作用及其可能机制,为其应用于ALI/ARDS提供实验依据。
1 材料 1.1 实验动物、细胞与试剂健康♂ C57BL/6小鼠,7~8周,体质量(20~23) g,清洁级,由上海斯莱克实验动物有限责任公司提供,合格证号:2007000550498。小鼠肺泡巨噬细胞株MHS(CRL-2019)和小鼠上皮细胞株MLE-12 (CRL-2110)购自美国ATCC细胞库。莰醇由先声药业提供;脂多糖(lipopolysaccharide, LPS)(大肠杆菌O127:B8)购于美国Sigma;地塞米松(浙江仙琚制药公司,批号:110202);肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、巨噬细胞炎症蛋白-2(macrophage inflammatory protein-2, MIP-2)、白介素-6(interleukin-6, IL-6)、白介素-1β(interleukin-1β, IL-1β)、角化生长因子(keratinocyte growth factor,KC)等细胞因子测定试剂盒购自R&D公司。
1.2 仪器Bio-Rad全波长酶标仪,Eppendorff低温离心机,美国Labconco公司纯水仪,意大利SCOTSMAN公司AF10制冰机,美国Forma Scientific公司低温冰箱,瑞典Mettler Toledo公司精密天平,美国Thermo公司细胞培养箱。
2 方法 2.1 小鼠ALI模型的建立及分组将48只C57BL/6 ♂小鼠随机分组,每组12只,气道滴入LPS 2 mg·kg-1后,立即阴茎静脉注射莰醇(2.5 mg·kg-1)、地塞米松(5 mg·kg-1)及生理盐水等进行干预,正常对照组气道滴入生理盐水。LPS滴入后6、12、24 h分3批处死动物,结扎右肺后,暴露气管行气管插管,用生理盐水1 mL分2次进行支气管肺泡灌洗(bronchoalveolar lavage fluid, BALF),回收率达90%。
2.2 支气管肺泡灌洗液中细胞因子含量的测定小鼠支气管肺泡灌洗液以250×g离心10 min,采用双抗体夹心ELISA法,按照试剂盒说明书中的要求,测定BALF上清中TNF-α、IL-1β、IL-6、KC等含量。
2.3 肺组织病理学检查每组取3只小鼠右下肺叶用中性福尔马林液固定,石蜡切片,HE染色,高倍显微镜观察肺水肿及炎症细胞浸润,观察肺组织病理学改变。
2.4 小鼠肺巨噬细胞株MHS的培养与处理培养条件:Cellgro RPMI 1640培养基+10% FBS。将2×108·L-1 MHS细胞株接种于48孔板,LPS刺激的终浓度为1 mg·L-1,莰醇的终浓度为1 mmol·L-1。分别于LPS刺激后1、3、6、9、12、24 h收获上清,采用R&D公司的Duo-set试剂盒测定TNF-α、IL-6等细胞因子浓度。
2.5 小鼠肺上皮细胞株MLE-12的培养与处理培养条件:Cellgro RPMI 1640培养基+4% FBS。将2×108·L-1 MLE-12细胞株接种于48孔板,LPS刺激的终浓度为1 mg·L-1,莰醇的终浓度为1 mmol·L-1。分别于LPS刺激后1、3、6、9、12、24 h收获上清,采用R&D公司的Duo-set试剂盒测定KC、MIP-2等细胞因子浓度。
2.6 统计学处理实验数据用x±s表示,各组均数先行方差齐性检验,各个样本均数的比较采用方差分析和两样本t检验。所有数据用SPSS 13.0统计软件处理。
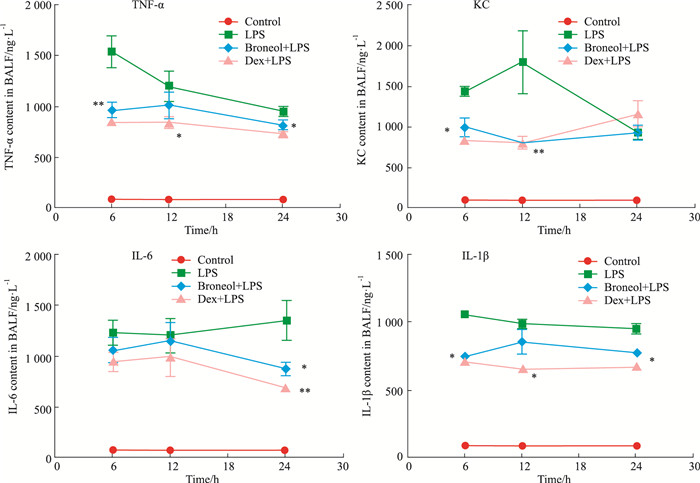
3 结果 3.1 莰醇对LPS诱导ALI的肺泡灌洗液中炎症细胞因子的影响在LPS气道滴入诱导的ALI模型中,莰醇1次用药后6、12、24 h收集BALF和肺组织。如Fig 1所示,LPS气道滴入6 h后,莰醇及地塞米松均可明显降低BALF中TNF-α、KC、IL-1β的含量,提示莰醇具有一定改善效果,且与地塞米松相当,但对BALF中IL-6的早期作用不明显。有趣的是,莰醇有一定的后期效应,用药后24 h还有一定效应,其对于TNF-α、IL-1β、IL-6的作用效果与地塞米松相当。莰醇及地塞米松均可明显抑制KC的分泌,这一作用持续至12 h。提示药物可能通过对炎症细胞因子TNF-α、IL-1β、IL-6及CXC趋化因子配体KC的影响,抑制中性粒细胞的迁移和募集到肺组织。
|
| Fig 1 Changes of secretion of KC, TNF-α, IL-6 and IL-1β in BALF *P < 0.05, **P < 0.01 vs LPS alone |
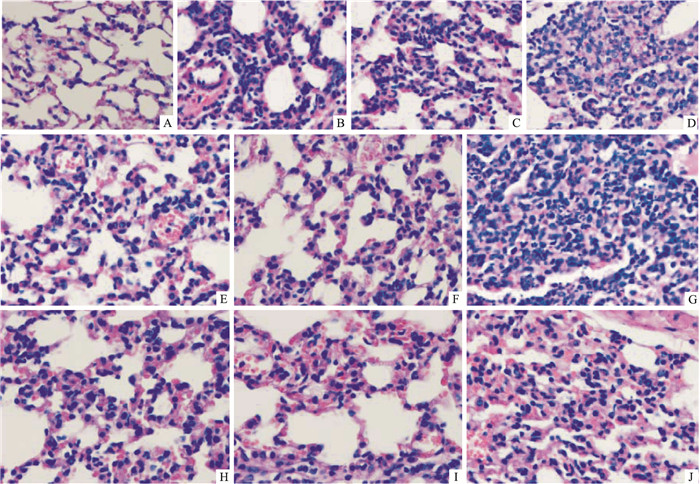
如Fig 2所示,光镜下LPS组肺组织表面有点状出血点、水肿区域,而对照组肺外观无这些异常改变;组织病理切片镜下可见气道管腔内、血管腔内有大量中性粒细胞聚集,肺组织间隙可见大量中性粒细胞浸润和红细胞渗出,肺泡内有蛋白水肿液,肺泡间隙边缘有轻度透明膜形成。随时间延长,LPS诱导的肺组织炎症浸润增加明显,24 h时组织炎症细胞浸润已导致组织结构上的破坏,用药组在6 h时间点,均较LPS组轻。
|
| Fig 2 Pathological changes of lung tissues of 6h, 12h and 24h after LPS airway instillation and drug treatment(HE staining, ×400) A: Control; B: LPS-6 h; C: LPS-12 h; D: LPS-24 h; E: Broneol-6 h; F: Broneol-12 h; G: Broneol-24 h; H: Dexamethasone-6 h; H: Dexamethasone-12 h; I: Dexamethasone-24 h |
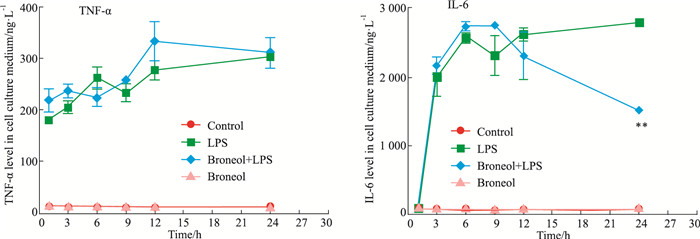
肺巨噬细胞是肺防御屏障的第一道防线,能对外来刺激产生明显的反应,从而启动肺部的炎症反应。莰醇对LPS诱导的MHS细胞分泌TNF-α没有明显影响,但对IL-6分泌的抑制作用后期更明显(Fig 3)。
|
| Fig 3 Effect of broneol on secretion of TNF-α and IL-6 from MHS **P < 0.01 vs LPS alone |
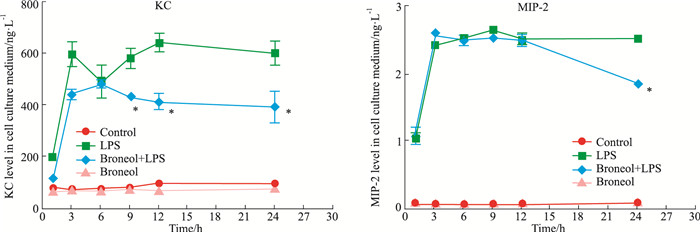
肺上皮细胞也是肺防御屏障的重要细胞,是肺部炎症反应的启动细胞。莰醇对LPS诱导的MLE-12细胞中KC的分泌在9 h以后开始显现,一直持续到24 h,对于MIP-2的影响则在后期比较明显,24 h后有明显差异(Fig 4)。
|
| Fig 4 Effect of broneol on secretion of KC and MIP-2 from MLE-12 *P < 0.05 vs LPS alone |
ALI/ ARDS发病机制复杂,目前尚未完全阐明,是临床常见的危急重症,病情发展迅速,病死率高。LPS是革兰阴性菌的主要致病成分[3],是引起ALI并最终导致患者死亡的重要原因之一,LPS可导致肺泡上皮细胞、肺泡毛细血管内皮细胞及肺间质的急性弥漫性损害,导致相关炎性细胞激活,继而释放IL-1β、IL-6、TNF-α、KC等一系列炎症介质[4],造成肺损伤。肺泡巨噬细胞和肺泡上皮细胞在肺部炎症性疾病中非常关键,而且肺泡上皮细胞的再生对于ARDS的恢复至关重要[5-6],炎症因子TNF-α的主要来源是巨噬细胞,而KC的主要来源是肺上皮细胞[7-8]。这也是本实验中选择肺巨噬细胞和上皮细胞进行体外实验的原因。
莰醇是传统中药冰片里的主要单体成分之一,又称龙脑。《中国药典》(2005年)规定合成冰片中的龙脑含量不低于55%,《本草纲目》记载,冰片具“通诸窍、散郁火”之功效,该药目前在临床上应用极为广泛,以冰片为主要成分的外用方有200多种,现代医学研究表明,其具有抗炎、镇痛、抗菌、抗病毒作用,另外,其还具有保护心脑和提高其他药物生物利用度等作用[9]。何晓静等[10]研究发现,冰片能抑制大鼠脑缺血/再灌注损伤时相关炎症细胞因子的表达,减少白细胞的浸润,对脑缺血/再灌注损伤有保护作用。但由于冰片本身来源复杂、成分各异,且纯度不一,目前临床对其药效及相关研究知之甚少,而作为冰片的主要成分之一的莰醇在呼吸系统的药理研究相对更少。鉴于冰片的良好抗炎、抗氧化效果,且ALI的本质是肺部各种炎性细胞激活浸润和一系列炎性介质的释放,故本实验在动物水平和细胞水平同时观察莰醇干预LPS诱导ALI的效果,并进一步探索其可能作用机制。
实验结果显示,动物水平上LPS气道滴入后6 h,莰醇可在不同时间节点上对TNF-α、IL-1β、IL-6、KC的分泌产生抑制作用,同时抑制中性粒细胞的迁移和募集到肺组织,改善肺部病理变化,对于TNF-α、IL-6、KC的抑制作用一定程度上与地塞米松效果相当。值得关注的是,莰醇有一定的后期效应,用药后24 h还有一定效应,能抑制TNF-α、IL-1β、IL-6的分泌,而且也与地塞米松相当。细胞水平上,莰醇对LPS诱导的MHS细胞中TNF-α分泌没有明显影响,但对IL-6的分泌抑制作用后期更明显,对IL-6的影响与动物水平上的结果一致;对MLE-12细胞中的KC和MIP-2的分泌在给药后期均有明显抑制作用。江光池等[11]采用无菌性炎症模型,发现莰醇能明显抑制大鼠蛋清性足跖肿胀,对液体的渗出和组织水肿等炎症过程有抑制作用,也提示莰醇有一定的抗炎作用。
目前临床对于不同因素所致的ALI,药物治疗均主要围绕抗炎、抗氧化应激、抗凝血、改善肺水肿等方面展开,如吸入NO及神经肌肉阻滞剂、糖皮质激素类药物等都被广泛用于LPS所致ALI的治疗,虽有一定疗效,但仍无确切证据证明此类药物可以明确治疗ALI[12]。本实验结果提示,莰醇对LPS诱导的ALI有保护作用,其作用机制可能与抑制TNF-α、IL-1β、IL-6、KC等炎症因子的分泌,抑制中性粒细胞、肺巨噬细胞、肺上皮细胞等的活化及释放相关炎性介质有关,莰醇在治疗ALI方面具有一定研究价值,为探索中药治疗ALI提供了一定思路。
( 致谢: 本实验在浙江大学医学院药理实验室和浙江大学实验动物中心完成,感谢在本课题研究中给予帮助的浙江大学医学院药理教研室的老师和同学!感谢先声药业在项目研究中提供的资助!)
| [1] | Matthay M A, McAuley D F, Ware L B. Clinical trials in acute respiratory distress syndrome: challenges and opportunities[J]. Lancet Respir Med, 2017, 5(6): 524-34. doi:10.1016/S2213-2600(17)30188-1 |
| [2] | 熊振宇, 肖复明, 徐旭, 等. 植物药用成分龙脑的药用活性研究[J]. 中国中药杂志, 2013, 6(38): 786-90. Xiong Z Y, Xiao F M, Xu X, et al. Studies on pharmacological activity of borneol[J]. China J Chin Mater Med, 2013, 6(38): 786-90. |
| [3] | Chen H, Bai C, Wang X. The value of the lipopolysaccharide-induced acute lung injury model in respiratory medicine[J]. Expert Rev Respir Med, 2010, 4(6): 773-83. doi:10.1586/ers.10.71 |
| [4] | 汪雪峰, 陈锋, 宋顺德, 等. 腺苷酸环化酶抑制剂和激动剂在脂多糖诱导的急性肺损伤中的作用[J]. 中国药理学通报, 2017, 33(10): 1410-4. Wang X F, Chen F, Song S D, et al. Effect of adenylate cyclase antagonists and agonist in acute lung injury induced by lipopolysaccharide[J]. Chin Pharmacol Bull, 2017, 33(10): 1410-4. doi:10.3969/j.issn.1001-1978.2017.10.016 |
| [5] | Jand K, Stacher E, Bálint Z, et al. Activated prostaglandin D2 receptors on macrophages enhance neutrophil recruitment into the lung[J]. J Allergy Clin Immunol, 2016, 137(3): 833-43. doi:10.1016/j.jaci.2015.11.012 |
| [6] | Sanders C J, Vogel P, McClaren J L, et al. Compromised respiratory function in lethal influenza infection is characterized by the depletion of type Ⅰ alveolar epithelial cells beyond threshold levels[J]. Am J Physiol Lung Cell Mol Physiol, 2013, 304(7): 481-8. doi:10.1152/ajplung.00343.2012 |
| [7] | Wang Y, Song Z, Bi J, et al. A20 protein regulates lipopolysaccharide-induced acute lung injury by downregulation of NF-κB and macrophage polarization in rats[J]. Mol Med Rep, 2017, 16(4): 4964-72. doi:10.3892/mmr.2017.7184 |
| [8] | Bone N B, Liu Z, Pittet J F, et al. Frontline science: D1 dopaminergic receptor signaling activates the AMPK-bioenergetic pathway in macrophages and alveolar epithelial cells and reduces endotoxin-induced ALI[J]. J Leukoc Biol, 2017, 101(2): 357-65. doi:10.1189/jlb.3HI0216-068RR |
| [9] | 魏楚蓉. 冰片的药理作用及其机制研究进展[J]. 国际病理学与临床杂志, 2010, 30(5): 447-51. Wei C R. Research advance in pharmacological effect of borneol and the underlying mechanism[J]. Int J Pathol Clin Med, 2010, 30(5): 447-51. |
| [10] | 何晓静, 吕庆杰, 刘玉兰. 冰片注射液对缺血/再灌注大鼠脑内炎症反应的影响[J]. 华西药学杂志, 2006, 21(6): 523-6. He X J, Lyu Q J, Liu Y L. Effects of borneol injection on inflammation in focal cerebral ischemia/reperfusion rats[J]. West China J Pharm Sci, 2006, 21(6): 523-6. |
| [11] | 江光池, 杨胜华, 冯旭军. 龙脑和异龙脑的抗炎作用[J]. 华西药学杂志, 1990, 5(3): 190-1. Jiang G C, Yang S H, Feng X J. Anti-inflammatory effects of borneol and isborneol[J]. West China J Pharm Sci, 1990, 5(3): 190-1. |
| [12] | Spieth P M, Zhang H. Pharmacological therapies for acute respiratory distress syndrome[J]. Curr Opin Crit Care, 2014, 20(1): 113-21. doi:10.1097/MCC.0000000000000056 |

