


2. 南华大学附属第一医院神经内科,湖南 衡阳 421001;
3. 怀化市第一人民医院老年科,湖南 怀化 418000;
4. 怀化市第一人民医院神经内科,湖南 怀化 418000
2. Dept of Neurology, the First Affiliated Hospital, University of South China, Hengyang, Hunan 421001, China;
3. Dept of Geriatrics, Huaihua First People's Hospital, Huaihua Hunan 418000, China;
4. Dept of Neurology, Huaihua First People's Hospital, Huaihua Hunan 418000, China
脑出血是危害人类健康的常见病、多发病,具有较高的致残率和死亡率。星形胶质细胞活化是脑出血后继发性损伤的主要机制[1]。神经胶质原纤维酸性蛋白(glial fibrillary acidic protein, GFAP)为星形胶质细胞的中间丝细胞骨架蛋白,是星形胶质细胞活化的分子标记物[2-3]。表皮生长因子受体(epidermal growth factor receptor, EGFR)是一种跨膜蛋白,本课题组前期研究发现,应用小干扰RNA(small interfering RNA, siRNA)或EGFR抑制剂染料木黄酮处理大鼠星形胶质细胞,可降低磷酸化的信号传导蛋白和转录激活物3(phosphorylated signal transducers and activators of transcription 3, p-STAT3)水平,进而下调GFAP表达,表明EGFR在触发星形胶质细胞由静息状态转变为活化状态中起关键作用[4-5]。微小RNA-7(microRNA-7, miR-7)是一种由23个核苷酸组成的miRNA,定位于第9号染色体,参与细胞增殖、分化、凋亡和自噬等生物学过程,并与脑卒中相关[6]。EGFR已经被鉴定为miR-7的靶基因[7-9]。新近研究表明,miR-7过表达有助于减少星形胶质细胞炎症介质的分泌[10]。然而,miR-7对星形胶质细胞活化的影响尚不清楚。为此,本研究以miR-7 mimic/inhibitor转染大鼠星形胶质细胞,分析miR-7对GFAP、EGFR、STAT3和p-STAT3表达的影响,旨在为脑损伤后神经功能恢复提供一个新的药效学靶点。
1 材料与方法 1.1 试剂新生胎牛血清、DMEM/F12培养基购自美国Gibco公司;重组的睫状神经营养因子(ciliary neurotrophic factor, CNTF)购自北京盛科博源生物公司;STAT3特异性抑制剂S31-201购自美国Selleck公司;LipofectamineTM 2000、LipofectamineTM RNAiMAX、TRIzol试剂购于美国Invitrogen公司;荧光素酶报告载体pGL3、逆转录试剂盒、SYBR Green Real Time PCR Master Mix购自美国Promega公司;荧光素酶检测试剂盒购于碧云天生物技术研究所;RIPA裂解液购自上海生工生物工程公司;兔抗大鼠GFAP、EGFR、STAT3、p-STAT3、β-actin抗体及山羊抗兔IgG均为美国Santa Cruz公司产品。
1.2 大鼠皮层星形胶质细胞的分离与培养取10只出生后24 h内的新生Wistar大鼠(SPF级,由南华大学医学研究实验中心动物学部提供),消毒后固定于木板上,在麻醉状态下断头取大鼠头部,取出大脑并剥离软脑膜,分离出大脑皮层组织。用眼科剪把大脑皮层剪成碎片,再用1.25 g·L-1的胰酶消化30 min,然后加入新生胎牛血清,以终止消化过程,以1 000 r·min-1离心5 min后,小心吸弃上层液体,并将沉淀中加入DMEM培养液中,再用100目不锈钢筛网进行过滤,收集过滤液,往过滤液中加入适量的新生胎牛血清,从而将细胞悬液的密度调整为3×108~5×108·L-1,并将其种植于培养瓶中,然后把培养瓶置入37℃、5% CO2的培养箱内培养,每隔3~4 d更换1次培养液,待细胞生长成致密单层后进行传代,取对数生长期细胞进行体外实验。
1.3 miR-7 mimic/inhibitor转染效率检测实验分为5组:对照组、miR-7 mimic组、miR-7 mimic control组、miR-7 inhibitor组、miR-7 inhibitor control组,对照组用培养液处理24 h,后4组按照操作说明用LipofectamineTM 2000将40 nmol·L-1的miR-7 mimic、inhibitor或者它们的阴性对照物(negative controls)分别转染星形胶质细胞24 h,荧光实时定量PCR(quantitative real-time polymerase chain reaction, qRT-PCR)检测各组细胞miR-7的表达水平。miR-7 mimic/inhibitor及相应的阴性对照物由广州锐博公司合成。
1.4 荧光素酶报告基因分析采用PCR的方法从星形胶质细胞基因组DNA中扩增目的基因EGFR 3′-非翻译区(3′-untranslated region, 3′-UTR)序列,插入荧光素酶报告载体pGL3(pGL3-EGFR),同时构建其突变载体(pGL3-EGFR-m),将上述两种质粒分别与miR-7 mimic或mimic control共转染HEK293T细胞(由中科院上海细胞生物所细胞中心提供)24 h,使用荧光素酶检测试剂盒测定荧光素酶的活性。
1.5 EGFR siRNA干扰效果检测实验分为3组:对照组、Scramble siRNA组和EGFR siRNA组,对照组用培养液处理24 h,后2组将LipofectamineTM RNAiMAX(4 μL)或20 μmol·L-1的siRNA(5 μL)加入100 μL Opti-MEM中,静置5 min后,将上述两种溶液混合再静置20 min,随后把混合液加入星形胶质细胞中,孵育48 h后用Western blot检测EGFR蛋白表达水平。EGFR siRNA和scrambled siRNA由上海吉玛公司合成。EGFR siRNA正义链序列为5′-CCUUAGCAGUCUUAUCUAATDT-3′,反义链序列为5′-dTdTGGAAUCGUCAGAAUAGAUU-3′;Scramble siRNA正义链序列为5′-UUCUCCGAACGUGUCACGU-3′,反义链序列为5′-ACGUGACACGUIJCGGAGAA-3′。
1.6 实验分组与处理为了观察miR-7对GFAP、EGFR、STAT3和p-STAT3表达的影响,取上述培养的星形胶质细胞随机分为6组:对照组、CNTF(用于活化星形胶质细胞)组、miR-7 mimic+CNTF组、miR-7 mimic control+CNTF组、miR-7 inhibitor+CNTF组和miR-7 inhibitor control+CNTF组,对照组、CNTF组分别予DMEM培养液、20 μg·L-1 CNTF处理48 h,后4组按照操作说明用LipofectamineTM 2000将40 nmol·L-1的miR-7 mimic、inhibitor或者它们的阴性对照物分别转染细胞24 h,再用20 μg·L-1 CNTF处理24 h。为了探讨EGFR/STAT3信号通路在miR-7抑制星形胶质细胞活化中的作用,将星形胶质细胞随机分为5组:对照组、CNTF组、miR-7 inhibitor+CNTF组、EGFR siRNA+miR-7 inhibitor+CNTF组和S31-201+miR-7 inhibitor+CNTF组,前3组处理同上,后2组先用EGFR siRNA(20 μmol·L-1)或S31-201(10 μmol·L-1)处理细胞24 h,再给予40 nmol·L-1的miR-7 inhibitor和20 μg·L-1 CNTF处理细胞24 h。待处理完毕后,进行相关指标检测。
1.7 qRT-PCR检测miR-7、GFAP和EGFR表达采用TRIzol试剂提取星形胶质细胞中的总RNA,并逆转录成cDNA。按照Tab 1所示序列由上海生工生物工程公司合成相应的引物。在Roach480荧光实时定量PCR仪上进行PCR反应,反应条件:95℃预变性10 min,95℃变性30 s,55℃复性30 s,72℃延伸2 min,总共35个循环。用ΔΔCt值法,以U6水平作为内参照定量miR-7表达,以GAPDH水平作为内参照定量GFAP、EGFR mRNA表达。
| Genes | Sequences | Product length/bp |
| miR-7 | Forward: 5′-AAAAAGAACACGTGGAAGGATAG-3′ | 63 |
| Reverse: 5′-CCGCCTAACGTACCGCGAATTT-3′ | ||
| U6 | Forward: 5′-CTCGCTTCGGCAGCACA-3′ | 72 |
| Reverse: 5′-AACGCTTCACGAATTTGCGT-3′ | ||
| GFAP | Forward: 5′-TAATGACTATCGCCGCCAACTG-3′ | 274 |
| Reverse: 5′-TTCGCCCTCCGCAATTTC-3′ | ||
| EGFR | Forward: 5′-CCTGGTCTGGAAGTACGCAG-3′ | 350 |
| Reverse: 5′-CGATGGACGGGATCTTAGGC-3′ | ||
| GAPDH | Forward: 5′-GGAGCCAAACGGGTCATCATCTC-3′ | 454 |
| Reverse: 5′-ATGCCTGCTTCACCACCACCTTG-3′ |
用RIPA裂解液提取星形胶质细胞蛋白质,BCA法进行蛋白定量,上样、电泳并转膜,分别加入兔抗大鼠GFAP(1 :500)、EGFR(1 :500)、STAT3(1 :500)、p-STAT3(1 :500)、β-actin(1 :2 500)一抗,4℃孵育过夜,洗涤后加入辣根过氧化物酶标记的山羊抗兔IgG(1 :2 500)二抗,在37℃条件下孵育1 h,ECL显色,暗室曝光。利用Labwork凝胶图像分析系统对所有胶片进行扫描,用β-actin为内参照定量目标蛋白表达水平。
1.9 统计学处理所有实验重复5次,结果取其平均值。用Graphpad Prism 5软件制图并进行统计学分析,多组均数比较采用单因素方差分析及两两之间比较的q检验。
2 结果 2.1 miR-7 mimic/inhibitor的转染效率为了评价miR-7的转染效率,分别以miR-7 mimic/inhibitor及它们的阴性对照转染星形胶质细胞24 h。Fig 1的qRT-PCR结果显示,miR-7 mimic转染明显增加miR-7水平,几乎是对照组的14倍(P < 0.01),miR-7 inhibitor转染则明显降低miR-7水平,约为对照组的1/4(P < 0.01),而它们的阴性对照对miR-7表达无影响(P>0.05),提示miR-7 mimic/inhibitor转染星形胶质细胞具有较高的效率。
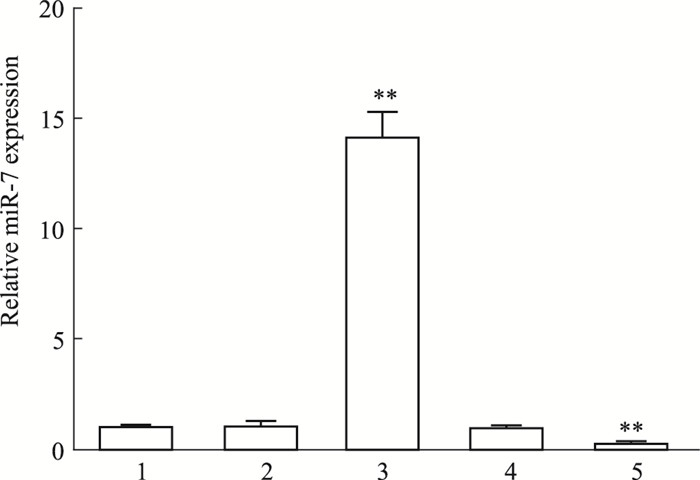
|
| Fig 1 Effects of miR-7 mimic/inhibitor transfection on miR-7 expression in astrocytes 1: Control group; 2: miR-7 mimic control group; 3: miR-7 mimic group; 4: miR-7 inhibitor control group; 5: miR-7 inhibitor group. **P < 0.01 vs control group |
GFAP是星形胶质细胞活化的分子标记物,为了观察miR-7对星形胶质细胞活化的影响,用CNTF和(或)miR-7 mimic/inhibitor处理细胞后,qRT-PCR、Western blot分别检测各组细胞GFAP mRNA、蛋白的表达情况。如Fig 2、3所示,对照组GFAP mRNA与蛋白呈低水平表达,CNTF组GFAP mRNA与蛋白表达水平较对照组明显增加(P < 0.01),说明此时星形胶质细胞处于活化状态,与CNTF组比较,miR-7 mimic预处理降低GFAP mRNA与蛋白表达水平(P < 0.01),miR-7 inhibitor预处理增加GFAP mRNA与蛋白表达水平(P < 0.01),而它们的阴性对照无此作用(P>0.05)。结果表明miR-7可抑制CNTF诱导的星形胶质细胞活化。
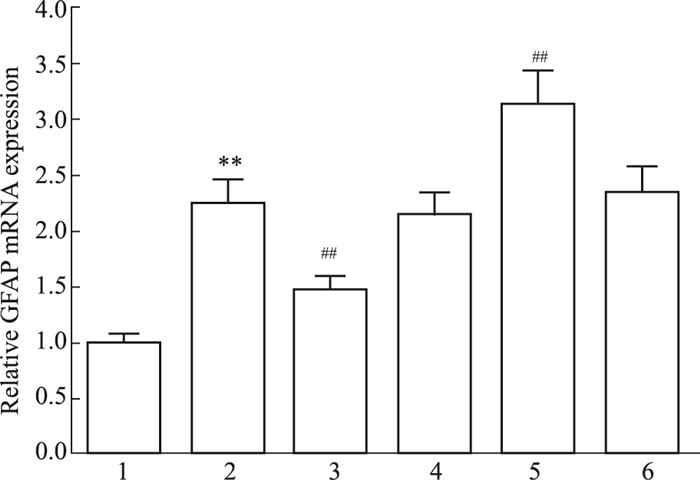
|
| Fig 2 Expression of GFAP mRNA in astrocytes among groups 1: Control group; 2: CNTF group; 3: miR-7 mimic+CNTF group; 4: miR-7 mimic control+CNTF group; 5: miR-7 inhibitor+CNTF group; 6: miR-7 inhibitor control+CNTF group. **P < 0.01 vs control group; ##P < 0.01 vs CNTF group |
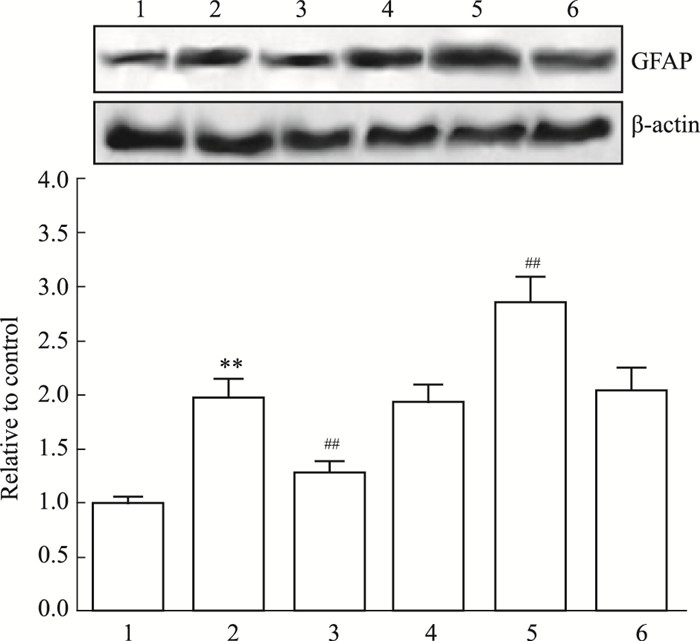
|
| Fig 3 Expression of GFAP protein in astrocytes among groups 1: Control group; 2: CNTF group; 3: miR-7 mimic+CNTF group; 4: miR-7 mimic control+CNTF group; 5: miR-7 inhibitor+CNTF group; 6: miR-7 inhibitor control+CNTF group. **P < 0.01 vs control group; ##P < 0.01 vs CNTF group |
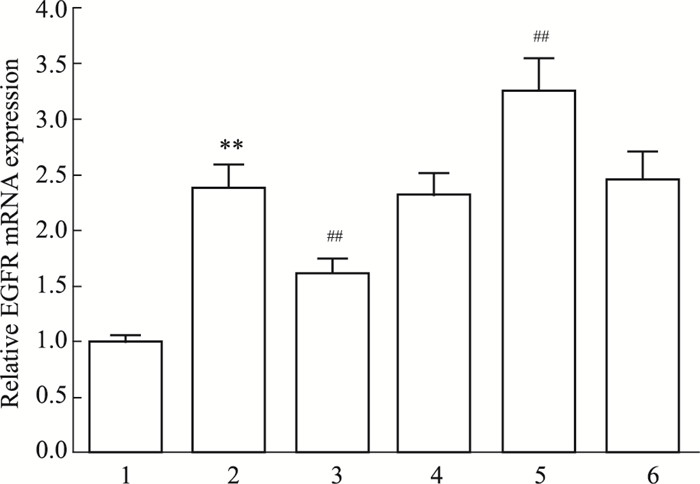
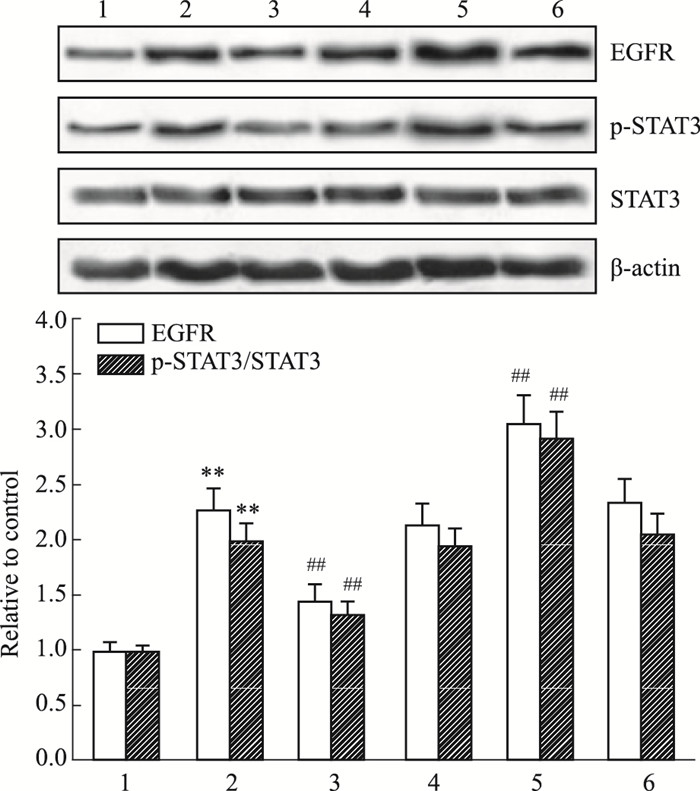
Fig 4荧光素酶报告基因显示,miR-7 mimic能明显降低野生型EGFR荧光素酶活性(P < 0.01),但对突变型无影响,进一步证实EGFR为miR-7的靶基因。本课题组前期研究表明,EGFR通过磷酸化STAT3上调GFAP表达,因此,我们接下来探讨miR-7对星形胶质细胞EGFR、STAT3、p-STAT3表达的影响。由Fig 5、6可知,CNTF组EGFR表达水平和p-STAT3/STAT3比值较对照组明显增加(P < 0.01),与CNTF组比较,miR-7 mimic+CNTF组EGFR表达水平和p-STAT3/STAT3比值降低(P < 0.01),miR-7 inhibitor+CNTF组EGFR表达水平和p-STAT3/STAT3比值升高(P < 0.01),而它们的阴性对照对上述指标无影响(P>0.05)。
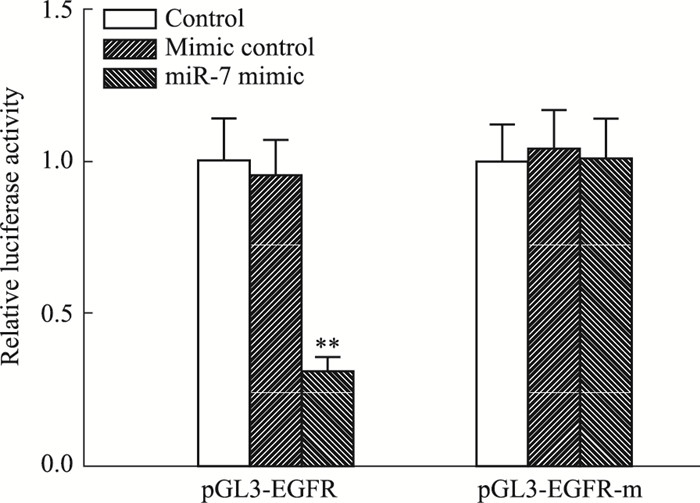
|
| Fig 4 Comparison of luciferase activity among groups **P < 0.01 vs control group |
|
| Fig 5 Expression of EGFR mRNA in astrocytes among groups 1: Control group; 2: CNTF group; 3: miR-7 mimic+CNTF group; 4: miR-7 mimic control+CNTF group; 5: miR-7 inhibitor+CNTF group; 6: miR-7 inhibitor control+CNTF group. **P < 0.01 vs control group; ##P < 0.01 vs CNTF group |
|
| Fig 6 EGFR protein expression and p-STAT3/STAT3 ratio in astrocytes among groups 1: Control group; 2: CNTF group; 3: miR-7 mimic+CNTF group; 4: miR-7 mimic control+CNTF group; 5: miR-7 inhibitor+CNTF group; 6: miR-7 inhibitor control+CNTF group. **P < 0.01 vs control group; ##P < 0.01 vs CNTF group |
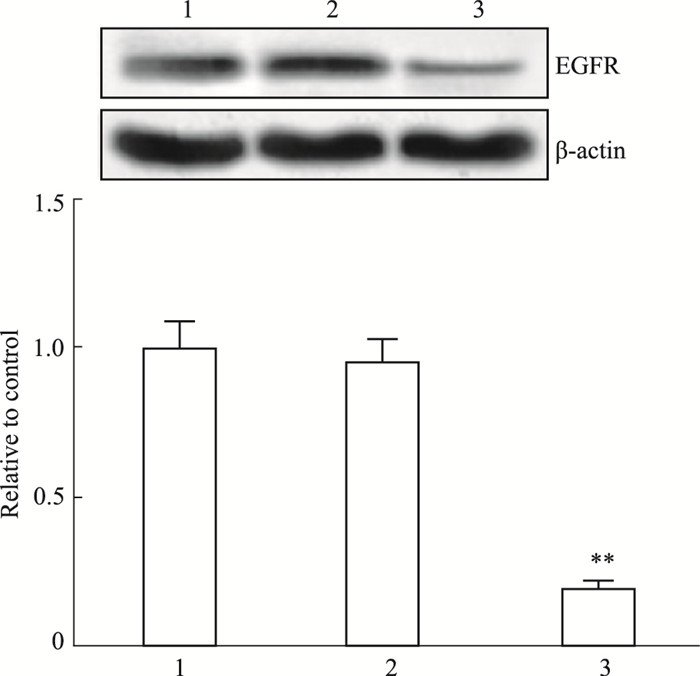
Fig 7 Western blot结果表明,与对照组比较,EGFR siRNA抑制了约80%的星形胶质细胞内源性EGFR蛋白表达,差异有显著性(P < 0.01),但Scrambled siRNA组EGFR蛋白表达水平与对照组相比无明显差异(P>0.05),提示EGFR siRNA能有效干扰EGFR基因表达。
|
| Fig 7 Expression of EGFR protein in astrocytes among groups 1: Control group; 2: Scramble siRNA group; 3: EGFR siRNA group. **P < 0.01 vs control group |
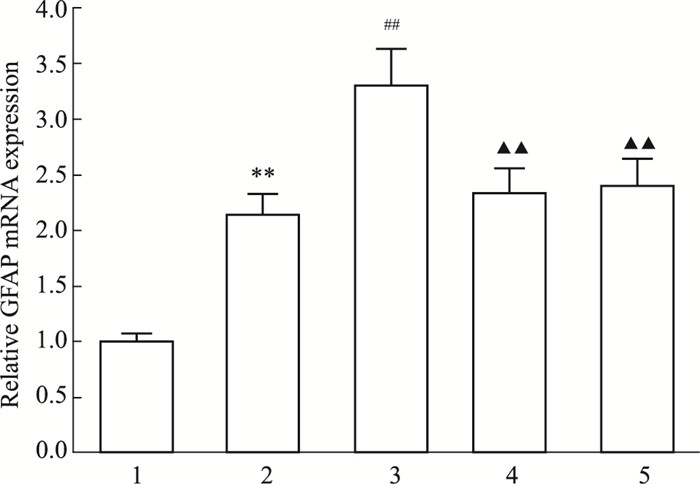
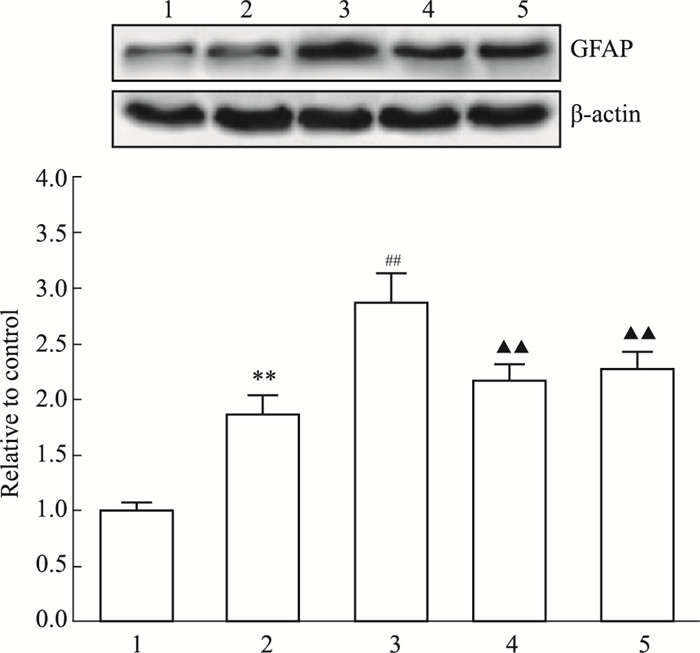
为了明确EGFR/STAT3信号通路在miR-7抑制星形胶质细胞活化中的作用,以EGFR siRNA或STAT3抑制剂S31-201预处理星形胶质细胞,再予miR-7 inhibitor和CNTF孵育,qRT-PCR、Western blot检测GFAP mRNA与蛋白表达。Fig 8、9结果显示,miR-7 inhibitor+CNTF组GFAP mRNA与蛋白表达水平较CNTF组增加(P < 0.01),EGFR siRNA或S31-201预处理后加miR-7 inhibitor和CNTF,GFAP mRNA与蛋白表达水平明显降低,与miR-7 inhibitor+CNTF组比较,差异均有显著性(P < 0.01),提示miR-7通过EGFR/STAT3途径抑制CNTF诱导的星形胶质细胞活化。
|
| Fig 8 Expression of GFAP mRNA in astrocytes among groups 1: Control group; 2: CNTF group; 3: miR-7 inhibitor+CNTF group; 4: EGFR siRNA+miR-7 inhibitor+CNTF group; 5: S31-201+miR-7 inhibitor+CNTF group. **P < 0.01 vs control group; ##P < 0.01 vs CNTF group; ▲▲P < 0.01 vs miR-7 inhibitor+CNTF group |
|
| Fig 9 Expression of GFAP protein in astrocytes among groups 1: Control group; 2: CNTF group; 3: miR-7 inhibitor+CNTF group; 4: EGFR siRNA+miR-7 inhibitor+CNTF group; 5: S31-201+miR-7 inhibitor+CNTF group. **P < 0.01 vs control group; ##P < 0.01 vs CNTF group; ▲▲P < 0.01 vs miR-7 inhibitor+CNTF group |
星形胶质细胞是中枢神经系统中含量最为丰富的细胞,与神经元之间存在复杂的相互作用,有助于维持神经系统内环境的稳定。在脑出血等病理情况下,星形胶质细胞从静息状态快速转变为活化状态,活化的星形胶质细胞一方面能够分泌多种细胞因子、炎症因子和补体蛋白等,导致继发性的神经损伤,另一方面促进瘢痕形成,阻碍神经再生[11]。因此,抑制星形胶质细胞活化已成为防治脑出血后继发性损伤的重要策略。miRNAs是一类长度为19~25个核苷酸的内源性非编码RNA,通过与靶mRNA的3′-非翻译区结合,导致其翻译过程受到抑制或引起mRNA的降解,在转录后水平特异性影响靶基因表达[12-13]。近年研究发现,miRNAs失调与脑出血的发生、发展密切相关,可作为脑出血早期诊断及预后评估的重要分子标记物[14]。本研究以miR-7 mimic、inhibitor和(或)CNTF处理大鼠星形胶质细胞,发现miR-7 mimic+CNTF组GFAP mRNA与蛋白表达水平较CNTF组降低,而miR-7 inhibitor+CNTF组GFAP mRNA与蛋白表达水平较CNTF组升高,这些结果表明miR-7可抑制CNTF诱导的星形胶质细胞活化。
EGFR是一种由53个氨基酸组成的活性多肽,广泛表达于上皮、间质及神经组织,与其配体结合后,可磷酸化STAT3,进而促进包括GFAP在内的多个基因转录[15]。研究发现,脑出血后血肿周围脑组织EGFR表达迅速上调,且主要定位于活化的星形胶质细胞,并持续较长时间[16]。我们前期研究表明,EGFR siRNA通过抑制STAT3磷酸化拮抗CNTF诱导的星形胶质细胞活化[4]。miRNAs本身不具备生物学功能,通过沉默其靶基因才能发挥作用。荧光素酶报告基因发现,miR-7 mimic明显减少野生型EGFR荧光素酶活性,但对突变型无影响,表明EGFR为miR-7的靶基因,与文献报道一致[7-9]。此外,相对于CNTF组,miR-7 mimic+CNTF组EGFR表达水平和p-STAT3/STAT3比值降低,而miR-7 inhibitor+CNTF组EGFR表达水平和p-STAT3/STAT3比值增加,提示miR-7通过靶向沉默EGFR抑制STAT3磷酸化。为了明确EGFR/ STAT3信号通路在miR-7抑制CNTF诱导的星形胶质细胞活化中的作用,本研究以EGFR siRNA或STAT3的抑制剂S31-201预处理星形胶质细胞,再用miR-7 inhibitor和CNTF孵育,发现干扰EGFR/STAT3信号通路几乎完全逆转了miR-7 inhibitor对GFAP表达的促进作用,表明抑制EGFR/STAT3信号通路可能是miR-7阻滞星形胶质细胞活化的主要机制。
综上所述,本研究结果表明,miR-7通过靶向沉默EGFR,使p-STAT3水平减少,从而抑制CNTF诱导的星形胶质细胞活化。然而,miR-7在体内是否有这种保护作用尚需进一步研究。此外,一个miRNA有多个靶基因,多个miRNAs可以作用于同一个靶基因,因此,miR-7也可能通过其它靶基因影响星形胶质细胞活化。随着对这些问题的深入探讨,将进一步揭示miR-7在脑出血后继发性损伤中的作用。
( 致谢: 本实验在侗医药研究湖南省重点实验室和南华大学附属第一医院临床医学研究所完成,感谢各位老师的指导和帮助。)
| [1] | Finsterwald C, Magistretti P J, Lengacher S. Astrocytes: new targets for the treatment of neurodegenerative diseases[J]. Curr Pharm Des, 2015, 21(25): 3570-81. doi:10.2174/1381612821666150710144502 |
| [2] | Stanca D M, Mǎrginean I C, Soriţǎu O, et al. GFAP and antibodies against NMDA receptor subunit NR2 as biomarkers for acute cerebrovascular diseases[J]. J Cell Mol Med, 2015, 19(9): 2253-61. |
| [3] | Foerch C, Pfeilschifter W, Zeiner P, et al. Glial fibrillary acidic protein in patients with symptoms of acute stroke: diagnostic marker of cerebral hemorrhage[J]. Nervenarzt, 2014, 85(8): 982-9. doi:10.1007/s00115-014-4128-1 |
| [4] | 钱红, 刘理静, 李艳春, 等. EGFR siRNA通过阻碍STAT3磷酸化抑制大鼠星形胶质细胞活化[J]. 中国药理学通报, 2016, 32(2): 216-22. Qian H, Liu L J, Li Y C, et al. EGFR siRNA inhibits activation of astrocytes derived from rats through blockade of STAT3 phosphorylation[J]. Chin Pharmacol Bull, 2016, 32(2): 216-22. |
| [5] | 郭志慧, 武衡. 星形胶质细胞活化与表皮生长因子受体表达的相关性研究[J]. 中风与神经疾病杂志, 2010, 27(8): 683-5. Guo Z H, Wu H. The relationship of the activity of astrocytes and the expression of EGFR[J]. J Apo Nerv Dis, 2010, 27(8): 683-5. |
| [6] | Horsham J L, Ganda C, Kalinowski F C, et al. MicroRNA-7: A miRNA with expanding roles in development and disease[J]. Int J Biochem Cell Biol, 2015, 69: 215-24. doi:10.1016/j.biocel.2015.11.001 |
| [7] | Cui Y X, Bradbury R, Flamini V, et al. MicroRNA-7 suppresses the homing and migration potential of human endothelial cells to highly metastatic human breast cancer cells[J]. Br J Cancer, 2017, 117(1): 89-101. doi:10.1038/bjc.2017.156 |
| [8] | Sun X, Li J, Sun Y, et al. miR-7 reverses the resistance to BRAFi in melanoma by targeting EGFR/IGF-1R/CRAF and inhibiting the MAPK and PI3K/AKT signaling pathways[J]. Oncotarget, 2016, 7(33): 53558-70. |
| [9] | 刘晓智, 姜忠敏, 陈镭, 等. miR-7沉默EGFR/PI3K通路逆转脑胶质瘤U251细胞的恶性表型[J]. 肿瘤, 2011, 31(11): 987-92. Liu X Z, Jiang Z M, Chen L, et al. MicroRNA-7 silencing EGFR/PI3K pathway reverses the malignant phenotype of U251 glioma cells[J]. Tumor, 2011, 31(11): 987-92. |
| [10] | Dong Y F, Chen Z Z, Zhao Z, et al. Potential role of microRNA-7 in the anti-neuroinflammation effects of nicorandil in astrocytes induced by oxygen-glucose deprivation[J]. J Neuroinflammation, 2016, 13(1): 60. doi:10.1186/s12974-016-0527-5 |
| [11] | Grafstein B. Subverting the hegemony of the synapse: complicity of neurons, astrocytes, and vasculature in spreading depression and pathology of the cerebral cortex[J]. Brain Res Rev, 2011, 66(1-2): 123-32. doi:10.1016/j.brainresrev.2010.09.007 |
| [12] | Yu X, Zheng H, Chan M T, et al. MicroRNAs: new players in cataract[J]. Am J Transl Res, 2017, 9(9): 3896-903. |
| [13] | Chatterjee N, Rana S, Espinosa-Diez C, et al. MicroRNAs in cancer: challenges and opportunities in early detection, disease monitoring, and therapeutic agents[J]. Curr Pathobiol Rep, 2017, 5(1): 35-42. doi:10.1007/s40139-017-0123-0 |
| [14] | Tan J R, Koo Y X, Kaur P, et al. microRNAs in stroke pathogenesis[J]. Curr Mol Med, 2011, 11(2): 76-92. doi:10.2174/156652411794859232 |
| [15] | Wendt M K, Balanis N, Carlin C R, et al. STAT3 and epithelial-mesenchymal transitions in carcinomas[J]. JAKSTAT, 2014, 3(1): e28975. |
| [16] | Liu B, Neufeld A H. Activation of epidermal growth factor receptors in astrocytes: from development to neural injury[J]. J Neurosci Res, 2007, 85(16): 3523-9. doi:10.1002/(ISSN)1097-4547 |

