


2. 安徽医科大学附属阜阳医院药剂科,安徽 阜阳 236000
 ,
LI Yan1,
AN Meng-yao1,
PAN Ying-ying1,
KANG Yi1,
YIN Yong-qiang1,
SUN Tao1,
GAO Wei-zhen1,
LOU Jian-shi1
,
LI Yan1,
AN Meng-yao1,
PAN Ying-ying1,
KANG Yi1,
YIN Yong-qiang1,
SUN Tao1,
GAO Wei-zhen1,
LOU Jian-shi1

2. Dept of Pharmacy, Fuyang Hospital of Anhui Medical University, Fuyang Anhui 236000, China
短QT综合征(short QT syndrome, SQTS)作为一种新的心脏离子通道疾病,由于其高发的恶性心律失常和心源性猝死(sudden cardiac death, SCD),受到人们的高度重视。截至目前,研究者们根据其致病机制已发现至少7种类型的SQTS[1],它们分别是由于钾离子通道、钙离子通道和钠离子通道的功能获得或功能丧失所致。在临床诊断中,只有约23%的SQTS患者患病机制与其基因突变有关[2],而大部分则是由后天的疾病和药物所致。在发病率最高的3种类型SQTS中[3],以SQT1和SQT2最受关注。目前,在临床上,对SQTS的治疗主张安装植入式心率转复除颤器(implantable cardioverter defibrillator,ICD)作为该病症首选治疗方法,尤其是对于有晕厥、心脏骤停等家族史的患者[4]。然而,ICD由于T波误感知容易产生不适当放电的现象[5],而且对于新生儿、儿童和继发性SQTS等患者来说,他们不适宜安装ICD,再加上ICD价格昂贵等原因,使得抗SQTS药物的研发与应用显得格外重要。
牛磺酸镁配合物(taurine-magnesium coordination compound, TMCC)是本实验室以牛磺酸为配体与金属镁离子(Mg2+)配位结合形成的新型化合物。本实验室前期的实验结果显示,牛磺酸镁作为一种新型药物,对氯化铯、乌头碱、氯化钙、哇巴因以及肾上腺素等诱导的触发活动与心律失常有着明确的防治效果[6-7],并且还能通过对离子通道作用,降低新的心律失常的诱发危险性[8-9],这也表明了牛磺酸镁可能具备着广泛的抗心律失常作用。但到目前为止,未见其抗SQTS方面的应用研究,所以,本实验初步探索TMCC抗SQT2的药理作用和特性。
1 材料与方法 1.1 材料健康成年♂豚鼠,SPF级,购自中国人民解放军军事医学科学院实验动物中心,动物合格证号:SCXK-2014-0012。Langendorff灌流装置(成都泰盟软件有限公司),多通道生理信号采集处理系统(BioPac,美国),电子分析天平(上海舜宇恒平科学仪器有限公司),超纯水系统(Millipore,美国)。牛磺酸镁(实验室自行合成),吡那地尔(Sigma,美国)。
1.2 方法 1.2.1 实验液体配制K-H灌流液(mmol·L-1):NaCl 118.06、KCl 4.69、KH2PO4 1.18、NaHCO3 25、MgSO4 1.18、Glucose 11.11、CaCl2 2.5。预先通入混合氧气(95% O2+5% CO2)20 min后,调节pH值至7.4。药物母液:TMCC(200 mmol·L-1)由蒸馏水溶解配成;吡那地尔(1 mol·L-1)由DMSO溶解配成。实验时确保K-H灌流液中DMSO浓度不超过千分之一。
1.2.2 离体心脏摘取及Langendorff灌流法取健康豚鼠称重,25%乌拉坦1.0 g·kg-1将其麻醉,随后将豚鼠仰卧并固定于鼠台之上,剪去胸部毛发,然后快速剪开胸腔暴露出心脏,从主动脉根部剪断并取出心脏,放入预冷的4℃生理盐水中,轻轻按压,挤出心脏中残余血液,进行修剪,除去多余的结缔组织和心包膜。随后立即将预留出的主动脉连通于心脏插管上,用血管动脉夹钳住,用手术缝合线系牢,然后取下动脉夹,实验过程中应注意防止灌流的插管插入过深,而影响离体心脏的功能。接着以37℃恒温、预通混合氧的K-H液灌流,灌注压维持在60~70 mmHg左右,初期排尽残血,从取心脏到灌流系统运行的整个过程应控制在1 min以内,减少一定时间的缺血对心脏组织造成损伤。待心脏搏动稳定后,将心电图记录电极的正、负极分别贴附至心脏的心尖和主动脉根部,记录心电图。
1.2.3 给药步骤首先观察TMCC对正常心脏的作用,先灌流已通过混合氧的K-H液,稳定20 min并记录稳定的ECG,然后再灌流不同浓度的TMCC,灌流30 min再观察其ECG的变化;接着研究TMCC的抗心律失常作用,选择钾离子通道激动剂吡那地尔制备SQT2的心律失常模型,在此模型基础上给予TMCC,观察ECG中各指标的变化,首先灌流K-H液20 min并记录稳定的ECG,接着灌流含浓度为20 μmol·L-1吡那地尔,待模型成功后再加入不同浓度TMCC的含吡那地尔灌流液,观察TMCC的抗心律失常作用。
1.2.4 实验分组正常给药组:① 1 mmol·L-1 TMCC组;② 2 mmol·L-1 TMCC组;③ 4 mmol·L-1 TMCC组。SQT2给药组:① 20 μmol·L-1吡那地尔造模组;② 20 μmol·L-1吡那地尔+1 mmol·L-1 TMCC组;③ 20 μmol·L-1吡那地尔+2 mmol·L-1 TMCC组;④ 20 μmol·L-1吡那地尔+4 mmol·L-1 TMCC组。每只离体心脏初始正常灌流阶段设为基准对照(Control)。
1.3 统计学处理采用BioPac生物信号系统得到的心电图,利用AcqKnowledge 4.1软件进行分析处理,运用GraphPad Prism 6和Inkscape 0.91以及Adobe Photoshop CS6等软件进行绘图,运用SPSS 22.0软件进行统计学分析,数据资料以x±s表示,各组间比较采用配对t检验或单因素方差分析,方差齐时,多组间比较用LSD法、SNK法;方差不齐时,采用Dunnett T3法,以α=0.05为检验水平。
2 结果 2.1 TMCC对吡那地尔所致离体心脏QT间期缩短的影响Fig 1结果表明,20 μmol·L-1吡那地尔对豚鼠离体心脏的QT间期缩短约8.8% (P < 0.01);1、2、4 mmol·L-1的TMCC使缩短的QT间期分别延长6.9%、9.1%、15.6% (P < 0.01)。
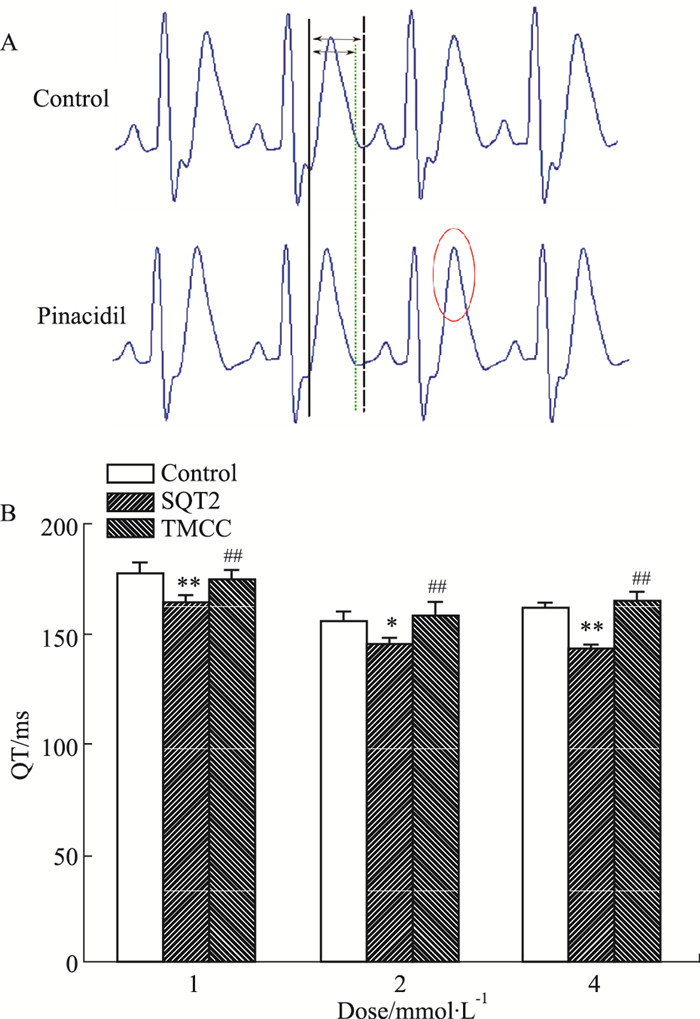
|
| Fig 1 Effects of TMCC on shortened QT interval induced by pinacidil in isolated hearts of guinea pig(x±s, n=7) A: ECG of guinea pig; B: TMCC prolonged shortened QT interval induced by pinacidil in isolated hearts of guinea pig. *P < 0.05, **P < 0.01 vs control group; ##P < 0.01 vs SQT2 group |
在心电图中,从QRS波开始至T波波峰的时程(Q-Tpeak, QTpeak)能够反映心脏心肌细胞的有效不应期(effective refractory period, ERP)。Fig 2结果表明,20 μmol·L-1吡那地尔能够使QTpeak缩短21.2% (P < 0.01);1、2、4 mmol·L-1的TMCC使缩短的QTpeak分别延长14.5%、14.6%、24.5% (P < 0.01)。
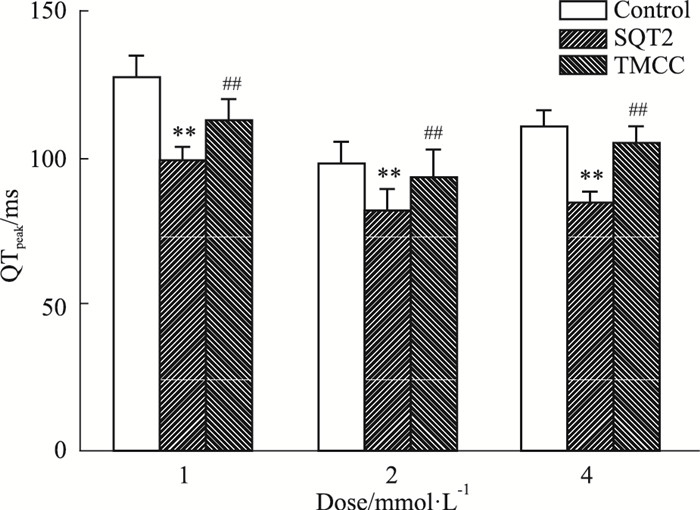
|
| Fig 2 Effects of TMCC on shortened QTpeak induced by pinacidil in isolated hearts of guinea pig(x±s, n=7) **P < 0.01 vs control group; ##P < 0.01 vs SQT2 group |
在心电图中,T波起始至T波波峰的时程可反映心外膜心室肌细胞3相复极时程的快慢,而从T波波峰开始至T波终止的时程(Tpeak-Tend, Tp-Te)能够反映出心脏心肌细胞的跨室壁复极离散度(transmural dispersion of repolarization, TDR)的大小,同时类似于QT间期通常会随着HR变化而需要校正,Tp-Te的变化也应根据QT间期或HR的变化而进行校正。在本实验中,采用两种校正方法,分别为Tp-Te(corrected)=QTc×Tp-Te/QT和rTp-Te= (Tp-Te/QT) ×100%。Fig 3结果表明,20 μmol·L-1吡那地尔能够使Tp-Te、Tp-Te(corrected)、rTp-Te分别增大16.0% (P>0.05)、15.6% (P>0.05)、23.3% (P < 0.05);1、2、4 mmol·L-1的TMCC对延长的Tp-Te没有明显影响(P>0.05),对延长的Tp-Te(corrected)分别缩短10.3% (P>0.05)、4.8% (P>0.05)、12.9% (P < 0.05),对延长的rTp-Te分别缩短11.8% (P < 0.01)、8.3% (P < 0.05)、11.0% (P < 0.05)。
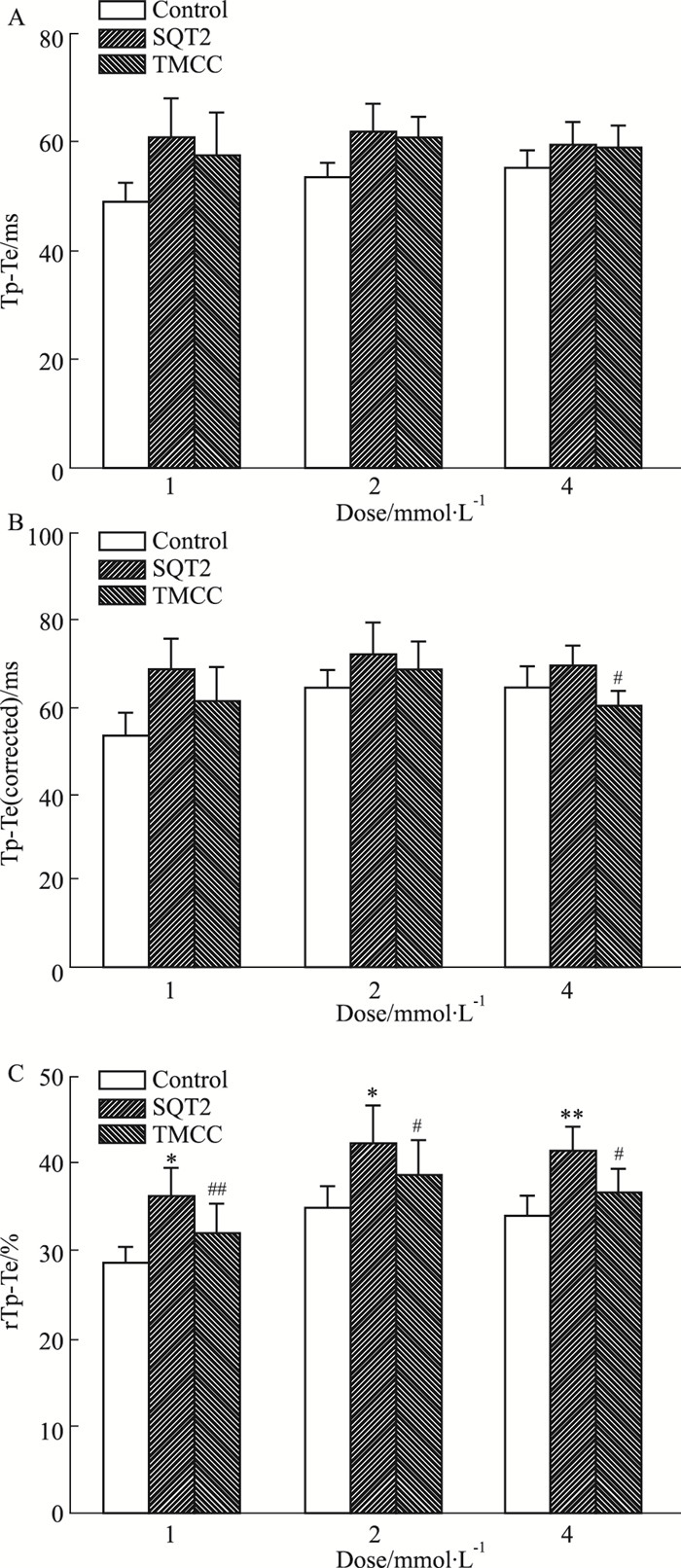
|
| Fig 3 Effects of TMCC on Tp-Te interval(A) and prolonged Tp-Te(corrected) (B) and rTp-Te(C) induced by pinacidil in isolated hearts of guinea pig(x±s, n=7) *P < 0.05, **P < 0.01 vs control group; #P < 0.05, ##P < 0.01 vs SQT2 group |
根据Sarusi等[10]的研究发现,RR间期和QT间期不稳定性对于预测尖端扭转型室性心动过速(torsade de pointes, TdP)或者室颤(ventricular fibrillation, VF)等心律失常发生具有重要意义。本实验中,计算心电图中RR和QT间期复极不稳定性时,采用van der Linde H等[11]报道的新方法。首先,30个坐标点的重心(center of gravity, cg)计算公式为: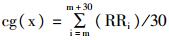
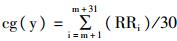
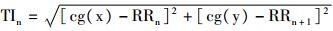
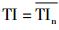
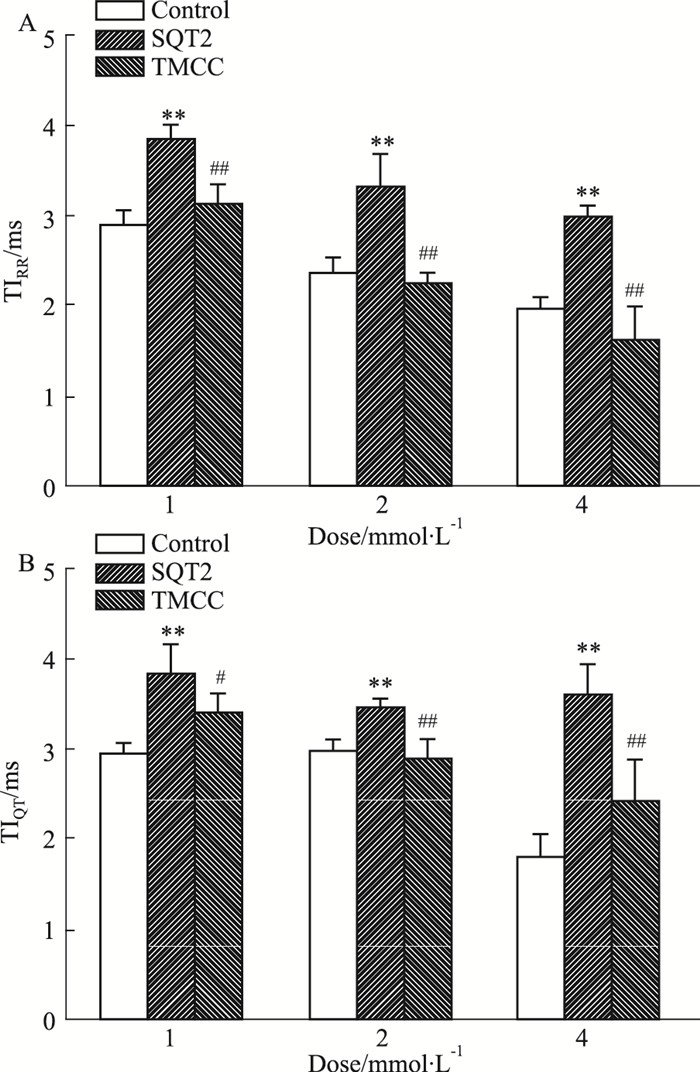
Fig 4结果表明,20 μmol·L-1吡那地尔能够使TIRR、TIQT分别增大41.2%、48.9% (P < 0.01);1、2、4 mmol·L-1的TMCC使增大的TIRR分别减小18.3%、31.6%、45.5% (P < 0.01),使增大的TIQT分别减小11.0% (P < 0.05)、16.0% (P < 0.01)、32.9% (P < 0.01)。
|
| Fig 4 TMCC decreased increased instability of repolarization induced by pinacidil(x±s, n=7) A: Instability of RR interval; B: Instability of QT interval. **P < 0.01 vs control group; #P < 0.05, ##P < 0.01 vs SQT2 group |
2型短QT综合征(type 2 short QT syndrome,SQT2)的产生主要是由于慢速激活延迟整流钾电流(slowly activating delayed outward potassium current, IKs)通道的电流易受基因突变或外界诱因影响,通过减慢去激活、加速激活等方式来激动IKs通道,增加IKs电流,促进钾外流,缩短动作电位时程,从而引发的疾病[3]。而IKs作为形成2相和3相复极的主要离子流之一,其通道功能的异常或数目的上调、下调均可引起心律失常的发生,所以将IKs通道作为治疗SQT2的靶点研究也变得越来越重要。本实验利用吡那地尔建立SQT2模型,然后在离体心脏水平观察TMCC抗SQT2作用。
QT间期由QRS时程和ST段构成,其中QRS时程表示心室除极过程,而ST段则表示实际心室复极过程[12],二者共同组成了心室中的电传导过程。本实验结果表明,吡那地尔缩短QT间期,给予TMCC后能够使缩短的QT间期延长,表明TMCC能够抑制钾离子通道活性,减慢吡那地尔所致的复极时程加快。
在临床ECG中,从Q点起始到T波峰的距离(QTpeak)可以用来表示有效不应期(ERP)[13],ERP是指心室肌细胞从除极开始到复极膜电位回到阈电位的时间计量,这段时间内任何刺激均不能引起新的动作电位。ERP缩短可能会使新的刺激或异常冲动在传导过程中形成折返,从而引起心律失常事件发生。吡那地尔缩短QTpeak,给予TMCC后可使缩短的QTpeak延长,这样就会使异常冲动到此处之后正好处于不应期,阻止异常传导的形成,避免折返出现,表明了TMCC具有一定的抗心律失常作用。
跨室壁复极离散度(TDR)是近几年来研究的热点。有报道,TDR的异常增大是室性心动过速、室颤和SCD的发生机制,也是预测心律失常事件发生的一项指标[14]。吡那地尔能够增大豚鼠离体心脏的TDR[Tp-Te、Tp-Te(corrected)、rTp-Te],给予TMCC后可使增大的TDR减小,吡那地尔增大TDR是因为其能够使心肌内、中、外3层细胞的APD90均缩短(M细胞的APD90值大于内外膜的APD90值),但中层M细胞动作电位的缩短幅度较内、外膜细胞更为小一点,因而导致TDR明显增大。TMCC能够减小TDR,其机制是由于TMCC抑制IKs通道,又因IKs在心肌细胞内膜和外膜分布相对较多,从而使得在SQT2模型下内膜和外膜动作电位延长较M细胞明显,从而缩小了3层细胞间的异质性,进而减小TDR[15],避免心律失常的发生。
吡那地尔能够引起RR和QT间期的不稳定性增大,而RR和QT间期的不稳定性是预测心律失常的重要指标,其值增大就预示着发生心律失常的风险增大。通过给予TMCC后能够逆转吡那地尔所致的不稳定性增大,表明TMCC有抗心律失常作用。
综上所述,TMCC可通过延长QT间期和QTpeak,降低模型条件下TDR和不稳定性等作用对抗SQT2。
( 致谢: 本文于天津医科大学基础医学院药理系完成,在此衷心感谢药理学系各位老师和同学对本实验给予的帮助!)
| [1] | Hong K, Hu J, Yu J, et al. Concomitant Brugada-like and short QT electrocardiogram linked to SCN5A mutation[J]. Eur J Hum Genet, 2012, 20(11): 1189-92. doi:10.1038/ejhg.2012.63 |
| [2] | Giustetto C, Schimpf R, Mazzanti A, et al. Long-term follow-up of patients with short QT syndrome[J]. J Am Coll Cardiol, 2011, 58(6): 587-95. doi:10.1016/j.jacc.2011.03.038 |
| [3] | Harrell D T, Ashihara T, Ishikawa T, et al. Genotype-dependent differences in age of manifestation and arrhythmia complications in short QT syndrome[J]. Int J Cardiol, 2015, 190: 393-402. doi:10.1016/j.ijcard.2015.04.090 |
| [4] | Priori S G, Wilde A A, Horie M, et al. Executive summary: HRS/EHRA/APHRS expert consensus statement on the diagnosis and management of patients with inherited primary arrhythmia syndromes[J]. Europace, 2013, 15(10): 1389-406. doi:10.1093/europace/eut272 |
| [5] | Sieira J, Brugada P. Management of Brugada syndrome 2016: should all high risk patients receive an ICD? All high-risk patients should receive an implantable cardiac defibrillator[J]. Circ Arrhythm Electrophysiol, 2016, 9(11): pii: e004195. doi:10.1161/CIRCEP.116.004195 |
| [6] | Zhao L, Lou J, Wu H, et al. Effects of taurine-magnesium coordination compound on ionic channels in rat ventricular myocytes of arrhythmia induced by ouabain[J]. Biol Trace Elem Res, 2012, 147(1-3): 275-84. doi:10.1007/s12011-011-9317-1 |
| [7] | Zhao L, Lou J S, Kang Y. Taurine-magnesium coordination compound attenuates hypoxia/reoxygenation induced ion channel dysfunction in rat ventricular myocytes[J]. Drug Res (Stuttg), 2013, 63(4): 185-91. doi:10.1055/s-00023610 |
| [8] | 何海燕, 尹永强, 李宏杰, 等. 牛磺酸镁对缺氧/复氧致大鼠心肌细胞内向整流钾通道异常的影响[J]. 中国药理学通报, 2012, 28(12): 1751-6. He H Y, Yin Y Q, Li H J, et al. Effects of traurine-magnesium corrdination compound on abnormal inward retifier potassium channel current induced by hypoxia-reoxygenation in cardiomyocytes of rats[J]. Chin Pharmacol Bull, 2012, 28(12): 1751-6. |
| [9] | 汪玲芳, 尹永强, 赵临, 等. 牛磺酸镁对乌头碱致大鼠心肌细胞心律失常模型钠离子通道的影响[J]. 中国药理学通报, 2010, 26(5): 611-4. Wang L F, Yin Y Q, Zhao L, et al. Effects of traurine-magnesium corrdination compound on sodium channel in rat cardiomyocytes of arrthmia induced by aconitine[J]. Chin Pharmacol Bull, 2010, 26(5): 611-4. |
| [10] | Sarusi A, Rarosi F, Szucs M, et al. Absolute beat-to-beat variability and instability parameters of ECG intervals: biomarkers for predicting ischaemia-induced ventricular fibrillation[J]. Br J Pharmacol, 2014, 171(7): 1772-82. doi:10.1111/bph.12579 |
| [11] | van der Linde H, Van de Water A, Loots W, et al. A new method to calculate the beat-to-beat instability of QT duration in drug-induced long QT in anesthetized dogs[J]. J Pharmacol Toxicol Methods, 2005, 52(1): 168-77. doi:10.1016/j.vascn.2005.03.005 |
| [12] | Guo L, Dong Z, Guthrie H. Validation of a guinea pig Langendorff heart model for assessing potential cardiovascular liability of drug candidates[J]. J Pharmacol Toxicol Methods, 2009, 60(2): 130-51. doi:10.1016/j.vascn.2009.07.002 |
| [13] | Gupta P, Patel C, Patel H, et al. T(p-e)/QT ratio as an index of arrhythmogenesis[J]. J Electrocardiol, 2008, 41(6): 567-74. doi:10.1016/j.jelectrocard.2008.07.016 |
| [14] | Alizade E, Yesin M, Yazicioglu M V, et al. Evaluation of Tp-e interval, Tp-e/QT ratio, and Tp-e/QTc ratio in patients with asymptomatic arrhythmogenic right ventricular cardiomyopathy[J]. Ann Noninvasive Electrocardiol, 2017, 22(1). doi:10.1111/anec.12362 |
| [15] | 石亮, 杨新春, 刘秀兰, 等. 短QT间期发生室性心律失常的电生理机制探讨[J]. 中国心脏起搏与心电生理杂志, 2006, 20(2): 117-20. Shi L, Yang X C, Liu X L, et al. Study of electrophysiological mechanism of ventricular arrhythmias in the short QT duration models[J]. Chin J Card Pacing Electrophysiol, 2006, 20(2): 117-20. |