


2. 湖北民族学院医学院解剖教研室, 湖北 恩施 445000
2. Dept of Anatomy, Medical College, Hubei university for Nationalities, Enshi Hubei 445000, China
已有研究表明,臂丛撕脱伤可导致脊髓前角运动神经元的大量死亡,而且神经元死亡主要表现为凋亡[1],但臂丛撕脱伤导致神经元凋亡的机制仍不清楚。近年来越来越多的资料证实,氧化应激可能是导致臂丛撕脱伤神经元凋亡的触发因素[2]。因此,抑制氧化应激损伤诱导的神经元凋亡可能成为臂丛撕脱伤神经元保护的重要策略。葛根素(puerarin,Pue)最早是20世纪50年代中后期从野葛根中分离出来的,是一种异黄酮类化合物。葛根素不仅对包括阿尔茨海默病(Alzheimer's disease,AD)[3]、帕金森病(Parkinson disease,PD)[4]等在内神经退行性疾病导致的脑损伤有保护作用,也能加快损伤后的坐骨神经再生[5]。但具体的保护调控机制目前尚不清楚。
目前,用于建立神经元损伤模型的细胞大多采用大鼠嗜铬细胞瘤细胞(PC12)和人神经母细胞瘤细胞(SH-SY5Y)。SH-SY5Y细胞的形态、生理和生化等功能与正常人的神经细胞相似,且其增殖较快,因此,在神经系统疾病的药物治疗[6]、发病机制[7]等研究中,SH-SY5Y细胞被广泛应用。H2O2是一种氧化剂,它产生的羟自由基可引起脂质过氧化反应,进而产生大量的自由基,最终导致细胞氧化损伤。由于臂丛撕脱伤可诱导脊髓神经元发生过氧化损伤,为了模拟体内神经元损伤的情形,本实验选用H2O2作为氧化剂诱导SH-SY5Y细胞产生氧化损伤,建立神经元体外损伤模型,观察葛根素对细胞的保护作用,并探讨其机制,为臂丛撕脱伤的治疗提供理论依据。
1 材料与方法 1.1 细胞株、药物与试剂人神经母细胞瘤SH-SY5Y细胞株由上海中医药大学神经退行性疾病研究室提供。葛根素(北京北纳创联生物技术研究院),纯度96%,批号:201313。RPMI 1640培养基、0.25%胰酶(Hyclone);胎牛血清(Gibco);MTT(Amresco);Hoechst 33342(Sigma);抗兔IgG、抗小鼠IgG(CST);Bcl-2、Bax抗体(Santa Cruz);JC-1和caspase-3、caspase-9酶(碧云天公司);蛋白marker(Fermentas)。
1.2 仪器CO2培养箱(日本SANYO),倒置显微镜(Nikon),超净工作台(上海博讯实业),低温高速离心机(Eppendorf),酶标仪(Thermo Fisher),电泳仪及转膜仪(Bio-Rad),化学发光系统(Synoptics)。
1.3 细胞培养与分组SH-SY5Y细胞置于RPMI 1640培养基(含10%胎牛血清、青霉素100 kU·L-1和链霉素100 kU·L-1)中,在37℃、5% CO2培养箱培养,2~3 d传代1次。实验分空白对照组(不种细胞,只有培养基)、正常对照组、H2O2干预组以及4个浓度葛根素组(50、100、200、400 μmol·L-1)。每组设5个平行复孔,实验重复3次。
1.4 MTT比色法检测细胞存活率取对数生长期细胞,调整细胞密度,以2×107·L-1接种于96孔板,每孔200 μL。在37℃、5% CO2培养箱中培养24 h后,用不同浓度的葛根素(10~1 000 μmol·L-1)预处理3 h,再用H2O2刺激24 h。干预时间结束后,进行MTT检测。
1.5 Hoechst 33342染色检测凋亡细胞SH-SY5Y细胞经胰酶消化后,按4×107·L-1的密度接种。分为对照组、H2O2组(100 μmol·L-1)、Pue处理组(50、100、200、400 μmol·L-1)。接种后24 h,Pue处理组分别用不同浓度的Pue预处理细胞3 h,再用H2O2(100 μmol·L-1)干预24 h后,按试剂盒步骤行Hoechst 33342染色。
1.6 线粒体膜电位(mitochondrial membrane potential, MMP)的测定SH-SY5Y细胞经过上述干预后,进行JC-1染色。吸弃各孔的旧培养液,PBS洗2次,依次加入0.5 mL新鲜培养基和0.5 mL JC-1工作液,置于37℃孵育30 min,随后吸弃染色液,用1×JC-1工作液洗2次,最后加入200 μL新鲜培养基,在荧光显微镜下观察并拍照。
1.7 Caspase-3和caspase-9酶活性的检测SH-SY5Y细胞经过上述干预后,进行caspase-3和caspase-9酶活性的检测,操作程序按试剂盒要求进行。
1.8 Western blot检测Bcl-2、Bax、p-Akt和Akt蛋白的表达用200 μmol·L-1的Pue预处理SH-SY5Y细胞3 h后,再加100 μmol·L-1的H2O2孵育24 h,10 μmol·L-1 LY294002在Pue预处理前1 h加入培养液中。用Western blot法检测p-Akt、Akt、Bcl-2、Bax蛋白在各组的表达。程序如下:提取蛋白,测蛋白浓度,蛋白变性,SDA-PAGE电泳,转膜,抗体孵育,ECL显色,最后用Image软件分析结果。
1.9 统计学处理数据采用x±s表示,采用SPSS 18.0软件进行统计学分析, 多组间比较采用单因素方差分析(AVOVA)。
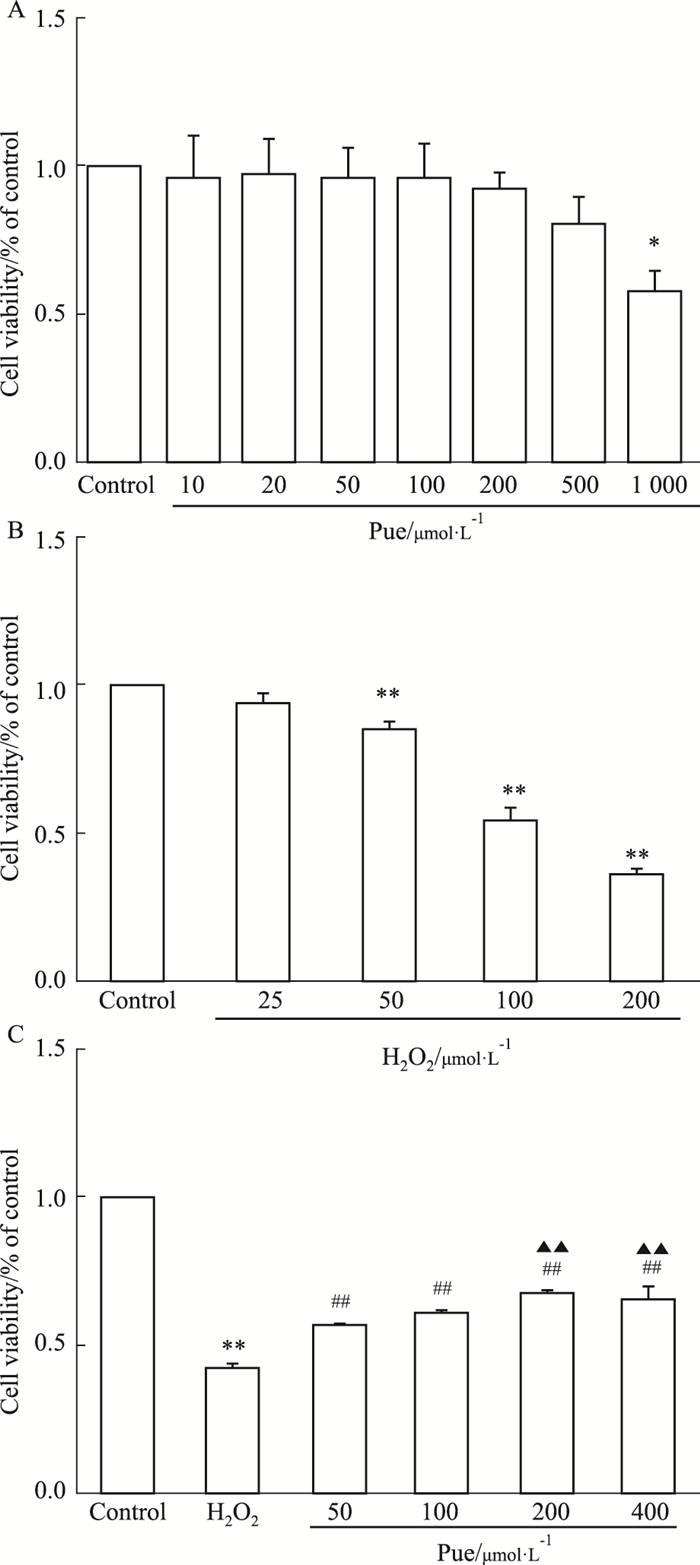
2 结果 2.1 葛根素预处理改善H2O2诱导的SH-SY5Y细胞存活率下降与正常对照组相比,10~500 μmol·L-1浓度的Pue预处理组的细胞存活率差异无显著性,但当Pue的浓度提高到1 000 μmol·L-1时,SH-SY5Y细胞的存活率明显下降(Fig 1A)。因此,本研究选用(50~400) μmol·L-1浓度范围的Pue进行后续实验。如Fig 1B所示,与正常对照组相比,当H2O2的浓度从50 μmol·L-1升至200 μmol·L-1时,细胞存活率逐渐下降(P<0.01),由此确定造模所用H2O2的浓度为100 μmol·L-1。如Fig 1C所示,与正常对照组相比,经(50~400) μmol·L-1的Pue预处理3 h后,SH-SY5Y细胞存活率较模型组有明显提高(P<0.01);且与Pue 50 μmol·L-1组相比,Pue 200、400 μmol·L-1组细胞存活率明显提高(P<0.01),存在剂量依赖关系。
|
| Fig 1 Puerarin exerted neuroprotective effects against H2O2-induced cell loss in SH-SY5Y neuroblastoma cells A:Cell viability of SH-SY5Y neuroblastoma cells treated by different concentrations of puerarin; B: Cell viability of SH-SY5Y neuroblastoma cells treated by different concentrations of H2O2; C: Effect of different concentrations of puerarin on viability of SH-SY5Y neuroblastoma cells treated by 100 μmol·L-1 H2O2. *P < 0.05, **P < 0.01 vs control group; ##P < 0.01 vs H2O2 group; ▲▲P < 0.01 vs Pue 50 μmol·L-1 group. |
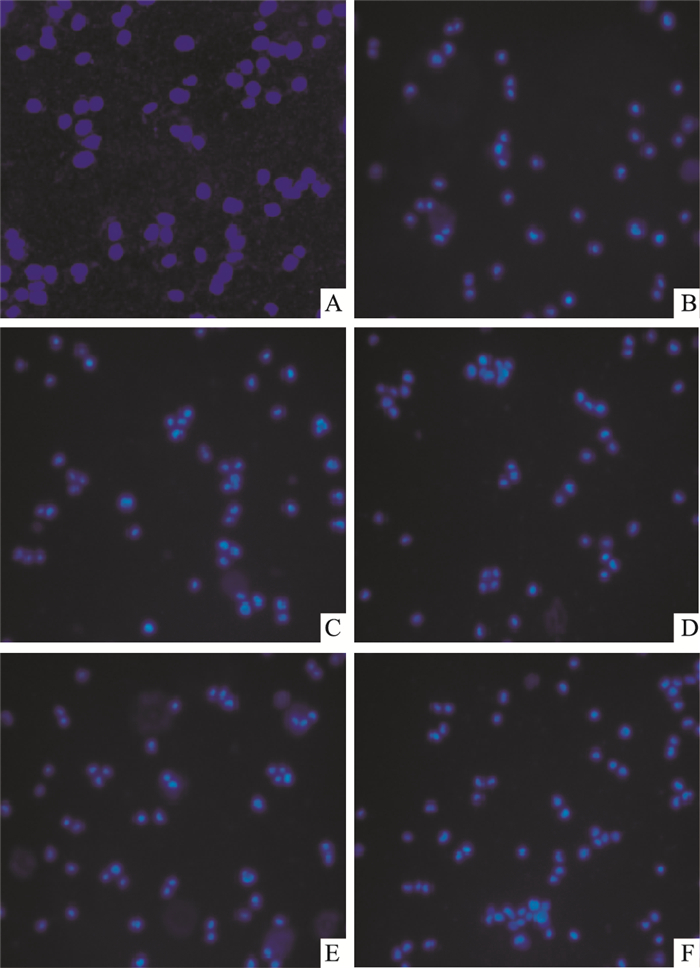
如Fig 2所示,正常组SH-SY5Y细胞经Hoechst 33342染色后,细胞核呈均匀的低强度蓝色荧光,而H2O2模型组呈浓染致密的固缩形态荧光。经Pue预处理后,SH-SY5Y细胞的核固缩情况有明显改善。
|
| Fig 2 Effect of puerarin treatment on H2O2-induced SH-SY5Y cell apoptosis (Hoechst 33342 staining, ×200) A: Control group; B: H2O2 group; C: Pue 50 μmol·L-1 group; D; Pue 100 μmol·L-1 group; E: Pue 200 μmol·L-1 group; F: Pue 400 μmol·L-1 group |
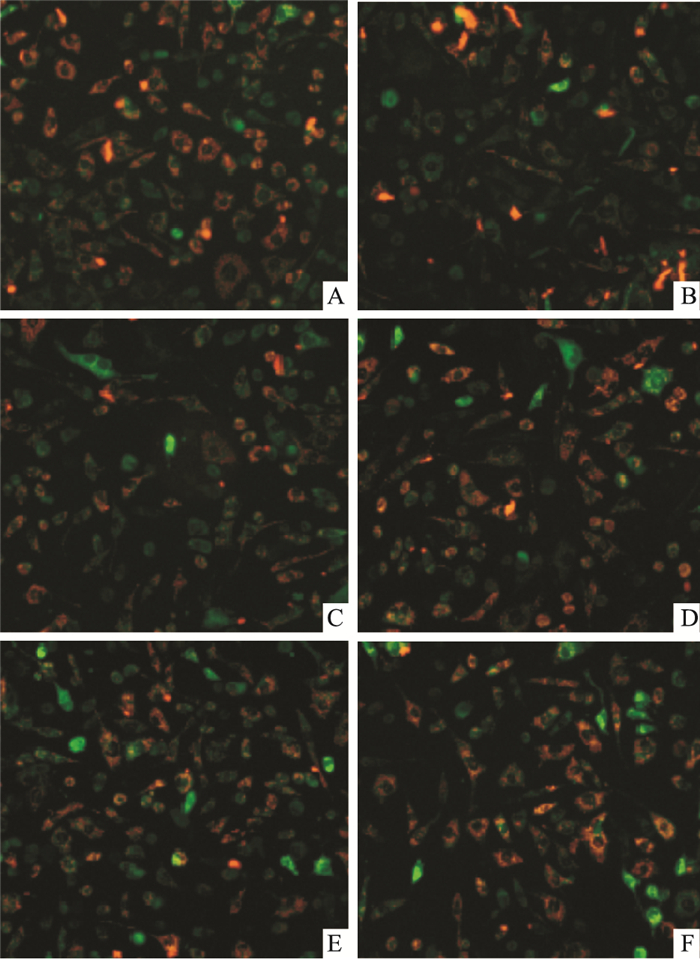
橙色荧光表示SH-SY5Y细胞线粒体功能正常,绿色荧光表示SH-SY5Y细胞线粒体功能异常,表现为线粒体膜电位下降。Fig 3的JC-1染色结果显示,对照组细胞线粒体膜电位多为正常,用100 μmol·L-1 H2O2处理后,线粒体膜电位明显下降,而经Pue预处理后,线粒体膜电位的下降得到明显抑制。
|
| Fig 3 Effects of puerarin on H2O2-induced MMP loss on SH-SY5Y cells (JC-1 staining, ×200) A: Control; B:H2O2; C: Pue 50 μmol·L-1 group; D; Pue 100 μmol·L-1 group; E: Pue 200 μmol·L-1 group; F: Pue 400 μmol·L-1 group |
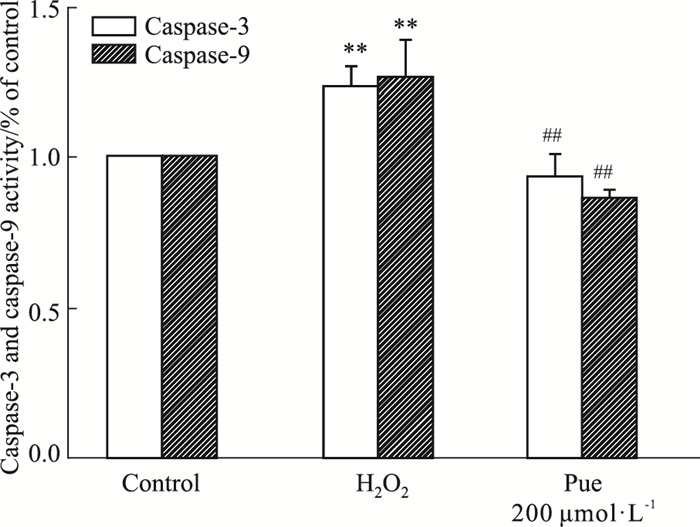
如Fig 4所示,与对照组相比,H2O2模型组caspase-3和caspase-9的活性明显升高(P<0.01),而预先加入200 μmol·L-1的葛根素作用后,caspase-3和caspase-9的活性明显下降(P<0.01)。
|
| Fig 4 Effects of puerarin on enzymatic activities of Caspase-3 and Caspase-9 **P < 0.01 vs control group; ##P < 0.01 vs H2O2 group |
如Fig 5所示,与对照组相比,经100 μmol·L-1的H2O2处理后,Bcl-2蛋白的表达明显降低(P<0.01),Bax的蛋白表达明显增高(P<0.01),p-Akt蛋白的表达降低(P<0.05);与H2O2组比较,200 μmol·L-1的Pue预孵育后,p-Akt、Bcl-2蛋白的表达增高(P<0.01),Bax的蛋白表达降低(P<0.05),这种作用可被PI3K的抑制剂LY2940002所抑制。

|
| Fig 5 Effects of puerarin on levels of p-Akt, Akt(A) and Bcl-2, Bax(B) protein expression in SH-SY5Y cells *P < 0.05, **P < 0.01 vs control group; #P < 0.05, ##P < 0.01 vs H2O2 group; ▲P < 0.05, ▲▲P < 0.01 vs Pue group. |
研究表明[8],过量的H2O2将导致神经元死亡,其主要原因是氧化应激产生大量的活性氧(reactive oxygen species,ROS),ROS产生与抗氧化系统之间失去平衡,造成细胞损伤。此外,氧化应激增加线粒体膜的渗透性,进而破坏膜电位。线粒体膜的破坏进一步导致ATP产生减少,并增加ROS的产生。持续升高的ROS反过来损害线粒体功能,激活了腺苷和蛋白酶系统,最终导致不可逆性的线粒体膜、染色质和细胞器的破坏,引起细胞死亡[9]。本研究结果显示,葛根素预处理能明显抑制H2O2诱导的SH-SY5Y细胞死亡,提高了凋亡相关蛋白Bcl-2的表达,降低了Bax蛋白的表达,抑制了caspase-3和caspase-9的酶活性和线粒体膜电位的下降。因此,我们认为Pue抑制ROS形成或许有助于线粒体膜电位的保护,最终对H2O2诱导的SH-SY5Y细胞凋亡发挥保护作用。有文献报道用PC12细胞代替SH-SY5Y细胞进行研究,发现葛根素可以抑制由H2O2氧化引起的细胞凋亡[10]。
PI3K-Akt信号通路通过Akt的磷酸化作用,激活或抑制其下游靶蛋白Bcl-2、Bax、caspase的表达[11],进而调控细胞增殖、分化和凋亡等多种功能,尤其在细胞存活方面发挥重要作用。有研究表明,葛根素通过抗氧化途径发挥神经保护作用与Akt的活化有关[12]。我们的研究结果显示,Pue预处理使H2O2诱导的SH-SY5Y细胞的Akt磷酸化作用增强,且Pue的保护作用被PI3K的抑制剂LY294002所阻断。此外,LY294002预处理抑制了葛根素对凋亡相关蛋白表达的影响,这些结果均提示葛根素的抗凋亡作用是通过PI3K/Akt通路的激活所介导。这与Pue在其他细胞如PC12细胞和HepG2细胞中的研究结果相一致[13]。
综上所述,葛根素对H2O2诱导的SH-SY5Y细胞凋亡有保护作用,其机制可能是通过激活PI3K/Akt信号通路,进而抑制与凋亡密切相关的caspase-3、caspase-9的酶活性、Bax蛋白的表达,促进Bcl-2蛋白的表达,以及稳定线粒体膜电位等有关,这将为治疗臂丛撕脱伤提供新的策略。
( 致谢: 本实验部分工作在湖北民族学院生物资源保护与利用湖北省重点实验室和风湿性疾病发生与干预湖北省重点实验室完成,感谢老师们实验过程中的耐心指导。)
| [1] | Li K, Cao R J, Zhu X J. Erythropoietin attenuates the apoptosis of adult neurons after brachial plexus root avulsion by downregulating JNK phosphorylation and c-Jun expression and inhibiting c-PARP cleavage[J]. J Mol Neurosci, 2015, 56(4): 917-25. doi:10.1007/s12031-015-0543-4 |
| [2] | Cheng X, Liu F L, Zhang J, et al. EGb761 protects motoneurons against avulsion-induced oxidative stress in rats[J]. J Brachial Plex Peripher Nerve Inj, 2010, 5: 12. |
| [3] | Hong X P, Chen T, Yin N N, et al. Puerarin ameliorates D-galactose induced enhanced hippocampal neurogenesis and tau hyperphosphorylation in rat brain[J]. J Alzheimers Dis, 2016, 51(2): 605-17. doi:10.3233/JAD-150566 |
| [4] | Cheng Y, Leng W, Zhang J. Protective effect of puerarin against oxidative stress injury of neural cells and related mechanisms[J]. Med Sci Monit, 2016, 22: 1244-9. doi:10.12659/MSM.896058 |
| [5] | Wu M, Zhao G, Yang X, et al. Puerarin accelerates neural regeneration after sciatic nerve injury[J]. Neural Regen Res, 2014, 9(6): 589-93. doi:10.4103/1673-5374.130097 |
| [6] | Wang Y, Liu T E, Pan W, et al. Small molecule compounds alleviate anisomycin-inducedoxidative stress injury in SH-SY5Y cells via downregulation of p66shc and Aβ1-42 expression[J]. Exp Ther Med, 2016, 11(2): 593-600. doi:10.3892/etm.2015.2921 |
| [7] | 赵素晨, 程月发, 吴庆文, 等. 葛根素对MPP+诱导的SH-SY5Y细胞凋亡过程中p53和mir-34a表达的影响[J]. 中国药理学通报, 2015, 31(10): 1479-80. Zhao S C, Chen Y F, Wu Q W, et al. Effect of puerarin on expression of p53 and mir-34a in apoptosis of SH-SY5Y cell induced by Mpp+[J]. Chin Pharmacol Bull, 2015, 31(10): 1479-80. doi:10.3969/j.issn.1001-1978.2015.10.031 |
| [8] | Wang K, Zhu L, Zhu X, et al. Protective effect of paeoniflorin on Aβ25-35-induced SH-SY5Y cell injury by preventing mitochondrial dysfunction[J]. Cell Mol Neurobiol, 2014, 34(2): 227-34. doi:10.1007/s10571-013-0006-9 |
| [9] | Dumont M, Beal M F. Neuroprotective strategies involving ROS in Alzheimer disease[J]. Free Radic Biol Med, 2011, 51(5): 1014-26. doi:10.1016/j.freeradbiomed.2010.11.026 |
| [10] | Jiang B, Liu J H, Bao Y M, et al. Hydrogen peroxide-induced apoptosis in PC12 cells and the protective effect of Puerarin[J]. Cell Bio Int, 2003, 27(12): 1025-31. doi:10.1016/j.cellbi.2003.09.007 |
| [11] | 赵泓翔, 郭可, 崔亚迪, 等. 半枝莲黄酮对复合Aβ25-35引起线粒体膜Bcl-2、Bax、Bcl-xL及Bak异常的干预作用[J]. 中国病理生理杂志, 2014, 30(12): 2262-6. Zhao H X, Guo K, Cui Y D, et al. Effect of scutellaria barbata flavonoids on abnormal changes of Bcl-2, Bax, Bcl-xL and Bak protein expression in mitochondrial membrane induced by composite Aβ25-35[J]. Chin J Pathophysiol, 2014, 30(12): 2262-6. doi:10.3969/j.issn.1000-4718.2014.12.026 |
| [12] | Duarte A I, Santos P, Oliveira C R, et al. Insulin neuroprotection against oxidative stress is mediated by Akt and GSK-3beta signaling pathways and changes in protein expression[J]. Biochim Biophys Acta, 2008, 1783(6): 994-1002. doi:10.1016/j.bbamcr.2008.02.016 |
| [13] | Xing G, Dong M, Li X, et al. Neuroprotective effects of puerarin against beta-amyloid-induced neurotoxicity in PC12 cells via a PI3K-dependent signaling pathway[J]. Brain Res Bull, 2011, 85(3-4): 212-8. doi:10.1016/j.brainresbull.2011.03.024 |

