


2. 上海交通大学附属第六人民医院骨科,上海 200233
2. Dept of Orthopaedics, Shanghai Jiaotong University Affiliated Sixth People's Hospital, Shanghai 200233, China
非酒精性脂肪肝(non-alcoholic fatty liver disease,NAFLD)是一种与胰岛素抵抗和遗传易感性密切相关的代谢应激性肝损伤。随着人民物质生活水平的不断提高和膳食结构的巨大改变,NAFLD的发病率逐年增高,研究表明,中国普通人群中已有高达15%的成年人罹患此病。而各种原因导致的肝细胞内脂肪过度沉积是NAFLD的主要特征,因此,减少肝细胞中甘油三酯的蓄积是治疗NAFLD的关键步骤。
小檗碱又名黄连素,是由中药黄连中提取出来的异喹啉生物碱,具有抗菌、消炎、抗氧自由基、抗消化性溃疡等作用。近年来研究已证实,小檗碱具有降糖、调脂、减轻体重、改善胰岛素抵抗等作用[2],然而其作用机制尚未完全阐明。
磷酸腺苷活化蛋白激酶(adenosine 5′-monophosphate-activated protein kinase,AMPK)被认为是细胞的“能量调节器”,在2型糖尿病、NAFLD、代谢综合征等疾病中发挥重要作用[3]。一些报道认为小檗碱通过激活AMPK来调节糖脂代谢[4],然而我们前期研究表明,小檗碱降糖的根本机制是抑制线粒体复合物Ⅰ,并不依赖于AMPK的激活[5]。此外,以往研究表明小檗碱通过促进脂肪酸(free fatty acid,FFA)氧化,进而缓解脂肪肝,而尚未有研究探讨其与FFA摄取之间的关系。因此,本研究将使用小鼠原代肝细胞模型探讨小檗碱对脂肪酸摄取的影响及其与AMPK通路和线粒体间的关系,以进一步阐明小檗碱降低肝脂质沉积的作用机制。
1 材料与方法 1.1 材料 1.1.1 实验动物提取原代肝细胞的10只C57BL/6J野生型♂小鼠购自南京大学南京生物医药研究院。
1.1.2 试剂盐酸小檗碱购自上海纯优生物科技有限公司(批号:14110603,纯度96%);盐酸二甲双胍购自上海生工生物工程股份有限公司(批号:B311BA0002,纯度98%);低糖DMEM培养基、高糖DMEM培养基、胎牛血清(FBS)、胰酶(Trypsin-EDTA)、青链霉素、油酸钠、鱼藤酮、Ⅳ型胶原酶均购自美国Sigma公司;化合物C(compound C,CC)购自美国默克公司;甘油三酯试剂盒购自上海科华生物工程股份有限公司;FFA试剂盒购自日本WAKO公司;乳酸脱氢酶(lactate dehydrogenase,LDH)试剂盒购自中国碧云天公司;AMPK和磷酸化AMPK一抗、乙酰辅酶A羧化酶(acetyl-CoA carboxylase,ACC)和磷酸化ACC一抗、β-actin一抗、抗兔二抗、抗鼠二抗均购自美国CST公司。
1.1.3 仪器7600全自动生化分析仪(日本日立公司);多功能酶标仪(美国Molocular Device);低温台式离心机(德国Eppendorf公司);化学发光成像系统(美国GE公司);倒置显微镜(日本奥林巴斯公司);电泳仪、半干转印系统(美国Bio-Rad公司)。
1.2 方法 1.2.1 小檗碱的配制将小檗碱粉末溶于DMSO中,配成10 mmol·L-1储备液,作用于原代肝细胞时用无菌双蒸水稀释为2、4 μmol·L-1加入培养基中。
1.2.2 小鼠原代肝细胞提取及培养将6~8周龄C57BL/6J野生型♂小鼠禁食12 h后,异戊巴比妥腹腔注射深度麻醉,由小鼠肝门静脉先后推入无钙灌流液和Ⅳ型胶原酶溶液冲洗消化,小心取下肝脏放入高糖DMEM中划散,200目过滤筛过滤后离心,弃上清,加入高糖DMEM重悬,加入Percoll提纯后,再次离心弃上清,沉淀加入适量低糖DMEM重悬,细胞计数后,铺入明胶孵育的6孔或12孔板,4~6 h待细胞贴壁后更换培养基。放置过夜后,更换为含0.25% BSA的低糖培养基,加入白蛋白偶联的油酸(oleic acid, OA)诱导原代肝细胞脂肪变,同时加入小檗碱或二甲双胍处理24 h,或提前1 h加入20 μmol·L-1 CC抑制细胞AMPK通路后,再加入OA和小檗碱或二甲双胍培养24 h。
1.2.3 LDH细胞毒性检测根据碧云天试剂盒说明书,细胞加药处理24 h后,取各孔上清120 μL,加入60 μL工作液,室温避光孵育30 min后,在490 nm和600 nm处分别测定吸光度。
1.2.4 甘油三酯检测根据试剂盒说明书,NP40加入培养板中,刮下细胞后,90℃水浴5 min,冷却至室温,重复此步骤,室温离心后取上清检测,加入工作液37℃孵育5 min,在550 nm和660 nm处分别测定吸光度,结果用每毫克总蛋白中的甘油三酯量(g·g-1 Pro)表示,总蛋白含量用BCA法测定。
1.2.5 油红O染色取出细胞,弃DMEM用PBS清洗,10%多聚甲醛室温固定30 min,再次PBS清洗后,加入油红O染色液室温孵育1 h,去离子水清洗2遍,在显微镜下观察拍照。
1.2.6 FFA摄取根据日本WAKO试剂盒说明书,取200 μL细胞上清液,用日立7600自动分析仪检测FFA含量。将不加细胞对照组FFA含量减去各组上清液FFA含量换算为细胞的FFA摄取量。
1.2.7 Western blot小鼠原代肝细胞经药物处理后,加入含有苯甲基磺酰氟(PMSF)和磷酸酶抑制剂的RIPA裂解液裂解细胞,提取细胞总蛋白,BCA法测定蛋白浓度。蛋白经SDS-PAGE电泳分离后,转至PVDF膜,5%脱脂奶粉封闭1 h后,加入一抗4 ℃孵育过夜;次日用TBST缓冲液洗10 min×3次后,加入二抗室温孵育1 h,TBST再次充分洗膜10 min×3次,ECL试剂显影曝光。最后用Image J软件分析各条带灰度值,以β-actin条带灰度值为对照计算各目的蛋白的相对表达量,进行组间比较。
1.2.8 诱导脂肪变OA浓度筛选随着OA浓度的增高,细胞内甘油三酯的含量呈剂量依赖性增多(Fig 1),提示OA诱导原代肝细胞脂肪变模型构建成功,其中0.8 mmol·L-1最适宜,因其在促进小鼠原代肝细胞内脂质明显蓄积的同时未造成细胞存活率的明显下降,因此,确定0.8 mmol·L-1作为OA诱导小鼠原代肝细胞脂肪变的浓度。
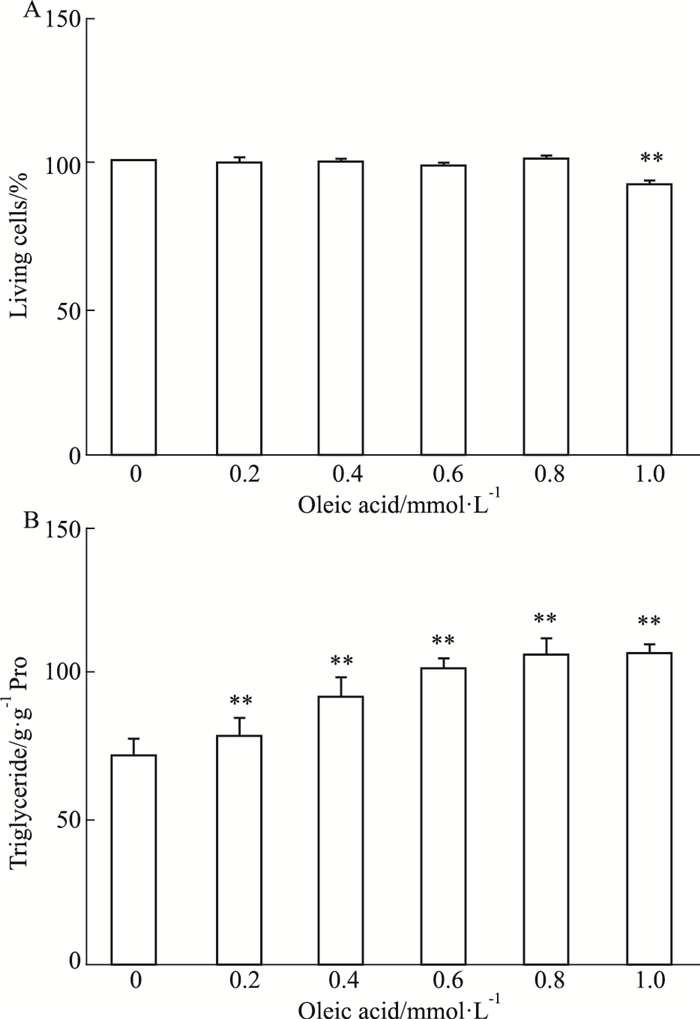
|
| Fig 1 Induction of steatosis by different doses of oleic acid in mouse primary hepatocytes (x±s, n=4) A: Cell viability was measured after different concentrations of oleic acid (OA) treat; B: Triglyceride of each group. **P < 0.01 vs control |
与对照组相比,0.5~4 μmol·L-1的小檗碱对小鼠原代肝细胞的活细胞百分比无明显影响(Fig 2),因此,0.5~4 μmol·L-1为小檗碱的安全浓度,进一步确定2、4 μmol·L-1为细胞处理浓度。
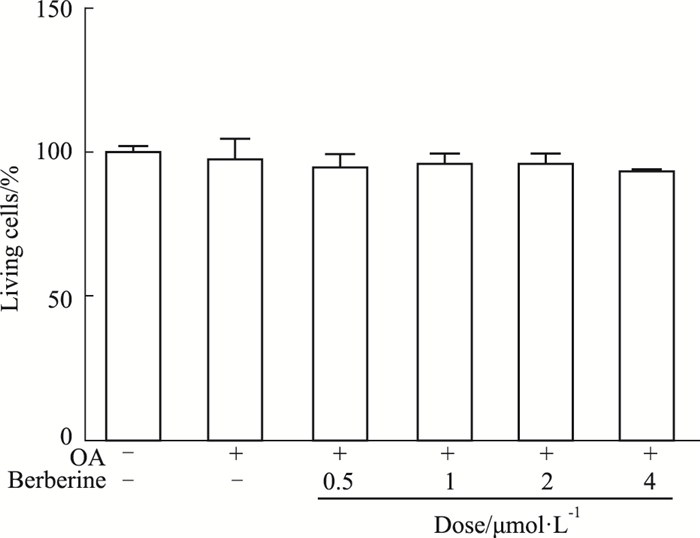
|
| Fig 2 Cell viability was measured after different concentrations of berberine(BBR) intervention (x±s, n=5) |
将所得数据用SPSS 21.0统计软件进行统计分析,以x±s表示,每组实验重复次数以n表示,多组间均数比较采用单因素方差分析。
2 结果 2.1 小檗碱可明显降低原代肝细胞脂质沉积如Fig 3所示,以二甲双胍为阳性对照,用2、4 μmol·L-1盐酸小檗碱处理小鼠原代肝细胞,油红O染色发现,二甲双胍和小檗碱均可明显降低OA所致脂质沉积,且4 μmol·L-1小檗碱组较2 μmol·L-1小檗碱组效果更为明显。同时,定量检测肝细胞内甘油三酯含量,相比于只加OA的对照组,2、4 μmol·L-1小檗碱处理可使细胞甘油三酯含量分别下降34.7%(P<0.05)和51.2%(P<0.01),进一步证明了小檗碱可降低OA诱导的小鼠原代肝细胞脂质沉积。
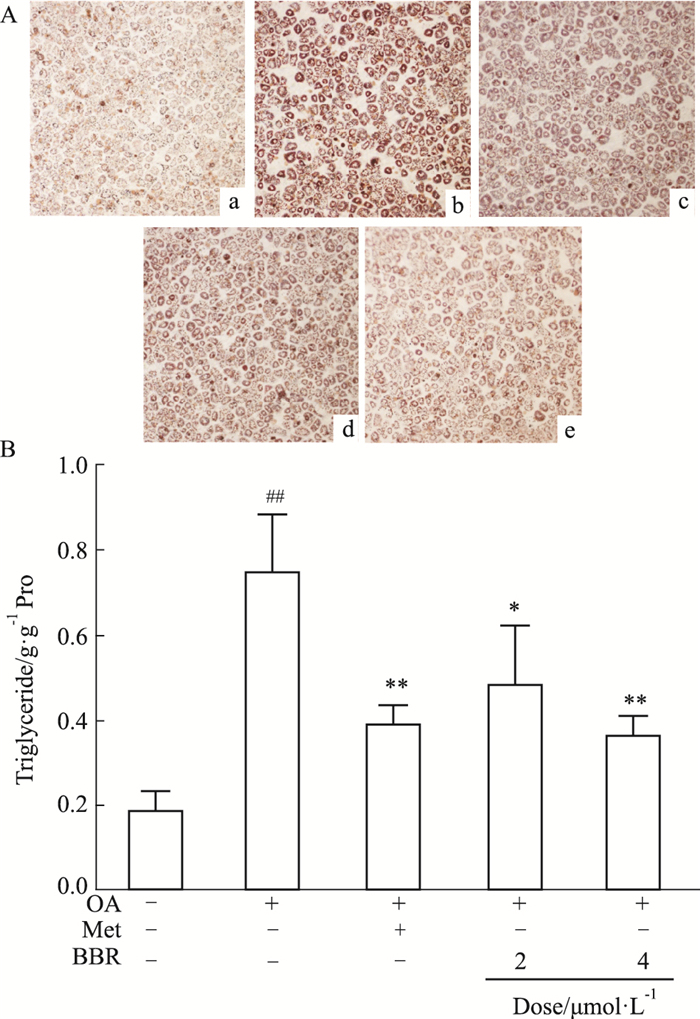
|
| Fig 3 Lipid-lowing effect of berberine in mouse primary hepatocytes in a dose-dependent manner (x±s, n=8) A: Oil red staining was made after different treat (×100); a: control (without OA); b: OA; c: OA+Met 5 mmol·L-1; d: OA+BBR 2 μmol·L-1; e: OA+BBR 4 μmol·L-1; B: Triglyceride of each group. *P < 0.05, **P < 0.01 vs OA group; ##P < 0.01 vs control group (without OA). |
如Fig 4所示,与对照组相比,OA处理使AMPK和ACC磷酸化水平分别下降了21.2%和31.9%(P<0.01),而4 μmol·L-1小檗碱使AMPK和ACC磷酸化在OA组的基础上升高了89.2%和53.1%(P<0.01),说明小檗碱可增强AMPK及其下游产物的磷酸化,激活AMPK通路。
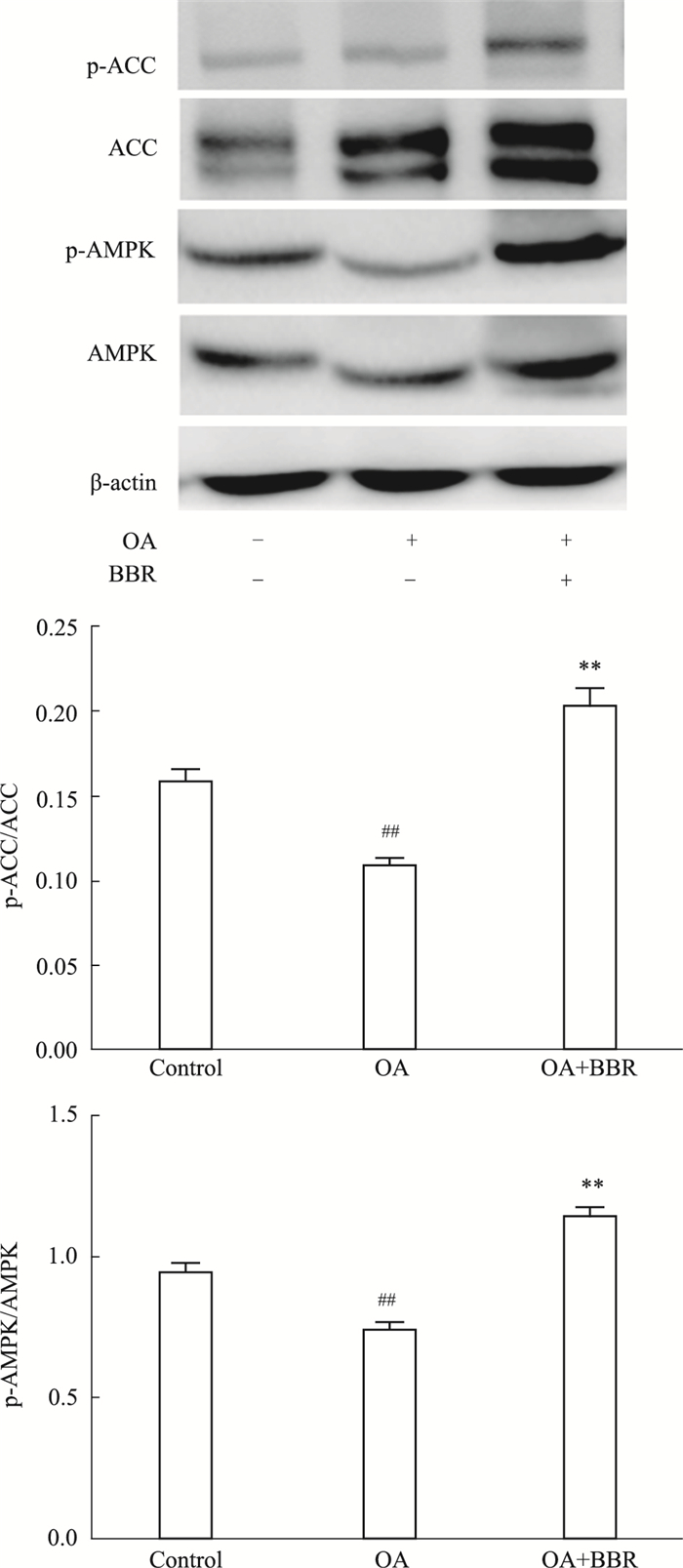
|
| Fig 4 AMPK phosphorylation after BBR treatment (x±s, n=3) Ratios of p-ACC/ACC and p-AMPK/AMPK were quantified using densitometry and normalized to β-actin. BBR: 4 μmol·L-1. **P < 0.01 vs OA group; ##P < 0.01 vs control group (without OA). |
AMPK化学抑制剂CC可特异性阻断AMPK通路[6],抑制AMPK通路下游信号的传导。如Fig 5所示,油红O染色发现,单纯小檗碱组和二甲双胍组脂滴较OA组明显减少,而CC的加入并未使脂滴数目发生明显变化。同时定量实验中,CC组甘油三酯的含量与OA处理组相比无明显差异,而小檗碱组甘油三酯含量下降了30.2%(P<0.01),小檗碱+CC组下降了37.1%(P<0.01),两者相比无明显差异(P>0.05)。说明CC本身对甘油三酯含量无明显影响,即当AMPK被抑制时,小檗碱仍具有降低肝细胞脂质沉积的效应。
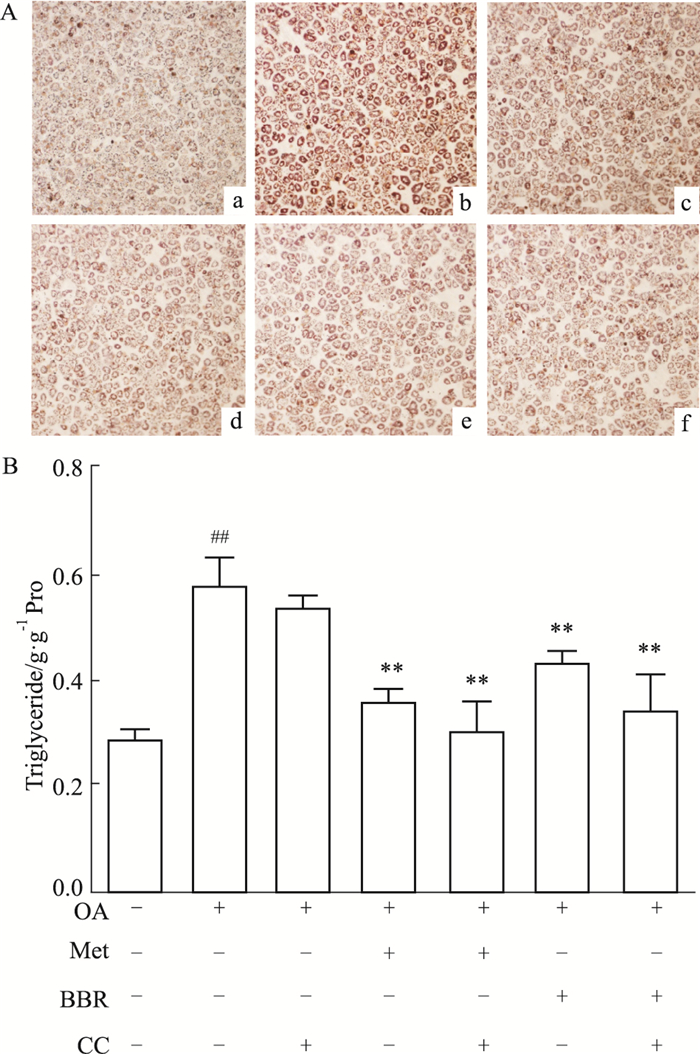
|
| Fig 5 Effect of berberine on lipid accumulation under the condition of AMPK inhibited (x±s, n=6) A: Oil red staining of different treat (×100); a: control (without OA); b: OA; c: OA+Met; d: OA+Met+CC; e: OA+BBR; f: OA+BBR+CC; B: Triglyceride of each group. BBR: 4 μmol·L-1, Met: 5 mmol·L-1, CC: 20 μmol·L-1. **P < 0.01 vs OA group; ##P < 0.01 vs control group (without OA) |
如Fig 6所示,与OA对照组相比,二甲双胍可明显降低原代肝细胞对脂肪酸的摄取,而小檗碱使脂肪酸摄取量减少31.2%(P<0.01),表明小檗碱可抑制脂肪酸摄取。同时,为了验证小檗碱的这一作用是否与线粒体抑制有关,将5 μmol·L-1的鱼藤酮(线粒体复合物Ⅰ抑制剂)与OA共同孵育细胞24 h,发现鱼藤酮组脂肪酸的摄取量也下降了23.6%(P<0.01),即抑制线粒体复合物Ⅰ具有相同作用。说明小檗碱可能是通过抑制复合物Ⅰ抑制脂肪酸摄取,进而降低细胞内脂质沉积。
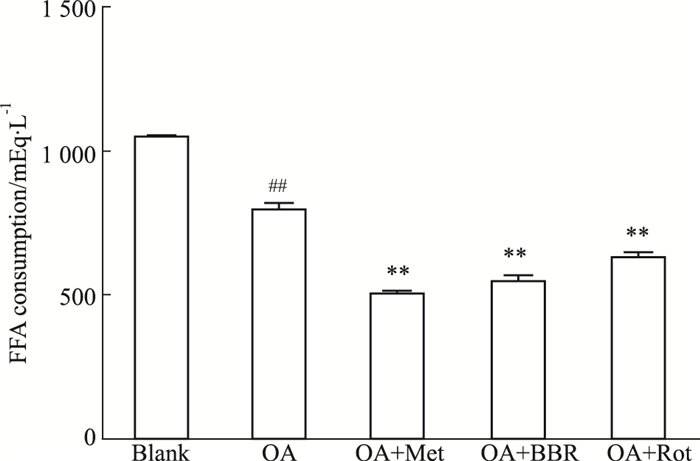
|
| Fig 6 Free fatty acid uptake of primary hepatocytes after BBR and rotentone treated (x±s, n=4) BBR: 4 μmol·L-1, Rot: 5 μmol·L-1. **P < 0.01 vs OA group; ##P < 0.01 vs Blank group (without OA) |
黄连素是由黄连、黄柏、三颗叶等植物中提取出的异喹啉生物碱,具有抑菌、抗炎、抗血小板、抗心律失常等药理作用,临床上广泛应用于多种疾病的治疗。本课题组在国际上首次报道了小檗碱非胰岛素依赖的体外降糖作用[7],可用于糖尿病的治疗,并发现小檗碱可通过改善脂质沉积,达到胰岛素增敏的疗效[2]。小檗碱逐渐引起国际糖尿病界的关注,近年来的研究也相继发现,小檗碱的确可以明显降糖、增加组织对葡萄糖的摄取和消耗,同时降低血脂、减少组织脂质沉积[8]。
AMPK被称为机体的“能量调节器”,是一种广泛存在于真核细胞中的丝氨酸/苏氨酸激酶,由催化亚基α和调节亚基β、γ共同组成。AMPK激活剂可刺激AMPKα亚基苏氨酸172位点磷酸化,进而激活AMPK,增强脂肪酸β氧化等分解代谢,抑制葡萄糖、脂质、蛋白质的合成,改善胰岛素抵抗[3, 9-10]。以往研究认为,小檗碱与二甲双胍类似,均通过激活AMPK发挥调节糖脂代谢的效应[11-13]。但也有研究指出,在肝脏AMPK基因敲除小鼠中应用二甲双胍仍能减少肝葡萄糖的输出,降低血糖[14]。而我们前期研究发现,小檗碱是通过抑制线粒体的有氧呼吸,进而刺激糖酵解以增加葡萄糖的利用,并不依赖于AMPK[15]。这些结果均动摇了AMPK在糖脂代谢中的核心地位。
本研究显示,给予小鼠原代肝细胞小檗碱处理24 h,油红染色和甘油三酯定量检测均表明细胞内脂质含量较对照组明显下降,Western blot证实AMPK及其下游靶点ACC磷酸化水平明显增加,这与以往研究结果相符,提示小檗碱的确可以激活AMPK,但能否说明小檗碱就是通过AMPK信号通路降低肝细胞脂质沉积的呢?为明确其具体作用机制,我们选取AMPK化学抑制剂CC预处理细胞以阻断AMPK通路,并在此基础上给予小檗碱处理,结果显示,小檗碱在AMPK被抑制的情况下,仍能明显减少肝细胞脂质沉积,这一结果表明小檗碱的降脂效应独立于AMPK。
FFA被细胞摄取入胞,与甘油结合生成甘油三酯,因此,在FFA绝对充足的前提下,细胞对FFA摄取的多少决定了甘油三酯合成的数量,而既往尚未见相关研究报道小檗碱对脂肪酸摄取的影响及其与线粒体的关系。本实验中,我们使用油酸处理细胞,在诱导肝细胞脂肪变的同时也为细胞提供充足的脂肪酸。为探究小檗碱的降脂作用与其对线粒体的抑制是否有关,我们设置了线粒体复合物Ⅰ抑制剂鱼藤酮组。结果显示,小檗碱可使细胞对脂肪酸的摄取大大减少,同时鱼藤酮组脂肪酸的摄取量也明显下降,说明小檗碱可能是通过抑制复合物Ⅰ抑制脂肪酸摄取,进而减少甘油三酯合成。我们推测脂代谢与糖代谢相似,都受复合物Ⅰ的直接调控,当复合物Ⅰ功能被轻度抑制时,ATP合成减少,消耗ATP的生理活动如糖异生、脂肪酸摄取、脂质合成等代偿性减少,该过程受底物水平的调控,并不需要AMPK的介导。
既然AMPK激活并非小檗碱降脂的必要条件,那么AMPK在其中扮演什么角色呢?我们推测小檗碱抑制线粒体复合物Ⅰ,降低脂质合成,使ATP合成减少,AMP/ATP比值增高,AMPK激活。AMPK通路的激活是小檗碱降脂的“果”而非“因”。
综上所述,小檗碱通过抑制线粒体复合物Ⅰ抑制脂肪酸摄取,进而降低肝细胞内脂质沉积,这一过程独立于AMPK通路。AMPK激活是线粒体功能抑制的结果,而非小檗碱降脂的原因。电子传递链复合物Ⅰ可能才是代谢通路复杂网络调控体系的开端,AMPK仅仅是其下游的一条通路,阻断后并不会影响复合物Ⅰ抑制剂的作用,但具体机制有待于进一步研究。
( 致谢: 本文实验在上海市糖尿病研究所糖尿病重点实验室完成,对曾给予过帮助的老师和同学表示衷心感谢!)
| [1] | Fan J G. Epidemiology of alcoholic and nonalcoholic fatty liver disease in China[J]. J Gastroenterol Hepatol, 2013, 28(Suppl 1): 11-7. |
| [2] | 殷峻, 陈名道, 唐金凤, 等. 小檗碱对实验大鼠糖脂代谢的影响[J]. 中华糖尿病杂志, 2004, 12(3): 215-8. Yin J, Chen M D, Tang J F, et al. Effects of berberine on glucose and lipid metabolism in animal experiment[J]. Chin J Diabetes, 2004, 12(3): 215-8. |
| [3] | Day E A, Ford R J, Steinberg G R. AMPK as a therapeutic target for treating metabolic diseases[J]. Trends Endocrinol Metab, 2017, 28(8): 545-60. |
| [4] | Kim W S, Lee Y S, Cha S H, et al. Berberine improves lipid dysregulation in obesity by controlling central and peripheral AMPK activity[J]. Am J Physiol Endocrinol Metab, 2009, 296(4): E812-9. |
| [5] | 肖元元, 徐淼, 殷峻, 等. 小檗碱的降糖作用独立于AMPK的信号通路[J]. 中华老年多器官疾病杂志, 2014, 13(11): 847-51. Xiao Y Y, Xu M, Yin J, et al. Berberine enhances glucose metabolism in absence of AMP-activated protein kinase activation[J]. Chin J Mult Organ Dis Elderly, 2014, 13(11): 847-51. |
| [6] | Rao E, Zhang Y, Li Q, et al. AMPK-dependent and independent effects of AICAR and compound C on T-cell responses[J]. Oncotarget, 2016, 7(23): 33783-95. |
| [7] | Yin J, Hu R, Chen M, et al. Effects of berberine on glucose metabolism in vitro[J]. Metabolism, 2002, 51(11): 1439-43. doi:10.1053/meta.2002.34715 |
| [8] | 龚菂, 李芬, 邹欣, 等. HepG2细胞胰岛素抵抗模型建立及盐酸小檗碱改善胰岛素抵抗的实验研究[J]. 中国药理学通报, 2016, 32(12): 1750-4. Gong D, Li F, Zou X, et al. HepG2 cell IR: establishment of model and improvement by berberine[J]. Chin Pharmacol Bull, 2016, 32(12): 1750-4. doi:10.3969/j.issn.1001-1978.2016.12.022 |
| [9] | 俞牧雨, 殷峻. 腺苷酸活化蛋白激酶调节糖脂代谢的研究进展[J]. 山东医药, 2017, 57(1): 109-11. Yu M Y, Yin J. Research progress of the effects of AMPK on glucose and lipid metabolism[J]. Shandong Med J, 2017, 57(1): 109-11. |
| [10] | 孙乐, 贺震旦, 杨润梅, 等. 粗壮女贞总苷降脂作用及其基于AMPK通路的降脂作用机制研究[J]. 中国药理学通报, 2017, 33(8): 1073-9. Sun L, He Z D, Yang R M, et al. Hypolipidemic activity of total phenylpropanoid glycosides from Ligustrum robustum(Roxb.)Blume and its mechanisms on AMPK pathway[J]. Chin Pharmacol Bull, 2017, 33(8): 1073-9. |
| [11] | Kim W S, Lee Y S, Cha S H, et al. Berberine improves lipid dysregulation in obesity by controlling central and peripheral AMPK activity[J]. Am J Physiol Endocrinol Metab, 2009, 296(4): E812-9. doi:10.1152/ajpendo.90710.2008 |
| [12] | Zhu X, Bian H, Gao X. The potential mechanisms of berberine in the treatment of nonalcoholic fatty liver disease[J]. Molecules, 2016, 21(10): pii:E1336. |
| [13] | 吴文君, 汤孙寅炎, 时俊锋, 等. 二甲双胍抑制SREBP-1c改善高脂诱导的骨骼肌胰岛素抵抗[J]. 中国药理学通报, 2016, 32(1): 55-9. Wu W J, Tang S Y Y, Shi J F, et al. Metformin ameliorates PA-induced skeletal muscle insulin resistance by suppressing SREBP-1c[J]. Chin Pharmacol Bull, 2016, 32(1): 55-9. |
| [14] | Foretz M, Hébrard S, Leclerc J, et al. Metformin inhibits hepatic gluconeogenesis in mice independently of the LKB1/AMPK pathway via a decrease in hepatic energy state[J]. J Clin Invest, 2010, 120(7): 2355-69. doi:10.1172/JCI40671 |
| [15] | Xu M, Xiao Y, Yin J, et al. Berberine promotes glucose consumption independently of AMP-activated protein kinase activation[J]. PLoS One, 2014, 9(7): e103702. |

