


肿瘤细胞耐药是引起肿瘤化疗失败的主要原因之一,虽然针对肿瘤治疗的药物持续被研发,但是现有的抗肿瘤药物的机制尚未被完全解析,因而在药物的临床使用上存在一定的干扰。特别是肿瘤细胞的耐药往往影响它们在临床上的使用,并加速了现有药物从一线往二线低走的趋势。阿霉素(adriamycin, ADM)是较为经典的乳腺癌治疗一线用药,进入细胞后主要通过插入DNA碱基对之间发挥细胞毒作用[1-3]。ADM自1974年经美国国家癌症研究所(NCI)批准临床使用以来,对急性粒细胞病变、恶性淋巴瘤、乳腺癌、肉瘤等的治疗效果明显,被美国食品药品监督管理局(FDA)评为最有效的抗肿瘤药物之一[4],而近来由于ADM的治疗引发的细胞耐药制约了其作为一线药物的使用。
载脂蛋白A-Ⅱ(apolipoprotein A-Ⅱ, APOA-Ⅱ)为高密度脂蛋白(high density lipoprotein, HDL)中含量第二多的蛋白[5],仅次于APOA-Ⅰ。APOA-Ⅰ介导胆固醇从外周组织到肝脏的“反向运输”,可以预防动脉粥样硬化[6];APOA-Ⅱ却会增加罹患动脉粥样硬化的可能性,并增加游离脂肪酸的含量、增加体脂、增加胰岛素抵抗[7]。APOA-Ⅰ与APOA-Ⅱ的比值决定了HDL的功能[8]。然而,为何同为HDL的主要成分,APOA-Ⅱ与APOA-Ⅰ的作用却如此迥异,这一机制依然是科学界的一大困扰。作者在药物作用靶点筛选过程中,发现高表达APOA-Ⅱ的细胞中核内的有效阿霉素含量大大减少,因而立足于APOA-Ⅱ与阿霉素耐药的关系展开研究,首次发现APOA-Ⅱ与阿霉素引起的乳腺癌耐药呈正相关,这对乳腺癌的阿霉素临床用药极具指导意义。
1 材料与方法 1.1 材料 1.1.1 细胞株HEK293细胞、乳腺癌细胞T47D、乳腺癌细胞MDA-MB231、乳腺癌亲本野生型细胞MCF7/W购自ATCC;阿霉素耐药乳腺癌细胞株MCF7/ADM为本实验室建株。
1.1.2 试剂DMEM培养基购自Gibco公司;0.05%胰酶-EDTA、双抗(青霉素、链霉素)购自上海吉诺公司;LipofectamineTM 2000、TRIzol试剂购自Invitrogene公司;胎牛血清(fetal bovine serum, FBS)购自杭州四季青;APOA-Ⅱ质粒、DDK抗体(clone OTI11C3)、APOA-Ⅱ抗体为Origene公司产品;Alexa Fluor 647标记的抗小鼠IgG购自Jackson’s lab; Cell Titer Blue购自Promega公司;阿霉素为浙江海正药业产品。
1.1.3 仪器酶标仪购自Tecan公司;NanoDrop 2000购自Thermo scientific公司;Leica TCS SP8激光共聚焦显微镜为德国Leica公司产品。
1.2 细胞培养HEK293细胞、MCF7/W和MCF7/ADM细胞均用含10% FBS和1%双抗的DMEM培养基作为培养液,MCF7/W和MCF7/ADM细胞培养时需补加终浓度为2 kU·L-1的胰岛素,为维持MCF7/ADM的耐药性状,培养时需加入终浓度2 mg·L-1的阿霉素,置于30℃、5% CO2的恒温培养箱培养。细胞消化传代时使用0.05%胰酶-EDTA。
1.3 细胞活力检测将对数生长期的细胞以5 000~8 000/孔接种到96孔细胞板中,24 h后将药物以2倍梯度稀释,每组3个复孔加入到细胞中,置于恒温培养箱继续培养48 h,每孔加入10 μL Cell Titer Blue,继续培养4 h,于酶标仪激发光560 nm,发射光590 nm检测荧光值,GraphPad Prism 5.0软件分析细胞对药物的IC50。
1.4 细胞转染将对数生长期的细胞接种于相应的细胞培养皿中,按照说明书的操作要求,细胞培养24 h融合度达60%~80%时,将培养液换成无血清、无双抗的DMEM基础培养基,再将一定量的LipofectamineTM 2 000及APOA-Ⅱ质粒于Opti-MEM培养基中混匀,室温静置15 min后加入到基础培养基中。置于恒温培养箱培养18~40 h。
1.5 激光共聚焦检测将对数生长期细胞接种于玻底共聚焦小皿,待细胞培养至对数生长期,加入2 mg·L-1阿霉素作用24 h,取出小皿,每皿加入200 μL细胞固定液(4%多聚甲醛),静置30 min。加入200 μL PBS,洗涤3次,每次10 min,加入封闭通透液(含5% BSA及0.1% Triton X-100的PBS溶液)处理1 h。加入PBS,洗涤3次。加入一抗常温孵育2 h,PBS洗涤3次,每次10 min;加入荧光二抗常温孵育1 h,PBS洗涤3次,每次10 min(加入荧光二抗后的操作过程避光进行);加入DAPI作用15 min,PBS洗涤3次,每次10 min,最后加入100 μL PBS,于激光共聚焦显微镜拍摄成像。
1.6 逆转录聚合酶链式反应(RT-PCR)加入一定量的TRIzol,按照说明书操作要求,提取细胞RNA,NanoDrop 2 000于A260检测RNA浓度,A260/A280检测RNA纯度,再以10%甲醛变性琼脂糖凝胶电泳检测RNA的完整性,按照TaKaRa逆转录试剂盒进行逆转录。PCR扩增APOA-Ⅱ引物序列:5′-ACCGTGACTGACTATGGCAA-3′、5′-CAGGCTGTGTTCCAAGTTCC-3′;内参β-actin引物序列:5′-CTGGCCGGGACCTGACT-3′、5′-TCCTTAATGTCACGCACGATTT-3′。PCR产物经1.5%琼脂糖电泳,紫外灯凝胶成像系统拍照,Image J分析各PCR条带灰度值。
1.7 Western blot检测蛋白表达0.05%胰酶消化收集细胞后,PBS离心法洗涤3次,每次3 min,500×g,4℃,弃上清。向所得细胞沉淀内加入RIPA细胞裂解液,置于冰上裂解10 min,其间振荡器数次混匀,12 000×g,4℃离心15 min,取上清即为所得蛋白,NanoDrop 2 000检测蛋白浓度,取实验所需量的蛋白液,用RIPA调整至相同浓度,加入上样缓冲液于100℃热变性5 min,进行SDS-PAGE凝胶电泳后,取出凝胶进行转膜(100 V,60 min),取出PVDF膜,加含5%脱脂奶粉的TBST封闭1 h,取出PVDF膜,TBST洗涤3次,每次5 min,加入一抗4℃孵育过夜,TBST洗涤3次,每次5 min,加入二抗37℃孵育1 h,TBST洗涤3次,每次10 min。按照ECL显色说明书要求进行显色,于成像仪进行拍照。Image J分析各条带灰度值。
1.8 统计学处理所有数据均用GraphPad Prism 5.0分析,数据结果以x±s表示,组间比较采用t检验。
2 结果 2.1 MCF7/ADM细胞对阿霉素耐药由Fig 1可见,亲本细胞MCF7/W对阿霉素的IC50为8.0 mg·L-1,而MCF7/ADM细胞对阿霉素的IC50则达到104.3 mg·L-1,耐药指数达13.0(P<0.05)。
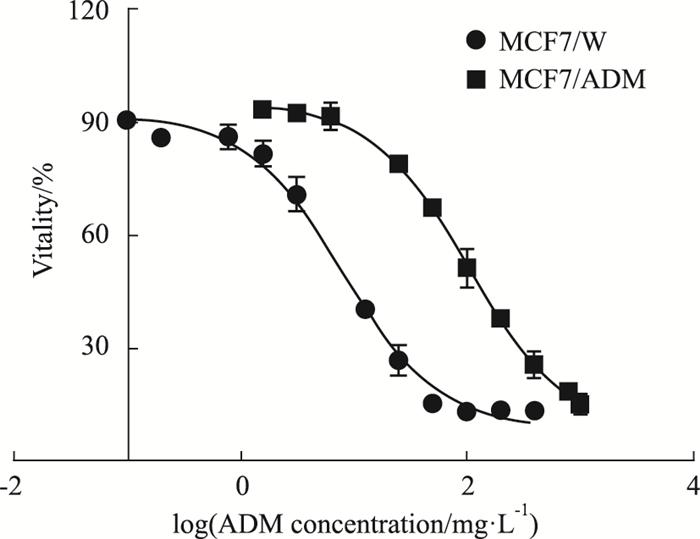
|
| Fig 1 IC50 assay of MCF7/W and MCF7/ADM cell to ADM |
由Fig 2可见,在MCF7/W细胞中阿霉素主要呈细胞核分布,胞质中几乎无分布;而耐药细胞MCF7/ADM中阿霉素则在细胞核中几乎无分布。阿霉素的细胞毒性主要是通过进入细胞核,插入DNA碱基对之间而发挥作用的,耐药细胞中阿霉素的非核分布说明阿霉素并未发挥该细胞毒作用,因而无法进一步介导细胞死亡。
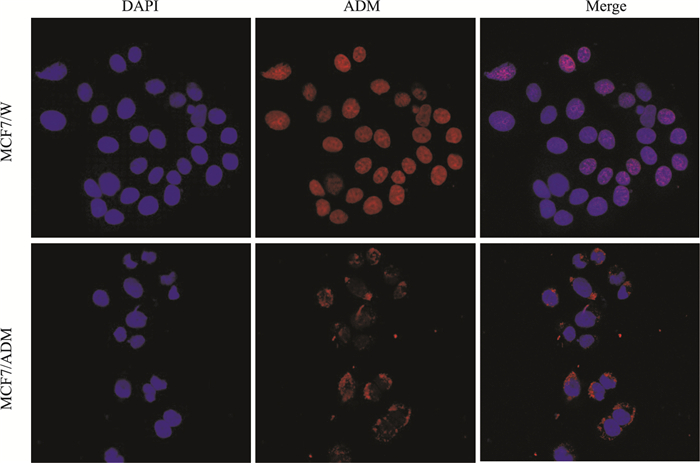
|
| Fig 2 Differences of localization of ADM in MCF7/W and MCF7/ADM cells (scale bar=30 μm) Cells were treated with ADM (2 mg·L-1) for 24 h, and the nuclei were stained with DAPI (blue). Localization of ADM (red) was observed by laser scanning confocal microscopy in MCF7/W and MCF7/ADM cells. |
用于转染MCF7/W的APOA-Ⅱ质粒中带有DDK(DYKDDDDDK)末端的标签多肽。细胞转染APOA质粒后,用DDK抗体作为一抗进行孵育。由Fig 3可见,转染APOA-Ⅱ后高表达的MCF7/W细胞,与未转染APOA-Ⅱ的细胞相比,细胞核中阿霉素的含量明显减少。说明APOA-Ⅱ可能与阿霉素入核以及阿霉素的药效相关。
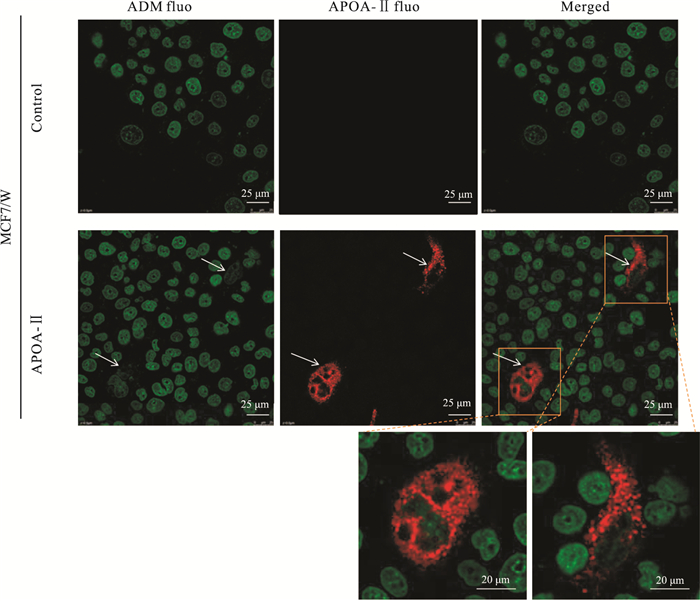
|
| Fig 3 Decrease of content of ADM in APOA-Ⅱ transgenic MCF7/W cells MCF7/W cells were transfected with APOA-Ⅱ (contained DDK tail), and the cells transfected with empty vector of APOA-Ⅱ were set as negative control. Then the transfected cells were treated with ADM (2 mg·L-1) for 24 h. The localization of ADM (green) were observed by laser scanning confocal microscopy, APOA-Ⅱ was labeled by a primary mouse anti-DDK aitibody and Alexa Fluor 647 conjugated anti-mouse IgG (red). The white arrows mean cells with high expression of APOA-Ⅱ. |
Fig 4A的RT-PCR检测结果显示,耐药细胞MCF7/ADM中的APOA-Ⅱ的mRNA表达水平明显高于MCF7/W野生型细胞(P<0.05);同时,Fig 4B的Western blot检测表明,耐药细胞中APOA-Ⅱ蛋白的表达也明显高于耐药细胞(P<0.05)。说明APOA-Ⅱ可能与阿霉素引起的细胞耐药相关。
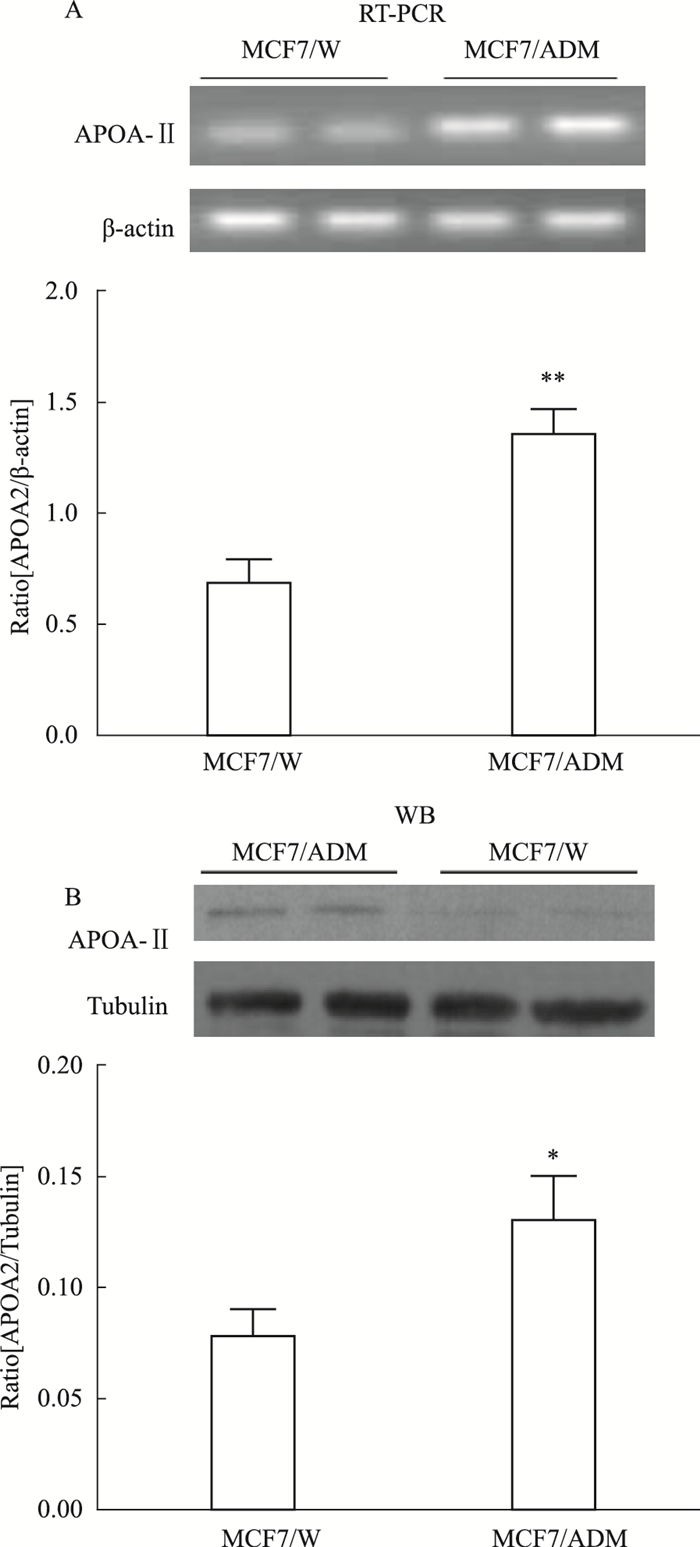
|
| Fig 4 The higher expression level of APOA-Ⅱ in resistant MCF7/ADM cells A:RT-PCR assay of APOA-Ⅱ in MCF7/W and MCF7/ADM cells; B:Western blot assay of APOA-Ⅱ in MCF7/W and MCF7/ADM cells. *P < 0.05, **P < 0.01 vs MCF7/W. |
如Fig 5所示,将APOA-Ⅱ基因转染进HEK293细胞,APOA-Ⅱ在HEK293细胞中瞬时高表达,加入梯度稀释的阿霉素作用48 h后,APOA-Ⅱ高表达的HEK293细胞与正常的HEK293细胞相比,对阿霉素的IC50从0.13 mg·L-1增加至0.38 mg·L-1(P<0.05),药敏性降低,说明APOA-Ⅱ与细胞对阿霉素的药敏性以及细胞对阿霉素的耐药相关。
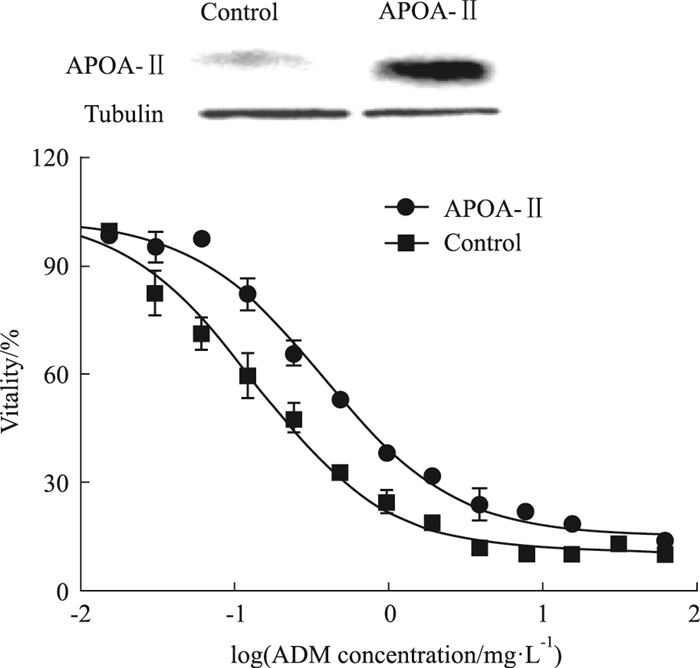
|
| Fig 5 IC50 assay of APOA-Ⅱ transgenic HEK293 cells and parent control HEK293 cells to ADM Western blot assay showed the protein expression levels of transfected APOA-Ⅱ in HEK293 cells, untransfected HEK293 cells were set as negative control. |
将APOA-Ⅱ基因转染进乳腺癌细胞T47D和MDA-MB231,细胞内APOA-Ⅱ蛋白的表达水平提高,细胞的药敏性随之提高,其中T47D细胞对阿霉素的IC50从0.11 mg·L-1增加到0.23 mg·L-1(Fig 6A),MDA-MB231细胞对阿霉素的IC50从0.16 mg·L-1增加到0.59 mg·L-1(Fig 6B)(P<0.05),说明APOA-Ⅱ与乳腺癌细胞对阿霉素的药敏性相关。
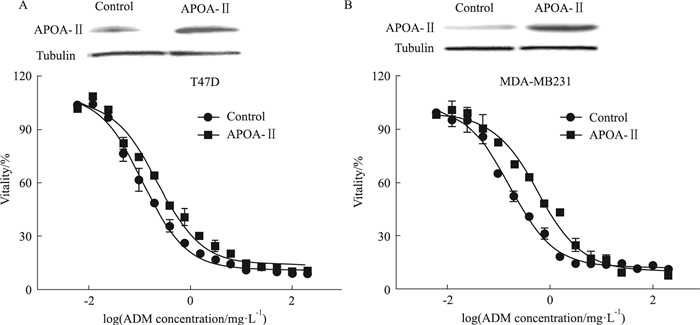
|
| Fig 6 IC50 assay of APOA-Ⅱ transgenic T47D cells (A) and MDA-MB231 cells (B) to ADM Western blotting showed the protein expression levels of transfected APOA-Ⅱ in cells, untransfected cells were set as negative control. |
每年全世界约有1 380万的新增乳腺癌病例以及45.8万的死亡病例,是导致女性死亡最主要的癌症[9]。虽然乳腺癌的治疗已经有多种针对性治疗方案,但对于高风险以及免疫治疗或分子生物疗法无效的乳腺癌,传统的化疗药物治疗依然是首选。与此同时,即使接受了分子生物学疗法(内分泌疗法、曲妥单抗),60%的患者仍然将化疗作为辅助治疗[10]。作为一种主要的治疗方法,化疗药物对90%原发性乳腺癌的治疗都是有效的,然而一段时间后,对这些化学治疗的抗癌药物的耐药性则可能会出现[11]。反复暴露于单一抗肿瘤药物通常会导致乳腺癌对同一类的某些药物或不同类别的药剂的交叉抗性,最终导致化疗治疗的失败。但耐药性的机制仍未得到充分解析,这已经成为乳腺癌治疗面临的主要临床问题。
蒽环类药物是化疗治疗的首选,阿霉素是最为常用的乳腺癌化疗药物之一[12]。此前的实验中,我们利用了含17 950个蛋白的芯片对阿霉素进行了结合靶点筛选,并获取了芯片上的14种阳性结合蛋白的质粒[13],再进一步将质粒转染于MCF7/W细胞中,并观察ADM的结合分布情况。结果发现,分别转染了14种基因的MCF7/W细胞中,凡转染有APOA-Ⅱ基因的细胞,细胞核内ADM的含量均减少,无法进入细胞核的ADM则难以发挥细胞毒性,这与细胞的ADM在耐药细胞MCF7/ADM中的分布类似,因而我们对APOA-Ⅱ与乳腺癌耐药的相关性进行了进一步研究。结果表明,APOA-Ⅱ蛋白在细胞中的表达与ADM耐药相关,APOA-Ⅱ在细胞中的表达量与细胞对ADM的药敏性呈负相关。高表达APOA-Ⅱ可导致MCF7/W细胞内ADM含量的减少,并可以导致HEK293细胞及乳腺癌细胞MDA-MB231、T47D对ADM IC50的增加。
APOA-Ⅱ与ADM耐药的关系目前还未见报道,有研究表明,APOA-Ⅱ过表达的小鼠影响了HDL在抗动脉粥样硬化方面的两大功能——胆固醇反相运输以及对低密度脂蛋白(low density lipoprotein, LDL)氧化变性的保护作用[14]。APOA-Ⅱ的基因水平已经成为HDL胆固醇体内浓度的决定因素[15]。APOA-Ⅱ基因的定位可以决定游离脂肪酸在血浆中的水平,同时2型糖尿病也与APOA-Ⅱ相关,APOA-Ⅱ甚至可以作为2型糖尿病发生的基因标志[6]。因而乳腺癌ADM临床用药时推荐根据体脂情况、有无糖尿病、有无动脉粥样硬化等,结合APOA-Ⅱ基因检测进行用药,可以增强药物的有效性。文中所用的阿霉素为兼性离子,在非极性方面的性质与胆固醇类似,载脂蛋白APOA-Ⅱ也与胆固醇运输相关,因而阿霉素与APOA-Ⅱ之间的关系是否类同于与胆固醇之间的关系尚未可知,课题组接下来准备用其他极性的药物来验证,是否APOA-Ⅱ亦可引发极性的药物与非极性的药物的耐药,即APOA-Ⅱ是否引发多药耐药。
( 致谢: 感谢OriGene公司前期提供的蛋白芯片技术支持及后期实验相关的试剂及技术支持,感谢参与本实验的所有老师和同学们。)
| [1] | Agudelo D, Bourassa P, Bérubé G, et al. Review on the binding of anticancer drug doxorubicin with DNA and tRNA:Structural models andantitumor activity[J]. J Photochem Photobiol B, 2016, 158: 274-9. doi:10.1016/j.jphotobiol.2016.02.032 |
| [2] | Tacar O, Sriamornsak P, Dass C R. Doxorubicin:an update on anticancer molecular action, toxicity and novel drug delivery systems[J]. J Pharm Pharmacol, 2013, 65(2): 157-70. doi:10.1111/j.2042-7158.2012.01567.x |
| [3] | 孙凤姣, 张译丹, 张密霞, 等. β-AR/PKA/CaMKⅡ信号通路在阿霉素诱导大鼠心肌细胞凋亡中的作用[J]. 中国药理学通报, 2017, 33(3): 360-5. Sun F J, Zhang Y D, Zhang M X, et al. Roles of β-AR/PKA/CaMKⅡ signaling pathway in cardiomyocyte apoptosis induced by adriamycin in rats[J]. Chin Pharmacol Bull, 2017, 33(3): 360-5. |
| [4] | 蔡燕飞, 陈蕴, 朱瑞宇, 等. 耐阿霉素人乳腺癌细胞MCF-7/ADM钙稳态失调及其机制研究[J]. 中国药理学通报, 2013, 29(6): 863-7. Cai Y F, Chen Y, Zhu R Y, et al. Study on calcium homeostasis disorders of adriamycin resistant human breast cancer cells MCF-7/ADM and its mechanism[J]. Chin Pharmacol Bull, 2013, 29(6): 863-7. |
| [5] | Blanco-Vaca F, Escolà-Gil J C, Martín-Campos J M, et al. Role of apoA-Ⅱ in lipid metabolism and atherosclerosis:advances in the study of an enigmatic protein[J]. J Lipid Res, 2001, 42(11): 1727-39. |
| [6] | Julve J, Escolà-Gil J C, Marzal-Casacuberta A, et al. Increased production of very-low-density lipoproteins in transgenic mice overexpressing human apolipoprotein A-Ⅱ and fed with a high-fat diet[J]. Biochim Biophys Acta, 2000, 1488(3): 233-44. |
| [7] | Castellani L W, Lusis A J. ApoA-Ⅱ versus ApoA-Ⅰ:two for one is not always a good deal[J]. Arterioscler Thromb Vasc Biol, 2001, 21(12): 1870-2. |
| [8] | Hedrick C C, Castellani L W, Wong H, et al. In vivo interactions of apoA-Ⅱ, apoA-Ⅰ, and hepatic lipase contributing to HDL structure and antiatherogenic functions[J]. J Lipid Res, 2001, 42(4): 563-70. |
| [9] | 虞林玉, 李慕鹏, 旷达彬, 等. 肿瘤免疫治疗新策略[J]. 中国药理学通报, 2016, 32(8): 1037-40. Yu L Y, Li M P, Kuang D B, et al. New immunotherapy strategies in breast cancer[J]. Chin Pharmacol Bull, 2016, 32(8): 1037-40. |
| [10] | 袁立明, 马楠, 曹交欢, 等. 顺铂加重乳腺癌MCF-7细胞D NA损伤促凋亡的研究[J]. 中国药理学通报, 2017, 33(3): 334-7. Yuan L M, Ma N, Cao J H, et al. Study of cisplatin aggravating DNA damage and causing a high apoptosis rate on breast cancer MCF-7 cells[J]. Chin Pharmacol Bull, 2017, 33(3): 334-7. |
| [11] | 于存治, 戚新明, 任进. 靶向乳腺癌耐药蛋白逆转肿瘤耐药:研究进展与药物开发[J]. 中国药理学通报, 2014, 30(5): 615-8. Yu C Z, Qi X M, Ren J. BCRP-targeted reverse of multidrug resistance:research progress and drug development[J]. Chin Pharmacol Bull, 2014, 30(5): 615-8. |
| [12] | Romano S, Nappo G, Calì G, et al. Synergy between enzastaurin doxorubicin in inducing melanoma apoptosis[J]. Pigment Cell Melanoma Res, 2013, 26(6): 900-11. doi:10.1111/pcmr.2013.26.issue-6 |
| [13] | Chen S, Wang X, Ye X, et al. Identification of human UMP/CMP kinase 1 as doxorubicin binding target using protein microarray[J]. J Biomol Screen, 2017, 22(8): 1007-15. |
| [14] | Smith L E, Segrest J P, Davidson W S. Helical domains that mediate lipid solubilization and ABCA1-specific cholesterol efflux in apolipoproteins C-Ⅰ and A-Ⅱ[J]. J Lipid Res, 2013, 54(7): 1939-48. doi:10.1194/jlr.M037903 |
| [15] | Castellani L W, Nguyen C N, Charugundla S, et al. Apolipoprotein AⅡ is a regulator of very low density lipoprotein metabolism and insulin resistance[J]. J Biol Chem, 2008, 283(17): 11633-44. doi:10.1074/jbc.M708995200 |

