


胃肠黏膜通过上皮细胞迁移、增殖、分化、凋亡等以维持黏膜完整性的动态平衡, 胃肠黏膜是人体更新速度最快的组织, 胃肠上皮细胞增殖是维持胃肠黏膜完整性的生理特征之一[1]。检测细胞增殖的方法包括间接观察DNA合成含量和直接检测细胞代谢活性等。检测细胞存活状况的方法有3H-TdR参入法、MTT法、WST法、CCK-8法等, 但这些方法都不能实时动态地观察细胞生长情况, 且受多种因素的影响[2]。实时细胞分析仪(real-time cell analyzer, RTCA)是实时观察细胞贴壁状态的电感应仪, 细胞贴壁于E-Plate板底部时, 其电极电阻值会发生相应变化, 并转化为细胞生长指数[3], 可通过细胞指数曲线的方式实时观察细胞生长(主要是增殖)情况, 且较少受其它因素干扰。表皮生长因子(epidermal growth factor, EGF)可刺激细胞生长因子受体酪氨酸磷酸化以促进细胞增殖, 在胃肠道, EGF可增加上皮细胞鸟氨酸脱羧酶(ornithine decarboxylase, ODC)活性, 刺激黏膜DNA合成, 维持胃肠黏膜上皮正常功能[4]。本实验以RTCA建立小肠上皮细胞(IEC-6)生长模型, 以EGF作为促进细胞生长的工具药, 观察不同培养条件对IEC-6细胞生长的影响及EGF的药效, 为建立IEC-6细胞增殖药理实验模型提供参考。
1 材料 1.1 试剂重组人EGF(批号0815AFC05, 美国Peprotech公司); 胎牛血清(批号1671324)、高糖DMEM(批号8115346)、双抗Pen Strep(批号1677648), 均为美国Gibco公司产品; 海藻糖D-Trehalose(分子质量:378.33, 批号T-5251, 美国Sigma公司); 其他试剂均为分析纯。
1.2 仪器xCELLigence RTCA DP(实时动态细胞分析仪)、E-Plate 16(批号20140224), 均为瑞士罗氏公司产品; 3111型CO2培养箱(美国Thermo Scientific公司)。
1.3 细胞大鼠小肠隐窝细胞(IEC-6)购自American Type Culture Collection(ATCC), 批号58541019。选择22~24代细胞进行实验。
2 方法 2.1 EGF的配制EGF试剂开盖前先离心试剂管(10 000 r·min-1, 30 s), 加灭菌超纯水200 μL到该试剂管, 静置5 min使其充分溶解, 再加80 μL含5%海藻糖的PBS溶液, 配成终浓度0.1 g·L-1的EGF, 分装, -20 ℃冻存备用。后续稀释EGF时, 均用含5%海藻糖的PBS溶液。
2.2 细胞培养IEC-6细胞以2×104 cells/cm2接种于25 cm2培养瓶, 培养基为高糖DMEM含10% FBS和1%双抗; 培养条件为37℃, 饱和湿度, 5% CO2。细胞生长至80%~90%时, 以每孔1×104个细胞接种于E-Plate 16板, 每孔加入200 μL含10%血清和1%双抗的DMEM, 培养24 h后, 培养液换成200 μL无血清DMEM继续培养20 h(即血清饥饿20 h)。
2.3 统计学方法所有统计结果均采用x±s表示, 结果“3.5”用独立样本t检验, 其余实验均采用单因素方差分析, 统计软件用SPSS 17.0。
3 结果 3.1 10%血清浓度时EGF对细胞生长的影响按“2.2”培养方法, 血清饥饿20 h后, 每孔更换200 μL培养液; 空白对照组为含10%血清的DMEM 200 μL, 受试药组分别加入终浓度为1、10、100 μg·L-1 EGF的10%血清的DMEM 200 μL, 每组3个复孔, 分别观察给药后24、48、72 h细胞指数(cell index, CI); 各组细胞指数及其生长曲线图由仪器配套软件自动计算并导出。由Fig 1、Tab 1结果可见, 细胞加药后24、48、72 h, EGF各剂量组细胞指数与空白组比较均P>0.05, 表明EGF在10%血清浓度时对细胞生长无明显影响。提示培养液含10%血清时, 不能反映EGF促进细胞生长的药效。
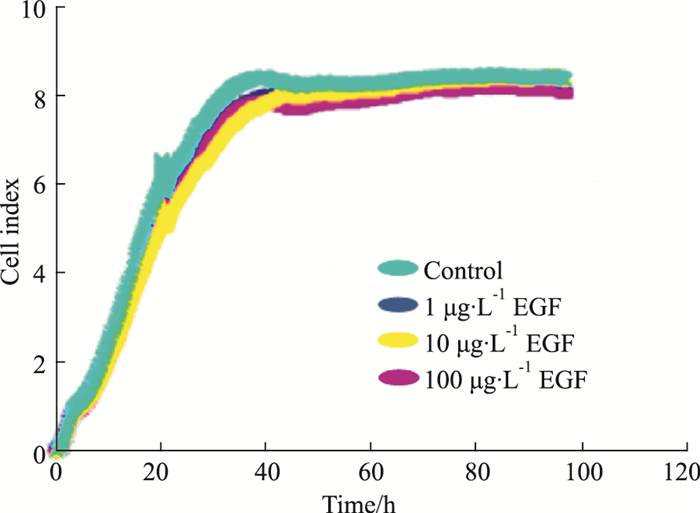
|
| Fig 1 Efficacy of EGF on cell growth under serum concentration of 10% |
| Group | Concentration/μg·L-1 | Cell index | |||
| 0 h | 24 h | 48 h | 72 h | ||
| Control | - | 5.99±0.93 | 8.15±0.38 | 8.08±0.26 | 8.02±0.23 |
| EGF | 1 | 6.34±0.61 | 7.79±0.49 | 8.17±0.22 | 8.12±0.08 |
| 10 | 5.90±0.97 | 8.05±0.48 | 8.32±0.20 | 8.38±0.10 | |
| 100 | 6.31±1.06 | 8.25±0.41 | 8.42±0.20 | 8.39±0.07 | |
按“2.2”培养方法, 血清饥饿20 h后, 每孔更换200 μL DMEM; “5%血清空白组”为培养液加入含5%血清的DMEM, “0%血清空白组”加入不含血清的DMEM, 给药组分别加入含终浓度1、10、100 μg·L-1 EGF的不含血清DMEM; 每组3个复孔, 观察给药后24、48、72 h细胞生长指数。由Fig 2、Tab 2结果可见, 无血清培养可致细胞生长明显抑制(0%血清空白组细胞指数与5%血清空白组比较, 在24、48、72 h均P < 0.01);EGF对无血清培养所致的细胞生长抑制有一定改善作用(1、10 μg·L-1的EGF组与0%血清空白组比较, 细胞指数在48、72 h均P < 0.01), 说明EGF对细胞的生长有促进作用, 但不能使其恢复至正常水平(与5%血清组比较, 均P < 0.01)。提示培养液不含血清时, 不能较好反映EGF促进细胞生长的药效。Fig 2结果还提示, 5%血清能较好维持细胞生长, 但也不利于体现EGF促进细胞生长的药效, 应适当调低血清浓度, 以利于反映EGF药效。
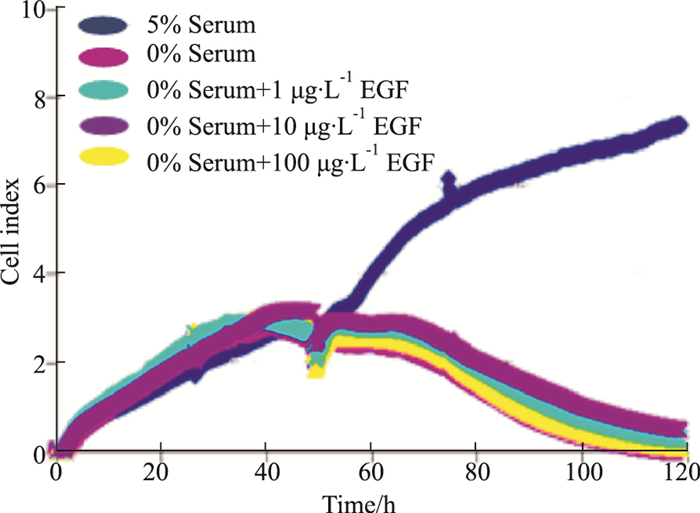
|
| Fig 2 Efficacy of EGF on cell growth under serum concentration of 0% |
| Group | Concentration/μg·L-1 | Cell index | |||
| 0 h | 24 h | 48 h | 72 h | ||
| 5% serum | - | 2.85±0.68 | 5.45±0.99 | 6.65±0.64 | 7.38±0.51 |
| 0% serum | - | 2.43±0.25 | 2.04±0.11## | 0.48±0.13## | -0.01±0.10## |
| 0% serum+EGF | 1 | 2.46±0.28 | 2.45±0.12## | 0.86±0.13##** | 0.28±0.04##** |
| 10 | 2.85±0.08 | 2.55±0.29## | 1.17±0.19##** | 0.48±0.11##** | |
| 100 | 2.41±0.26 | 2.18±0.24## | 0.53±0.07## | 0.08±0.02## | |
| ##P < 0.01 vs 5% serum group; **P < 0.01 vs serum-free group | |||||
按“2.2”培养方法, 血清饥饿20 h后, 每孔更换200μL DMEM, 设0%、0.5%、1%血清浓度组, 每组3个复孔, 观察加入不同浓度血清培养24、48、72 h后细胞生长指数。由Fig 3、Tab 3结果可见, 不同浓度血清可致细胞生长产生明显差异。无血清培养(0%血清)可明显抑制细胞生长; 1%血清浓度可维持细胞指数处于上升阶段约48 h, 后续则细胞指数逐渐下降; 0.5%血清浓度可维持细胞指数处于上升或平台阶段约36 h, 后续则细胞指数逐渐下降。提示0.5%血清既不会对细胞生长产生明显抑制, 也不会由于促进细胞生长时间较长而不利于反映EGF药效。
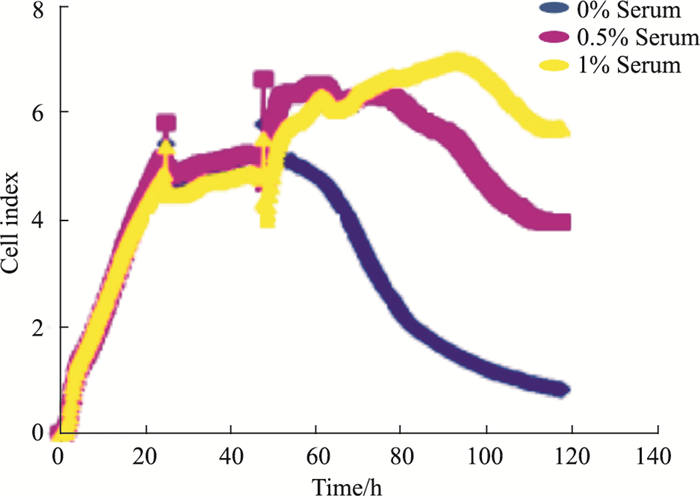
|
| Fig 3 Efficacy of different serum concentrations on cell growth |
| Group | Cell index | |||
| 0 h | 24 h | 48 h | 72 h | |
| 0% serum | 4.98±0.17 | 3.25±0.17 | 1.34±0.07 | 0.83±0.06 |
| 0.5% serum | 4.67±0.98 | 6.33±0.47** | 5.08±0.73** | 3.96±0.68** |
| 1% serum | 4.02±0.35 | 6.47±0.05** | 6.88±0.08** | 5.72±0.20** |
| **P < 0.01 vs serum-free group | ||||
按“2.2”培养方法, 血清饥饿20 h后, 每孔更换200 μL培养液; 空白对照组为含0.5%血清的DMEM, 受试药组为在含0.5%血清的DMEM中分别加入EGF, 使其终浓度为1、10、50、100 μg·L-1。每组3个复孔, 观察加药24、48、72 h后细胞生长指数。由Fig 4、Tab 4可见, 加药24 h内, EGF各剂量组与空白对照组生长曲线基本相似(加药24 h时EGF各组细胞指数与空白对照组比较均P>0.05);加药48~72 h, 空白对照组细胞生长曲线明显下降, EGF 1、10 μg·L-1组细胞生长曲线基本维持在平台期, EGF 50、100 μg·L-1组细胞生长曲线则缓慢下降, EGF各组细胞指数与空白组比较均P < 0.01。提示0.5%血清培养时可体现EGF促进细胞生长的药效, 其中1、10 μg·L-1组药效较优; 为进一步验证实验结果, 选择EGF(10 μg·L-1)进行重复实验。
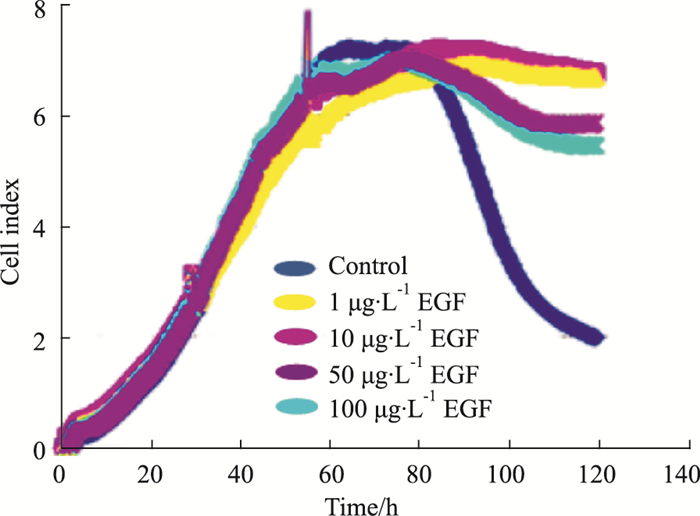
|
| Fig 4 Efficacy of EGF on cell growth under serum concentration of 0.5% |
| Group | Concentration/μg·L-1 | Cell index | |||
| 0 h | 24 h | 48 h | 72 h | ||
| Control | - | 6.77±0.25 | 6.47±1.22 | 2.01±1.09 | 1.70±1.38 |
| EGF | 1 | 5.92±0.64 | 6.77±0.88 | 6.75±0.55** | 6.71±0.44** |
| 10 | 6.52±1.15 | 7.20±1.58 | 6.94±0.49** | 6.78±0.44** | |
| 50 | 6.60±0.35 | 6.93±0.17 | 5.88±0.48** | 5.89±0.50** | |
| 100 | 6.73±0.25 | 6.84±0.75 | 5.65±1.32** | 5.47±1.05** | |
| **P < 0.01 vs control | |||||
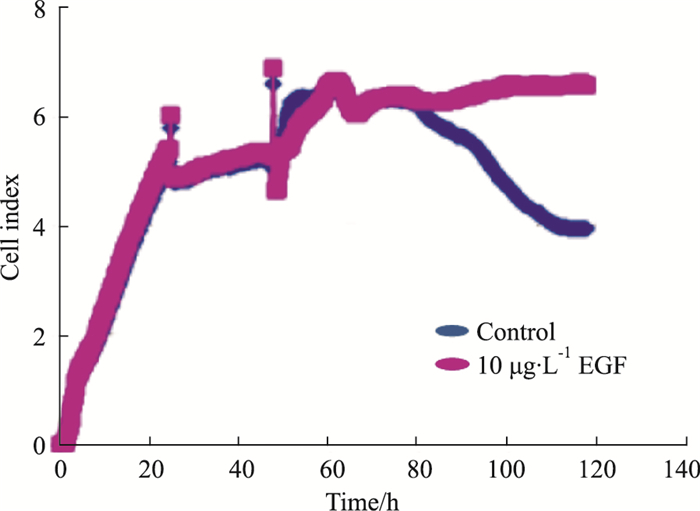
按“2.2”培养方法, 血清饥饿20 h后, 每孔更换200 μL培养液, 空白对照组为含0.5%血清的DMEM, 受试药组在含0.5%血清的DMEM中加入EGF, 使其终浓度为10 μg·L-1。每组3个复孔, 观察加药24、48、72 h后细胞生长指数。由Fig 5、Tab 5结果可见, 加药48 h后, 空白对照组细胞生长曲线明显下降, EGF组(10 μg·L-1)细胞生长曲线基本维持在平台期, 加药48、72 h时, EGF组生长指数与空白对照组比较P < 0.05或P < 0.01, 与Fig 4、Tab 4的实验结果相似, 重复验证了0.5%血清浓度时可反映EGF促进细胞生长药效的结果。
|
| Fig 5 Efficacy of EGF(10 μg·L-1)on cell growth under serum concentration of 0.5% |
| Group | Concentration/μg·L-1 | Cell index | |||
| 0 h | 24 h | 48 h | 72 h | ||
| Control | - | 4.67±0.98 | 6.33±0.47 | 5.10±0.71 | 3.96±0.68 |
| EGF | 10 | 4.66±0.84 | 6.35±0.10 | 6.49±0.20* | 6.57±0.23** |
| *P < 0.05, **P < 0.01 vs control | |||||
胃肠黏膜具有消化、吸收、分泌和免疫屏障等功能, 细胞增殖是维持胃肠黏膜完整性和正常功能的重要因素, 也是胃肠黏膜损伤修复的重要环节[5]。促进上皮细胞增殖是胃肠黏膜损伤修复药物如益气健脾中药白术、黄芪等的药理作用之一[6]。本课题组以RTCA检测白术多糖对IEC-6细胞生长的影响, 结果发现在培养液含10%血清条件下, 白术多糖促进细胞增殖的作用较弱[7], 与本实验Fig 1和Tab 1结果相似, 即在培养液含10%血清时, 较难反映受试药促进细胞增殖的作用。对IEC-6细胞的研究表明, 无血清培养24 h后, 培养液再加入5%血清, 可通过增加细胞多胺和DNA合成等途径, 促进细胞增殖[8], 表明培养液所含血清是促进细胞增殖的因素之一, 因此, 可能对受试药的药效结果产生干扰。本实验观察不同实验条件(包括血清浓度)对细胞生长的影响, 为建立适合反映受试药对细胞增殖影响的药理模型提供参考。
本实验结果表明, 血清浓度较高时(5%~10%血清), 由于血清本身对细胞增殖的促进作用, 可能会掩盖受试药(如EGF)促进细胞增殖的药效; 而培养液不含血清时(0%血清), 由于细胞增殖受到明显抑制, 也不利于较好体现受试药促进细胞增殖的药效; 而血清浓度0.5%左右时, 较有利于体现受试药对细胞增殖的影响。综上结果, 本实验在实时细胞分析仪建立IEC-6细胞生长(增殖)药理实验模型的参考方案为:细胞以含10%血清培养24 h, 再无血清培养(即血清饥饿)20 h, 然后加受试药, 并以含0.5%血清培养48~72 h, 可观察到受试药对细胞生长(增殖)影响的药效。
目前, 常用的检测细胞增殖方法如3H-TdR参入法、MTT法、WST法、CCK-8法等[9], 都是检测特定时间点细胞增殖的情况, 而RTCA采用电子阻抗技术检测贴壁细胞黏附于E-plate板底部时电阻值的变化, 并将变化的电阻值转换为细胞指数, 从而可在数十甚至数百小时中, 动态反映细胞生长(增殖)等情况[3], 避免了仅进行单个时间点观察药效的缺点, 可以动态观察受试药对细胞增殖的影响, 是细胞药理实验的较好方法[10]。
本课题组在小肠上皮细胞(IEC-6)建立了细胞迁移药理实验模型[11], 以柱前衍生高效液相色谱法建立了检测IEC-6细胞多胺含量的方法[12], 以流式细胞仪建立了IEC-6细胞膜电位检测方法[13], 并观察了益气健脾中药通过影响多胺信号通路而促进细胞迁移的作用[14]。本实验又以实时细胞分析仪建立了IEC-6细胞增殖药理实验模型, 为更好地探讨受试药(如益气健脾中药)的药理作用提供参考。
( 致谢: 本实验是在国家中医药管理局三级实验室“中药药理(消化)实验室”(由广州中医药大学脾胃研究所建设)和广州中医药大学国家重点学科“中医内科学”实验室(脾胃研究所是该学科组成部分)完成, 在此对实验室各位同学和老师表示感谢!)
| [1] | Liu L, Ouyang M, Rao J N, et al. Competition between RNA-binding proteins CELF1 and HuR modulates MYC translation and intestinal epithelium renewal[J]. Mol Biol Cell, 2015, 26(10): 1797-810. doi:10.1091/mbc.E14-11-1500 |
| [2] | 石淙, 万腊根. 细胞增殖的检测方法[J]. 实验与检验医学, 2012, 45(2): 153-5. Shi C, Wan L G. The detection method of cell proliferation[J]. Exp Lab Med, 2012, 45(2): 153-5. |
| [3] | Rakers S, Imse F, Gebert M. Real-time cell analysis:sensitivity of different vertebrate cell cultures to copper sulfate measured by xCELLigence®[J]. Ecotoxicology, 2014, 23(8): 1582-91. doi:10.1007/s10646-014-1279-6 |
| [4] | 廖小金. 表皮生长因子结构和生物学效应[J]. 海峡药学, 2006, 18(5): 14-7. Liao X J. Epidermal growth factor structure and biological effects[J]. Strait Pharm J, 2006, 18(5): 14-7. |
| [5] | Gao J H, Guo L J, Huang Z Y, et al. Roles of cellular polyamines in mucosal healing in the gastrointestinal tract[J]. J Physiol Pharmacol, 2013, 64(6): 681-93. |
| [6] | 胡灿, 李茹柳, 莫全毅, 等. 白术和黄芪不同提取部位对小肠上皮细胞增殖的影响[J]. 中药新药与临床药理, 2010, 21(2): 156-60. Hu C, Li R L, Mo Q Y, et al. Effects of different extract parts from Rhizoma atractylodis macrocephalae and Radix astragali on proliferation of intestinal epithelial cells[J]. Tradit Chin Drug Res Clin Pharmacol, 2010, 21(2): 156-60. |
| [7] | 王一寓, 李茹柳, 宋厚盼, 等. 白术多糖提取物对IEC-6细胞迁移及细胞生长的影响[J]. 中药药理与临床, 2014, 30(4): 51-4. Wang Y Y, Li R L, Song H P, et al. The effect of polysaccharides from Atractylodes macrocephala on IEC-6 cell migration and growth[J]. Tradit Chin Drug Res Clin Pharmacol, 2014, 30(4): 51-4. |
| [8] | Liu L, Li L, Rao J N, et al. Polyamine-modulated expression of c-myc plays a critical role in stimulation of normal intestinal epithelial cell proliferation[J]. Am J Physiol Cell Physiol, 2005, 288(1): C89-9. doi:10.1152/ajpcell.00326.2004 |
| [9] | 苏程程, 向国安, 马永强, 等. 基于5-乙炔基-2'-脱氧尿苷参入法的不同细胞增殖检测方法比较[J]. 武警后勤学院学报(医学版), 2016, 25(1): 21-4. Su C C, Xiang G A, Ma Y Q, et al. Comparison of different cell proliferation detection methods based on 5-acetylene-2'-deoxyuridine infiltration method[J]. J Logist Univ PAP(Med Sci), 2016, 25(1): 21-4. |
| [10] | 侯雪芹, 张晓晶, 王奇, 等. 体外抗AD药物筛选中MTT、Edu和RTCA法的比较研究[J]. 时珍国医国药, 2015, 26(3): 741-3. Hou X Q, Zhang X J, Wang Q, et al. Comparative study of MTT Edu and RTCA in vitro anti-AD drug screening[J]. Lishizhen Med Mater Med Res, 2015, 26(3): 741-3. |
| [11] | Hu C, Li R L, Lu W B, et al. Studies on cell migration model in intestinal epithelial restitution for pharmacological research[J]. J Chin Med Mater, 2011, 34(5): 738-46. |
| [12] | 随晶晶, 卢文彪, 李茹柳, 等. 高效液相色谱法检测小肠上皮细胞多胺含量[J]. 中国药理学通报, 2011, 27(9): 1309-12. Sui J J, Lu W B, Li R L, et al. Determination of polyamines in rat intestinal epithelial cell line IEC-6 by RP-HPLC[J]. Chin Pharmacol Bull, 2011, 27(9): 1309-12. |
| [13] | 宋厚盼, 李茹柳, 王一寓, 等. 小肠上皮细胞迁移过程中膜电位检测方法的建立及应用[J]. 中国药理学通报, 2013, 29(12): 1758-61. Song H P, Li R L, Wang Y Y, et al. Establishment and application of membrane potential detection method for intestinal epithelial cell migration[J]. Chin Pharmacol Bull, 2013, 29(12): 1758-61. doi:10.3969/j.issn.1001-1978.2013.12.030 |
| [14] | 李茹柳, 陶玉珠, 曾丹, 等. 党参、甘草糖提取物对小肠上皮细胞迁移多胺信号通路的影响[J]. 中国药理学通报, 2016, 32(2): 245-51. Li R L, Tao Y Z, Zeng D, et al. Effect of Codonopsis and Glycyrrhizae saccharide extracts on polyamine-dependent signaling pathway during cell migration in IEC-6[J]. Chin Pharmacol Bull, 2016, 32(2): 245-51. |

