


心肌细胞凋亡是指心肌细胞程序性自主死亡。近年研究发现,氧化应激、缺血/再灌损伤等可诱导细胞凋亡[1-2],在各种心血管疾病的发病机制和预后中发挥重要作用。所以,抗心肌细胞凋亡对心脏疾病的治疗是一个重要的靶点。促分裂原激活蛋白激酶(mitogen activated protein kinases,MAPKs)通路是真核细胞调控介导细胞内信号转导的重要系统,参与动物细胞的增殖、凋亡、分化、转化等生物学反应,包括ERK、JNK、p38 MAPK以及ERK5/BMK1四条途径[3]。通常情况下,ERK起保护细胞作用,而JNK和p38 MAPK则表现为促凋亡作用[4]。当JNK被不同的刺激因子激活后,其转移至细胞核内,激活其下游作用底物——核内转录因子(c-Jun),并磷酸化。研究发现,c-Jun大量磷酸化可导致细胞凋亡和分化[5]。ASK1-MKK4/7-JNK信号通路可以激活细胞氧化应激通路,调控NF-κB的活性,使一氧化氮(NO)的生成增加,诱导细胞损伤[6]。NF-κB是核转录因子,通过调节炎症因子、诱导酶、趋化因子等,在免疫、炎症、凋亡中发挥重要作用[7]。NF-κB既可调节其下游的促炎症因子肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-1β(interleukin-1β, IL-1β)的表达, 又可被其反馈激活,进而放大炎症反应,上调NF-κB的表达,诱导细胞凋亡[8]。
黄芪多糖(Astragalus polysaccharide, APS)是黄芪的主要活性成分之一,研究发现,APS具有免疫促进剂或调节剂及增强机体抵抗力的作用,尤其具有保护心肌的作用[9]。现已证实,脂多糖(lipopolysaccharide, LPS)能刺激NF-κB和JNK信号通路的活化[10],且本实验室前期实验已证明APS可抑制心肌细胞凋亡[11],但其具体机制尚不明确。本研究采用LPS诱导小鼠心肌细胞凋亡,通过检测相关凋亡因子表达水平及其在心肌组织中的浸润情况,阐明APS通过抑制NF-κB和JNK信号通路减轻LPS诱导的小鼠心肌细胞凋亡。
1 材料与方法 1.1 药品与试剂黄芪多糖,南京景竹生物技术有限公司,批号JZ150206A,APS纯度为98%;LPS,购自北京鼎国昌盛生物技术有限公司;TUNEL试剂盒购自Roche公司;IL-β、TNF-α ELISA试剂盒购自R & D公司;一抗p-JNK、JNK、IκB-α、Bcl-2、caspase-3、β-actin均购自ABclonal公司;Bax抗体购自Proteintech公司;HRP山羊抗兔IgG(H+L)、NF-κB购自北京博奥森生物技术有限公司;辣根过氧化物酶标记山羊抗小鼠IgG(H+L)、ECL化学发光显色试剂盒、BCA试剂盒、细胞质细胞核蛋白提取试剂盒、FITC标记山羊抗兔IgG(H+L),均购自北京鼎国昌盛生物技术有限公司;胰蛋白酶、二甲基亚砜(dimethyl sulfoxide,DMSO)均购自美国Sigma公司;高糖DMEM培养基购自Gibco公司;小牛血清购自美国Hyclone公司。
1.2 实验动物与细胞♂ SPF级昆明小鼠40只,7周龄,体质量(20±2)g,由锦州医科大学实验动物中心提供,动物合格证号:SCXK2014-0004。H9c2细胞株购自武汉博士德生物有限公司。
1.3 仪器DMI 3000B倒置显微镜(德国Leica公司);凝胶成像仪、电泳仪、电泳槽、转印机(美国Bio-Rad公司);酶标仪(上海赛默飞世尔仪器有限公司);小动物超声影像系统Prospect3.0(台湾S-Sharp公司);超净工作台(江苏吴县市净化技术研究所);CO2孵箱(美国Sheldon Manufacturing Inc公司)。
1.4 方法 1.4.1 动物实验分组SPF级昆明小鼠40只,随机分为空白对照组、模型组、APS(200、400、800 mg·kg-1)组,每组8只,对照组和模型组给予同等剂量的生理盐水灌胃。14 d后,给药组和模型组腹腔注射LPS(10 mg·kg-1),8 h后进行下一步实验。
1.4.2 H9c2心肌细胞的培养用含15%胎牛血清的高糖DMEM培养液,于37℃、5% CO2恒温培养箱中进行常规培养。至密度90%左右时传代,以2×107·L-1浓度接种6孔板,约48 h后换液1%胎牛血清16 h,进行诱导分化后开始实验。实验所需药品APS为水溶性,以三蒸水溶解后,用0.22 μm针式滤器过滤除菌;APS预先孵育30 min后,加入1 mg·L-1 LPS,24 h后进行各指标的测定。实验共分为5组:空白对照组、LPS模型组(1 mg·L-1)、APS低、中、高剂量组(10、25、50 mg·L-1)。
1.4.3 超声心动检测心脏情况对照组和模型组给予同等剂量的生理盐水灌胃。14 d后,给药组和模型组腹腔注射脂多糖10 mg·kg-1,8 h后,小鼠吸入麻醉,超声心动测左心室射血分数(ejection fraction, EF)、左心室缩短分数(fractional shortening, FS)、搏出量(stroke volume, SV)、心输出量(cardiac output,CO)。
1.4.4 ELISA法检测IL-1β、TNF-α水平小鼠摘眼球取血于EP管中,常温下静置2 h,析出血清后,12 000 r·min-1离心10 min,取上清液。根据试剂盒说明书操作,酶标495 nm波长处测定吸光度(OD)值。
1.4.5 TUNEL染色检测心肌细胞凋亡取心肌组织常规固定,冰冻切片,用PBS冲洗30 min,甩干后3%过氧化氢-甲醇处理10 min,PBS浸洗3次,每次5 min,然后在冰上进行如下操作:0.1% Triton X-100、0.1%柠檬酸钠溶液处理2 min,PBS浸洗2次,每次5 min,TUNEL反应混合液37℃孵育1 h,PBS浸洗3次。吸净PBS,用荧光显微镜进行观察。
1.4.6 细胞核细胞质蛋白的提取将心肌组织碾碎成细小碎片,按照20 :1的比例混合细胞质蛋白抽提试剂A和B,加入PMSF配制成终浓度为1 mmol·L-1的混合液,每60 mg的组织中加入200 μL匀质液,冰浴放置15 min,15 000 r·min-1离心5 min,把上清移至EP管中,此为细胞质蛋白。每20 μL的细胞沉淀再加入200 μL细胞质蛋白抽提试剂A,超声10 s, 冰浴15 min,加入细胞质蛋白抽提试剂B,超声10 s, 冰浴1 min,再超声10 s, 4℃、15 000 r·min-1离心5 min,吸取上清液,此为细胞质蛋白。然后将沉淀加入细胞核蛋白抽提剂,最高涡速30 s, 冰浴2 min,再次涡速30 s,共30 min,然后4℃、15 000 r·min-1离心10 min, 取上清液,此为细胞核蛋白。贴壁细胞用细胞刮子刮下并用移液器吹打,离心收集,然后实验方法与上述相同。
1.4.7 Western blot检测取冷冻心肌组织100 mg和心肌细胞悬液200 μL,加入1 mL蛋白裂解液,用超声细胞破碎仪于冰上超声,4℃、12 000 r·min-1离心10 min,将离心后的上清BCA法测定蛋白含量。SDS-PAGE凝胶电泳,将蛋白质转移到硝酸纤维素滤膜上。10%的BSA室温封闭2 h后,分别加IκB-α(1 :1 000)、NF-κB (1 :500)、p-JNK(1 :1 000)、JNK(1 :1 000)、Bax(1 :5 000)、Bcl-2(1 :1 000)、caspase-3(1 :1 000)、Lamin-B(1 :1 000)、β-actin(1 :5 000)一抗,孵育过夜。然后加入HRP标记的羊抗小鼠二抗(1 :5 000),室温孵育l.5 h,ECL发光剂显色发光,生物发光成像分析仪检测分析。
1.4.8 统计学方法实验数据以x±s表示, 统计学分析应用SPSS 17.0统计软件,各组间比较用单因素方差分析(One-way ANOVA),各组间两两比较采用配对t检验。
2 结果 2.1 APS对小鼠心功能的影响超声心动图结果显示,不同浓度的APS能有效地防止LPS引起的心肌功能的减退,其作用存在剂量依赖性。如Tab 1所示,与正常组相比,模型组的EF和FS都明显降低,模型组心肌收缩功能明显改变(P < 0.01);与模型组相比,APS(400、800 mg·kg-1)处理组EF和FS明显恢复(P<0.01)。
| Group | FS/% | EF/% | SV/μL | CO/mL·min-1 |
| Control | 36.1±2.0 | 68.9±3.2 | 47.6±6.7 | 11.6±0.7 |
| LPS | 18.0±1.1** | 36.7±1.5** | 22.2±5.3** | 4.6±0.3** |
| APS 200 mg·kg-1 | 27.8±2.0 | 37.5±2.4 | 31.0±5.5 | 7.7±1.3 |
| APS 400 mg·kg-1 | 37.7±2.2## | 54.6±2.7 ## | 30.1±2.0## | 4.2±0.6 ## |
| APS 800 mg·kg-1 | 27.3±9.0## | 53.0±14.2## | 37.1±1.6 ## | 10.7±0.4## |
| EF: Left ventricular ejection fraction; FS: Left ventricular shortening score; SV: Stroke volume; CO: Cardiac output. **P < 0.01 vs control; ##P < 0.01 vs LPS model | ||||
TNF-α、IL-1β是促炎症因子,它们可以被LPS诱导,并激活NF-κB和JNK信号通路,进而引起心肌细胞凋亡。Tab 2的ELISA结果表明,LPS诱导后TNF-α、IL-1β水平明显升高(P < 0.01),APS (400、800 mg·kg-1)能有效抑制LPS刺激后TNF-α、IL-1β水平的升高,其作用呈剂量依赖性(P < 0.01)。
| Group | TNF-α /ng·L-1 | IL-1β/pg·L-1 |
| Control | 43.4±11.4 | 6 142.4±1 052.3 |
| LPS | 129.9±14.1** | 10 613.3±548.2** |
| APS 200 mg·kg-1 | 107.2±12.1 | 10 291.4±365.1 |
| APS 400 mg·kg-1 | 91.0±6.2## | 9 435.6±200.5## |
| APS 800 mg·kg-1 | 72.3±6.7## | 8 927.7±244.8## |
| **P < 0.01 vs control; ##P < 0.01 vs LPS model | ||
如Fig 1所示,与正常对照组相比,LPS组细胞凋亡明显增加(P < 0.01)。与LPS组相比,APS (400、800 mg·kg-1)干预后能明显降低凋亡(P < 0.01),而APS 200 mg·kg-1组的凋亡率与LPS组比较无差别。
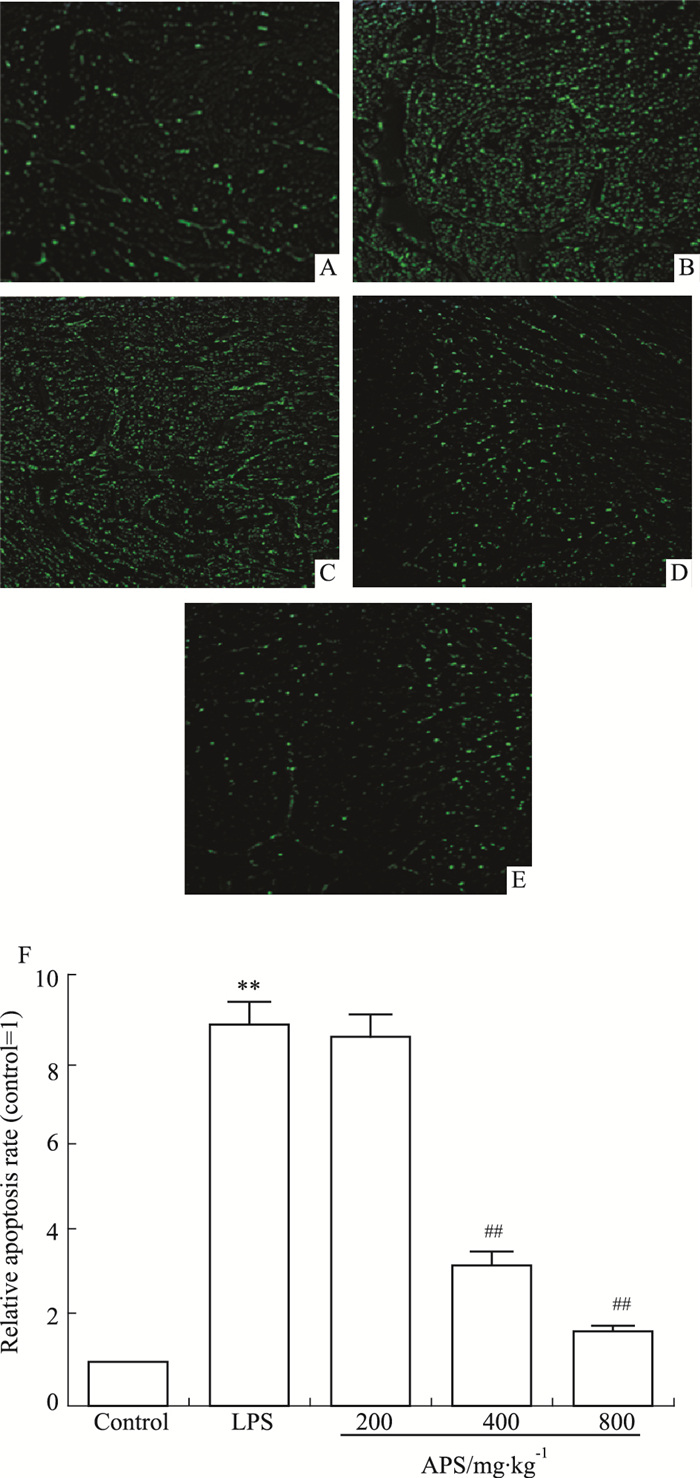
|
| Fig 1 Effect of APS on cardiomyocyte apoptosis(×200) A: Normal control group; B: LPS model group; C: APS 200 mg·kg-1 group; D: APS 400 mg·kg-1 group; E: APS 800 mg·kg-1 group; F: Cardiac myocyte apoptosis rate(x±s, n=4). **P < 0.01 vs control; ##P < 0.01 vs LPS model |
APS是否通过JNK信号通路而抑制心肌细胞凋亡呢?在体内与体外实验中,与正常对照组相比,LPS组p-JNK明显升高(P < 0.01);与LPS组相比,APS中、高剂量组p-JNK明显降低(P < 0.01),且呈剂量依赖性,而JNK则没有明显变化(Fig 2)。
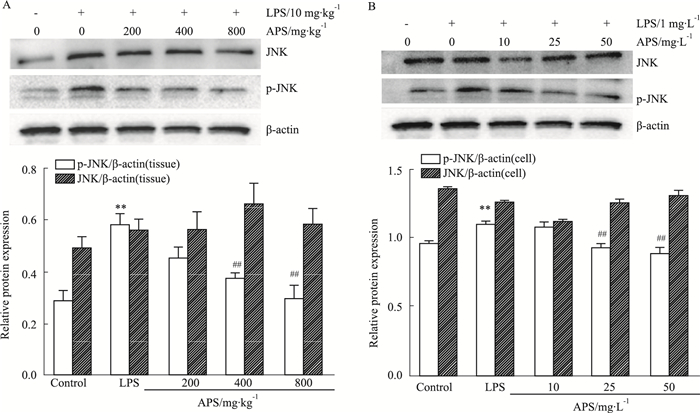
|
| Fig 2 Effect of APS on LPS-induced JNK pathway in vivo and in vitro(x±s, n=8) A: The protein levels of JNK and p-JNK were measured by Western blot in vivo experiments; B: The protein levels of JNK and p-JNK were measured by Western blot in vitro experiments. **P < 0.01 vs control; ##P < 0.01 vs LPS model |
Fig 3 Western blot结果表明,在体内与体外实验中,LPS处理后细胞质中的IκB-α、NF-κB蛋白表达降低(P < 0.01),而细胞核中NF-κB的表达增高(P < 0.01);APS中、高剂量可明显抑制IκB-α降解和NF-κB向核内转移(P < 0.05)。提示APS对LPS诱导的IκB-α的降解和NF-κB向核内转移有抑制作用。
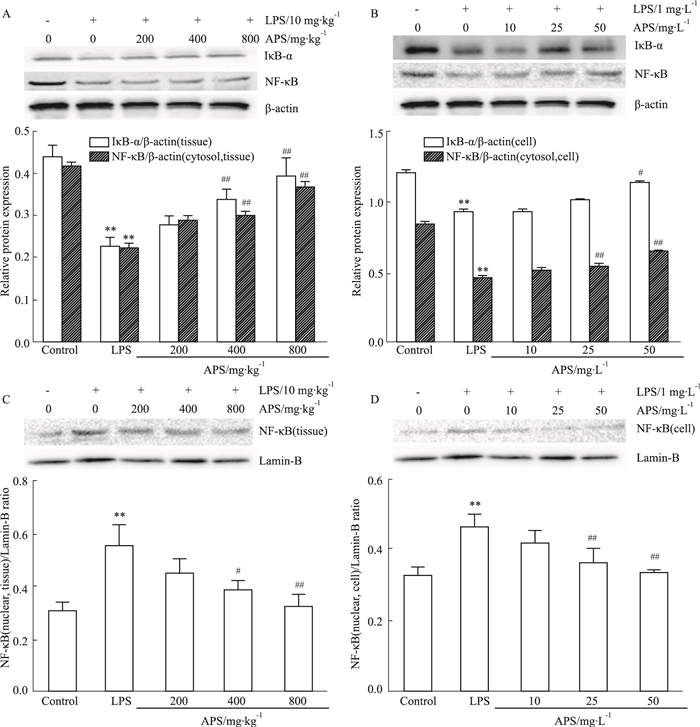
|
| Fig 3 Effect of APS on LPS-induced NF-κB signaling pathway in vivo and in vitro(x±s, n=8) The contents of IκB-α and NF-κB protein in cytoplasm of cardiomyocyte induced by LPS-induced myocardium in vivo(A) and in vitro(B); APS inhibited the content of NF-κB protein in LPS-induced nuclear in vivo(C) and in vitro(D). **P < 0.01 vs control; #P < 0.05, ##P < 0.01 vs LPS model. |
Fig 4结果显示,与对照组相比,模型组Bax、caspase-3蛋白表达明显增高,而Bcl-2表达降低(P < 0.01);APS中、高剂量组中Bax、caspase-3的蛋白表达明显降低,Bcl-2表达增高(P < 0.01)。提示APS对caspase家族、Bax蛋白表达有抑制作用,而促进Bcl-2蛋白表达。
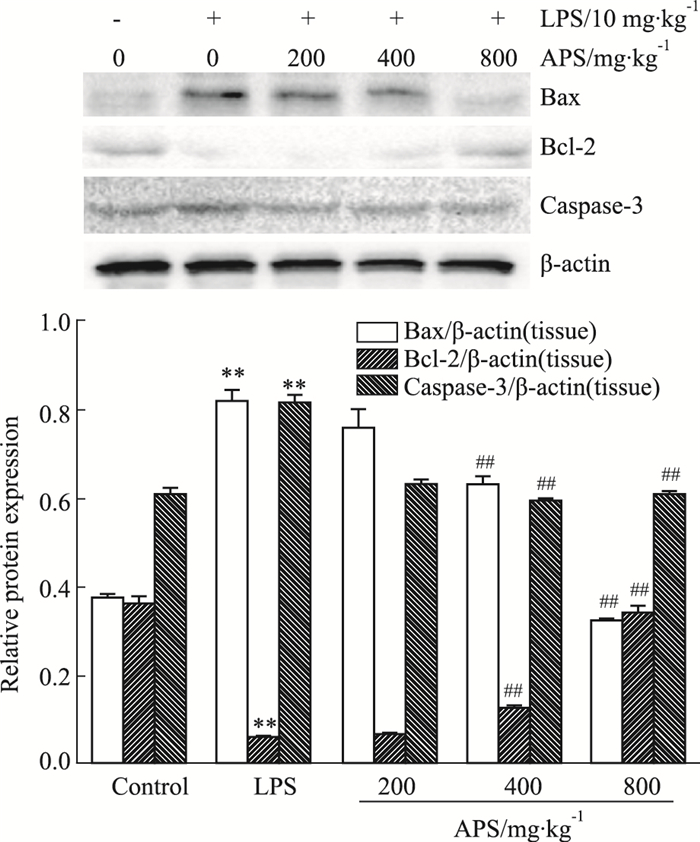
|
| Fig 4 Effects of APS on Bcl-2 and caspase families in vivo(x±s, n=4) **P < 0.01 vs control; ##P < 0.01 vs LPS model |
心肌细胞凋亡与许多心血管疾病的发生、发展有关联。Bcl-2特异性抑制细胞凋亡的主要机制是其在线粒体水平上与Bid、Bim或Bad结合, 却与Bax或Bak解离, 从而维护线粒体膜的完整性, 因而防止膜间隙中凋亡蛋白的渗出; 同时还可以抑制Ca2+的释放, 降低线粒体对Ca2+的摄取, 从而抑制心肌细胞凋亡。另外, Bcl-2还能直接与凋亡蛋白活性因子-1(Apaf-1)结合, 形成Bcl-2/ Apaf-1/caspase-9复合物, 也能阻断caspase的始动激活[12]。caspase-3是caspase家族在心肌细胞凋亡过程中重要的蛋白酶、多种凋亡途径的共同下游效应因子、心肌细胞凋亡蛋白酶级联反应的必经之路,可直接诱导细胞凋亡。本研究中,LPS模型组心肌组织中Bcl-2降低, Bax、caspase-3的蛋白表达增加。而APS中、高剂量组均可增加Bcl-2表达,降低Bax、caspase-3的蛋白表达。表明APS可以对抗LPS诱导的心肌细胞凋亡,对心脏起保护作用。
既往研究显示,NF-κB和JNK信号通路可以诱导心肌细胞凋亡[13-14]。c-Jun氨基末端激酶(c-Jun N-terminal kinase, JNK)是MAPKs家族成员,在细胞凋亡中也是重要的信号通路, 当其受到外界刺激后,JNKK1/MKK4/SEK1或者JNKK2/MKK7介导JNK上Thr183和Tyr185位点磷酸化,使JNK完全活化并具有酶催化活性[7]。而当JNK被活化后,其转移到细胞核内,并使它主要的下游作用物c-Jun磷酸化,激活依赖于转录的凋亡信号通路[15]。p-JNK诱导心肌细胞凋亡可能的机制是既可促进多种凋亡蛋白的表达, 又可通过线粒体水平发挥其有效抗凋亡作用, 还可作用于Bcl-2家族中促凋亡蛋白Bax、Bak等,诱导细胞色素释放入细胞质内, 从而激活细胞凋亡的起始[12]。本实验体内、体外研究中,APS中、高剂量组可以明显降低JNK蛋白的磷酸化,表明APS对抗LPS诱导的心肌细胞凋亡可能与JNK信号通路有关。
NF-κB是一个转录因子,在炎症、凋亡等细胞生理活动中发挥重要作用。NF-κB的活化可被炎症因子IL-1β、TNF-α激活,进而引起一系列的心肌损伤。NF-κB既可以调节IL-1β、TNF-α等炎症因子的释放,又可以被其反馈调节。IκB是一个分子复合物,当IκB被激活磷酸化后,NF-κB p65/50异源二聚体从复合物IκB中脱落,并从细胞质进入细胞核,诱导细胞凋亡。我们研究发现,APS中、高剂量组可以有效抑制LPS诱导的IκB磷酸化和随后的降解,而且阻止NF-κB p65/50进入细胞核,并使其下游细胞因子IL-1β、TNF-α释放减少。所以我们推断,APS可能通过抑制信号通路NF-κB来抑制LPS诱导的心肌细胞凋亡。
综上所述,LPS通过活化NF-κB和JNK信号通路诱导心肌细胞凋亡,APS减少LPS所致心肌细胞凋亡的机制可能与抑制NF-κB和JNK信号通路有关。本实验部分揭示了APS的作用机制,并且为心血管疾病的治疗提供了新的靶点,为寻找新的治疗药物提供了新的思路。
( 致谢: 本实验完成于锦州医科大学心脑血管药物研究重点实验室,实验过程中得到该实验室全体老师的指导及同学的协助,在此表示感谢。)
| [1] | Vila-Petroff M, Salas M A, Said M, et al. CaMK Ⅱ inhibition protects against necrosis and apoptosis in irreversible ischemia-reperfusion injury[J]. Cardiovasc Res, 2007, 73(4): 689-98. doi:10.1016/j.cardiores.2006.12.003 |
| [2] | 陈丹丹, 彭成, 万峰, 等. 氢溴酸樟柳碱对抗大鼠急性脑缺血/再灌注损伤的作用机制研究[J]. 中国药理学通报, 2017, 33(8): 1096-102. Cheng D D, Peng C, Wan F, et al. The protective mechanism of anisodine hydrobromide gainstcerebral ischemia-reperfusion injury in rats[J]. Chin Pharmacol Bull, 2017, 33(8): 1096-102. |
| [3] | 叶蕾, 陈芝芸, 严茂祥, 等. 肝纤维化大鼠肝组织MAPKs信号通路的活化及意义[J]. 中华中医药学刊, 2013, 31(12): 2748-50. Ye L, Chen Z Y, Yan M X, et al. Activation and significance of MAPKs signaling pathway in hepatic tissue of rats with hepatic fibrosis[J]. Chin J Tradit Chin Med, 2013, 31(12): 2748-50. |
| [4] | Patterson K I, Brummer T, O'Brien P M, et al. Dual-specificity phosphatases: critical, regulators with diverse cellular targerts[J]. Biochem J, 2009, 418(3): 475-89. doi:10.1042/BJ20082234 |
| [5] | Weiss C, Schneider S, Wagner E F, et al. JNK phosphorylation relieves HDAC3-dependent suppression of the transcriptional activity of c-jun[J]. EMBO J, 2003, 22(14): 3686-95. doi:10.1093/emboj/cdg364 |
| [6] | Su C C, Chen J Y, Din Z H, et al. 13-Acetoxysarcocrassolide induces apoptosis on human gastric carcinoma cells through mitochondria-related apoptotic pathways:p38/JNK activation and PI3K/AKT suppression[J]. Mar Drugs, 2014, 12(10): 5295-315. |
| [7] | Lawrence T, Willoughby D A, Gilroy D W. Anti-inflammatory lipid mediators and insights into the resolution of inflammation[J]. Nat Rev Immunol, 2002, 2(10): 787-95. doi:10.1038/nri915 |
| [8] | Yeom M, Kim J H, Min J H, et al. Xanthii fructus inhibits inflammatory responses in LPS-stimulated RAW 264.7 macrophages through suppressing NF-κB and JNK/p38MAPK[J]. J Ethnopharmacol, 2015, 176: 394-401. doi:10.1016/j.jep.2015.11.020 |
| [9] | 柏冬志, 东方, 唐文婷, 等. 黄芪多糖药理作用的研究进展[J]. 黑龙江医药, 2014, 27(1): 103-6. Bai D Z, Dong F, Tang W T, et al. Research progress on pharmacological action of Astragalus polysaccharide[J]. Heilongjiang Med, 2014, 27(1): 103-6. |
| [10] | 孙雪芳, 王洪新, 梁灵君, 等. 黄芪多糖通过TLR4/NF-κB信号通路抑制脂多糖诱导的大鼠心肌细胞肥大[J]. 中国药理学通报, 2013, 29(2): 208-12. Sun X F, Wang H X, Liang L J, et al. Inhibition of Astragalus polysaccharide in lipopolysccharide-induced cardiomyocyte hypertrophy in rats through the TLR4/NF-κB signal transduction[J]. Chin Pharmacol Bull, 2013, 29(2): 208-12. |
| [11] | 于胜男, 曹琼丹, 鲁美丽, 等. 黄芪多糖对糖尿病大鼠心肌细胞凋亡的影响[J]. 中药药理与临床, 2015, 31(4): 102-5. Yu S N, Cao Q D, Lu M L, et al. Effect of Astragalus polysaccharide on myocardial cell apoptosis in diabetic rats[J]. Pharmacol Clin Chin Mater Med, 2015, 31(4): 102-5. |
| [12] | Takagi Y, Nozaki K, Sugmo T, et al. Phosphorylation of c-Jun NH(2)-terminal kinase and p38 mitogen-activated protein kinase after transient forebrain ischemia in mice[J]. Neurosci Lett, 2000, 294(2): 117-20. doi:10.1016/S0304-3940(00)01552-4 |
| [13] | Paul A, Cuenda A, Bryant C E, et al. Involvement of mitogen-activated protein kinase homologues in the regulation of lipopolysaccharide-mediated induction of cyclo-oxygenase-2 but not nitric oxide synthase in RAW 264.7 macrophages[J]. Cell Signal, 1999, 11(7): 491-7. doi:10.1016/S0898-6568(99)00018-2 |
| [14] | Uto T, Fujii M, Hou D X. 6-(Methylsulfinyl) hexyl isothiocyanate suppresses inducible nitric oxide synthase expression through the inhibition of Janus kinase 2-mediated JNK pathway in lipopolysaccharide-activated murine macrophages[J]. Biochem Pharmacol, 2005, 70(8): 1211-21. doi:10.1016/j.bcp.2005.07.011 |
| [15] | 魏娜, 贺海波, 张长城, 等. JNK信号通路与细胞凋亡关系的研究进展[J]. 中国临床药理学与治疗学, 2013, 18(7): 807-12. Wei N, He H B, Zhang C C, et al. Advances in the relationship between JNK signaling pathway and apoptosis[J]. Chin J Clin Pharmacol Ther, 2013, 18(7): 807-12. |

