


2. 大连市妇女儿童医疗中心,辽宁 大连 116037;
3. 上海中医药大学附属龙华医院心病研究室,上海 200032
2. Dalian Municipal Women and Children's Medical Center, Dalian 116037, China;
3. Cardiology Lab, Longhua Hospital Affiliated to Shanghai University of Traditional Chinese Medicine, Shanghai 200032, China
冠心病心肌缺血侧枝循环代偿建立不足的重要病理生理基础是其血管新生不足。促进侧枝循环的建立,以自我搭桥的方式缓解缺血区血管的病理症状成了寻求冠心病等缺血性疾病治疗方法的另一有效手段和理想途径。所以,开展促血管新生作用的研究和其作用机制的探索,对血管新生不足导致的冠心病的防治有着重要现实意义。中医中药在促血管新生方面具有其独特且长足的优势[1],借助以转基因斑马鱼快速筛选、高通量化、与人的遗传物质相似度高等优点来作为药物筛选模型已成为研究的热点[2]。血管内皮生长因子(vascular endothelial growth factor,VEGF)是重要的血管新生因子,参与调控人体内血管的正常发育,故VEGF及其受体(vascular endothelial growth factor receptor,VEGFR)的表达是影响血管新生相关信号通路的关键[3],也是中药促血管新生的重要作用机制。活血软坚方(SEHM)是全国名中医严世芸教授治疗胸痹心痛的常用基础方。处方由三棱、莪术、海藻、牡蛎四味药组成,药味精少,却包含活血和软坚两法,故在临床上行之有效。
本研究通过在中医理论的指导下,研究活血软坚方对冠心病的治疗,并且验证其具有促进血管新生的作用及作用机制,为中医药促血管新生的研究提供现代生物学依据,旨在揭示活血软坚方促血管新生的内在规律,为该方的临床应用提供实验依据,也为后续具有基因调控作用的促血管新生创新药物研究打下坚实的基础。
1 材料 1.1 动物与细胞内皮细胞标记绿色荧光的转基因斑马鱼Tg(fli-1a:EGFP)y1斑马鱼,由上海中医药大学附属龙华医院斑马鱼实验室提供。人脐静脉融合内皮细胞(HUVEC)购自ATCC。
1.2 药物与试剂活血软坚方水煎液的配制:活血软坚方(三棱12 g、莪术12 g、海藻30 g、生牡蛎30 g)中药统一采用传统方法水煎并水浴浓缩至1 kg·L-1,由上海龙华医院制剂室制备,所用中药购自龙华医院中药房,经鉴定,产地明确,各中药含量以药物指纹图谱进行控制。临用前均用0.22 μm滤膜过滤除菌,得到澄清液体,分装后冷藏于-20℃冰箱储存。内皮细胞生长因子受体酪氨酸激酶抑制剂(VRI),购自Calbiochem公司,溶解于DMSO中,并配制为100 mmol·L-1,-20℃储存。Tripure Reagent购自Roche公司;逆转录试剂盒(RT-PCR)和ROX购自TaKaRa公司;DEPC水购自美国Sigma公司;兔抗VEGFR-1(AF0315)抗体购自碧云天生物技术公司;兔抗Akt(4685S)、p38(8690S)、p-p38(9215S)、p44/42(4695S)、p-p44/42(4370S)抗体,均购自CST公司。
1.3 仪器Nikon荧光倒置显微镜(日本Nikon公司);荧光定量PCR仪(Funglyn Biotech公司);电泳仪(美国Bio-Rad公司);28.5℃培养箱(德国Heraues公司)。
2 方法 2.1 斑马鱼体内毒性实验选择状态良好,受精24 h的斑马鱼幼鱼放入每孔含1 mL饲养液的24孔板中,每孔8条。采用3倍浓度梯度稀释法,用胚胎培养液稀释活血软坚方水煎液至300、100、30、10、3、1 g·L-1,以培养液为空白对照组。加完药物放入28.5℃培养箱中培养24 h后,荧光倒置显微镜下观察斑马鱼的状态。
2.2 促斑马鱼肠下静脉新生实验选择状态良好,受精24 h的斑马鱼幼鱼,使用镊子除去胚胎软壳,将其放入含有1 mL饲养液的24孔板中,(每孔8个)。采用3倍浓度梯度稀释法,用胚胎培养液稀释活血软坚方水煎液到安全剂量及以下为加药组,以培养液为空白对照组。加完药物放入28.5℃的饲养箱中培养24 h后,清洗24孔板上的加药孔,重新加入培养液和不同浓度的活血软坚方水煎液,操作同d 1。培养48h后在荧光倒置,显微镜下观察活血软坚方在不同浓度下对斑马鱼肠下静脉血管(SIVs)的影响。干预时间为48 h。斑马鱼肠下血管出芽数统计方法=血管出芽数×1。斑马鱼肠下血管交叉数(Crossing points)统计方法=血管交叉数×1。
2.3 VRI诱导斑马鱼节间血管损伤实验选择发育24 h、状态良好的斑马鱼幼鱼,放入含有每孔1 mL培养液的24孔板中,每孔8条。采用浓度梯度稀释法,使培养液中各组的VRI浓度依次为120、100、80、60、40 nmol·L-1,并以培养液为空白对照组,以确定VRI对斑马鱼节间血管(ISVs)的影响及VRI模型的最佳浓度。放入28.5℃培养箱中培养,并至24 h时荧光倒置显微镜下观察结果。斑马鱼节间血管数统计方法=完整血管数×1+不完整血管数×0.5。
2.4 斑马鱼节间血管损伤的保护实验选择状态良好、受精24 h的斑马鱼幼鱼,将其放入加有培养液的24孔板中,每孔8条。以VRI 100 nmol·L-1浓度为培养液,采用3倍浓度梯度稀释法,加入不同浓度的活血软坚方水煎液为加药组,并设不加入VRI的培养液为空白对照组,放入28.5℃的培养箱中。培养至约受精48 h,即干预时间为24 h。斑马鱼节间血管数统计方法同“2.3”。
2.5 Real-time PCR检测斑马鱼体内VEGFR mRNA选择受精24 h的斑马鱼幼鱼于24孔板中,每孔10条。分为空白对照组、模型组(VRI 100 nmol·L-1)、活血软坚方不同剂量组(VRI + SEHM 10、30、100 g·L-1),药物干预24 h后,用Tripure提取各组斑马鱼总RNA,使用转录因子cDNA合成试剂盒将总RNA反转录为cDNA,取反转录后cDNA作为模板,使用SYBR Green Master进行定量PCR。扩增条件为:95℃预变性10 min,95℃变性20 s;60℃退火30 s,72℃延伸15 s,40个循环。检测flt1、kdr、kdrl基因的表达,以GAPDH为内参基因,2-ΔΔCt法计算相对表达量。引物序列见Tab 1。
| Zebrafish gene | Forward primer(5′-3′) | Reverse primer(5′-3′) |
| FLT1(flt1) | AACTCACAGACCAGTGAACAAGATC | GCCCTGTAACGTGTGCACTAAA |
| Flk1B (kdr) | CAAGTAACTCGTTTTCTCAACCTAAGC | GGTCTGCTACACAACGCATTATAAC |
| Flk1A (kdrl) | GACCATAAAACAAGTGAGGCAGAAG | CTCCTGGTTTGACAGAGCGATA |
| GAPDH | GCTTGGCTCCTCTGGCTAAA | GTCTTCTGTGTGGCGGTGTA |
将HUVEC内皮细胞悬液按每孔100 μL,终浓度为1×107·L-1加入96孔板中,在37℃、5% CO2培养箱中培养24 h后,抽去旧培养液;将活血软坚方水煎液用0.5%的DMEM培养液稀释成300、100、30、10 g·L-1,再以每孔100 μL的量加入96孔板中,每个浓度设6个复孔。另设6个只加0.5%的DMEM培养液的复孔作为空白对照组。培养箱中培养24 h后,弃去旧培养液,每孔加入100 μL的1%的MTT,在培养箱中培养4 h后吸弃MTT溶液,每孔加入100 μL DMSO后放置摇床上避光震荡15min,用酶标仪检测其吸光度值(OD值)。
2.7 HUVEC细胞促增殖实验根据细胞毒性实验,选择活血软坚方安全浓度进行促细胞增殖实验。步骤中除了将细胞悬液终浓度调整为3×107·L-1进行加药孵育外,其余皆同“2.6”。
2.8 Western blot检测HUVEC细胞血管新生相关蛋白的表达根据每个培养皿中细胞数量加入含相应比例的RIPA,待充分裂解后提取蛋白,10 000×g、4℃离心5 min后取上清,用BCA法检测蛋白浓度。取20 μg总蛋白进行凝胶电泳,后采用电压为120 mA,转膜时间为90 min的半干转将蛋白质转移至PVDF膜。用含5%脱脂奶粉的PBST封闭2 h后,孵以1:1 000稀释的一抗,4 ℃过夜。洗膜后加入以1:2 000稀释的二抗,室温孵育2 h后,将膜放入发光成像仪中,滴加发光试剂曝光。检测Akt、p38、p-p38、p44/42、p-p44/42、VEGFR-1表达量,以β-actin为内参。
2.9 统计学方法采用SPSS 21.0统计软件进行数据分析。计量资料符合正态分布时以x±s表示,组间数据比较采用单因素方差分析(One Way ANOVA),各组间比较采用LSD检验,不符合条件时则采用秩和检验,用中位数(四分位间距)表示。各组实验数据统计时均全部以对照组归一。
3 结果 3.1 活血软坚方对斑马鱼的毒性作用活血软坚方水煎液300 g·L-1组的斑马鱼全部死亡,100、30、10、3、1 g·L-1组斑马鱼存活率分别为89.58%、87.5%、87.5%、89.58%、87.5%(Tab 2)。故活血软坚方水煎液的安全剂量为100 g·L-1及以下。
| Group | Dose/g·L-1 | Number | Survival | Death | Survival rate/% |
| Control | - | 24 | 24 | 0 | 100 |
| SEHM | 1 | 24 | 21 | 3 | 87.5 |
| 3 | 48 | 43 | 5 | 89.58 | |
| 10 | 48 | 42 | 6 | 87.5 | |
| 30 | 48 | 42 | 6 | 87.5 | |
| 100 | 48 | 43 | 5 | 89.58 | |
| 300 | 24 | 0 | 24 | 0 |
如Fig 1、Tab 3所示,活血软坚方水煎液在1、10、30、100 g·L-1浓度下对斑马鱼肠下静脉有明显出芽且交叉数量有明显增多(P<0.05或P<0.01)。
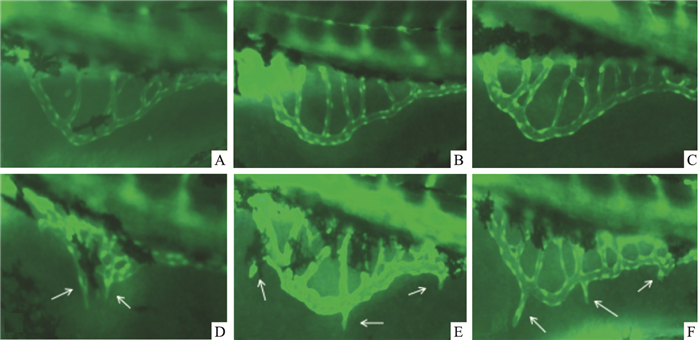
|
| Fig 1 Effect of SEHM in zebrafish SIVs A:Control; B~F: SEHM 1, 3, 10, 30, 100 g·L-1 |
| Group | Dose/ g·L-1 |
Number | Number of SIVs | Number of crossing points |
| Control | - | 14 | 0(0~0) | 0.5(0~1) |
| SEHM | 1 | 15 | 0(0~1)* | 2(0~4)* |
| 3 | 17 | 0(0~1) | 2(1~4)** | |
| 10 | 16 | 1.5(0~2)** | 3(2~5)** | |
| 30 | 17 | 0(0~2)* | 4(1.5~6)** | |
| 100 | 18 | 2(0~3)** | 5(2.75~7)** | |
| *P < 0.05, **P < 0.01 vs control | ||||
如Fig 2、Tab 4所示,与空白对照组比较,在40~120 nmol·L-1的浓度下,VRI对斑马鱼节间血管均有不同程度的损伤,且均有统计学意义。在考虑到对血管损伤程度较大,有利于药物作用的观察,但又不至于损伤程度过重而难以恢复,最终选取100 nmol·L-1作为VRI斑马鱼节间血管损伤模型的造模浓度。
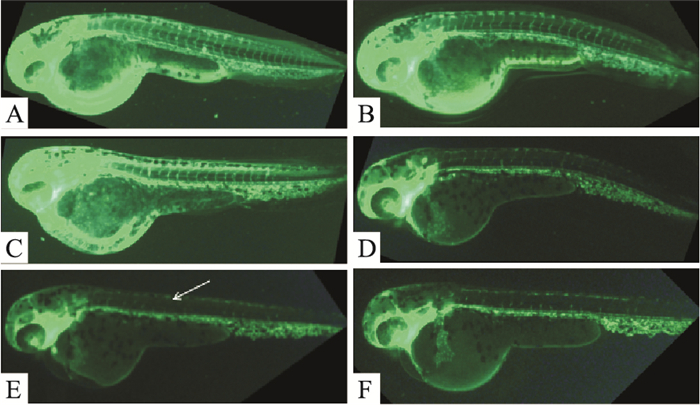
|
| Fig 2 Damage of VRI-induced ISVs A:Control; B~F: VRI 40, 60, 80, 100, 120 nmol·L-1 |
| Group | Dose/nmol·L-1 | Number | Number of ISVs |
| Control | - | 18 | 28.5(28~29) |
| VRI | 40 | 13 | 20(18.75~22)** |
| 60 | 18 | 15.75(11.88~18.63)** | |
| 80 | 15 | 8.5(6.5~14.5)** | |
| 100 | 15 | 5.5(3~8)** | |
| 120 | 12 | 2.75(1~4.38)** | |
| **P < 0.01 vs control | |||
如Fig 3、Tab 5所示,与对照组比较,VRI组的斑马鱼节间血管数明显减少,说明VRI对斑马鱼节间血管有明显损伤(P<0.01),表明转基因斑马鱼节间损伤模型造模成功;和VRI组比较,活血软坚方水煎液在3、10、30、100 g·L-1浓度下对斑马鱼节间血管均有明显恢复和保护作用(P<0.01)。
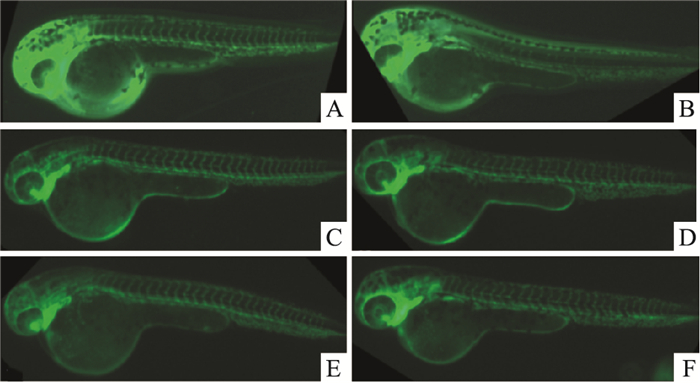
|
| Fig 3 Effect of SEHM in VRI-induced zebrafish ISVs A:Control; B:VRI 100 nmol·L-1; C~F:VRI+SEHM 3, 10, 30, 100 g·L-1 |
| Group | Dose/g·L-1 | Number | Number of ISVs |
| Control | - | 15 | 28(28~29) |
| VRI | - | 21 | 2(0.25~4.25)## |
| SEHM | 3 | 12 | 28(27.13~28.38)** |
| 10 | 12 | 27.75(25.5~28)** | |
| 30 | 12 | 28(24.13~28)** | |
| 100 | 12 | 27(22.75~28)** | |
| ##P < 0.01 vs control; **P < 0.01 vs VRI | |||
如Fig 4所示,与对照组相比,VRI组flt-1、kdr、kdrl的mRNA表达量明显降低(P<0.05),VRI+10 g·L-1活血软坚方组flt-1 mRNA表达量与VRI组比较无明显差异(P>0.05),而VRI+活血软坚方(30、100 g·L-1)组flt-1 mRNA表达量比VRI组明显升高(P<0.05);VRI+活血软坚方(10、30、100 g·L-1)组kdr、kdrl mRNA表达量比VRI组明显升高(P<0.01)。
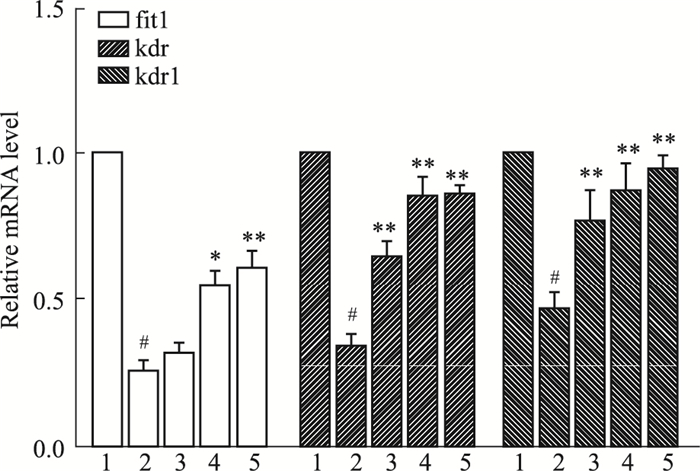
|
| Fig 4 Effect of SEHM on mRNA expression of flt-1, kdr, kdrl 1:Control; 2:VRI 100 nmol·L-1; 3~5:VRI+SEHM 10, 30, 100 g·L-1. #P < 0.05 vs control group; *P < 0.05, **P < 0.01 vs VRI group |
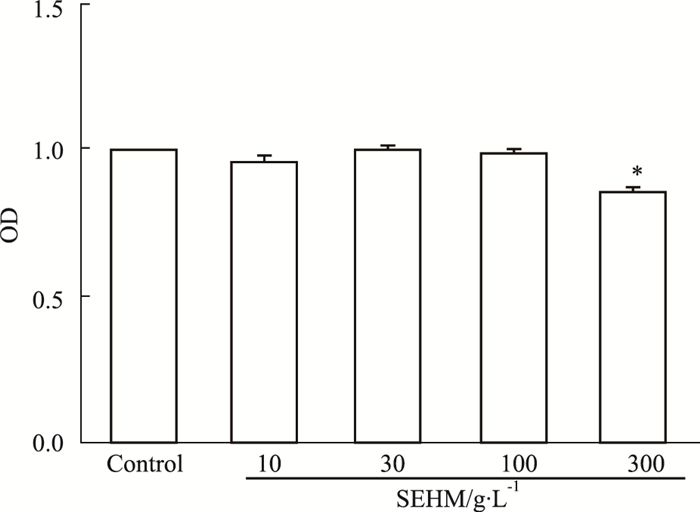
Fig 5 MTT结果显示,活血软坚方水煎液在100、30、10 g·L-1的浓度下,HUVEC细胞存活率与空白对照组比较,差异无统计学意义(P>0.05),而在300 g·L-1的浓度下,HUVEC细胞的存活率与空白对照组比较,差异有统计学意义(P<0.05),说明活血软坚方水煎液300 g·L-1的浓度对HUVEC细胞有毒性作用。
|
| Fig 5 Toxicity of SEHM on HUVECs *P < 0.05 vs control group |
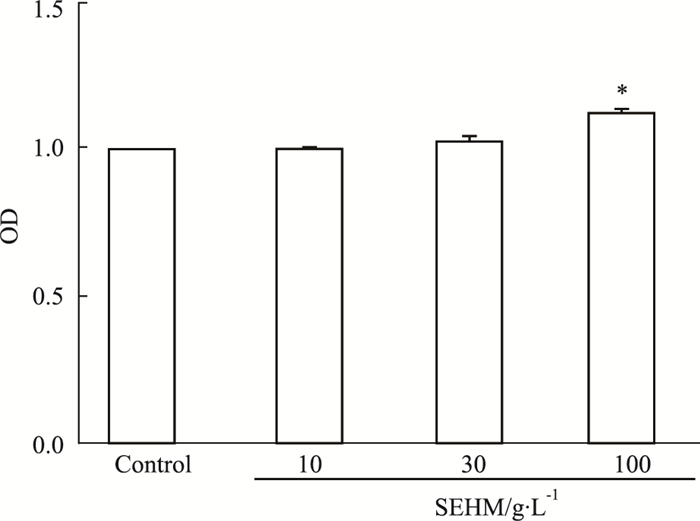
Fig 6 MTT结果表明,活血软坚方水煎液在30、10 g·L-1的浓度下,HUVEC细胞存活率与空白对照组比较差异无统计学意义(P>0.05),而在100 g·L-1的浓度下,HUVEC细胞的存活率与空白对照组比较,明显升高(P<0.05),说明活血软坚方水煎液(100 g·L-1)对HUVEC细胞有促增殖作用。
|
| Fig 6 Promoting proliferation effect of SEHM on HUVECs *P < 0.05 vs control group |
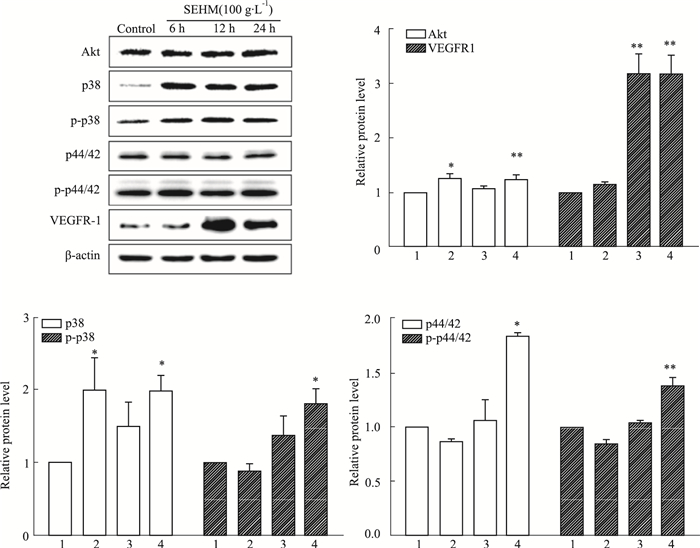
如Fig 7所示,与对照组比较,活血软坚方100 g·L-1 12 h组Akt和p38的表达量无明显差异(P>0.05),而活血软坚方100 g·L-1 6、24 h组Akt和p38的表达量均有明显升高(P<0.05)。与对照组比较,活血软坚方100 g·L-1 6、12 h两组p-p38、p44/42、p-p44/42的表达量无明显差异(P>0.05),而活血软坚方100 g·L-1 24 h组的表达量明显上升(P<0.05)。与对照组比较,活血软坚方100 g·L-1 6 h组VEGFR-1的表达量无明显差异(P>0.05),而活血软坚方100 g·L-1 12、24 h两组VEGFR-1的表达量明显上升(P<0.01)。
|
| Fig 7 Effect of SEHM on protein expression of Akt, VEGFR-1, p38, p-p38, p44/42, p-p44/42 1:Control; 2~4:SEHM 10, 30, 100 g·L-1. *P < 0.05, **P < 0.01 vs control group |
随着对冠心病不断深入的研究,治疗方案已逐渐从缺血/再灌注向促血管新生转变,通过移植VEGF到缺血的心肌组织,促使其侧支循环形成和血管新生,可明显提高冠心病患者的生活质量。血管新生作为冠心病的内科治疗手段,已成为治疗冠心病的一种可能[4],并在心血管疾病中表现出了积极的治疗作用。斑马鱼模型具有建模周期短、直接给药等优点,且重复试验一致性好、高通量化筛选、与人的遗传物质相似度高,实验结果更接近临床。其模型应用领域广泛,且已成为药物筛选的常用手段[2]。张哲睿等[5]和陈锡强等[6]通过斑马鱼模型研究发现,三七及三七花总皂苷和熊果酸的促血管新生作用。本课题即是通过建立斑马鱼模型,发现活血软坚方能够有效促进血管的新生。
冠心病属于中医“胸痹”、“心痛”、“真心痛”等病范畴。中医认为,胸痹的成因往往由瘀血和痰实两大病理产物导致。《黄帝内经》为中医活血化瘀学说之肇始[7],并提出“血实宜决之”的治则治法。张仲景在《金匮要略》中指出:“胸痹,不得卧,心痛彻背者,栝楼薤白半夏汤主之”,这是胸痹病的首论,该方也成为后世治疗冠心病的经典方。此后历代医家逐渐认识到痰浊在胸痹、心痛发病中的重要性。清代王清任在《医林改错》中,创立了以活血化瘀为基本治疗原则的血府逐瘀汤,强调了瘀血既是胸痹病的发病关键,也是重要的病理产物。活血化瘀法的提出,也为治疗胸痹病奠定了理论和实践基础。
近年临床及文献报道均提到,中药复方及单体可以促进血管的新生[8-10]。其中周忠焱等[11]和赵外荣等[12]分别通过建立转基因斑马鱼模型和内皮细胞模型,研究由桂枝、三棱、莪术组成的通阳活血方和由三棱、莪术组成的活血化瘀方促血管新生作用和机制研究。这些文献记载提示了具有“活血化瘀”、“化痰软坚”等作用的中药及复方皆有可能具有促血管新生的作用。本课题采用活血软坚方对血管新生的作用及其机制研究,是对活血化瘀和软坚散结药物组合促血管新生的进一步研究和探索。活血软坚方是严世芸教授从胸痹治疗的用药经验中,结合自己多年的临床经验总结而来。对于胸痹的辨治,严教授在临床上往往首辨标本虚实,本虚为肝肾不足,气血亏虚。标实为风、火、痰、瘀诸邪相互搏结,七情劳倦耗伤气血,久之则涩滞于脉而结于胸中,所谓不通则痛,即发为胸痹。对于标本之辨,结合临床实际,往往两者兼见,且互为标本,临证采取急则治标缓则治本。
VEGF及VEGFR对于血管新生中的作用至关重要,可以促进血管内皮细胞的迁移、增殖,且能够诱导产生内皮一氧化氮合成酶(endothelial nitric oxide synthase,eNOS)提高,从而引起血管舒张,提高血管的通透性,达到血管新生的作用。VEGF有5个成员,分别为VEGF-A、VEGF-B、VEGF-C、VEGF-D、PIGF;3种受体分别为VEGFR-1、VEGFR-2、VEGFR-3。VEGF-A主要结合在VEGFR-1和VEGFR-2上,VEGF-B和PIGF只结合在VEGFR1上,VEGF-C和VEGF-D只结合在VEGFR-3上。VEGFR1主要表达在造血干细胞上,VEGFR-2主要表达在血管内皮细胞上,VEGFR3主要表达在淋巴内皮细胞上,所以不同的受体在不同的细胞上表达并不一致。而VEGF有3种跨膜受体VEGFR-1(flt-1)、VEGFR-2(在人体中被称作kdr)和VEGFR-3,故flt-1、kdr、kdrl的表达也均与血管新生有密切的联系。
VEGFR-1主要表达于血管内皮细胞上,其调节的信号通路主要在缺血时造血干细胞的聚集和迁移中起着重要作用。在VEGF引起的内皮细胞改变中,VEGFR-2是主要参与的受体,且与细胞的增殖、迁移以及血管的通透性有关。VEGFR-2及其随后激活的PI3K可在细胞膜附件催化PIP2生成PIP3,随后激活Akt,直接参与调控内皮细胞的存活,Akt的表达还可以在缺血区诱导产生血管的新生。p44/42和p38均是MAKP家族中重要的亚型,大量研究证明,p44/42信号通路可因VEGF等细胞因子通过丝裂原活化的蛋白激酶信号途径而介导细胞增殖。p38是细胞信号传递的交汇处,常常参与调控细胞的增殖,其通路的作用可根据不同的细胞和不同的刺激而完全不同。
根据“活血化瘀”,“软坚散结”的中医理论,并结合严世芸教授在临床上善用活血软坚药物治疗胸痹心痛的经验心得,活血软坚方可促进斑马鱼节间血管损伤的恢复,其机制可能与增加斑马鱼体内flt-1、kdr、kdrl的mRNA的表达有关。活血软坚方可促进斑马鱼肠下静脉血管出芽和交叉的效用,且在100 g·L-1的浓度下可促进HUVEC细胞的增殖,其机制可能与增加细胞内Akt、p38、p-p38、p44/42、p-p44/42、VEGFR-1的表达量有关。本研究证明了活血软坚方具有在体内和体外的促血管新生作用,其作用机制可能是通过上调VEGFR表达。
( 致谢: 本实验于上海中医药大学附属龙华医院斑马鱼实验室完成,感谢老师的悉心指导和同学的帮助!)
| [1] | 朱博杰, 杨清华, 卢健棋, 等. 中药促缺血心肌血管新生的研究进展[J]. 辽宁中医杂志, 2016, 43(3): 649-51. Zhu B J, Yang Q H, Lu J Q, et al. Research progress of Chinese medicine in promoting neogenesis of ischemic myocardial vascular[J]. Liaoning J Tradit Chin Med, 2016, 43(3): 649-51. |
| [2] | 廖小立, 姚峰, 吴端生. 实验鱼类在药学研究中的应用[J]. 中国医药科学, 2013, 3(22): 18-21. Liao X L, Yao F, Wu R S. The application of laboratory fish in pharmaceutical research[J]. China Med Pharm, 2013, 3(22): 18-21. |
| [3] | 向本旭, 刘婷婷, 孙芳玲, 等. VEGF相关信号通路在血管新生中的研究进展[J]. 中国比较医学杂志, 2015, 25(12): 81-6. Xiang B X, Liu T T, Sun F L, et al. Advances in research on VEGF-related signaling pathways in angiogenesis[J]. Chin J Comparative Med, 2015, 25(12): 81-6. doi:10.3969/j.issn.1671-7856.2015.12.016 |
| [4] | Syed I S, Sanborn T A, Rosengart T K. Therapeutic angiogenesis:a biologic bypass[J]. Cardiology, 2004, 101(1-3): 131-43. doi:10.1159/000075994 |
| [5] | 张哲睿, 黎晌, 王佑华, 等. 三七及三七花总皂苷对斑马鱼模型促血管新生作用的研究[J]. 上海中医药大学学报, 2013, 27(1): 45-9. Zhang Z R, Li X, Wang Y H, et al. Angiogenic effect of total saponins extracted from root and flower of Panax Notoginseng in zebrafish model[J]. Acta Univ Tradit Med Sin Pharmacol Shanghai, 2013, 27(1): 45-9. |
| [6] | 陈锡强, 程丽芳, 徐新刚, 等. 熊果酸对斑马鱼血管生成及斑马鱼移植癌的抑制作用[J]. 中国药理学通报, 2015, 31(7): 1004-8. Zhang X Q, Cheng L F, Xu X G, et al. Inhibition of ursolic acid on angiogenesis and xenografts in zebrafish[J]. Chin Pharmacol Bull, 2015, 31(7): 1004-8. |
| [7] | 蔡建伟. 《内经》论瘀血揽要[J]. 中医研究, 2003, 16(1): 2-4. Cai J W. Synopsis on blood stasis in Huangdi ' Canon of Medicine[J]. Tradit Chin Med Res, 2003, 16(1): 2-4. |
| [8] | 崔国祯, 徐燕玲, 孙安露, 等. 丹参素衍生物对斑马鱼促血管新生作用的研究[J]. 中国药理学通报, 2016, 32(6): 795-800. Cui G Z, Xu Y L, Sun A L., et al. Effect of Danshensu derivative on angiogenesis in zebrafish[J]. Chin Pharmacol Bull, 2016, 32(6): 795-800. |
| [9] | 魏英, 余丽梅, 王钰莹, 等. 人参总皂苷促进血管新生改善急性心肌梗死大鼠心功能[J]. 中国药理学通报, 2016, 32(4): 559-64. Wei Y, Yu L M, Wang Y Y, et al. Total ginsenosides improve cardiac function via promoting angiogenesis in a rat model of acute myocardial infarction[J]. Chin Pharmacol Bull, 2016, 32(4): 559-64. |
| [10] | 唐靖一, 马子霖, 余松轩. 启心饮联合氨氯地平对原发性高血压病患者血管内皮功能的影响[J]. 上海中医药杂志, 2012, 46(4): 32-4. Tang J Y, Ma Z L, Yu S X. Effect of "Qixin Decoction" and amlodipine on vascular endothelial function in patients with essential hypertension[J]. Shanghai J Tradit Chin Med, 2012, 46(4): 32-4. |
| [11] | 周忠焱, 赵外荣, 范竹鸣, 等. 通阳活血方在内皮细胞及斑马鱼模型上促血管新生作用及其机制的研究[J]. 中华中医药学刊, 2015, 33(12): 2868-70. Zhou Z Y, Zhao W R, Fan Z M, et al. Pro-angiogenic effect and action mechanism study of GSE formula in EA.hy 926 cells in vitro and zebrafish in vivo[J]. Chin Archives Tradit Chin Med, 2015, 33(12): 2868-70. |
| [12] | 赵外荣, 范竹鸣, 陈昕琳, 等. 基于斑马鱼和EA.hy926细胞模型评价活血化瘀方的促血管新生作用[J]. 上海中医药大学学报, 2016, 30(1): 40-4. Zhao W R, Fan Z M, Chen X L, et al. Pro-angiogenic effect of SE formula in zebrafish in vivo and EA.hy 926 cells in vitro[J]. Acta Univ Tradit Med Sin Pharmacol Shanghai, 2016, 30(1): 40-4. |

