


研究表明,脑缺血发生后,缺血区的神经细胞发生明显凋亡,神经细胞凋亡与脑缺血疾病具有密切的联系[1]。线粒体作为调控真核细胞生命活动的中心,其不仅是细胞的供能场所,且是调控细胞凋亡的重要细胞器,在细胞凋亡过程中发挥重要的作用[2]。因此,保证线粒体生理功能的完整性对急性脑缺血的治疗具有重要意义。细胞凋亡主要有内源性的线粒体、内质网途径以及外源性的死亡受体途径3种。内源性的线粒体途径又包括caspase依赖性及caspase非依赖性细胞凋亡途径两种[3]。线粒体介导的非caspase依赖凋亡通路主要为当细胞受到内部凋亡刺激因子作用后,细胞凋亡诱导因子(apoptosis inducing factor,AIF)与核酸内切酶G (endonuclease G,Endo G)可由线粒体释放到胞质,并最终进入细胞核,引起DNA的破坏,直接导致细胞凋亡[4]。课题组前期研究发现,哈巴苷对急性脑缺血具有保护作用,且其作用可能与caspase依赖性细胞凋亡通路相关[5-6]。本研究采用多指标研究哈巴苷抗急性脑缺血的作用机制,为哈巴苷应用于临床治疗脑缺血疾病提供实验基础和理论依据。
1 材料 1.1 实验动物ICR小鼠,SPF级,♂,体质量23~25 g,由浙江中医药大学实验动物中心提供,动物许可证号:SCXK(沪):2013-2016。饲养环境温度22-25℃,相对湿度45%~70%,昼夜周期12 h/12 h,喂以普通饲料,自由饮水。
1.2 药物与试剂哈巴苷(批号:15030621,上海同田生物技术股份有限公司);依达拉奉(批号:86-141106,南京先声东元制药有限公司);AnnexinV-FITC/PI细胞凋亡双染试剂盒(批号:6033840,美国BD公司);JC-1探针粉末(批号:MKBZ3766V,美国Sigma公司);线粒体蛋白提取试剂盒(批号:20151228,凯基生物技术股份有限公司);BCA蛋白定量检测试剂盒(批号:10121,北京康为生物科技有限公司);5×蛋白上样缓冲液(批号:LMYG 15502,杭州诺森德生物技术有限公司);预染蛋白Marker(批号:00135995,美国赛默飞世尔科技有限公司);AIF兔抗人单克隆抗体(批号:ab32516)、Endo G兔抗人单克隆抗体(批号:ab76122)、β-actin单克隆抗体(批号:3700S-10),均购自美国Abcam公司;山羊抗兔荧光二抗、山羊抗鼠荧光二抗(批号:C50113-05、C50331-05,美国LI-COR公司);Mini BEST Universival RNA提取试剂盒、Prime ScriptTM RT-PCR试剂盒、Premix Ex TaqTM (Tli RNaseH Plus)(批号:AK901、AK4102、AK7509,日本TaKaRa公司);其余试剂均为分析纯。引物由上海生物工程有限公司提供,引物序列见Tab 1。
| Gene | Primer sequence (5′ to 3′) | |
| GAPDH | Forward | ACAGCAACAGGGTGGTGAC |
| Reverse | TTTGAGGGTGCAGCGAACTT | |
| AIF | Forward | TGCTTTCAAGCAGAAACTGG |
| Reverse | TCTAGAGGAACACGCCATTG | |
| Endo G | Forward | TGGACGACACCTTCTACCTG |
| Reverse | CTGCGGCTGTACTTCTCAAG |
Centrifuge5804R高速冷冻离心机、Master cycler nexus gradient梯度PCR仪(德国Eppendorf公司);Accuri C6小型流式细胞仪(美国BD公司);EM UC7超薄切片机(德国徕卡公司);H-7650透射电镜(日本HITACHI公司);PowerWaveX340型酶标仪(美国BioTek仪器有限公司);MiniT-H2C型恒温金属浴(杭州奥盛仪器有限公司);Odyssey荧光扫描成像系统(美国LI-COR公司);Onedrop微量紫外分光光度计(美国Merinton公司);ABI 7500/7500 Fast实时荧光定量PCR仪(美国应用生物系统公司)。
2 方法 2.1 实验动物分组、造模及给药实验前,小鼠禁食不禁水12 h,按体质量随机分为6组:假手术组、模型组、依达拉奉3.2 mg·kg-1组及哈巴苷4、8、12 mg·kg-1组。腹腔注射4%水合氯醛(10 mL·kg-1)麻醉,参考改进的Zea Longa法[7]建立小鼠大脑中动脉阻塞(middle cerebral artery occlusion,MCAO)模型。各组小鼠造模后立即经尾静脉注射相应药物(10 mL·kg-1),假手术组及模型组同法给予等量生理盐水。
2.2 流式细胞术检测MCAO小鼠缺血侧海马神经细胞凋亡率造模6 h后立即断头取脑,无菌条件下快速分离MCAO小鼠缺血侧海马,D-Hank’s漂洗2遍后,用眼科剪剪成1 mm3的组织块,于37℃条件下,边震荡边胰酶消化30 min后,1 000 r·min-1离心5 min,弃上清,沉淀用DMEM完全培养基重悬,300目滤网过滤得单细胞悬液,细胞计数。取5~10万细胞,1 000 r·min-1,离心5 min,取沉淀,PBS洗涤2次后,按AnnexinV-FITC/PI细胞凋亡双染试剂盒说明书方法进行染色,流式细胞仪检测海马神经细胞的凋亡率。
2.3 流式细胞术检测MCAO小鼠缺血侧海马神经细胞线粒体膜电位按“2.2”项下方法制备海马神经单细胞悬液。取5~10万细胞,1 000 r·min-1,离心5 min,取沉淀,PBS洗涤2次,加入0.5 mL JC-1染色工作液,颠倒数次混匀。细胞培养箱中37℃孵育15 min。37℃孵育结束后,600×g,4℃离心5 min,取沉淀,PBS洗涤2次。500 μL PBS缓冲液重悬后,流式细胞仪检测海马神经细胞线粒体的膜电位变化。
2.4 透射电镜观察MCAO小鼠缺血侧海马神经细胞线粒体超微结构造模6 h后,将小鼠麻醉固定,拔出线栓,打开小鼠胸腔,暴露心脏,将灌注针头插入左心室,剪开右心耳。首先使用生理盐水进行快速灌注,直至小鼠四肢、两肺及肝脏变白且灌注液变清后,换成4%多聚甲醛+1%戊二醛进行灌注,刚开始灌注时老鼠前后肢剧烈抽动,尾部翘起并逐渐变僵硬,灌注时间10~15 min。灌注结束后,断头取出整个大脑组织。分离缺血侧海马组织,并取1 mm3大小的组织块,立即放入含有2.5%戊二醛溶液的离心管内4℃固定,固定过夜后使用常规电镜样品方法处理。包埋好的样品采用超薄切片机切片,片厚70 nm,该切片经醋酸双氧铀50%乙醇饱和溶液染色1 h以及柠檬酸铅溶液染色15 min后,于透射电镜下观察。
2.5 Western blot法检测线粒体中AIF及Endo G的蛋白表达造模6 h后,各组小鼠脱颈处死,立即于冰上取大脑,仔细分离左侧大脑皮层及海马组织,按线粒体蛋白提取试剂盒说明书分别制备线粒体蛋白提取液及胞质蛋白提取液。按BCA蛋白定量试剂盒说明书定量蛋白,并以PBS调整蛋白浓度一致,加入5×上样缓冲液(蛋白液:5×上样缓冲液=4 :1)后,100℃变性10 min,室温冷却后,4℃保存备用。每泳道以30 μg蛋白上样,AIF及Endo G经10% SDS-聚丙烯酰胺凝胶电泳(以β-actin为内参照),待目的蛋白电泳至距胶上侧2/3位置时停止电泳。100 V、转膜110 min,将蛋白从SDS-聚丙烯酰胺凝胶转至0.22 μm PVDF膜上。5% BSA封闭2 h后,TBST缓冲液洗膜3次,每次5 min。分别加入AIF兔抗人单克隆抗体稀释液(1 :5 000)、Endo G兔抗人单克隆抗体稀释液(1 :1 000),4℃过夜。TBST缓冲液漂洗PVDF膜3次,每次5 min;加入兔二抗,于摇床上室温孵育2 h后,TBST缓冲液洗膜3次,每次5 min,用Odyssey荧光扫描成像系统对蛋白结果进行分析。以目的蛋白的灰度值与内参蛋白β-actin的灰度值的比值作为样品中目的蛋白的相对表达量。
2.6 qPCR法检测MCAO小鼠海马组织中AIF及Endo G mRNA的表达造模6 h后立即断头取脑,置于培养皿中以生理盐水清洗干净,滤纸吸干表面液体。立即按TaKaRa RNA提取试剂盒说明书步骤提取RNA。使用Onedrop微量紫外分光光度计测定总RNA的浓度和纯度。按TaKaRa Prime ScriptTM RT-PCR试剂盒说明书步骤将mRNA逆转录为cDNA。按TaKaRa® Premix Ex TaqTM (Tli RNaseH Plus)试剂盒说明书进行qPCR反应。qPCR反应条件:94℃预变性5 min,94℃变性30 s,60℃退火45 s,72℃延伸30 s,35个循环后,72℃延伸7 min。以2-△△CT方法分析基因的相对表达量,以管家基因甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase, GAPDH)为内参。
2.7 统计学分析实验数据采用SPSS 18.0进行统计分析,数据均以x±s表示,完全随机设计的多个样本均数比较采用单因素方差分析(One-Way ANOVA)进行处理;两组间相互比较,满足方差齐性时用LSD检验,不满足方差齐性时用T2检验。
3 结果 3.1 哈巴苷对MCAO小鼠海马神经细胞凋亡率的影响如Tab 2、Fig 1所示,与假手术组相比,模型组小鼠海马神经细胞凋亡率明显增加(P<0.01);与模型组相比,哈巴苷各剂量组小鼠海马神经细胞凋亡率均明显降低(P<0.05,P<0.01)。
| Group | Dose/mg·kg-1 | Apoptotic rate/% |
| Control | - | 13.73±3.39 |
| Model | - | 26.78±4.30** |
| Edaravone | 3.2 | 16.07±4.86## |
| Harpagide | 4 | 20.35±3.45# |
| 8 | 18.75±3.53## | |
| 12 | 20.20±4.44# | |
| **P<0.01 vs control; #P<0.05, ##P<0.01 vs model | ||
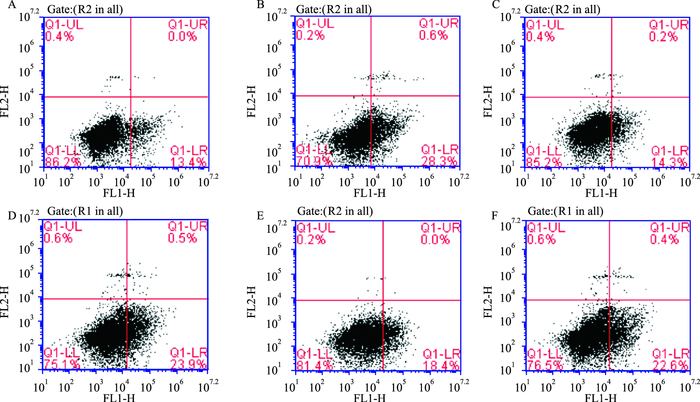
|
| Fig 1 Effects of harpagide on apoptosis of hippocampal neurons in MCAO mice A: Control; B: Model; C: Edaravone 3.2 mg·kg-1; D: Harpagide 4 mg·kg-1; E: Harpagide 8 mg·kg-1; F: Harpagide 12 mg·kg-1 |
如Tab 3、Fig 2所示,与假手术组相比,模型组小鼠海马神经细胞线粒体膜电位明显降低(P<0.01);与模型组相比,哈巴苷4、8、12 mg·kg-1组小鼠海马神经细胞线粒体膜电位均明显增加(P<0.01)。
| Group | Dose/mg·kg-1 | Red/Green |
| Control | - | 7.216±0.600 |
| Model | - | 1.940±0.603** |
| Edaravone | 3.2 | 6.385±1.425## |
| Harpagide | 4 | 4.688±0.586## |
| 8 | 6.519±1.063## | |
| 12 | 5.241±1.052## | |
| **P<0.01 vs control; ##P<0.01 vs model | ||
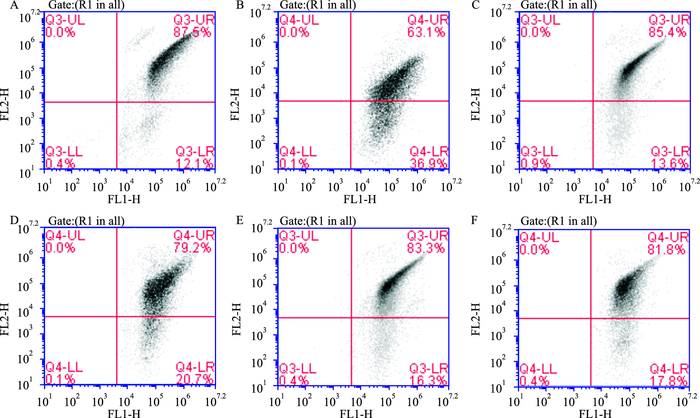
|
| Fig 2 Effects of harpagide on mitochondrial membrane potential of hippocampal neurons in MCAO mice A: Control; B: Model; C: Edaravone 3.2 mg·kg-1; D: Harpagide 4 mg·kg-1; E: Harpagide 8 mg·kg-1; F: Harpagide 12 mg·kg-1 |
与假手术组相比,MCAO小鼠神经元核膜皱缩,核染色质密度增高,线粒体内室扩张,基质变稀,电子密度明显降低,线粒体结构松散(呈空泡状),可见明显肿胀,线粒体嵴短而少,移至边缘或发生断裂,可见溶酶体。与模型组相比,哈巴苷4、8、12 mg·kg-1能不同程度减轻MCAO小鼠缺血侧海马神经细胞线粒体结构损伤(Fig 3)。
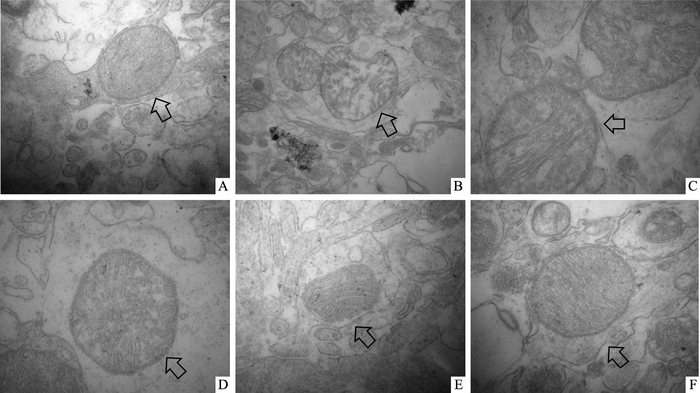
|
| Fig 3 Effects of harpagide on ultrastructure of hippocampus neuron mitochondria in MCAO mice (×80 000) A: Control; B: Model; C: Edaravone 3.2 mg·kg-1; D: Harpagide 4 mg·kg-1; E: Harpagide 8 mg·kg-1; F: Harpagide 12 mg·kg-1 |
如Fig 4所示,与假手术组相比,模型组小鼠脑组织线粒体中AIF及Endo G蛋白表达明显降低(P<0.01);与模型组相比,哈巴苷4、8、12 mg·kg-1组小鼠脑组织线粒体中Endo G蛋白表达明显增加(P<0.05),哈巴苷8、12 mg·kg-1组小鼠脑组织线粒体中AIF蛋白表达明显增加(P<0.05)。
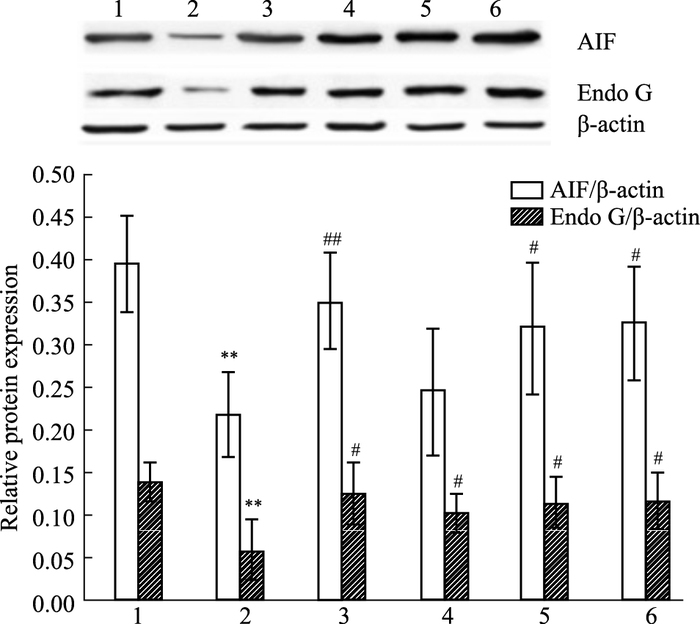
|
| Fig 4 Effects of harpagide on contents of AIF and Endo G in mitochondria 1: Control; 2: Model; 3: Edaravone 3.2 mg·kg-1; 4: Harpagide 4 mg·kg-1; 5: Harpagide 8 mg·kg-1; 6: Harpagide 12 mg·kg-1. **P < 0.01 vs control; #P < 0.05, ##P < 0.01 vs model. |
如Tab 4所示,与假手术组相比,模型组小鼠海马组织AIF及Endo G mRNA表达明显增加(P<0.01);与模型组相比,哈巴苷8 mg·kg-1组小鼠海马组织AIF及Endo G mRNA表达明显减少(P<0.01)。
| Group | Dose/mg·kg-1 | AIF | Endo G |
| Control | - | 1 | 1 |
| Model | - | 2.262±0.533** | 2.885±0.386** |
| Edaravone | 3.2 | 1.361±0.278## | 1.390±0.386## |
| Harpagide | 4 | 1.647±0.326 | 2.244±0.787 |
| 8 | 1.411±0.175## | 1.798±0.536## | |
| 12 | 1.414±0.261# | 1.896±0.884# | |
| **P<0.01 vs control; #P<0.05,##P<0.01 vs model | |||
本实验所造的模型为永久性局灶性脑缺血模型,造模后立即尾静脉给药,同步观察受试药物对脑缺血急性期(6 h)的保护作用。有研究利用线栓法致大鼠MCAO模型,观察缺血1、1.5、2、3、4、6、9、12、24 h后脑梗死体积的变化,发现缺血1、1.5 h组未发现梗死灶;缺血2 h组基底节区出现梗死灶,梗死灶边界欠清,4 h组梗死体积明显增大,且与时间呈正相关。在观察局部脑血流变化时,缺血30 min时血流量开始下降,缺血1 h时,血流量下降为正常的42.2%,6 h时降为正常的8.5%,9 h时为正常的7.1%,缺血侧脑血流已趋于平稳,到12 h时几乎已无变化。课题组前期研究了哈巴苷对MCAO 6、8、10 h等时间段的保护作用,发现哈巴苷在MCAO 6 h具有明显保护作用,8、10 h时间点有作用,但不及6 h[8]。综上,权衡脑血流、脑梗死体积及哈巴苷在不同缺血时间的抗脑缺血作用等方面,所以在本实验选择了MCAO 6 h。
众多研究表明,神经细胞凋亡是目前公认的脑缺血疾病中导致神经系统损伤的重要机制,是梗死区神经细胞死亡的主要方式。因此,抗凋亡治疗已成为治疗脑缺血疾病的重要途径以及当前脑缺血疾病研究的热点[9]。本研究采用Annexin V-FITC/PI双染法检测MCAO小鼠海马神经细胞的细胞凋亡率,评价哈巴苷对小鼠海马神经细胞的保护作用。结果表明,哈巴苷4、8、12 mg·kg-1均可明显降低因缺血而增加的神经细胞凋亡,提示哈巴苷的抗脑缺血作用可能与其保护神经细胞的作用相关。
当细胞受到如缺血、缺氧等因素的刺激后,会发生一系列的病理改变,主要变化为线粒体膜去极化,线粒体膜电位下降后,线粒体通透性转换孔(mitochondrial permeablity transition pore,MPTP)开放,Smac/DIABLO和Cyt C等从线粒体释放出来,进一步活化caspase家族蛋白,引起细胞凋亡。由此可见,线粒体膜电位的变化与细胞凋亡相关,研究线粒体膜电位的变化规律对脑缺血疾病的研究具有重要意义[10-11]。线粒体在哺乳动物维持正常的生理功能中发挥重要作用,其除产生ATP提供能量外,在维持钙稳态、细胞氧化还原状态以及细胞信号转导中起重要作用。Solenski等[12]发现,再灌注可加重缺血引起的线粒体肿胀、线粒体嵴断裂、电子密度增加等改变。上述改变是线粒体功能障碍的形态学基础,脑缺血后,大量神经细胞线粒体的损伤可直接引起该损伤区域脑组织的功能障碍,临床表现为脑缺血损伤。本研究采用JC-1探针检测MCAO小鼠海马神经细胞元的线粒体膜电位,采用透射电镜观察MCAO小鼠的海马神经细胞线粒体的超微结构。结果显示,哈巴苷4、8、12 mg·kg-1可不同程度地增加MCAO小鼠海马神经细胞的线粒体膜电位,减轻海马神经细胞线粒体结构损伤,可见哈巴苷组小鼠海马神经细胞线粒体形态结构基本完整,线粒体水肿程度明显降低,线粒体嵴部分变短或断裂,基质密度与模型组相比较大。表明哈巴苷能在一定程度上通过上调脑缺血后造成的线粒体膜电位下降,以及保护神经细胞线粒体生理结构的完整性,发挥抗脑缺血作用。
线粒体介导的非caspase依赖性凋亡途径主要为细胞受到某些因子刺激后,线粒体释放AIF与Endo G到胞质中,并最终进入细胞核,引起DNA片段化,直接导致细胞凋亡[6]。AIF的前体是在细胞质合成后,再转移到线粒体中的。在凋亡条件的诱导下,AIF先从线粒体转移至胞质中,再转移至细胞核,在细胞核引起染色体凝聚和DNA大片段断裂,最终导致细胞凋亡[13]。与Cyt C不同,AIF诱导凋亡不依赖caspase。在慢性酒精中毒的大鼠海马神经细胞凋亡过程中,可观察到AIF蛋白表达明显增加[14]。细胞凋亡过程中,线粒体内膜释放Endo G至胞质,并转移到细胞核,进而引起DNA断裂,引发细胞凋亡。Endo G诱导的DNA降解可以在非依赖caspase的级联反应中观察到,表明其在非依赖caspase细胞凋亡途径诱导的细胞凋亡中起重要作用[15]。结果显示,哈巴苷可明显减少线粒体释放AIF及Endo G至胞质,表明哈巴苷可能通过抑制线粒体介导的caspase非依赖性细胞凋亡通路,发挥抗脑缺血作用。
本研究通过3个剂量组(4、8、12 mg·kg-1)来评价哈巴苷的抗脑缺血作用,8 mg·kg-1剂量组在小鼠脑神经功能评分、脑含水量、脑指数以及大脑皮层神经细胞数量等指标均显示有明显疗效,与阳性药组疗效相当,差异没有显著性[6]。本实验进一步研究了哈巴苷对MCAO小鼠神经细胞及caspase非依赖性凋亡通路的影响。结果表明,8 mg·kg-1剂量组疗效较4、12 mg·kg-1剂量组好,与阳性药组疗效相当,两者差异无显著性。3个剂量组的作用效果呈现倒钟状趋势,亦与大多数脑神经药物研究趋势类似,可能与神经药物的作用机制有关,当药物作用靶点达到饱和的情况下,继续增加药物的剂量,治疗效果降低。因此,本实验12 mg·kg-1剂量组的治疗效果反而略低于8 mg·kg-1组。
综上可得,本研究采用多指标评价哈巴苷抗急性脑缺血的作用机制,结果表明哈巴苷可能通过保护大脑神经细胞及其线粒体功能的完整性,以及抑制caspase非依赖性细胞凋亡通路,发挥抗脑缺血作用。
( 致谢: 本实验在浙江中医药大学药学院中药资源研究所完成,感谢各位老师和同学在实验过程中给予的指导和帮助。)
| [1] | 谭金山, 李永刚, 陈红兵, 等. 脑缺血/再灌注损伤神经细胞凋亡的形态学特征[J]. 青岛大学医学院学报, 2003, 39(3): 304-6. Tan J S, Li Y G, Chen H B, et al. The morphology of apoptotic neurons after cerebral-ischemia reperfusion in rats[J]. Acta Acad Med Qingdao Univ, 2003, 39(3): 304-6. |
| [2] | 代海滨, 苗晓蕾, 嵇晴, 等. 线粒体及凋亡相关信号途径在脑缺血性损伤细胞死亡过程中的重要角色[J]. 中国组织工程研究, 2015, 19(15): 2425-30. Dai H B, Miao X L, Ji Q, et al. Neuronal mitochondria and apoptosis signaling pathways play an important role in cell death during transient cerebral ischemia[J]. Chin J Tissue Eng Res, 2015, 19(15): 2425-30. doi:10.3969/j.issn.2095-4344.2015.15.025 |
| [3] | Susin S A, Daugas E, Ravagnan L, et al. Two distinct pathways leading to nuclear apoptosis[J]. J Exp Med, 2000, 192(4): 571-80. doi:10.1084/jem.192.4.571 |
| [4] | 赵丹, 贺莉芳, 刘晖, 等. 线粒体?细胞色素C?caspase与细胞凋亡[J]. 医学动物防制, 2012, 28(12): 1337-40. Zhao D, He L F, Liu H, et al. Mitochondrion, cytochrome C, caspase and apoptosis[J]. J Med Pest Control, 2012, 28(12): 1337-40. |
| [5] | 应夏丽, 钟晓明, 徐慕蝶, 等. 哈巴苷对急性脑缺血小鼠神经保护作用及线粒体保护机制的研究[J]. 中国药学杂志, 2015, 50(12): 1026-31. Ying X L, Zhong X M, Xu M D, et al. Neuro-protective effect of harpagide on acute cerebral ischemic injury mice and its mechanism involving mitochondria[J]. Chin Pharm J, 2015, 50(12): 1026-31. |
| [6] | 楼烨亮, 陈梦静, 王可, 等. 哈巴苷对急性脑缺血及线粒体介导的caspase依赖性细胞凋亡信号通路的影响[J]. 中国药理学通报, 2017, 33(4): 563-7. Lou Y L, Chen M J, Wang K, et al. Effects of harpagide on cerebral ischemia and mitochondria mediated caspase dependent apoptotic signaling pathway in mice[J]. Chin Pharmacol Bull, 2017, 33(4): 563-7. |
| [7] | Allan L M, Rowan E N, Firbank M J, et al. Long term incidence of dementia, predictors of mortality and pathological diagnosis in older stroke survivors[J]. Brain, 2011, 134(12): 3716-27. doi:10.1093/brain/awr273 |
| [8] | 曹霞, 曹秉振, 郭述芬. 大鼠大脑中动脉局灶性脑缺血模型的时间梗死体积相关研究[J]. 解放军医学杂志, 2004, 8(34): 7838-9. Cao X, Cao B Z, Guo S F. Correlation between time and infarct volume in focal cerebral ischemia of middle cerebral artery in rats[J]. Med J Chin PLA, 2004, 8(34): 7838-9. |
| [9] | 宋修云, 胡金凤, 陈乃宏. 神经细胞凋亡与脑缺血疾病[J]. 中国药理学通报, 2012, 28(3): 307-10. Song X Y, Hu J F, Chen N H. Neurons apoptosis and cerebral ischemia[J]. Chin Pharmacol Bull, 2012, 28(3): 307-10. |
| [10] | 张颖. 丹酚酸B对脑缺血小鼠脑组织线粒体作用及其机制的研究[D]. 北京: 北京中医药大学, 2007. Zhang Y. Effects of salvianolic acid B on mitochondrial in mice with cerebral ischemia[D]. Beijing: Beijing University of Chinese Medicine, 2007. http://cdmd.cnki.com.cn/article/cdmd-10026-2006085547.htm |
| [11] | Li Y H, Gong P L. Neuroprotective effect of dauricine in cortical neuron culture exposed to hypoxia and hypoglycemia: involvement of correcting perturbed calcium homeostasis[J]. Can J Physiol Pharmacol, 2007, 85(6): 621-7. doi:10.1139/Y07-056 |
| [12] | Solenski N J, diPierro C G, Trimmer P A, et al. Ultrastrural changes of neuronal mitochondria after transient and permanent cerebral ischemia[J]. Stroke, 2002, 33(3): 816-24. doi:10.1161/hs0302.104541 |
| [13] | 周茹, 郝银菊, 姚婉霞, 等. 枸杞多糖对离体缺血性脑损伤后PARP-1和AIF的影响[J]. 中药药理与临床, 2015, 31(4): 120-3. Zhou R, Hao Y J, Yao W X, et al. Effect of Lycium barbarum polysaccharide on expression of PARP-1 and AIF in hippocampal neurons injured by oxygen-glucose deprivation and reperfusion[J]. Pharmacol Clin Chin Mater Med, 2015, 31(4): 120-3. |
| [14] | 段玉香, 石秋艳, 姜进克. 慢性酒精中毒大鼠海马神经元凋亡及caspase-8?AIF的表达升高[J]. 基础医学与临床, 2010, 30(12): 1309-12. Duan Y X, Shi Q Y, Jiang J K. Hippocampal neuronal apoptosis and the increased expression of caspase-8 and AIF after chronica alcoholism in rats[J]. Basic Clin Med, 2010, 30(12): 1309-12. |
| [15] | 张弘, 张连荣, 姜海军, 等. 莪术醇对胃癌SGC7901细胞凋亡及AIF?Endo G表达的影响[J]. 肿瘤学杂志, 2015, 21(9): 703-7. Zhang H, Zhang L R, Jiang H J, et al. Effect of curcumol on apoptosis and expressions of AIF, Endo G in gastric cancer SGC7901 cells[J]. J Chin Oncol, 2015, 21(9): 703-7. doi:10.11735/j.issn.1671-170X.2015.09.B001 |

