


高血压是严重危害人类健康的心血管疾病之一,目前对它的治疗既强调降低血压,又要注重靶器官的保护[1]。高血压心脏病是代偿负荷所继发的病理过程,是高血压患者的主要并发症之一[2]。因心肌细胞属于永久细胞,为保证循环血量、增强心肌收缩力,在高血压初期心肌细胞主要以肥大的形式代偿,但同时也会使心肌耗氧、耗能增加;若负荷持续增加,冠状动脉供血减少,心肌缺血缺氧,导致心肌细胞凋亡增多,病理性重构加重。心肌细胞凋亡是心肌代偿性肥厚向心力衰竭过渡的重要机制之一[3]。因此,降低血压和减少心肌细胞凋亡是改善高血压心脏病心室重构的重要策略。
淫羊藿是我国传统中草药,具有“补肾阳,益气力,强心力”等药理功效。黄酮类化合物淫羊藿苷是淫羊藿的主要活性成分之一。现代药代动力学研究表明,淫羊藿苷在肠道1~2 h内完全转化为淫羊藿次苷Ⅱ(icariside Ⅱ, ICS Ⅱ)[4]。据报道,ICS Ⅱ可以抑制H2O2诱导的PC12细胞凋亡[5]。但关于ICS Ⅱ对心肌细胞凋亡的研究鲜有报道。因此,本研究以自发性高血压大鼠(spontaneously hypertensive rat, SHR)为研究对象,观察ICS Ⅱ是否能够改善SHR左室心肌细胞凋亡,并初步探讨其可能机制。
1 材料与方法 1.1 药品、试剂与仪器淫羊藿次苷Ⅱ购自南京泽朗医药有限公司(纯度≥ 98%);原位细胞凋亡检测试剂盒(TdT-mediated dUTP Nick-End Labeling, TUNEL),德国Roche公司;荧光混合物、RNA逆转录试剂盒、引物(GAPDH、Bax、Bcl-2)购自TaKaRa生物工程公司;Bcl-2、Bax、cleaved-caspase-3兔抗鼠一抗购自美国Abcam公司;GAPDH小鼠抗大鼠抗体购自武汉三鹰生物技术有限公司;辣根过氧化物酶(HRP)标记的山羊抗兔、山羊抗小鼠IgG购自江苏碧云天生物技术研究所。光学显微镜及照相系统,日本Olympus公司;RNA逆转录仪,德国Eppendorf公司;i-mark酶标仪、real-time RT-PCR扩增仪、Mini PROTEAN3电泳仪、Mini Trans-Blot转移系统以及CCD成像系统,均为美国Bio-Rad公司产品。
1.2 实验动物及分组13周龄♂ SHR 30只、WKY 6只均购自北京维通利华实验动物技术有限公司,许可证号: SCXK (京) 2012-0001。SHR随机分为模型组、ICS Ⅱ低、中、高剂量组和阳性药组(n=6),WKY作为空白对照组(n=6)。ICS Ⅱ低、中、高剂量组分别给予ICS Ⅱ 4、8、16 mg·kg-1(ig, qd),至26周龄,阳性药组给予氯沙坦20 mg·kg-1,WKY和SHR组给予等体积的双蒸水。
1.3 大鼠血压测定采用Kent Scientific CODA测量大鼠在避光、安静环境下的鼠尾血压。
1.4 左心质量指数的计算给药12周后,称大鼠体重,用7%水合氯醛(0.35 g·kg-1)腹腔注射麻醉,取出心脏,分离左心室,计算左心质量指数=左心室(g) /体重(g)×100。
1.5 左心室病理学观察将左心室组织置于4%甲醛中固定48 h,脱水、包埋制成蜡块。切片后行HE染色,在光学显微镜下观察左心室组织的病理学变化。
1.6 左心室心肌细胞凋亡检测上述心脏蜡块切片、脱蜡,采用终浓度为20 mg·L-1的蛋白激酶K破膜、3% H2O2消除内源性过氧化物酶后,经TUNEL法染色,具体操作参照试剂盒说明书。最后用中性树胶封片,在光学显微镜下观察各组心肌细胞凋亡情况,正常细胞和凋亡细胞的细胞核分别被染成蓝色和棕黄色。
1.7 real-time RT-PCR法检测左心室组织Bcl-2、Bax mRNA水平取各组左心室组织,置于TRIzol中提取总RNA,经两步法-聚合酶链反应分别检测GAPDH、Bcl-2、Bax mRNA的水平。所检测基因的引物序列参照GenBank中大鼠GAPDH、Bcl-2、Bax序列设计(Tab 1)。目的基因表达用相对定量法,以PCR扩增过程中荧光信号强度达到阈值所需要的循环数(cycle threshold,Ct值)为统计参数,依次计算下列数据,Ct值的平均值= (Ctl + Ct2) /2(重复管);dCt = Ct值的平均值-中间值(相同检测基因的不同样品Ct值的平均值中居中的值);基因的表达= 2-dCt;相对定量=目的基因的表达/内参基因的表达×100,将WKY组的mRNA表达设为100。
| Gene | GenBank accession No | Forward primer (5′-3′) | Reverse primer (5′-3′) |
| Bcl-2 | NM_016993.1 | CTTCAGGGATGGGGTGAACT | CAGCCTCCGTTATCCTGGAT |
| Bax | NM_017059.2 | TCATGAAGACAGGGGCCTTT | CTGCAGCTCCATGTTGTTGT |
| GAPDH | NM_017008.4 | GAGACAGCCGCATCTTCTTG | TGACTGTGCCGTTGAACTTG |
取各组大鼠冰冻左室组织300 mg,剪碎后放入1 mL RIPA裂解液中,加入PMSF、蛋白磷酸酶抑制剂各10 μL,冰上匀浆后静置30 min,4℃下12 000 r·min-1离心20 min,取上清液,BCA法测定样本浓度。每孔上样量为10 μL(含30 μg蛋白),SDS-聚丙烯酰胺凝胶电泳。电泳后转至PVDF膜,5%蛋白封闭液封闭2.5 h,TBST洗膜10 min×3次,一抗GAPDH (1:10 000)、Bcl-2 (1:1 000)、Bax(1:1 000)、cleaved-caspase-3(1:2 000) 4℃过夜,TBST洗膜10 min×3次,二抗(1:2 000)常温浸泡1.5 h,ECL化学发光显色,CCD成像系统获取图像。
1.9 统计学分析所有数据均采用SPSS 18.0统计软件处理,以x±s表示,组间比较采用单因素方差分析。
2 结果 2.1 大鼠血压的变化如Tab 2所示,26周龄SHR血压较WKY明显升高(P<0.05),收缩压是WKY的1.36倍,舒张压是WKY的1.53倍;与SHR组相比,ICS Ⅱ中、高剂量组和阳性药组收缩压分别下降了9.6%、16.6%、20.9%(P<0.05);舒张压分别下降了13.6%、27.3%、35.3%(P<0.05)。以上结果表明ICS Ⅱ具有降低SHR血压的作用。
| Group | Systolic pressure/kPa | Diastolic pressure/kPa | Left ventricular mass index |
| WKY | 16.284±1.047 | 11.609±0.945 | 0.222±0.008 |
| SHR | 22.097±1.137# | 17.706±1.194# | 0.293±0.006# |
| ICSⅡ-L | 21.746±1.143 | 17.043±1.089 | 0.283±0.009 |
| ICSⅡ-M | 20.014±1.009* | 15.382±1.558* | 0.262±0.009* |
| ICSⅡ-H | 19.770±1.032* | 13.495±0.817* | 0.253±0.008* |
| Losartan | 18.181±1.095* | 11.946±0.898* | 0.247±0.005* |
| #P<0.05 vs WKY; *P<0.05 vs SHR | |||
与WKY组相比,SHR组左心质量指数升高(P<0.05);与SHR组相比,ICS Ⅱ中、高剂量及阳性药组左心质量指数明显下降(P<0.05),见Tab 2。
2.3 大鼠左心室病理学变化HE染色显示,WKY组心肌细胞大小正常、细胞排列规则;与其相比,SHR组心肌细胞肥大明显且排列紊乱,可见肌丝断裂。与SHR组相比,ICS Ⅱ组和阳性药组细胞肥大减轻且细胞排列趋于整齐,并且以ICS Ⅱ中、高剂量及阳性药组效果更为明显,见Fig 1。
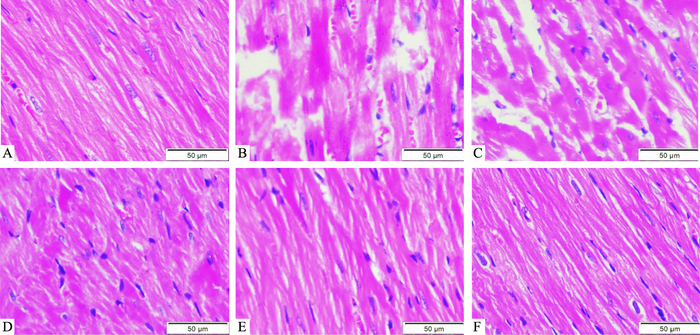
|
| Fig 1 Effects of ICS Ⅱ on left ventricular pathology in SHR (×400) A: WKY; B: SHR; C: ICS Ⅱ-L; D: ICS Ⅱ-M; E: ICS Ⅱ-H; F: Losartan |
TUNEL染色显示,与WKY组相比,SHR组心肌细胞凋亡明显增多;而与SHR组相比,ICS Ⅱ各剂量组和阳性药组心肌细胞凋亡不同程度减少。表明ICS Ⅱ能减少SHR心肌细胞凋亡,见Fig 2。
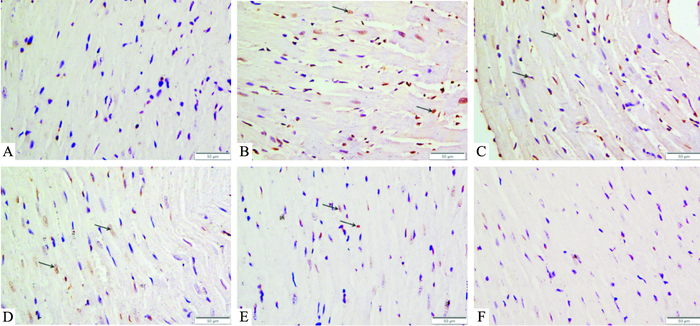
|
| Fig 2 Effects of ICS Ⅱ on apoptosis in left ventricular myocytes (×400) A: WKY; B: SHR; C: ICS Ⅱ-L; D: ICS Ⅱ-M; E: ICS Ⅱ-H; F: Losartan |
与WKY组相比,SHR组Bax mRNA水平明显上调(P<0.05),Bcl-2 mRNA水平明显下调(P<0.05);经ICS Ⅱ和氯沙坦处理后,Bcl-2 mRNA水平明显上调(P<0.05),Bax mRNA水平下调(P<0.05),见Fig 3。
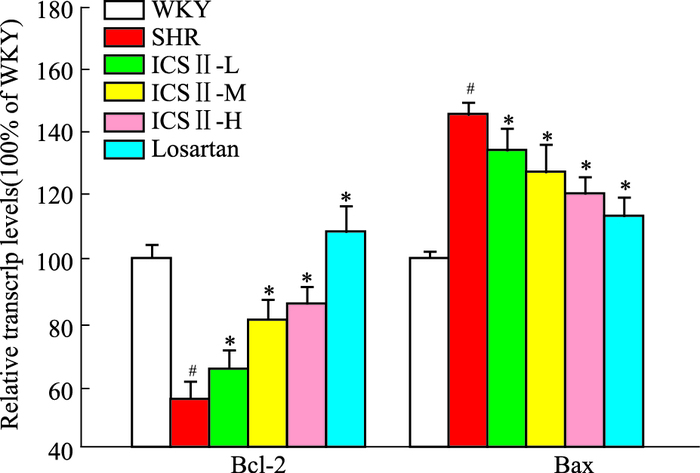
|
| Fig 3 Effects of ICS Ⅱ on left ventricular Bcl-2 and Bax mRNA levels (n=6) #P < 0.05 vs WKY; *P < 0.05 vs SHR |
与WKY组相比,SHR组Bax、cleaved-caspase-3蛋白表达明显上调,Bcl-2蛋白表达下调,Bax/Bcl-2比值升高(P<0.05);而给予ICS Ⅱ各剂量及氯沙坦治疗后,Bax、cleaved-caspase-3水平下调,Bcl-2蛋白表达上调,Bax/Bcl-2比值降低(P<0.05),见Fig 4。
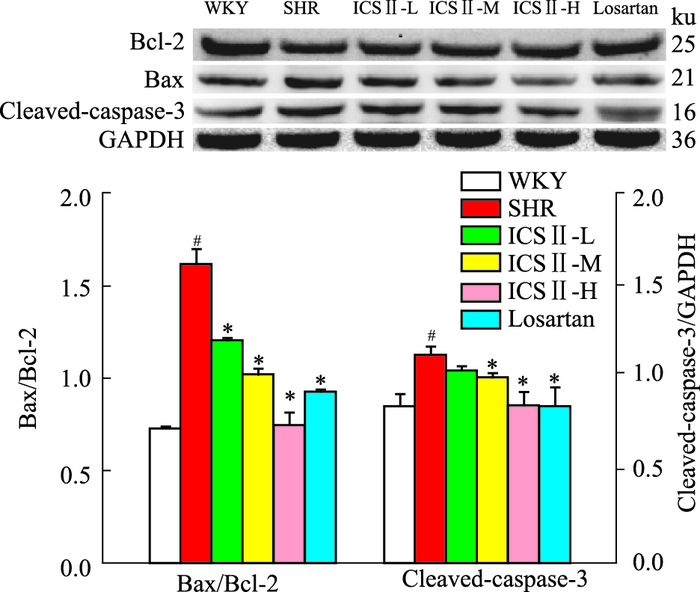
|
| Fig 4 Effect of ICS Ⅱ on expression of Bcl-2, Bax, cleaved-caspase-3 proteins and Bax/Bcl-2 in left ventricle (n=3) # P < 0.05 vs WKY; *P < 0.05 vs SHR |
SHR在第6~8周属于高血压前期,在12~14周发展为持续性高血压,随着疾病进展出现高血压终末靶器官损伤的许多特征,如心室重构、心力衰竭等[6]。在本研究中,26周SHR已有明显的动脉性高血压,收缩压和舒张压分别是WKY的1.36倍和1.53倍,而ICS Ⅱ能降低SHR血压,且以中高剂量效果明显。病理染色结果显示,与WKY组相比,SHR组心肌细胞肥大明显且排列紊乱,可见肌丝断裂,同时左心质量指数也明显升高,表明26周龄SHR已出现心室重构,这也与本课题组以往研究的报道一致[7]。而与SHR组比较,ICS Ⅱ中、高剂量和阳性药氯沙坦心肌细胞排列趋于整齐,心肌细胞肥大不同程度改善,且左心质量指数下降。故ICS Ⅱ具有改善SHR心室重构的作用,其机制可能部分与其降低动脉血压有关。
心肌细胞仅在胚胎时期进行分裂,当负荷增加时主要是以肥大的形式代偿。当负荷持续增加超过这种代偿能力时,可导致心肌细胞凋亡。大量研究指出,8周龄以上的SHR均有心肌细胞凋亡,16周龄后其凋亡明显加速,且细胞凋亡水平与左心室重塑之间具有明显相关性[6, 8-9]。本研究TUNEL染色结果显示,模型组心肌细胞凋亡数明显增多,而ICS Ⅱ各剂量及阳性药组心肌细胞凋亡减少。提示ICS Ⅱ具有抑制心肌细胞凋亡的作用。
大量报道指出,线粒体凋亡途径在高血压心脏重塑中起重要作用[10-11]。一直以来,Bcl-2家族都受到了广泛关注,它包括促凋亡家族和抗凋亡家族。促凋亡Bcl-2家族包括含有BH3-only结构域的蛋白(如Bim、Bid、Bad)和多结构域蛋白(如Bax、Bak)。在受到凋亡信号刺激时,BH3-only蛋白被激活,直接或间接促进Bax/Bak寡聚,使线粒体外膜通透性改变和细胞色素C释放,释放入细胞质的细胞色素C又可导致caspase-3裂解活化,执行细胞凋亡;抗凋亡Bcl-2家族主要通过与促凋亡家族成员形成异源二聚体,维持线粒体膜的通透性以抑制细胞色素C的释放,从而减轻细胞凋亡[12-14]。抗凋亡和促凋亡家族蛋白失衡是细胞凋亡的关键因素。在本项研究中,与WKY相比,SHR左心组织中促凋亡蛋白Bax mRNA和蛋白的表达上调,执行凋亡的cleaved-caspase-3蛋白上调,而抗凋亡蛋白Bcl-2 mRNA和蛋白的表达明显下调,Bax/Bcl-2比值升高,以上结果表明线粒体凋亡途径是SHR心肌细胞凋亡的途径之一。而经ICS Ⅱ处理后,抗凋亡蛋白Bcl-2 mRNA和蛋白表达明显上调,而Bax mRNA水平和Bax、cleaved-caspase-3蛋白表达均下调,Bax/Bcl-2比值降低,提示ICS Ⅱ可以通过抑制线粒体凋亡途径减轻SHR心肌细胞凋亡。
综上,ICS Ⅱ可减轻SHR左心室心肌细胞凋亡,其机制与其降低血压和抑制线粒体凋亡途径相关。
( 致谢: 本实验在遵义医学院基础药理教育部重点实验室暨特色民族药教育部国际合作联合实验室完成,感谢药理学教研室的支持和帮助,感谢朱玲、孙瑞敏、吴芹、黄波提供的帮助! )
| [1] | 蒋嘉烨, 罗珊珊, 栗源, 等. SHR高血压进程中肾脏蛋白表达谱的变化[J]. 中国药理学通报, 2012, 28(2): 189-94. Jiang J Y, Luo S S, Su Y, et al. Study in the renal protein expressions during the developing progress of SHR[J]. Chin Pharmacol Bull, 2012, 28(2): 189-94. |
| [2] | 邱华丽, 潘晓彦. 高血压病防治研究现状[J]. 世界中西医结合杂志, 2014, 9(2): 210-2. Qiu H L, Pan X Y. Current status of prevention and treatment of hypertension[J]. World J Integr Tradit Western Med, 2014, 9(2): 210-2. |
| [3] | 赫连曼, 王浩, 赵海鹰, 等. 黄芩苷对肾性高血压大鼠血压及抑制左心室重构的作用[J]. 中国动脉硬化杂志, 2017, 25(7): 693-700. He L M, Wang H, Zhao H Y, et al. Effect of Baicalin on blood pressure and inhibition of left ventricular remodeling in renovascular hypertensive rats[J]. Chin J Arteriosclerosis, 2017, 25(7): 693-700. |
| [4] | 赵艳红, 贾晓斌, 陈彦, 等. 淫羊藿苷大鼠在体肠吸收动力学的研究[J]. 中华中医药杂志, 2007, 22(10): 681-6. Zhao Y H, Jia X B, Chen Y, et al. Study on kinetics of intestine uptake of icariin in rats[J]. Chin J Tradit Chin Med, 2007, 22(10): 681-6. |
| [5] | Gao J, Deng Y Y, Yin C, et al. Icariside Ⅱ, a novel phosphodiesterase 5 inhibitor, protects against H2O2-induced PC12 cells death by inhibiting mitochondria-mediated autophagy[J]. Cell Mol Med, 2017, 21(2): 375-86. doi:10.1111/jcmm.2017.21.issue-2 |
| [6] | Abbate A, Scarpa S, Santini D, et al. Myocardial expression of surviving, an apoptosis inhibitor, in aging and heart failure. An experimental study in the spontaneously hypertensive rat[J]. Int J Cardiol, 2006, 111(3): 371-6. doi:10.1016/j.ijcard.2005.07.061 |
| [7] | 王颖婉, 李叶丽, 王俊逸, 等. PPARα?PPARγ的上调参与淫羊藿苷对自发性高血压大鼠心室重构的调节[J]. 中国药理学通报, 2015, 31(8): 1117-20. Wang Y W, Li Y L, Wang J Y, et al. Upregulation of PPARα and PPARγ in the regulation of ventricular remodeling in spontaneously hypertensive rats[J]. Chin Pharmacol Bull, 2015, 31(8): 1117-20. |
| [8] | Hamet P, Richard L, Dam T V, et al. Apoptosis in target organs of hypertension[J]. Hypertension, 1995, 26(4): 642-8. doi:10.1161/01.HYP.26.4.642 |
| [9] | Cuspidi C, Vaccarella A, Negri F, et al. Resistant hypertension and left ventricular hypertrophy: an overview[J]. J Am Soc Hypertens, 2010, 4(6): 319-24. doi:10.1016/j.jash.2010.10.003 |
| [10] | Zhang C, Wang F, Zhang Y, et al. Celecoxib prevents pressure overload-induced cardiac hypertrophy and dysfunction by inhibiting inflammation, apoptosis and oxidative stress[J]. J Cell Mol Med, 2016, 20(1): 116-27. doi:10.1111/jcmm.12709 |
| [11] | Hamet P, deBlois D, Dam T V, et al. Apoptosis and vascular wall remodeling in hypertension[J]. Can J Physiol Pharmacol, 1996, 74(7): 850-61. doi:10.1139/Y96-076 |
| [12] | Hardwick J M, Chen Y, Jonas E A. Multipolar functions of Bcl-2 proteins link energetics to apoptosis[J]. Trends Cell Biol, 2012, 22(6): 318-28. doi:10.1016/j.tcb.2012.03.005 |
| [13] | Chen Q, Xu T, Li D, et al. JNK/ PI3K/ Akt signaling pathway is involved in myocardial ischemia/ reperfusion injury in diabetic rats: effects of salvianolic acid A intervention[J]. Am J Transl Res, 2016, 8(6): 2534-48. |
| [14] | Wang X, Zhang C, Yan X, et al. A novel bioavailable BH3 mimetic efficiently inhibits colon cancer via cascade effects of mitochondria[J]. Clin Cancer Res, 2016, 22(6): 1445-58. doi:10.1158/1078-0432.CCR-15-0732 |

