


非小细胞肺癌(non-small cell lung cancer, NSCLC)是全世界范围内肺癌致死的主要原因,也是肺恶性肿瘤的主要病理类型。NSCLC的临床和实验肿瘤学研究尽管已取得了较大进展,但其预后仍不理想[1]。细胞周期是保证细胞正常生命活动的基本过程,通过细胞周期时相的有序变迁,细胞进入增殖、分化、衰老和死亡等生理状态。通过对肿瘤细胞周期进行调控可以有效抑制肿瘤细胞周期进展及其增殖能力。
麦冬皂苷B(ophiopogonin-B, OP-B)对NSCLC细胞株有广谱性的增殖抑制作用,前期研究表明OP-B可明显阻滞H460细胞的细胞周期在G0/G1期[2],但导致细胞周期阻滞的相关原因并不清楚。本研究中,我们通过免疫组化及细胞核染色观察OP-B对H460细胞有丝分裂的影响,通过对调控细胞周期的相关蛋白信号通路进行Western blot检测,试图发现导致周期阻滞及有丝分裂受限的主要原因,为OP-B的药理学作用机制研究进一步提供理论基础。
1 材料与方法 1.1 材料 1.1.1 细胞株NSCLC细胞株NCI-H460购自中国科学院上海生命科学院生物化学与细胞生物学研究所。
1.1.2 试剂麦冬皂苷-B购自南京泽朗医药科技有限公司(ZL20110412B),用二甲亚砜(DMSO)配成10 mmol·L-1的贮备液备用,细胞中使用时DMSO的最终浓度小于0.01%。胎牛血清及DMEM培养液购自Gibco公司;胰酶、牛血清白蛋白(BSA)、凝胶配制试剂盒、十字孢碱,均购自碧云天生物技术研究所;cyclinD1、cyclinD3、cyclinA2、cyclinE2、cyclinB1、CDK2、CDK4、CDK6、Myt1、p-Cdc2(Tyr15)、p-histone H3(Ser10)、p15、p21、p27、β-actin一抗及羊抗兔、羊抗鼠二抗、DAPI,均购自Cell Signaling公司;TUNEL检测试剂盒(美国Roche B.M)。
1.2 方法 1.2.1 细胞培养及给药处理将H460细胞培养于含10%胎牛血清的DMEM/F12培养液中,置37℃、5% CO2培养箱中培养,实验时取对数生长期细胞,胰酶消化,接种于6孔板。培养过夜后,分别给予0、5、10μmol·L-1的OP-B作用24 h,同时给予1μmol·L-1的十字孢碱作对照处理组,用作细胞核形态观察。
1.2.2 TUNEL免疫组化将细胞以2×108·L-1的密度接种到6孔板中进行细胞爬片,待细胞贴壁后给药处理。将爬片细胞在4%多聚甲醛中室温固定25 min;PBS浸洗2次;0.2%的Triton X-100透化细胞5 min;PBS浸洗2次;新鲜配制的3% H2O2室温处理细胞5 min;PBS浸洗2次;玻片干后,加50 μL TUNEL反应混合液(TdT与dUTP按1:9混合)于细胞上,阴性对照组仅加50 μL dUTP液,避光湿盒37℃反应60 min;PBS浸洗3次;玻片干后,加50 μL converter-POD于细胞上,避光湿盒37℃反应30 min;PBS浸洗3次;加100 μL DAB显色剂,室温反应10 min;PBS浸洗3次;苏木精复染数秒,立即用自来水冲洗;梯度乙醇脱水,二甲苯透明,中性树胶封片。每张切片在高倍镜下(×200和×400)随机选取5个不重叠的视野进行拍照。
1.2.3 DAPI染色H460细胞提前1 d接种于6孔细胞培养板,次日进行OP-B给药(10μmol·L-1)24 h,弃去细胞培养基,用PBS洗涤细胞2次,4%多聚甲醛室温固定20 min,PBS洗细胞3次,加入DAPI(1 mg·L-1)室温避光染色5 min,PBS洗涤细胞之后,于荧光倒置显微镜(徕卡DM18)下观察并拍照(×200)。
1.2.4 Western blot检测细胞内相关蛋白变化取对数生长期细胞消化接种到6孔板中,细胞密度为5×108·L-1。药物处理一定时间后,收集细胞并用PBS洗涤2次,每孔加入细胞裂解液200 μL,12 000 r·min-1离心20 min,收集蛋白并定量。取一定量的蛋白,加入5×电泳上样缓冲液,沸水浴变性5 min,经12%的SDS-聚丙烯酰胺凝胶电泳后,电转移至NC膜,5%脱脂奶粉封闭后,加入一抗4℃孵育过夜、二抗室温孵育1 h,TBST缓冲液洗涤3次,每次10 min,滴加ECL发光液,置于Bio-Rad凝胶成像仪中曝光,并采集图像。
2 结果 2.1 OP-B对H460细胞核物质及形态的影响如Fig 1所示,与对照组相比,细胞经过10 μmol·L-1的OP-B给药后,表现为细胞结构松散,胞质空泡化严重,细胞核边缘化,但和十字孢碱处理组相比,并未出现细胞核严重固缩的明显细胞凋亡现象。

|
| Fig 1 Observation of OP-B on nuclear morphology and nuclear matter in H460 cells by TUNEL immunohistochemical assay |
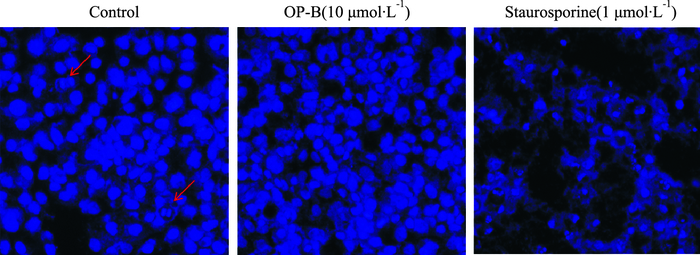
Fig 2的DAPI核染色结果表明,对照组细胞核在分布和形态上较均匀,且其中明显观察到处于有丝分裂状态的细胞核(箭头所示),十字孢碱处理组细胞则明显出现核固缩的凋亡特征,而10 μmol·L-1 OP-B给药组则既没有有丝分裂现象,也没有凋亡的细胞核形态。
|
| Fig 2 Observation of OP-B on cell mitosis and apoptosis in H460 cells by DAPI staining |
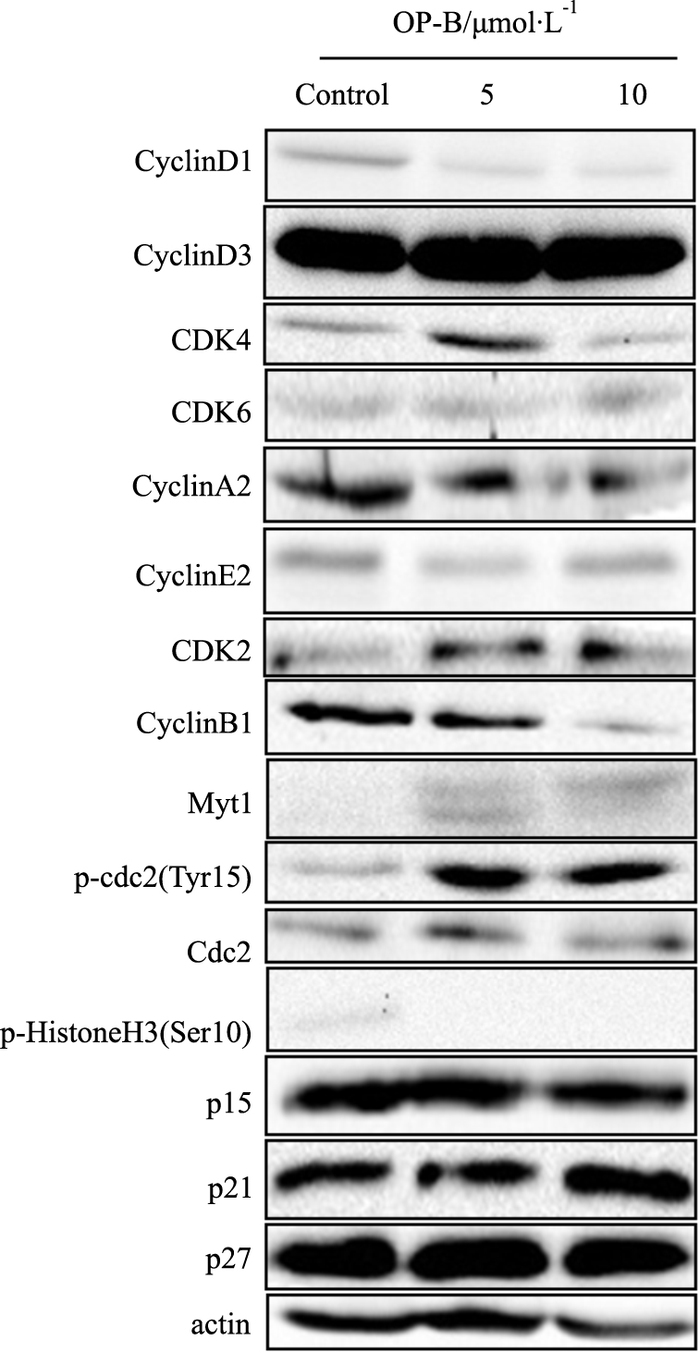
Fig 3结果表明,5、10μmol·L-1的OP-B明显抑制cyclinD1的表达,在10μmol·L-1浓度下对CDK4、cyclinB1也有明显抑制,对CyclinD3、CyclinA2、CyclinE2、CDK2、CDK6无显著影响。另外,OP-B还明显诱导Myt表达升高,继而导致其下游Cdc2磷酸化水平明显上调,Cdc2的磷酸化导致其活性被抑制,是导致细胞有丝分裂停止的主要原因。同时,我们检测了histoneH3在Ser10位点的磷酸化水平,其和细胞有丝分裂水平直接相关,结果发现在5、10μmol·L-1的OP-B作用下,p-histoneH3均被明显抑制,表明有丝分裂的停止;在细胞周期抑制性蛋白的表达上,观察到OP-B上调p21的表达,而对p15、p27无明显的调控作用。
|
| Fig 3 Western blot detection of effects of OP-B on cell cycle and mitosis regulated proteins in H460 cells |
OP-B是一种对NSCLC具有多靶点作用的麦冬皂苷类单体化合物[3]。前期研究中我们发现,OP-B能诱导H460细胞周期阻滞在G0/G1期,但相关的分子机制尚不清楚[2]。在此基础上,本研究进一步通过TUNEL免疫组化及DAPI核染色进行H460细胞核物质及核形态的观察,发现OP-B并不能诱导细胞凋亡,而是有抑制细胞有丝分裂的迹象。
众所周知,细胞周期分为4个时相,即G1期(DNA及蛋白质合成准备期)、S期(DNA合成期)、G2期(有丝分裂准备期)、M期(有丝分裂期)。在G1/S与G2/M两个过渡期各有1个检查点,分别制止G1期受损DNA进入S期进行复制和G2期受损DNA进入M期进行有丝分裂,从而中止细胞周期。
细胞周期蛋白(cyclin)是细胞周期调控的变速器,细胞周期依赖性蛋白激酶(cyclin-dependent kinase, CDK)是细胞周期调控的发动机,只有二者有机结合成cyclin/CDK复合物,并且作用于不同底物,才能对细胞分裂、细胞周期运行等过程进行调控[4]。CyclinD1是调控细胞周期G1期的关键蛋白,其结合并激活G1期特有的周期蛋白依赖性激酶CDK4,继而G1期周期抑制蛋白(Rb)发生磷酸化,并从E2F转录因子上解离,使E2F转录因子起始转录激活细胞周期的基因,从而推动细胞周期由G1时期进入到S时期[5]。CyclinE主要在G1晚期发挥作用[6-7]。CyclinE-CDK2为细胞从G1进入S期的关键激酶复合物[8-10]。CyclinE与CDK2结合后, 磷酸化其底物蛋白, 如视网膜母细胞瘤蛋白(pRb)、pRb家族成员p107、CDC6、定位于AT位点的核蛋白p220(NPAT)等, 使DNA合成得以进行, 细胞由G1期进入S期。另外,有丝分裂调控的焦点是MPF,它由调节亚基cyclinB1和催化亚基CDK1组成,其活性调节在有丝分裂起始、中后期转换以及有丝分裂退出调控中起重要作用。MPF活性主要受其催化亚基CDK1磷酸化/去磷酸化的调控以及其调节亚基cyclin B1的合成、亚细胞定位以及降解的调控。在G1期,cyclinB1蛋白水平极低;在S、G2期,其表达水平逐渐升高,并与CDK1形成MPF酶复合物,此时MPF主要定位于中心体,其催化亚基CDK1被Wee1、Myt1磷酸化而处于失活状态[11];在G2晚期,cyclinB1蛋白水平达到峰值,同时其N端发生磷酸化,促使MPF快速转移入核,在CDC25C的作用下,CDK1去磷酸化,其活性抑制被解除,从而导致MPF被活化[12]。活化的MPF磷酸化有丝分裂相关蛋白,如核纤层蛋白、组蛋白、微管蛋白等,导致核膜崩解、染色体凝集、有丝分裂微管形成,从而促使细胞进入有丝分裂期[13-14]。
细胞周期的调控蛋白还有CKIs,其通过竞争性地抑制cyclin或cyclin/CDK复合物,导致cyclin生物学功能丧失,从而对细胞生长起负调控作用。目前发现的CKI分为Ink4 (inhibitor of CDK4)和Kip (kinase inhibition protein)两大家族。Ink4包括P16ink4a、P15ink4b、P18ink4c和P19ink4d,特异性抑制CDK4/cyclinD1、CDK6/cyclinD1复合物;Kip包括P21cip1(cyclin inhibition protein 1)、P27kip1(kinase inhibition protein 1)和P57kip2等,能抑制大多数CDK的激酶活性。
通过对细胞周期和有丝分裂调控蛋白进行蛋白免疫印迹检测发现,G0/G1期周期调控蛋白cyclinD1、cyclinE2、CDK4、cyclinB1的表达均被OP-B明显抑制。另外,p-histoneH3(Ser10)水平代表着细胞的有丝分裂水平,我们观察到OP-B给药后明显抑制了p-histoneH3(Ser10)水平,表明细胞有丝分裂的停滞,而导致细胞有丝分裂被阻止的直接原因就是OP-B明显上调了Myt的表达水平及Cdc2的磷酸化水平,OP-B调控Myt /Cdc2信号通路的相关机制将有待进一步探讨。
| [1] | Verdecchia A, Francisci S, Brenner H, et al. Recent cancer survival in Europe: a 2000-02 period analysis of EUROCARE-4 data[J]. Lancet Oncol, 2007, 8(9): 784-96. doi:10.1016/S1470-2045(07)70246-2 |
| [2] | Chen M, Du Y, Qui M, et al. Ophiopogonin B-induced autophagy in non-small cell lung cancer cells via inhibition of the PI3K/Akt signaling pathway[J]. Oncol Rep, 2013, 29(2): 430-6. doi:10.3892/or.2012.2131 |
| [3] | 陈美娟, 赵若琳, 郭园园, 等. 麦冬皂苷B对A549细胞株体外黏附?侵袭及迁移的抑制作用及机制研究[J]. 中国药理学通报, 2015, 31(5): 660-4. Chen M J, Zhao R L, Guo Y Y, et al. Inhibitory effect of ophiopogonin-B on adhesion, invasion and migration of A549 cells in vitro[J]. Chin Pharmacol Bull, 2015, 31(5): 660-4. |
| [4] | Evan G I, Vouaden K H. Proliferation, cell cycle and apoptosis in cancer[J]. Nature, 2001, 411(6835): 342-8. doi:10.1038/35077213 |
| [5] | Coqueret O. Linking cyclins to transcription control[J]. Gene, 2002, 299(1-2): 35-55. doi:10.1016/S0378-1119(02)01055-7 |
| [6] | Ohtsubo M, Theodoras A M, Schumacher J, et al. Human cyclin E, a nuclear protein essential for the G1 to S phase transition[J]. Mol Cell Biol, 1995, 15(5): 2612-24. doi:10.1128/MCB.15.5.2612 |
| [7] | Krude T, Jackman M, Pines J, et al. Cyclin/cdk-dependent initiation of DNA replication in a human cell-free system[J]. Cell, 1997, 88(1): 109-19. doi:10.1016/S0092-8674(00)81863-2 |
| [8] | Duli′cV, Lees E, Reed SI. Association of human cyclin E with a periodic G1-S phase protein kinase[J]. Science, 1992, 257(5078): 1958-61. doi:10.1126/science.1329201 |
| [9] | Pagano M, Pepperkok R, Lukas J, et al. Regulation of the cell cycle by the cdk2 protein kinase in cultured human fibroblasts[J]. J Cell Biol, 1993, 121(1): 101-11. doi:10.1083/jcb.121.1.101 |
| [10] | Tetsu O, McCormick F. Proliferation of cancer cells despite CDK2 inhibition[J]. Cancer Cell, 2003, 3(3): 233-45. doi:10.1016/S1535-6108(03)00053-9 |
| [11] | Morgan D O. Principles of CDK regulation[J]. Nature, 1995, 374(6518): 131-4. doi:10.1038/374131a0 |
| [12] | Boutros R, Dozier C, Ducommun B. The when and wheres of CDC 25 phosphatases[J]. Curr Opin Cell Biol, 2006, 18(2): 185-91. doi:10.1016/j.ceb.2006.02.003 |
| [13] | Nigg E A. Mitotic kinases as regulators of cell division and its check-points[J]. Nat Rev Mol Cell Biol, 2001, 2(1): 21-32. doi:10.1038/35048096 |
| [14] | Pines J. Mitosis: a matter of getting rid of the right protein at the right time[J]. T Cell Biol, 2006, 16(1): 55-63. doi:10.1016/j.tcb.2005.11.006 |

