


2. 中南大学湘雅药学院药理学系,湖南 长沙 410078
2. Dept of Pharmacology, Xiangya School of Pharmaceutical Sciences, Central South University, Changsha 410078, China
心肌缺血/再灌注(ischemia/reperfusion,I/R)损伤是指心肌缺血恢复灌流后,引起心肌细胞超微结构、功能、代谢障碍及电生理方面发生进一步的损伤。大量研究表明,I/R损伤时的炎症反应与Toll样受体(Toll-like receptors,TLRs)密切相关[1]。TLR2缺陷小鼠I/R损伤时,心肌梗死面积减小,氧自由基生成和白细胞浸润减少[2]。TLR4缺陷小鼠心肌I/R时,炎症和组织损伤也明显减轻[3]。预先给予TLR4拮抗剂eritoran(E-5564)可减轻I/R的炎症反应[4]。在体I/R时,TLR介导的髓样分化因子88(myeloid differentiation factor 88, MyD88)依赖性信号通路被激活,表现为迅速激活IκB激酶(IKKβ),增加IκBα磷酸化和降解,导致心肌中核因子κB(nuclear factor-κB, NF-κB)活化[1];给予磷酸葡聚糖可使TLR磷酸化,从而与MyD88分离,使下游的NF-κB信号通路转为磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase, PI3K)/Akt信号通路而起保护作用[5]。
中药吴茱萸的主要药理活性成分吴茱萸次碱(rutaecarpine,Rut)具有很强的正性肌力、正性频率作用和舒血管作用[6]。已证明吴茱萸次碱能减轻离体和在体心肌I/R损伤,其机制与促进辣椒素敏感的感觉神经主要递质降钙素基因相关肽(calcitonin gene related peptide,CGRP)的合成与释放明显相关[6]。CGRP除了对心肌I/R损伤具有保护作用外,也可抑制免疫细胞的激活和TLR介导的炎症反应[7]。本实验旨在研究吴茱萸次碱是否通过抑制TLR4/NF-κB信号通路保护大鼠心肌I/R损伤,以及保护作用是否与升高血浆中CGRP水平有关。
1 材料与方法 1.1 试剂Capsazepine(溶于含20%二甲亚砜和80%无水乙醇的溶媒)、伊文思蓝(溶于生理盐水)、氯化三苯基四氮唑(溶于磷酸缓冲液)、焦磷酸二乙酸,均购自Sigma公司;吴茱萸次碱(纯度>98%,溶于含20%二甲亚砜和80%无水乙醇的溶媒),由中南大学湘雅药学院提供;TRIzol(Invitrogen);逆转录试剂盒(MBI);Taq DNA聚合酶(北京博大泰克生物技术公司);TLR4引物(广州英韦创津生物科技有限公司);GAPDH引物(宝生物工程有限公司);兔抗鼠TLR4多克隆抗体(Santa Cruz);NF-κB兔单克隆抗体(Epitomics);免疫组织化学试剂盒(晶美生物工程有限公司);CGRP放射免疫试剂盒(北京东亚放射免疫研究所);肌酸激酶(creatine kinase, CK)试剂盒(北京中生北控生物工程技术股份有限公司)。
1.2 仪器DH-150型小动物人工呼吸机(浙江大学医学仪器厂),紫外分光光度计(Eppendorf),高速冷冻离心机(Heraeus公司),Tgradient PCR仪(Biometra公司),凝胶成像系统(Labwork Uvp Inc),MIAS医学图像分析系统(北航公司),Motic B5显微摄像系统(麦克奥迪实业集团公司),Shandon325型石蜡切片机(英国Shandon公司),LEICA DM LB2型双目显微镜(德国LEICA公司)。
1.3 动物和实验设计清洁级Sprague-Dawley大鼠,♂,体质量(250±30) g,由中南大学湘雅医学院实验动物中心提供,合格证号为SCXK(湘)2009-0004。大鼠被随机分为9组:正常对照组(Con, n=5)、假手术组(Sham, n=5)、I/R组(n=7)、低剂量吴茱萸次碱处理组(Rut 100 μg·kg-1,n=6,I/R前10 min静脉注射)、高剂量吴茱萸次碱处理组(Rut 300 μg·kg-1,n=6,I/R前10 min静脉注射)、选择性辣椒素受体拮抗剂capsazepine+高剂量吴茱萸次碱处理组(Capz 1.5 mg·kg-1+Rut 300 μg·kg-1,n=6,I/R前12 min静脉注射capsazepine,2 min后静脉注射吴茱萸次碱)、溶媒处理组(Vehicle 0.125 mL·kg-1,n=5,I/R前10 min静脉注射)、正常对照组+Capsazepine(Con+Capz 1.5 mg·kg-1,n=5, I/R前12 min静脉注射)、正常对照组+溶媒(Con+ Vehicle 0.125 mL·kg-1,n=5, I/R前10 min静脉注射)。
1.4 在体大鼠I/R模型的制备大鼠用10%水合氯醛(300 mg·kg-1)腹腔注射麻醉,行气管插管,连接小动物呼吸机,进行正压呼吸,频率每分钟30~35次,潮气量为15 mL·kg-1。连心电图机。消毒局部皮肤,于左侧第3、4肋间距正中线开外5 mm处开胸,剪开心包膜,暴露心脏,以肺动脉圆锥与左心耳之间的左冠状静脉主干为标志,用0-0缝合线结扎左冠状动脉前降支,缺血60 min,剪开结扎线再灌注3 h。同时测心电图观察Ⅰ、Ⅱ、Ⅲ、aVR、aVF、aVL导联,尤以Ⅰ、Ⅱ、aVL导联的S-T段呈弓背型抬高,且肉眼观察结扎区变白等心肌缺血表现为心肌缺血成功。
1.5 心肌梗死面积的测定再灌注结束后,颈动脉采血,再次结扎左冠状动脉,从下腔静脉注入1%伊文思蓝生理盐水溶液1 mL,取出心脏,用滤纸吸干,称重,非缺血区染为蓝色,缺血区不染色,放置-20℃冰箱,20 min后取出,将心肌均匀切成6~8片,每片厚约1 mm,放置于1%TTC磷酸缓冲液(pH 7.4)中,37℃水浴15 min左右。坏死区因无脱氢酶故不染色,未坏死区因含有完整的脱氢酶故染为红色。标本在4%多聚甲醛溶液中固定24 h后照相,用图像分析软件分别测定危险区(area at risk,AAR,梗死区与非梗死区面积之和)和坏死区(area of necrosis)的面积(mm2)。梗死面积大小用梗死区面积与危险区面积的比值表示。
1.6 血中CK和CGRP浓度的测定再灌注结束后,颈动脉采两管血,各2 mL,一管离心后取上清,按照试剂盒说明书中介绍的N-乙酰半胱氨酸活化法测定血清CK活性(U·L-1)。另一管标本收集于10% Na2EDTA 30 μL和抑肽酶400 mU·L-1的离心管中,离心后收集血浆,按CGRP放免试剂盒方法测定其浓度(ng·L-1)。
1.7 免疫组织化学染色模型成功后,颈动脉采血,然后用4%多聚甲醛灌流,取心脏标本,放入4%多聚甲醛中固定24 h。包埋后的组织蜡块在组织切片机上做连续8 μm切片,并将切片贴附于已处理过的载玻片上烤干备用。随后经过二甲苯脱蜡、乙醇脱二甲苯,苏木精伊红染色评价形态学。用3% H2O2孵育10 min以消除内源性过氧化物酶活性。滴加封闭液封闭10 min,倾去,分别滴加兔抗鼠TLR4抗体(1 :100)、兔抗鼠NF-κB特异抗体(1 :100)后,将组织切片放置于湿盒中,4℃过夜。PBS冲洗后,加入生物素标记的山羊抗兔IgG,室温下孵育15 min,PBS冲洗3次各3 min。滴加辣根过氧化物酶标记的链酶卵白素工作液,室温孵育15 min,PBS冲洗3次各3 min。DAB显色。每张切片均设有阴性对照,用PBS代替一抗,其余操作步骤不变。通过光学显微镜观察染色结果并照相。采用MIAS医学图像分析系统计数,每张切片随机分析5个视野(×400),计算机自动测量阳性信号强度,得出平均光密度值,棕黄色为阳性信号。
1.8 HE染色制作组织切片方法同前。组织切片先经过两次各15 min的二甲苯脱蜡,在由高到低浓度梯度的乙醇(100%、90%、80%、70%)中各浸泡3 min。然后,苏木精染色1~3 min,1%盐酸乙醇分化10 s,稀氨水返蓝20 s,伊红染色3 min。以上每步处理间均用蒸馏水冲洗3次各1 min。再经过由低到高浓度梯度(70%、80%、90%、100%)乙醇脱水各5 min,二甲苯透明2次各15 min后,用中性树脂封片。通过光学显微镜观察染色结果并照相。
1.9 半定量反转录聚合酶链反应采用TRIzol试剂提取心肌总RNA。用紫外分光光度计测量总RNA的浓度(mg·L-1)、A260/A280的OD比值(要求1.8<OD260/280<2.0)。选取符合要求的RNA样本后,用1.0%琼脂糖凝胶,电泳鉴定RNA完整性,总RNA可见28 S、18 S和5 S三条带。取RNA 4 μg用于逆转录合成cDNA,总反应体系为20 μL。根据大鼠TLR4基因(No.NM_019178)和GAPDH基因(No.NM_017008)设计cDNA的引物序列分别是:5′-CAGCTCTCAACCTTGGTACT-3′和5′-GATGGAC ATGTAAACCAGTC-3′(TLR4);5′-AACTCCCTCAA GATTGTCAGC-3′和5′-GGGAGTTGCTGTTGAAGTC ACA-3′(GAPDH)。TLR4扩增反应条件是94℃变性5 min;94℃变性45 s,64℃退火45 s,72℃延伸1 min,共37个循环;最后72℃延伸10 min。GAPDH扩增反应条件不同的是58℃退火45 s,共25个循环。扩增结束后,取PCR产物8 μL,1.0%琼脂糖凝胶电泳20 min,用DNA分子量参照物PUX Mix Marker同时电泳,PCR产物在紫外透射仪上检测,用凝胶成像分析系统扫描并半定量分析TLR4/GAPDH的光密度比值。
1.10 统计学方法所有数据均以x±s表示。用单因素方差分析进行统计学处理,组间差异采用Student-Newman-Keuls多重比较t检验。所有数据用SPSS 17.0统计软件包统计处理。
2 结果 2.1 吴茱萸次碱对心肌梗死面积的影响如Tab 1所示,各组大鼠心脏质量和心肌危险区面积无明显差异(P>0.05),提示各组动物冠脉结扎部位具有可比性。吴茱萸次碱(100、300 μg·kg-1)能明显减小心肌梗死面积,其作用可被capsazepine取消。溶媒对心肌梗死面积无明显影响(P>0.05)。
| Group | n | Body weight/g | Heart wet weight/g | Area at risk /mm2 | Infarct size/% |
| I/R | 7 | 252.3±3.2 | 0.86±0.01 | 343.0±13.6 | 40.39±2.40 |
| Rut(100 μg·kg-1) | 6 | 262.6±7.1 | 0.87±0.01 | 393.2±87.3 | 25.37±0.95* |
| Rut(300 μg·kg-1) | 6 | 248.4±9.5 | 0.86±0.02 | 336.5±33.7 | 18.45±1.24* |
| Rut(300 μg·kg-1) +Capsazepine | 6 | 253.2±3.4 | 0.84±0.02 | 335.1±35.3 | 45.39±2.08△ |
| Vehicle | 5 | 261.8±4.7 | 0.86±0.02 | 365.4±43.6 | 42.09±2.10 |
| *P<0.05 vs I/R; △P<0.05 vs Rut 300 μg·kg-1 | |||||
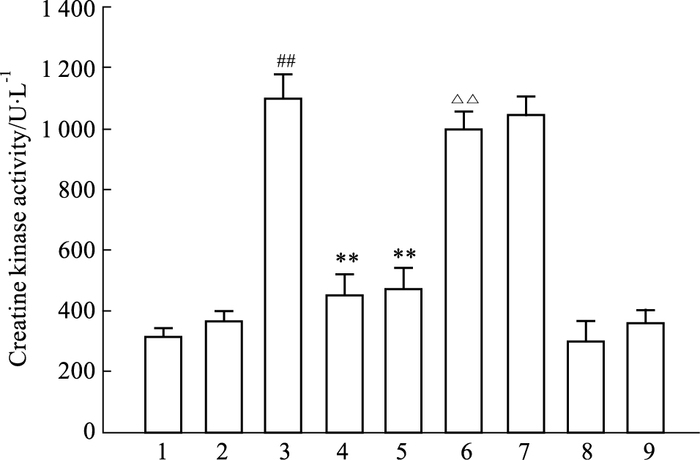
如Fig 1所示,与假手术组相比,I/R组血清CK活性明显升高(P<0.01)。吴茱萸次碱(100、300 μg·kg-1)能明显降低I/R导致的血清中CK活性升高(P<0.01),其作用可被Capsazepine取消(P<0.01)。capsazepine和溶媒对CK的活性无明显影响。
|
| Fig 1 Effects of rutaecarpine on serum CK activity in rats with myocardial I/R injury (n=5~7) 1:Con; 2:Sham; 3:I/R; 4:Rut (L); 5:Rut (H); 6:Rut (H) +Capz; 7:Vehicle; 8:Con+Capz; 9:Con+Vehicle.##P < 0.01 vs sham; **P < 0.01 vs I/R; △△P < 0.01 vs Rut 300 μg·kg-1 |
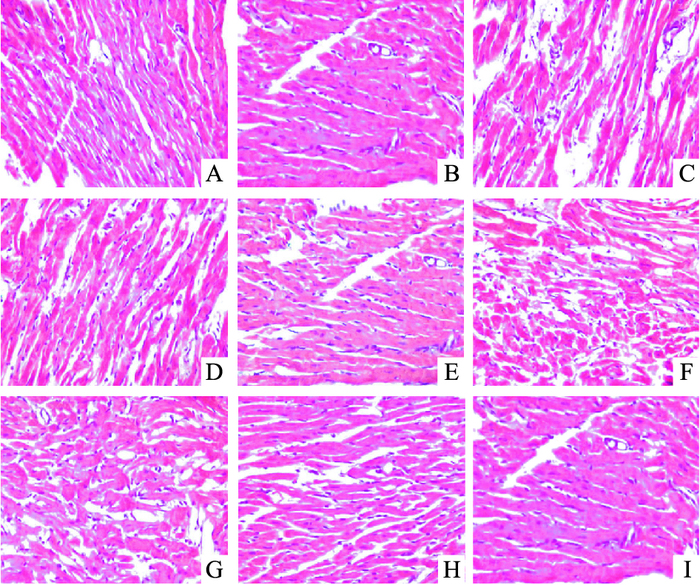
正常对照组和假手术组大鼠左心室心肌纤维排列整齐呈束状,细胞边界完整,心肌间质未见炎性细胞浸润。I/R组心肌纤维呈现大片坏死,界限不清,心肌细胞肿胀变性,胞核有浓缩或溶解,部分心肌纤维扭曲、断裂,伴有大量的中性粒细胞及淋巴细胞浸润。吴茱萸次碱处理组与I/R组相比,心肌纤维排列较整齐,坏死明显减少,水肿明显减轻,炎性细胞浸润也明显减少(Fig 2)。
|
| Fig 2 Myocardial HE staining in rats (×400) A: Control group; B: Sham-operated group; C: I/R group; D: Rut 100 μg·kg-1 group; E: Rut 300 μg·kg-1 group; F: Rut (300 μg·kg-1) + Capz (1.5 mg·kg-1) group; G: Vehicle group; H: Control+Capz; I: Control+Vehicle. |
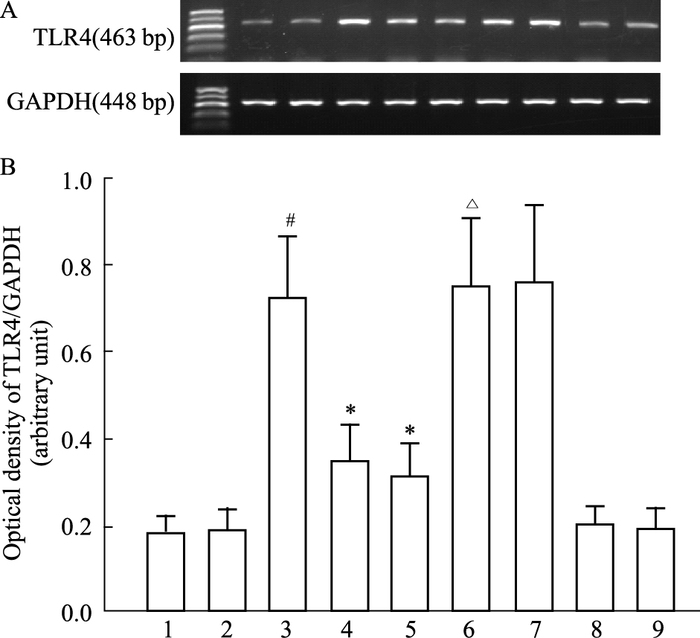
如Fig 3所示,与假手术组比较,I/R组TLR4 mRNA表达水平明显升高(P<0.05)。吴茱萸次碱(100、300 μg·kg-1)能明显降低I/R引起的TLR4 mRNA表达水平升高(P<0.05),其作用可被Capsazepine取消(P<0.05)。capsazepine和溶媒对TLR4 mRNA的表达无明显影响。
|
| Fig 3 Effects of rutaecarpine on myocardial TLR4 mRNA expression during I/R injury in rats (n=5~7) 1:Con; 2:Sham; 3:I/R; 4:Rut (L); 5:Rut (H); 6:Rut (H) + Capz; 7:Vehicle; 8:Con+Capz; 9:Con+Vehicle. A: RT-PCR products of TLR4 and GAPDH; B: Optical density of TLR4/GAPDH.#P < 0.05 vs sham; *P < 0.05 vs I/R; △P < 0.05 vs Rut 300 μg·kg-1. |
与假手术组比较,I/R组TLR4蛋白表达水平明显增加(P<0.05);吴茱萸次碱(100、300 μg·kg-1)能明显减少I/R引起的TLR4蛋白表达增加(P<0.05),其作用可被capsazepine取消(P<0.05);capsazepine和溶媒对TLR4蛋白表达无明显影响(Fig 4)。与假手术组比较,I/R组NF-κB蛋白表达水平明显增加(P<0.01);吴茱萸次碱(100、300 μg·kg-1)能明显减少I/R所致NF-κB蛋白表达增加(P<0.01),其作用可被capsazepine取消(P<0.01);capsazepine和溶媒对NF-κB蛋白表达无明显影响(Fig 5)。

|
| Fig 4 Immunohistochemical analysis of myocardial TLR4 protein during I/R in rats (n=5~7) A: Positive expression of TLR4 (×400). a: Control group; b: Sham-operated group; c: I/R group; d: Rut 100 μg·kg-1 group; e: Rut 300 μg·kg-1 group; f: Rut (300 μg·kg-1) + Capz (1.5 mg·kg-1) group; g: Vehicle group; h: Control+Capz; i: Control+Vehicle. B: Optical density.1:Con; 2:Sham; 3:I/R; 4:Rut (L) ; 5:Rut (H) ; 6:Rut (H) + Capz; 7:Vehicle; 8:Con+Capz; 9:Con+Vehicle. #P < 0.05 vs sham; *P < 0.05 vs I/R; △P < 0.05 vs Rut 300 μg·kg-1. |

|
| Fig 5 Immunohistochemical analysis of myocardial NF-κB protein during I/R in rats (n=5~7) A: Positive expression of NF-κB (×400). a: Control group; b: Sham-operated group; c: I/R group; d: Rut 100 μg·kg-1 group; e: Rut 300 μg·kg-1 group; f: Rut (300 μg·kg-1) + Capz (1.5 mg·kg-1) group; g: Vehicle group; h: Control+Capz; i: Control+Vehicle. B: Optical density.1:Con; 2:Sham; 3:I/R; 4:Rut (L) ; 5:Rut (H) ; 6:Rut (H) + Capz; 7:Vehicle; 8:Con+Capz; 9:Con+Vehicle. ##P < 0.01 vs sham; **P < 0.01 vs I/R; △△P < 0.01 vs Rut 300 μg·kg-1. |
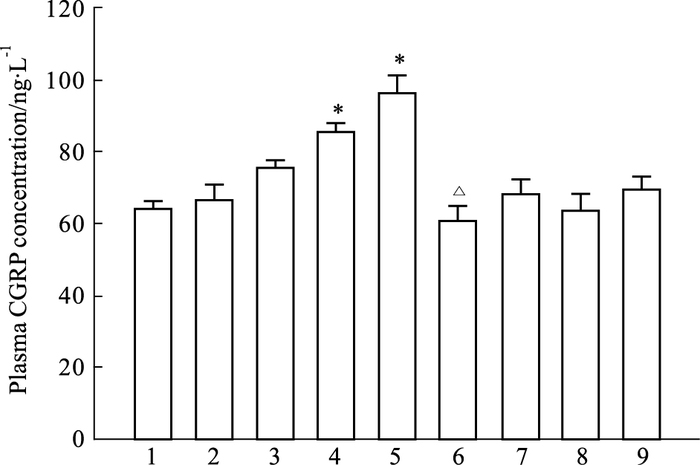
如Fig 6所示,与I/R组比较,吴茱萸次碱(100、300 μg·kg-1)能明显升高血浆中CGRP的浓度(P<0.05),其促CGRP释放作用可被capsazepine取消(P<0.05)。Capsazepine和溶媒对CGRP释放无明显影响。
|
| Fig 6 Effects of rutaecarpine on plasma CGRP concentration in myocardial I/R injury in rats (n=5~7) 1:Con; 2:Sham; 3:I/R; 4:Rut (L) ; 5:Rut (H) ; 6:Rut (H) + Capz; 7:Vehicle; 8:Con+Capz; 9:Con+Vehicle.*P < 0.05 vs I/R; △P < 0.05 vs Rut 300 μg·kg-1 |
TLR4作为一种模式识别受体,在先天性免疫和获得性免疫之间形成重要联系[8]。TLR4除分布在免疫细胞外,在心血管系统如血管内皮细胞、心肌细胞也有高表达[9]。大量研究表明,TLRs信号通路与心血管疾病的发生、发展密切相关,目前研究主要集中在高血压、动脉粥样硬化、病毒性心肌炎、败血症等发病的机制,倾向于认为心肌有一套功能完整的先天性免疫系统[10]。已证实TLR4主要通过MyD88依赖的NF-κB信号转导通路激活免疫和炎症反应[5],此通路在调节免疫和炎症反应中可能起重要作用。静息状态下,NF-κB以一种无活性的形式在胞质中与抑制性蛋白IκB相结合;在刺激因素作用下,IκB磷酸化并降解,NF-κB由胞质转移到胞核,启动一系列重要炎症相关基因的转录。在冠状内皮细胞,TLR4激活可促进TNF-α、IL-1、血管细胞黏附分子1及细胞间黏附分子1的表达[11],这些炎性因子基因启动子上都含有NF-κB的结合位点。而当机体遭受I/R时,心肌和内皮细胞可表达一些炎症因子,如IL-1、IL-6、IL-10、TNF-α等,启动和调节局部的炎症反应,从而诱发心脏损伤[12]。而且,在心肌I/R损伤模型中,NF-κB的活性和炎症因子基因的表达都增加[13]。因此,TLR4介导的炎症反应在I/R损伤中的作用也引起越来越多的关注。
CGRP是辣椒素敏感的感觉神经主要递质,广泛存在于动物和人的心血管组织。CGRP除具有正性肌力、正性频率和强大的舒血管作用外,对缺血心肌和内皮细胞具有保护作用[14]。我们前期研究证实,中药吴茱萸的主要药理活性成分吴茱萸次碱能减少离体和在体心肌I/R损伤,其保护作用与激活辣椒素受体,促进内源性CGRP释放有关,应用辣椒素受体阻断剂、感觉神经递质耗竭剂或CGRP受体阻断剂能取消此作用[6]。CGRP除了对心肌I/R损伤具有保护作用外,也可抑制免疫细胞的激活和TLR介导的炎症反应[7]。那么,吴茱萸次碱对心肌I/R损伤的保护作用是否通过促进CGRP释放,进一步影响心肌细胞TLR4信号转导途径?目前尚未见文献报道。因此,本课题从基因和蛋白两个水平,研究了吴茱萸次碱对心肌TLR4和NF-κB表达的影响,并进一步探讨吴茱萸次碱对心肌TLR4和NF-κB表达的影响是否由CGRP所介导。结果发现,吴茱萸次碱能明显降低心肌TLR4和NF-κB的表达,预先给予辣椒素受体阻断剂capsazepine能取消吴茱萸次碱的作用。我们的实验结果提示,TLR4/NF-κB通路介导的炎症反应在心肌I/R损伤中发挥重要作用,降低TLR4/NF-κB的表达能明显减少炎症反应,从而减轻心脏I/R损伤。
综上所述,吴茱萸次碱通过抑制TLR4/NF-κB信号通路保护心肌I/R损伤,此作用与促进CGRP释放有关。TLR4是介导心肌I/R炎性损伤的“中枢”通路,可能成为干预心肌I/R损伤的新途径。
( 致谢: 本文是在中南大学湘雅药学院药理学系心血管研究湖南省重点实验室完成,感谢李年生实验师给予的技术指导!)
| [1] | Ha T, Liu L, Kelley J, et al. Toll-like receptors: new players in myocardial ischemia/reperfusion injury[J]. Antioxid Redox Signal, 2011, 15(7): 1875-93. doi:10.1089/ars.2010.3723 |
| [2] | Shishido T, Nozaki N, Yamaguchi S, et al. Toll-like receptor-2 modulates ventricular remodeling after myocardial infarction[J]. Circulation, 2003, 108(23): 2905-10. doi:10.1161/01.CIR.0000101921.93016.1C |
| [3] | Oyama J, Blais C Jr, Liu X, et al. Reduced myocardial ischemia-reperfusion injury in toll-like receptor 4-deficient mice[J]. Circulation, 2004, 109(6): 784-9. doi:10.1161/01.CIR.0000112575.66565.84 |
| [4] | Shimamoto A, Chong A J, Yada M, et al. Inhibition of Toll-like receptor 4 with eritoran attenuates myocardial ischemia/reperfusion injury[J]. Circulation, 2006, 114(1 Suppl): 270-4. |
| [5] | Laird M H, Rhee S H, Perkins D J, et al. TLR4/MyD88/PI3K interactions regulate TLR4 signaling[J]. J Leukoc Biol, 2009, 85(6): 966-77. doi:10.1189/jlb.1208763 |
| [6] | Jia S, Hu C. Pharmacological effects of rutaecarpine as a cardiovascular protective agent[J]. Molecules, 2010, 15(3): 1873-81. doi:10.3390/molecules15031873 |
| [7] | Harzenetter M D, Novotny A R, Gais P. Negative regulation of TLR responses by the neuropeptide CGRP is mediated by the transcriptional repressor ICER[J]. J Immunol, 2007, 179(1): 607-15. doi:10.4049/jimmunol.179.1.607 |
| [8] | Lin L, Knowlton A A. Innate immunity and cardiomyocytes in ischemic heart disease[J]. Life Sci, 2014, 100(1): 1-8. doi:10.1016/j.lfs.2014.01.062 |
| [9] | Ding H S, Yang J, Chen P, et al. The HMGB1-TLR4 axis contributes to myocardial ischemia/reperfusion injury via regulation of cardiomyocyte apoptosis[J]. Gene, 2013, 527(1): 389-93. doi:10.1016/j.gene.2013.05.041 |
| [10] | Lopez Gelston C A, Mitchell B M. Recent advances in immunity and hypertension[J]. Am J Hypertens, 2017, 30(7): 643-52. doi:10.1093/ajh/hpx011 |
| [11] | Zeuke S, Ulmer A J, Kusumoto S, et al. TLR4-mediated inflammatory activation of human coronary artery endothelial cells by LPS[J]. Cardiovas Res, 2002, 56(1): 126-34. doi:10.1016/S0008-6363(02)00512-6 |
| [12] | 雷升萍, 王靓, 龙子江, 等. 黄精多糖通过TLR4-MyD88-NF-κB通路抑制缺氧/复氧H9c2心肌细胞炎性因子释放[J]. 中国药理学通报, 2017, 33(2): 255-60. Lei S P, Wang L, Long Z J, et al. Inhibitory effect of Polygonatum sibiricum polysaccharides on release of inflammatory cytokines of anoxia/reoxygenation H9c2 myocardial cells through TLR4-MyD88-NF-κB signaling pathway[J]. Chin Pharmacol Bull, 2017, 33(2): 255-60. |
| [13] | Frantz S, Tillmanns J, Kuhlencodt P J. Tissue-specific effects of the nuclear factor kappaB subunit p50 on myocardial ischemia-reperfusion injury[J]. Am J Pathol, 2007, 171(2): 507-12. doi:10.2353/ajpath.2007.061042 |
| [14] | Hu R, Li X H, Li Y J. Nitroglycerin-induced myocardial protection and tolerance: role for CGRP[J]. Trends Pharmacol Sci, 2014, 35(8): 369-70. doi:10.1016/j.tips.2014.06.001 |

