


S-腺苷蛋氨酸(S-adenosylmethionine,SAM,又称活性氨基酸)是1952年发现的广泛存在于体内的一种重要的生理活性物质。SAM是依赖甲基转移酶的酶促转甲基过程的甲基供体,修饰DNA、RNA及组蛋白,进而影响DNA复制、转录和翻译、DNA错配修复,调节表观遗传[1]。质膜微囊结构蛋白-1(caveolin-1,Cav-1)是位于细胞膜信号交易活跃的微域—小窝上的主要蛋白,能与多种信号分子形成复合物,对机体功能的调节发挥重要作用[2-4]。我们前期的研究结果表明,神经病理性疼痛状态下,小鼠前扣带回(anterior cingulate cortex,ACC) Cav-1会持续表达增加,干扰Cav-1表达,疼痛减轻[5]。高浓度KCl可使细胞膜电位升高,细胞膜上的电压依赖型钙离子通道开放,胞内钙离子升高,激活细胞内多种信号通路,并调控相关转录因子发挥生物学效应。KCl刺激可使神经细胞产生长时程增强(long-term-potentiation,LTP)现象,神经细胞在LTP活动过程中会引发各类基因表达,并合成诸多蛋白质[6-7]。本研究采用KCl刺激原代培养的皮层神经元模型,检测SAM对KCl刺激引起的细胞损伤是否有保护作用,并进一步研究SAM是否通过降低Cav-1的表达,对KCl刺激引起的细胞损伤发挥保护作用。
1 材料与方法 1.1 材料 1.1.1 动物孕13~15 d小鼠,清洁级,由徐州医科大学实验动物中心提供。
1.1.2 试剂SAM (HPLC>99%, 西安康诺化工有限公司);KCl(上海生工生物科技有限公司);DMEM培养基、Neuroasal Medium、B-27添加剂、胰酶(Life Technology Inc);胎牛血清(Biochem公司);L-多聚赖氨酸、二甲基亚砜(Sigma公司);抗p-Cav-1抗体、抗t-Cav-1抗体(Bioword公司);引物由上海吉玛基因有限公司合成;SYBR Green Master Mix (Invitrogen公司);辣根过氧化物酶标记的山羊抗小鼠二抗、山羊抗兔二抗、BCA蛋白测定试剂盒、ECL发光试剂盒(碧云天生物技术有限公司);其余为国产分析纯试剂。
1.2 方法 1.2.1 原代小鼠皮层神经元培养及各组神经元处理取胎龄为13~15 d的小鼠,无菌条件下分离出大脑皮层,在D-Hank′s平衡盐溶液中漂洗3次,尽量剔除脑膜,剪碎后用终浓度为0.25%胰酶,37℃消化10 min,离心,弃上清,用含15%胎牛血清的DMEM培养基制备成1.0×109·L-1密度的细胞悬液,接种于预先用L-多聚赖氨酸包被的培养板中,置37℃、5% CO2培养箱内孵育。d 2换成含2% B27的Neurobasal继续培养,隔天换液。培养至d 7[8],换液,KCl组为终浓度为0.05 mol·L-1 KCl作用12 h,SAM-KCl组为0.02 mol·L-1 SAM预处理6 h后加入KCl(终浓度为0.05 mol·L-1)作用12 h。然后,将各组细胞用于后续实验。
1.2.2 qPCR分析将细胞用预冷的0.01mol·L-1 PBS洗2遍,然后置于冰台上,用BBI公司B618133试剂盒提取总RNA,用vazyme试剂盒逆转成cDNA, 调节每组样品到浓度一致,-20℃保存备用。取0.5 μL cDNA产物,按10 μL反应体系进行real-time PCR,各成分加入量:Cav-1或β-actin引物1.0 μL,cDNA 0.5 μL,5×SYBR GREEN 2 μL,DEPC水6.5 μL。引物Cav-1: Forward 5′-ATTGCAGAACCAGAAGGGACAC-3′, Reverse 5′-CCATTGGGATGCCGAAGAT-3′, 产物121 bp;β-actin: Forward 5′-CATTGTTACCAACTGGGACGACAT-3′, Reverse 5′-GCCTCGGTGAGCAGCACA-3′, 产物102 bp。在95℃预变性1 min,按94℃ 30 s,59℃ 40 s,72℃ 40 s的参数进行PCR扩增,40个循环。然后记录Cav-1和β-actin的CT值,二者比值越大说明该样品含Cav-1拷贝数越少。CT值即达到一定荧光强度所经历的循环数。
1.2.3 Western blot分析将培养于6孔板的各组细胞用冰冷的PBS洗涤2遍,每孔加入0.6 mL蛋白裂解液,刮取细胞,收集到1.5 mL EP管,冰上放置30 min,超声粉碎细胞,13 000 r·min-1离心10 min,取少量上清液,用BCA法测蛋白浓度,30 μg总蛋白分装成1管,-20℃保存。用12% SDS聚丙烯酰胺凝胶电泳(SDS-PAGE)分离后,转移至PVDF膜上。经3% BSA封闭5~6 h后,加入适当稀释的一抗24 h, 漂洗3遍再加入相应的辣根过氧化物酶标记山羊抗兔或山羊抗小鼠二抗。用ECL曝光法显示蛋白质条带。扫描免疫印迹胶片,并以Image J软件分析条带灰度值。以目的蛋白条带灰度值与β-actin灰度值的比值表示目的蛋白的水平。
1.3 统计学分析采用GraphPad Prism 5统计软件分析数据,各组数据以x±s表示。采用One Way ANOVA法对实验结果进行统计学分析。
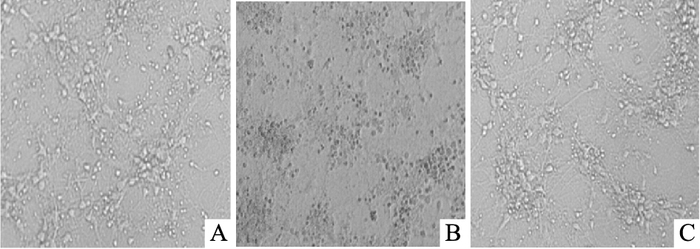
2 结果 2.1 SAM对各组神经元形态的影响0.05 mol·L-1 KCl作用于体外培养1周的小鼠皮层神经元12 h,可使神经元产生明显的损伤,突起缩短变细,胞体变小,细胞聚团。0.02 mol·L-1 SAM预处理6 h可明显降低KCl刺激引起的细胞损伤(Fig 1)。
|
| Fig 1 Effect of SAM on morphological characteristics of primary cultured neurons injured by KCl (×200) A: Neurons soma in control group were rounded, translucent, neurite extended naturally; B: Neurons soma in KCl group was significantly smaller, wrinkled, neurite shortened; C: The soma and neurite of neurons in SAM-KCl group was obviously better than those in KCl group. |
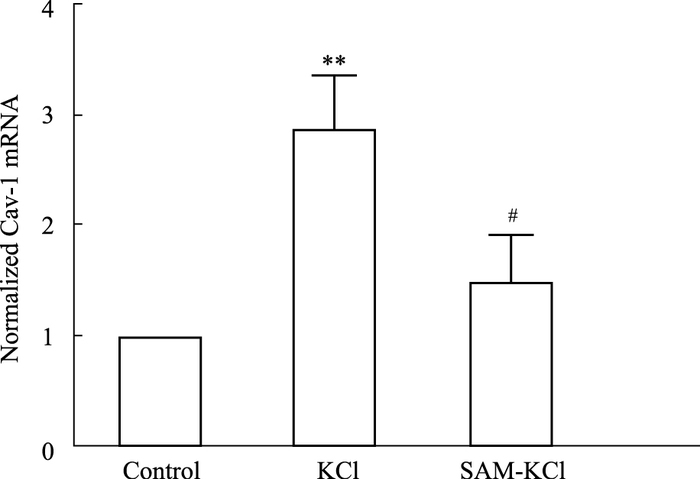
qPCR检测SAM对各组神经元Cav-1 mRNA表达的影响。Fig 2结果显示,KCl组Cav-1 mRNA表达较对照组明显升高(P<0.01), SAM-KCl组Cav-1 mRNA表达与KCl组相比降低(P<0.05), 说明SAM能够逆转KCl引起的神经元Cav-1 mRNA表达升高。
|
| Fig 2 SAM inhibited increases of Cav-1 mRNA of neurons induced by KCl (x±s, n=5) **P < 0.01 vs control group; #P < 0.05 vs KCl group |
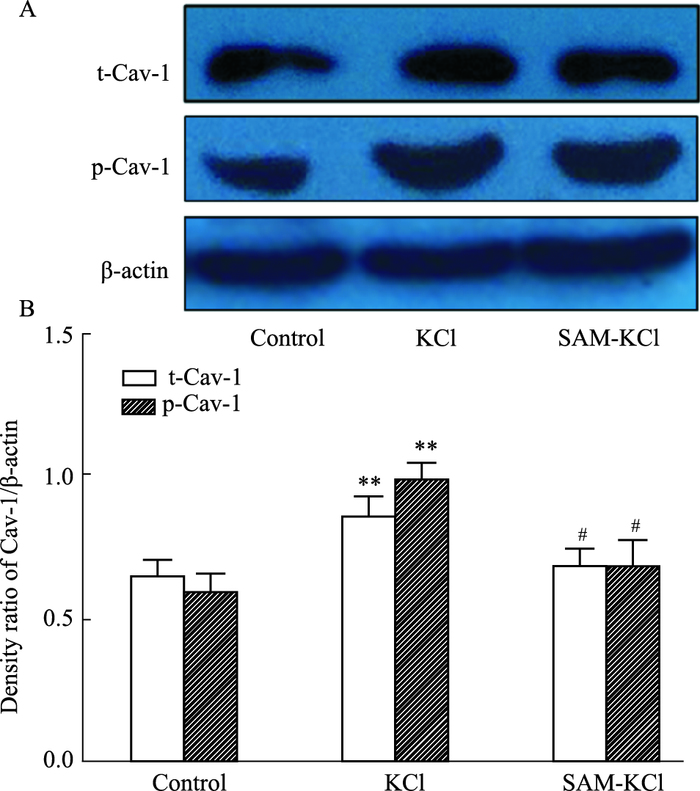
免疫印迹检测SAM对各组神经元Cav-1蛋白表达的影响。Fig 3结果显示,KCl刺激可使t-Cav-1和p-Cav-1蛋白表达上调(P<0.01),SAM预处理可抑制KCl刺激引起的t-Cav-1和p-Cav-1蛋白表达上调(P<0.05)。
|
| Fig 3 SAM reversed up-regulation of Cav-1 protein of KCl-injured neurons (x±s, n=5) A: The representative immunoblotting bands of Cav-1 protein of each group measured by Western blot; B: The quantitative data. **P < 0.01 vs control group; #P < 0.05 vs KCl group |
近年来,随着对SAM在体内代谢过程认识的深入和大量临床研究,SAM维护神经健康的作用越来越受到重视。有研究发现,SAM的抗抑郁效果与三环类抗抑郁药相当,在单独使用或与其他抗抑郁药物合用时,可提高其他抗抑郁药的治疗效果[9]。特别是对5-羟色胺再摄取抑制剂类抗抑郁药的药效有增强效应。也有研究发现,SAM的抗抑郁效果还与叶酸含量有关,SAM可与叶酸偶联,共同参与中枢神经递质(如乙酰胆碱[10])的合成,SAM作为甲基供体参与脑组织和细胞的生理活动,影响各种神经递质的合成和代谢。SAM能够提高阿尔茨海默病模型TgCRND8小鼠脑中超氧化物歧化酶(superoxide dismutase, SOD)和谷胱甘肽S-转移酶(glutathione S-transferase, GST)活性,增加还原型谷胱甘肽含量[11]。因此,SAM对维护人体健康至关重要。体内神经细胞的存活有赖于“电活动”或神经营养因子的“营养”作用,同样,体外原代培养的神经细胞维持存活也必须依赖于类似的“营养”作用。现已证明,大脑皮质神经细胞经KCl刺激诱导表现出LTP,KCl可使细胞膜电位升高,当神经细胞的膜电位上升到一定值时,细胞膜上的电压依赖型钙离子通道开放,引起细胞内多种信号通路的激活。比如细胞受KCl刺激后引起膜的去极化,细胞外钙内流,激活钙/钙调素依赖性蛋白激酶(calcium/calmodulin-dependent protein kinase, CAMK)及Ras/MAPK途径,通过级联反应磷酸化环磷腺苷效应元件结合蛋白(cAMP-response element binding protein, CREB),激活脑源性神经营养因子(brain derived neurotrophic factor, BDNF)发挥生物学效应。大脑皮质神经细胞经KCl刺激诱导表现出LTP,作为神经细胞活动最具特征性的表现方式,会引发各类基因表达并合成诸多蛋白质,从而使得神经细胞体现出不同的生物学功能[6-7, 12]。Cav-1是质膜微囊结构蛋白的一种,是细胞质膜表面小窝的标记蛋白。Cav-1作为支架蛋白与多种信号分子组成信号分子复合物,参与信号转导、物质转运、细胞增殖等活动。研究表明,Cav-1在神经元突触的生长发育、多种生理和病理生理的信号转导中是必需的,Cav-1可募集谷氨酸受体和多种神经营养因子受体在膜上的锚定,增强神经元信号转导[13-14]。神经病理性疼痛状态下,小鼠ACC区Cav-1会持续表达增加[5],那么在高浓度KCl刺激神经元时,Cav-1的表达是怎样的呢?
本研究首先从细胞形态上证实了SAM对高浓度KCl刺激引起的神经元胞体皱缩、突起变细变短有明显的改善作用。收集KCl刺激体外培养1周的小鼠皮层神经元12 h的总RNA和蛋白,qPCR和Western blot检测发现,Cav-1 mRNA和蛋白表达均升高。Cav-1具体是参与了KCl刺激细胞引起的膜去极化过程、或是钙内流、还是LTP形成有待进一步研究。SAM预处理神经元6 h组,再用KCl刺激神经元,不能引起Cav-1 mRNA和蛋白表达增高。说明SAM可抑制高浓度KCl引起的Cav-1表达增高,从而使神经元免受高浓度KCl引起的损伤。至于SAM是怎样调节高浓度KCl引起的Cav-1表达增高的,是通过甲基化Cav-1基因,还是通过某个信号通路的激活,有待进一步研究。
本研究证实了高浓度KCl刺激体外培养的小鼠皮层神经元,可使其Cav-1 mRNA和蛋白表达增高,SAM可抑制这种增高并起到保护神经元的作用。
( 致谢: 本实验在徐州医科大学麻醉学重点实验 & 麻醉与镇痛应用技术实验室完成,感谢实验室主任曹君利教授以及段雯珍、蔡衡、高甜慧老师在实验中给予的帮助。)
| [1] | Loenen W A. S-adenosylmethionine: jack of all trades andmaster of everything?[J]. Biochem Soc Trans, 2006, 34(Pt 2): 330-3. |
| [2] | Ostrom R S, Liu X, Head B P, et al. Localization of adenylyl cyclase isoforms and G protein-coupled receptors invascular smooth muscle cells: expression in caveolin-rich and noncaveolin domains[J]. Mol Pharmacol, 2002, 62(5): 983-92. doi:10.1124/mol.62.5.983 |
| [3] | Lisanti M P, Scherer P E, Tang Z, et al. Caveolae, caveolin and caveolin-rich membrane domains: a signalling hypothesis[J]. Trends Cell Biol, 1994, 4(7): 231-5. doi:10.1016/0962-8924(94)90114-7 |
| [4] | 高燕, 顾振纶, 蒋小岗, 等. 小窝蛋白-1与特发性肺纤维化[J]. 中国药理学通报, 2009, 25(6): 704-7. Gao Y, Gu Z L, Jiang X G, et al. Caveolin-1 and odiopathic lung fibrosis[J]. Chin Pharmacol Bull, 2009, 25(6): 704-7. |
| [5] | Yang J X, Hua L, Li Y Q, et al. Caveolin-1 in the anterior cingulate cortex modulates chronic neuropathic pain via regulation of NMDA receptor 2B subunit[J]. J Neurosci, 2015, 35(1): 36-52. doi:10.1523/JNEUROSCI.1161-14.2015 |
| [6] | Liu M C, Liu X Q, Wang W, et a1. Involvement of micriglia aetivation in the lead induced long term potentiation impairment[J]. PLoS One, 2012, 7(8): e43924. doi:10.1371/journal.pone.0043924 |
| [7] | Pandey K, Sharma S K. Activity-dependent acetylation of alpha tubulin in the hippocampus[J]. J Mol Neurosci, 2011, 45(1): 1-4. doi:10.1007/s12031-011-9506-6 |
| [8] | 许光明, 张晓静, 刘艺. 糖皮质激素诱导大鼠原代培养杏仁核神经元的凋亡[J]. 中国药理学通报, 2016, 32(12): 1688-94. Xu G M, Zhang X J, Liu Y. Glucocorticoid-induced rat primary amygdaloid neuron apoptosis[J]. Chin Pharmacol Bull, 2016, 32(12): 1688-94. doi:10.3969/j.issn.1001-1978.2016.12.011 |
| [9] | Delle Chiaie R, Pancheri P, Scapicchio P. Efficacy and tolerability of oral and intramuscular S-adenosyl-lmethionine 1, 4-butanedisulfonate (SAMe) in the treatment of major depression: comparison with imipramine in 2 multicenter studies[J]. Am J Clin Nutr, 2002, 76(5): 1172-6. |
| [10] | Serra M, Chan A, Dubey M, et al. Folate and S-adenosylmethionine modulate synaptic activity in cultured cortical neurons: acute differential impact on normal and apolipoprotein-deficient mice[J]. Phys Biol, 2008, 5(4): 044002. doi:10.1088/1478-3975/5/4/044002 |
| [11] | Cavallaro R A, Fuso A, Nicolia V, et al. S-adenosylmethionine prevents oxidative stress and modulates glutathione metabolism in TgCRND8 mice fed a B-vitamin deficient diet[J]. J Alzheimers Dis, 2010, 20(4): 997-1002. doi:10.3233/JAD-2010-091666 |
| [12] | Tohn F. The calcium rationale in aging and Alzheimer's disease[J]. Ann N Y Acad Sci, 1994, 747: 382-406. |
| [13] | Head B P, Patel H H, Tsutsumi Y M, et al. Caveolin-1 expression is essential for N-methyl-D-aspartate receptor-mediated Src and extracellular signal-regulated kinase 1/2 activation and protection of primary neurons from ischemic cell death[J]. FASEB J, 2008, 22(3): 828-40. |
| [14] | Head B P, Hu Y, Finley J C, et al. Neuron-targeted caveolin-1 protein enhances signaling and promotes arborization of primary neurons[J]. J Biol Chem, 2011, 286(38): 33310-21. doi:10.1074/jbc.M111.255976 |

