


2. 重庆医科大学附属第一医院急诊医学科&重症医学科,重庆 400016
2. Dept of Emergency and Critical Care Medicine, the First Affiliated Hospital of Chongqing Medical University, Chongqing 400016, China
衰老又称老化,分为生理性衰老与病理性衰老两类。生理学衰老是生物体自成熟期开始,随增龄发生的渐进的、受遗传因素影响的、全身复杂的形态结构与生理功能不可逆的退行性变化。衰老是人类生命进程的重要环节,常伴随着一些疾病的发生,如糖尿病、阿尔茨海默症、冠心病等。
PI3K/Akt/mTOR信号通路参与调控细胞代谢、生长、增殖和存活。PI3K、Akt和mTOR是这一途径的关键点[1]。PI3K活化后激活Akt,进一步激活mTOR。mTOR有2个亚型,即mTORC1和mTORC2。Akt激活的是mTORC1。mTORC1下游的直接底物为核糖体S6激酶1(S6K1)和真核起始因子4E结合蛋白1(4E-BP1);S6K1再进一步使核糖体蛋白S6磷酸化,最终启动cap-依赖性蛋白翻译(蛋白合成的限速步骤),实现蛋白合成、细胞生长和细胞周期进程的中心控制。处于生长状态的神经元需要合成大量新的蛋白质,胞内磷酸化核糖体蛋白S6(p-S6)的表达水平会明显上调。因此,p-S6表达水平可间接表征mTOR活性,并常作为神经元生长状态的分子标志[2]。研究发现,随着年龄的增加,p-S6蛋白表达减少,内在活性降低,轴突再生能力下降[3],提示衰老与细胞表达p-S6减少相关。
地黄作为滋阴补肾中药,在临床治疗老年性疾病中占有重要地位。以地黄为君药的复方在发育、衰老以及老年性疾病的治疗中应用历史也十分久远,如六味地黄丸是《小儿药证直诀》方,金匮肾气丸是《金匮要略》方,单味地黄抗衰老的实验研究已有较多报道[4-5]。梓醇(catalpol)是地黄最主要的有效成分之一,具有利尿、缓泻、降血糖、保肝等多种药理作用[6]。研究发现,梓醇对老年性疾病,如帕金森、脑卒中、糖尿病、老年性痴呆等有明显的治疗作用。梓醇可以促进离体大鼠皮质神经元轴突生长,上调轴突生长相关蛋白(growth associated protein-43,GAP-43)表达,有效促进脑卒中后的神经修复[7-8],提示梓醇对病理性衰老有治疗作用。但衰老还存在生理性衰老形式,梓醇对生理性衰老是否具有抗衰老作用,是否可以延缓正常神经元衰老,延迟其死亡等问题,目前尚未见报道。
因此,本研究旨在观察梓醇是否延缓正常离体皮质神经元衰老作用,并探讨其可能的机制,为后续实验提供实验依据,为研发新的延缓衰老的天然药物或保健活性物质奠定实验基础。
1 材料 1.1 实验动物健康SD大鼠,体质量(250±30)g,购自重庆医科大学实验动物中心,合格证批号:SCXK(渝)2007-2001。适应性喂养1周后合笼,让其进行自然交配。动物实验严格遵照实验动物科学与管理有关规定,善待实验动物。
1.2 药品与试剂梓醇(石家庄流波百鸟生物技术有限公司,批号20091091015,纯度 > 98%);B27、Neurobasal-A神经元培养基(Gibco);Pen-strep、0.25%胰蛋白酶(Genview);DMEM基础培养基(Hyclone);胎牛血清(杭州四季青生物公司);p-S6兔单克隆抗体(Cell Signaling Technology);FITC标记山羊抗兔IgG、辣根过氧化物酶标记羊抗兔IgG(H+L)、兔多克隆抗体Map-2、GAP-43、PI3K、p-PI3K、Akt、p-Akt、mTOR、p-mTOR,均购自Proteintech。
1.3 仪器生物安全柜(Haier);CO2细胞培养箱(ESCO);倒置显微镜(奥林巴斯);酶标仪(Bioteck);PCR仪(Eppendorf);低温冷冻离心机(Thermo);倒置荧光显微镜(Leica);化学发光成像仪(Tanon)。
2 方法 2.1 皮质神经元培养参考文献[9]并做改进,无菌条件下取出生后24 h内的乳鼠大脑皮质,剪去胼胝体和其他白质,PBS液清洗2遍,剪碎,离心,1 000 r·min-1×8 min。0.25%胰酶溶液37℃消化10 min,每5 min振摇1次,加入含10% FBS的DMEM培养基终止消化10 min,每5 min振摇1次,过200目筛网。取滤液,离心,1 000 r·min-1×5 min,弃上清,加含10% FBS的DMEM培养基,吹打均匀,计数,以1.4×108·L-1或者5×108·L-1的细胞密度接种在提前包被过L-多聚赖氨酸的96孔板和6孔板上。置于37℃、5% CO2的恒温培养箱中培养8 h后,换为Neurobasal-A(含2% B27)无血清培养基,每隔2 d半量换液。d 7的神经元可用于实验。
2.2 实验设计与分组皮质神经元培养至d 6,进行分组并作相应药物干预。实验分为:正常组、梓醇低(0.1 mg·L-1)、中(1 mg·L-1)、高(10 mg·L-1)剂量组。正常组不用任何药物处理,仅用Neurobasal-A培养基培养;梓醇组用Neurobasal-A培养基稀释至低、中、高剂量的梓醇进行干预。每组重复3次。
2.3 显微镜观察神经元接种后,分别于培养的7~13 d在倒置相差显微镜下观察各组细胞的生长情况。每组各孔随机选择5个视野,进行拍照记录。
2.4 细胞活力检测以96孔板每孔103~104个细胞种板,培养至6 d后,加入不同浓度梓醇进行干预,干预时间分别为1~6 d(即细胞培养d 7~13)。之后,每孔加入MTT溶液(5 g·L-1)20 μL,37℃继续孵育4 h,终止培养,小心吸弃孔内培养基后,每孔加入150 μL DMSO,振荡10 min。将96孔板置于酶标仪上,490 nm波长下,测定各孔吸光度(A)。
2.5 细胞内在活性检测皮质神经元培养至13 d后,弃培养液,用0.02 mol·L-1 PBS洗5 min×3次,加入4%多聚甲醛4℃固定15 min后,用p-S6兔单克隆抗体免疫荧光染色检测神经元细胞内在活性。阴性对照用0.02 mol·L-1 PBS代替一抗,其余步骤同上。荧光显微镜下观察,阳性细胞胞质呈现绿色荧光。在200倍镜下,分别计数3个孔各5个视野的阳性细胞数和总细胞数,计算阳性细胞的百分比。
2.6 轴突生长检测皮质神经元培养至13 d后,弃培养液,用0.02 mol·L-1 PBS洗5 min×3次,加入4%多聚甲醛4℃固定15 min后,用Map-2兔多克隆抗体免疫荧光染色检测神经元轴突生长情况。阴性对照用0.02 mol·L-1 PBS代替一抗,其余步骤同上。镜下观察,阳性细胞胞质呈绿色荧光。在200倍镜下每组各孔随机选择5个视野,所测细胞必须有晕光和突起,每个视野测量20个神经元轴突长度,取其平均值为该组轴突生长长度。
2.7 蛋白免疫印迹将细胞接种到6孔板中,细胞密度为5×108·L-1,每孔2 mL。待细胞培养至d 6,给予药物干预,继续培养至d 13后,除去培养基,收集细胞。每孔加100 μL RIPA裂解液裂解细胞。利用BCA试剂盒测定蛋白浓度。电泳,转膜,切膜,免疫印迹(GAP-43、p-S6、p-PI3K、p-Akt、p-mTOR抗体稀释度均为1 :1000,PI3K、Akt、mTOR抗体稀释度均为1 :500)。将显色后的膜照相,并用Multi-Gaμge软件对图像进行灰度分析,以灰度值代表蛋白的强度,以目的蛋白与内参蛋白(GAPDH、β-tubulin)的灰度比值作为目的蛋白表达的相对量。以上实验重复3次,取其平均值。
2.8 数据处理所有数据均以x±s表示,应用SPSS 20.0统计软件进行统计分析,组间比较采用单因素方差分析。
3 结果 3.1 梓醇可促进皮质神经元存活,提高其细胞活力皮质神经元在培养至d 7时,胞体光晕明显,突起增多,伸长且分支很多,形成致密细胞网络;培养至d 8时,绝大多数神经元仅可见1根较长的轴突,少部分神经元突起有分支,部分细胞突起交织成网;培养至d 9时,细胞突起构成的网状增多;从d 10开始,神经元数目开始减少,突起开始萎缩;至d 13时,只剩下胞体。由此可以推断,皮质神经元在培养7~9 d时,细胞状态最佳,处于旺盛期;在培养10~13 d时,细胞数目开始减少,细胞开始衰老、死亡,处于衰老期。梓醇干预各组(0.1、1、10 mg·L-1)神经元生长趋势与时间点的关系与正常组一致,但是正常组对应时间点比较,梓醇干预各组细胞晕光明显,轴突较正常组更粗,更长;梓醇各组神经元细胞突起多,神经元之间的网状联系均比正常组各对应时点更加丰富。培养至10~13 d时,梓醇干预各组神经元数目减少速度较正常组慢,d 13时,仍有部分神经元有轴突存在,而随着培养时间的延长,正常组神经元数目逐渐减少,突起逐渐萎缩,至d 13时,只剩下胞体(Fig 1)。提示不同浓度梓醇均可减少神经元细胞死亡,延缓衰老,维持神经元较长时间的生长状态。

|
| Fig 1 Morphological observation of cortical neurons in different time points in each group(×100) |
Tab 1的MTT检测结果显示,随着培养时间的延长,各组神经元细胞活力先升高,后降低。d 7~9,MTT值升高,与形态学观察所见细胞数增加,细胞生长状态增强一致;d 10~13,MTT值逐渐降低,与形态学观察所见细胞数减少,细胞生长状态减弱一致。梓醇各剂量组均明显高于正常组相应时点的MTT吸光度值(P < 0.05),而且呈现出一定的量效关系,在d 10之后尤其明显。提示不同浓度的梓醇可以提高神经元细胞活力,延缓其衰老,延迟其细胞死亡的时间。据Fig 1、Tab 1的结果,本实验后续研究选择衰老后期的d 13进行相关形态及机制的探讨。
| Group | 7 d | 8 d | 9 d | 10 d | 11 d | 12 d | 13 d | |
| Control | 2.21±0.24 | 2.69±0.06 | 3.16±0.09 | 2.98±0.15 | 2.36±0.06 | 2.23±0.03 | 2.01±0.06 | |
| Catalpol | 0.1 mg·L-1 | 2.91±0.09* | 2.94±0.05* | 3.50±0.01* | 3.12±0.12* | 3.11±0.07 | 2.43±0.16* | 2.17±0.03 |
| 1 mg·L-1 | 2.87±0.18* | 3.05±0.14* | 3.50±0.07* | 3.26±0.12* | 3.06±0.20 | 2.63±0.23* | 2.52±0.07* | |
| 10 mg·L-1 | 2.68±0.15* | 3.22±0.19* | 3.31±0.11* | 3.44±0.02* | 3.34±0.19* | 2.89±0.20* | 2.57±0.04* | |
| *P < 0.05 vs control | ||||||||
如Fig 2所示,药物干预6 d(细胞培养至13 d)后,梓醇各组p-S6阳性细胞数较正常组均增多(P < 0.05),其中梓醇1 mg·L-1剂量组增多最明显。与正常组相比,梓醇1 mg·L-1剂量组可明显促进p-S6蛋白表达(P < 0.05);而梓醇0.1、10 mg·L-1剂量组则无明显变化。提示不同浓度的梓醇可在神经元处于衰老期时诱导其细胞内在活性,延缓细胞衰老。
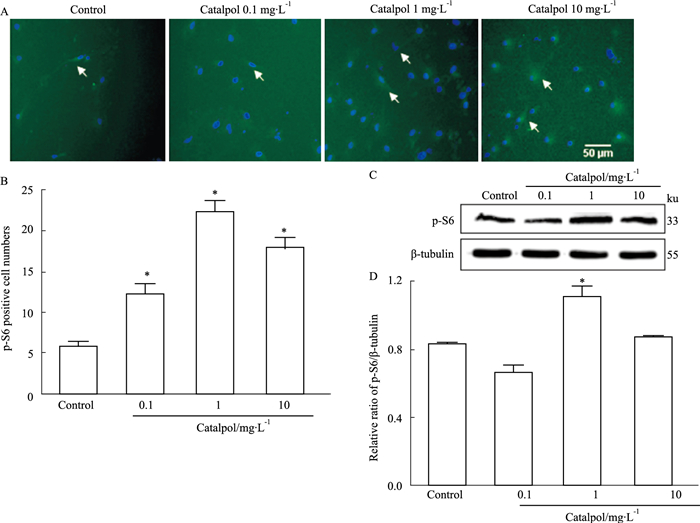
|
| Fig 2 Catalpol increased number of p-S6 positive cells, promote p-S6 protein expression and induce cortical neuronal cell activity A: Detection of neuronal cell activity in each group by p-S6 (×200); B: Analysis of number of p-S6 positive cells in each group; C: Effects of each group on expression of p-S6 protein; D: Analysis of expression of p-S6 protein in each group(x±s, n=3). *P < 0.05 vs control group. |
如Fig 3所示,给药6 d(细胞培养至13 d)后,正常组神经元轴突萎缩,轴突长度骤减,梓醇给药各组神经元轴突长度均比正常组明显延长(P < 0.05)。梓醇各组间比较,浓度为1 mg·L-1时对神经元轴突生长促进作用最强。与正常组相比,梓醇10 mg·L-1剂量组可明显促进GAP-43蛋白表达(P < 0.05)。提示不同浓度梓醇可明显促进神经元轴突延伸。
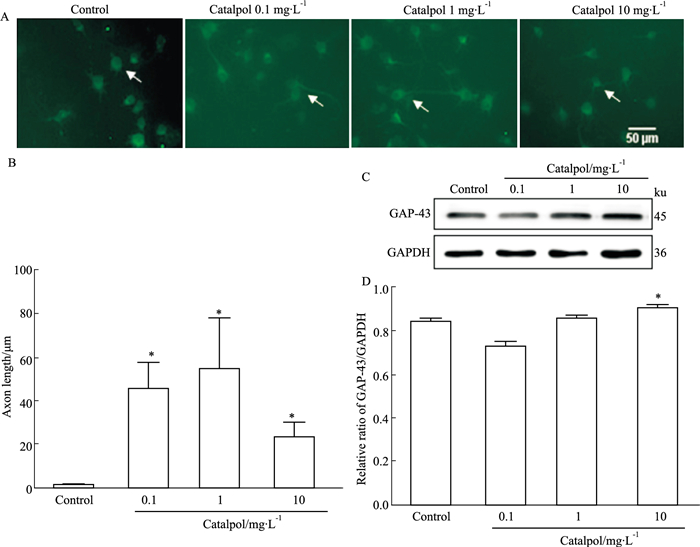
|
| Fig 3 Catalpol promoted GAP-43 protein expression and delayed cortical neuron axonal atrophy A: Detection of axon growth in each group by Map-2(×200, bar=50 μm); B: Analysis of axon length in each group; C: Effects of each group on expression of GAP-43 protein; D: Analysis of expression of GAP-43 protein in each group (x±s, n=3). *P < 0.05 vs control group. |
如Fig 4所示,各组内参蛋白GAPDH和β-tubulin的表达差异无显著性。给药6 d(细胞培养至13 d)后,与正常组相比,梓醇1、10 mg·L-1组可明显促进p-PI3K/t-PI3K、p-Akt/t-Akt蛋白表达(P < 0.05);梓醇各组p-mTOR/t-mTOR蛋白表达随着梓醇浓度的升高先增加后降低,但其表达均明显高于正常组(P < 0.05)。
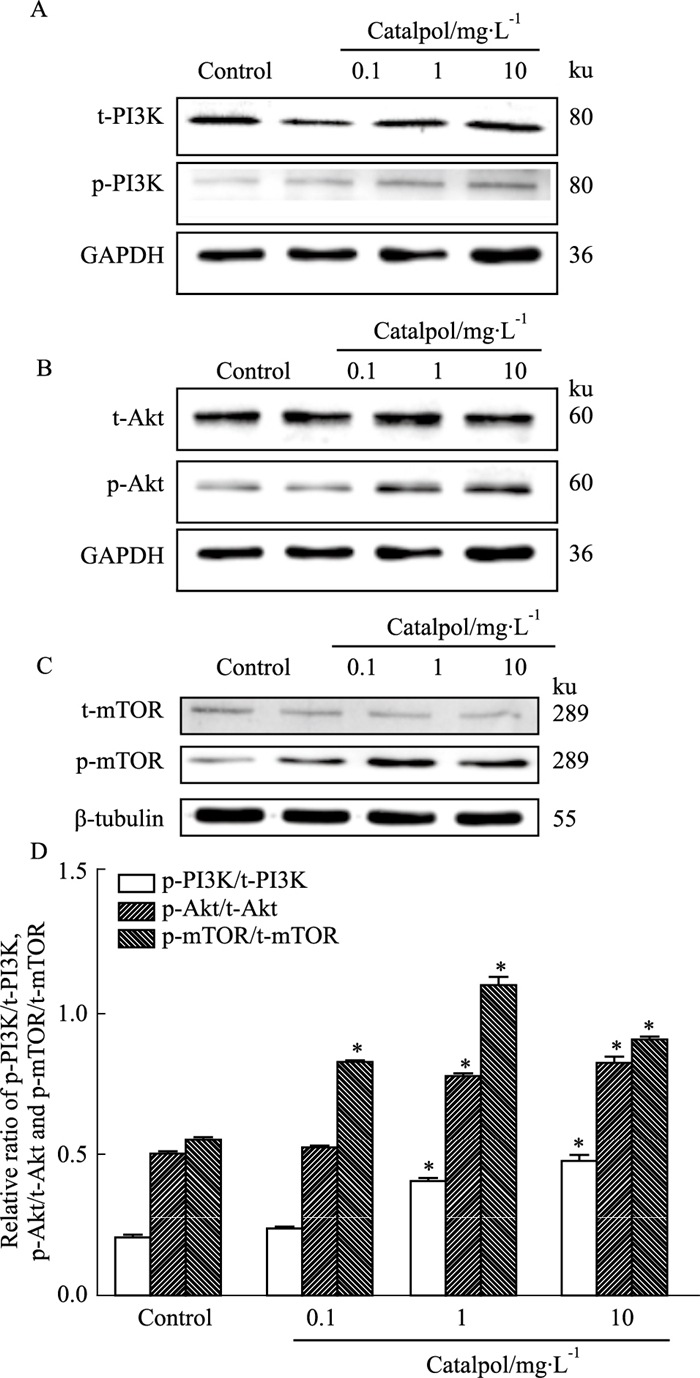
|
| Fig 4 Effect of catalpol on PI3K/Akt/mTOR signaling pathway related proteins in cortical neurons(x±s, n=3) A-C: Effects of each group on expressions of t-PI3K, p-PI3K, t-Akt, p-Akt, t-mTOR, p-mTOR protein; D: Analysis of expressions of p-PI3K/t-PI3K, p-Akt/t-Akt, p-mTOR/t-mTOR protein in each group. *P < 0.05 vs control group. |
地黄是滋阴补血、填精补髓的代表中药,本研究观察了地黄的主要活性成分梓醇对离体培养的新生大鼠皮质神经元的抗衰老作用。本研究结果发现,皮质神经元培养至7~9 d,细胞状态最佳,处于旺盛期;在培养至10~13 d时,细胞数目开始减少,细胞开始衰老、死亡,处于衰老期。我们的结果与其他研究一致[10-11]。皮质神经元培养至d 7时,细胞极性状态最佳,适合观测和研究树突与轴突的生长机制。而培养至13 d左右,细胞萎缩,处于衰老、死亡的边缘。本实验主要目的是观测梓醇对抗神经元衰老的作用和机制,故后期实验中衰老期的d 13进行机制的探讨。
本研究发现,与相应时点的正常组比较,梓醇终浓度在0.1~10 mg·L-1时可明显增加MTT吸光度值,促进神经元存活;从形态上看,梓醇低、中、高剂量组神经元数量多,光晕明显,轴突较长,神经元突起形成的网状联系丰富;而且更明显的是,不同浓度的梓醇组,在细胞培养d 10~13时,细胞活力均明显高于正常组(P < 0.05)。提示不同浓度的梓醇在细胞衰老期时可延缓神经元衰老,维持细胞较长时间的细胞活力。
研究表明[12],人在20~90岁神经元数量的减少不会超过10%或20%。大脑功能更多取决于神经元联系的质量,而不是神经元的数量。因此,与衰老有关的神经功能障碍是神经元网络连接质量下降的结果。细胞内在生长活性的提高与神经元联系的质量、大脑功能具有较强的关联度。因此,本研究选择p-S6染色来表征细胞内在活性,GAP-43染色来表征神经元内在联系。结果发现:当细胞培养至13 d后,梓醇各组p-S6阳性细胞数较正常组均增多,其中梓醇1 mg·L-1剂量组增多最明显。同时,梓醇能够增加神经元突起的长度,神经元之间的联系明显比正常组丰富,其变化趋势同p-S6染色结果一致,提示梓醇对神经元内在活性的调节与促进神经元内在联系有关,梓醇可能通过诱导神经元内在活性,提升神经元内在联系,来延缓神经元衰老。
PI3K/Akt/mTOR信号通路参与调控细胞生长、增殖、存活和分化[13]。本研究采用Western blot法检测了PI3K/Akt/mTOR信号通路的关键磷酸化蛋白,以探讨梓醇延缓离体培养的神经元衰老,维持较长时间细胞活力的可能机制。研究发现,给药6 d(细胞培养至13 d)后,与正常组相比,梓醇各组p-PI3K/t-PI3K和p-Akt/t-Akt比值随着梓醇浓度的升高而增加,呈现出浓度依赖性,且梓醇(1、10 mg·L-1)组差异具有显著性(P < 0.05);而p-mTOR/t-mTOR比值与梓醇浓度的关系与磷酸化S6蛋白变化一致,均是先升高后降低。梓醇(0.1、1、10 mg·L-1)组p-S6蛋白表达先升高后降低;但与正常组相比,仅梓醇(1 mg·L-1)组差异具有显著性(P < 0.05)。梓醇(10 mg·L-1)组可明显促进GAP-43蛋白表达。提示在细胞衰老期,GAP-43蛋白表达受PI3K/Akt/mTOR通路调控。PI3K蛋白活化,Akt被磷酸化激活,mTOR被进一步磷酸化激活,从而促进磷酸化S6蛋白和GAP-43蛋白表达,减缓轴突萎缩,增加突起,丰富神经元之间的联系,延缓神经细胞衰老。
总之,本研究结果证实了梓醇具有诱导神经元内在活性,提高神经元细胞活力,延缓轴突萎缩,丰富神经元之间的联系,延缓神经元衰老的潜能。其机制可能与调控PI3K/Akt/mTOR信号通路有关。提示梓醇对中枢神经系统损伤后神经再生和抗衰老可能有潜在的治疗价值。
( 致谢: 本研究在西南大学药学院中药药理学实验室完成,感谢各位老师和同学对本实验的指导、帮助。)
| [1] | Altomare D A, Khaled A R. Homeostasis and the importance for a balance between Akt/mTOR activity and intracellular signaling[J]. Curr Med Chem, 2012, 19(22): 3748-62. doi:10.2174/092986712801661130 |
| [2] | Lachyankar M B, Sultana N, Schonhoff C M, et al. A role for nuclear PTEN in neuronal differentiation[J]. J Neurosci, 2000, 20(4): 1404-13. |
| [3] | Park K K, Liu K, Hu Y, et al. Promoting axon regeneration in the adult CNS by modulation of the PTEN/mTOR pathway[J]. Science, 2008, 322(5903): 963-6. doi:10.1126/science.1161566 |
| [4] | 朱坤杰, 孙建宁. 六味地黄丸对D-半乳糖所致衰老大鼠学习记忆的改善作用及机理[J]. 中国实验方剂学杂志, 2006, 12(8): 44-6. Zhu K J, Sun J N. Effects of Liuwei Dihuang pills on learning and memory of D-galactose-induced senile rats and its mechanism[J]. Chin J Exp Tradit Med Formul, 2006, 12(8): 44-6. |
| [5] | 管家齐, 刘军莲, 王传金. 干地黄在金匿肾气丸中抗衰老实验研究[J]. 南京中医药大学学报(自然科学版), 2002, 18(3): 169-71. Guan J Q, Liu J L, Wang C J. Experimental study on anti-aging effect of dry Rehmannia in Jin Ni Shen Qi Wan[J]. J Nanjing Univ Tradit Chin Med, 2002, 18(3): 169-71. |
| [6] | 王静欢, 邹利, 万东, 等. 梓醇多效性相关信号通路研究进展[J]. 中国药理学通报, 2015, 31(9): 1189-94. Wang J H, Zou L, Wan D, et al. Research progress of catalpol on related signal pathways[J]. Chin Pharmacol Bull, 2015, 31(9): 1189-94. |
| [7] | 万东, 祝慧凤, 罗勇, 等. 梓醇促大鼠大脑皮质神经元轴突生长的离体研究[J]. 中国中药杂志, 2007, 32(17): 1771-4. Wan D, Zhu H F, Luo Y, et al. The study of catalpol on axon growth in the cerebral cortical neurons in vitro[J]. China J Chin Mater Med, 2007, 32(17): 1771-4. doi:10.3321/j.issn:1001-5302.2007.17.013 |
| [8] | 祝慧凤, 万东, 罗勇, 等. 梓醇上调GAP-43表达伴随局灶脑缺血大鼠神经功能恢复[J]. 中国药理学通报, 2007, 23(9): 1231-6. Zhu H F, Wan D, Luo Y, et al. Catalpol upregulated GAP-43 expression and made nerve function recovery in rats with focal cerebral ischemia[J]. Chin Pharmacol Bull, 2007, 23(9): 1231-6. |
| [9] | 林牧, 龚其海, 吴芹, 等. 金钗石斛多糖对脂多糖作用大鼠皮层胶质细胞-神经元体系的保护作用[J]. 中国药理学通报, 2016, 32(8): 1144-8. Lin M, Gong Q H, Wu Q, et al. Protective effect of Dendrobium nobile polysaccharide on cortical glial cell-neuronal system induced by lipopolysaccharide in rats[J]. Chin Pharmacol Bull, 2016, 32(8): 1144-8. |
| [10] | 张玮, 唐卉凌, 王筠, 等. 大鼠大脑皮质神经元原代培养不同培养体系及纯化方法的比较研究[J]. 现代生物医学进展, 2010, 10(6): 1043-6. Zhang W, Tang H L, Wang J, et al. Comparative study on different culture systems and purification methods of primary culture of rat cerebral cortical neurons[J]. Prog Mod Biomed, 2010, 10(6): 1043-6. |
| [11] | Lin Y C, Huang Z H, Jan I S, et al. Development of excitatory synapses in cultured neurons dissociated from the cortices of rat embryos and rat pups at birth[J]. J Neurosci Res, 2002, 67(4): 484-93. doi:10.1002/(ISSN)1097-4547 |
| [12] | Pakkenberg B, Gundersen H J G. Neocortical neuron number in humans: effect of sex and age[J]. J Comp Neurol, 1997, 384(2): 312-20. doi:10.1002/(ISSN)1096-9861 |
| [13] | 孙晓慧, 王燕, 牟艳玲. 2型糖尿病大鼠心肌PI3K/Akt/mTOR信号通路的改变及Sirt1的调控机制研究[J]. 中国药理学通报, 2017, 33(6): 793-8. Sun X H, Wang Y, Mou Y L. Changes of PI3K/Akt/mTOR signaling pathway in myocardium of type 2 diabetic rats and the regulatory mechanism of Sirt1[J]. Chin Pharmacol Bull, 2017, 33(6): 793-8. |

