


2. 中国医学科学院药用植物研究所药理毒理中心,北京 100193
 ,
LIU Xue-song1,
ZHANG Miao-di1,
WANG Min2,
ZHANG Jing-yi2,
WANG Rui-ying2,
SUN Gui-bo2
,
LIU Xue-song1,
ZHANG Miao-di1,
WANG Min2,
ZHANG Jing-yi2,
WANG Rui-ying2,
SUN Gui-bo2
 ,
SUN Xiao-bo2
,
SUN Xiao-bo2

2. Pharmacology and Toxicology Center, Institute of Medicinal Plant Development, Chinese Academy of Medical Sciences, Beijing 100193, China
缺血性心肌病在治疗后会发生缺血/再灌注(ischemia/reperfusion,I/R)损伤,导致受损心肌的梗死面积扩大,受损程度也会加重。这种现象的发生与多种机制有关,包括钙超载、氧自由基增多、炎症反应等。随着心肌缺血的治疗技术的提高,I/R时期的治疗已成为缺血性心肌病的治疗重点,因此,揭示心肌I/R损伤的发生机制和研究防治损伤的措施,已经成为现代心血管疾病防治中的关键课题之一[1]。
钙-钙调蛋白依赖性蛋白激酶Ⅱ(calcium-calmodulin-dependent protein kinase Ⅱ,CaMKII)是一种分布广泛的多功能丝氨酸/苏氨酸蛋白激酶,通过磷酸化与Ca2+调节相关的蛋白,影响心肌的兴奋收缩偶联及细胞钙稳态。在心肌缺血缺氧等病理条件下,心肌细胞钙离子循环出现异常,Ca2+超载进一步导致I/R损伤,CaMKII通过代偿性活性改变起到维持Ca2+稳态及心肌保护效应。深入了解楤木皂苷C(aralosdie C,SMC)对I/R原代大鼠心肌细胞收缩功能及钙瞬变产生的影响具有重要的临床应用前景[2]。
龙牙楤木[Aralia elata (Miq) Seem]系五加科楤木属植物,其性味辛、苦,有低毒,具有补气安神、养心除烦、活血通络之功效[3]。本课题组从上世纪80年代就开始了对龙牙楤木的系统研究,通过研究发现了龙牙楤木总皂苷治疗冠心病的新用途[4],目前,以龙牙楤木总皂苷为成分研制的楤木心脉通胶囊已获得药物临床研究批件(批件2003L01111),现已完成临床观察。SMC为龙牙楤木总皂苷中的成分之一,属于齐墩果酸型五环三萜,为龙牙楤木主要活性成分之一[5]。本研究采用Langendorff心脏灌流系统分离得到原代大鼠心肌细胞[6],通过细胞收缩与离子浓度同步测定系统[7],同步检测SMC对I/R心肌细胞的收缩/舒张功能和钙瞬变的影响[8]。通过KN-93抑制CaMKⅡ,进一步验证SMC发挥作用的机制。
1 材料 1.1 动物20只成年♂ SD大鼠,体质量180~200 g,SPF级,购自北京维通利华实验动物技术有限公司,许可证编号:SCXK(京)2012-0001。实验动物在清洁级动物室饲养,标准室温(22±2)℃和相对湿度(60±10)%。
1.2 药物与试剂龙牙楤木总皂苷单体C(SMC,中国医学科学院药用植物研究所药理毒理中心);台式液(单位:mmol·L-1,NaCl 137、KCl 5.4、MgCl2 1.2、HEPES 10、glucose 1.0,4℃ pH 7.4);Buffer A(牛磺酸终浓度10 mmol·L-1的无钙台式液);Buffer B(CaCl2终浓度1.2 mmol·L-1的台式液);Buffer E(30 mL Buffer A+30 mg BSA+24 mg胶原酶Ⅱ);KB液(单位:mmol·L-1,KOH 80、KCl 40、KH2PO4 25、MgSO4 3.0、L-谷氨酸50、牛磺酸20、HEPES 10、EGTA 1.0、D-Glu 10,pH 7.2);化学缺氧液(单位:mmol·L-1,NaCl 123、NaHCO3 6.0、NaH2PO4 0.9、KCl 8.0、MgSO4 0.5、Na-Lactale 20、CaCl2 1.8,pH 6.8);胶原酶Ⅱ、Fura-2/AM(美国Invitrogen公司);牛血清白蛋白、牛磺酸(美国Sigma Chemical公司)。
1.3 仪器细胞收缩与离子浓度同步测定系统(美国IonOptix公司);恒温磁力搅拌器(上海司乐仪器有限公司);电子天平(上海梅特勒-托利多仪器有限公司)。
2 方法 2.1 成年大鼠原代心肌细胞分离采用乌拉坦[9](1 g·kg-1,ip)麻醉大鼠后,打开胸腔并迅速取出心脏(尽量取足够长的主动脉),迅速置于冰冷无钙的台式液中。去除多余组织,迅速将动脉针套入主动脉并用缝合线扎紧,固定于Langendorff心脏灌流系统(从开胸到开始灌流时间不要超过2 min),经主动脉灌流(38℃)预充高纯氧的Buffer B约2 min,以泵出血污。换Buffer A灌流液灌5 min,使心脏的血液完全排出。氧饱和的Buffer E循环灌流,不断检查心脏硬度,灌流约10~15 min后,待心脏变得柔软,终止消化。用注射器注射15 mL Buffer A冲洗心脏内的消化酶,剪下左心室至KB液中,用镊子撕碎。用3 mL吸管反复吹打加速细胞分离,100目筛网过滤,吸取细胞滤液至10 mL的EP管中,室温静置10 min,使存活的心肌细胞沉降,弃去上清液,再次用KB液重悬细胞室温静置10 min,弃去上清。第3次KB液重悬细胞,室温静置超过30 min,让营养充分作用于细胞。然后分3次复钙,使Buffer B体积比逐渐升高,每次让细胞自然沉降10 min,弃上清加入下一浓度的钙溶液中。3次的Buffer B与台式液的体积比分别为1 :2、2 :1、3 :0,最终得到钙耐受心肌细胞。复钙完成后弃去上清液,定容至3 mL备用。终浓度取4~8 μL的Fura-2/AM加入细胞液中,负载15 min,弃上清,用Buffer B洗2次,各5 min。3 mL Buffer B稀释细胞,取2~3滴加到载物台静置2 min。选择外形呈棒状并具有清晰边缘的心室肌细胞用于本次研究。
2.2 I/R模型制备及实验分组将分离纯化的心肌细胞分为对照组(Control)、模型组(I/R)、模型加药组(根据前期实验基础筛选出终浓度为8 μmol·L-1 SMC,给药5 min[10])、抑制剂组(根据已有文献报道采用KN-93终浓度1 μmol·L-1,给药5 min[11])。心肌细胞在0.5 Hz、5 ms波宽电场刺激下,有节律收缩稳定后,模型组用化学缺氧液灌流20 min模拟缺血,然后换以Buffer B再灌注20 min。模型加药组使用含SMC(终浓度8 μmol·L-1)的Buffer B灌流液预给药5 min,然后以化学缺氧液进行模拟缺氧,20 min后再灌注Buffer B。抑制剂组灌流含KN-93的Buffer B(终浓度1 μmol·L-1)5 min,再以含SMC的Buffer B(终浓度8 μmol·L-1)预给药5 min,化学缺氧液灌流20 min,然后Buffer B再灌注20 min,模拟I/R。
2.3 心肌细胞收缩及钙瞬变检测心肌细胞收缩采用IonOptix细胞收缩与离子浓度同步测定系统同步检测细胞收缩及钙瞬变。该系统可以自动将波长变化与视频框架同步记录,可获得250对比率/秒的比率,配置中包含HyperSwith光源系统,测Ca2+可以实现340/380快速转化波长,其比率可达250 Hz,采样速度达到1 000次/秒,可以实现真正的实时测量。将心肌细胞置于倒置显微镜载物台上的细胞灌流小室内,并给予电场刺激(0.5 Hz,5 ms),IonOptix的MyoCam照相系统接收细胞收缩的影像并呈现在监视器上。心肌细胞肌小节收缩幅度及速度等指标由计算机实时采集并记录。同时,细胞内与游离Ca2+结合的荧光物质被激发,并通过双激发荧光光电倍增系统检测荧光信号。选取长杆状,边缘折光性好,横纹清晰,无自发收缩的心室肌细胞进行实验,且给药前细胞收缩幅度恒定至少5 min。
2.4 数据处理实验数据以x±s表示,各组数据采用两样本均数的t检验进行统计学处理,用SPSS 12.0统计软件进行统计学分析。
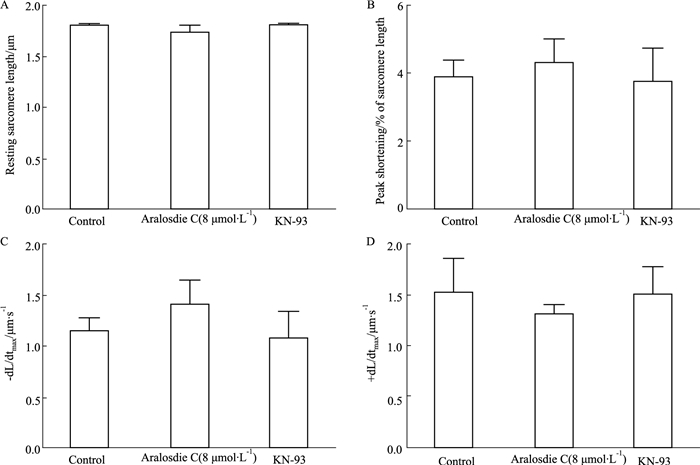
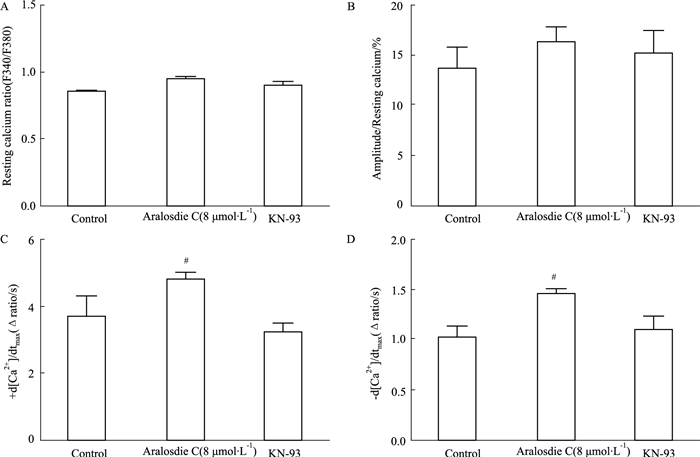
3 结果 3.1 SMC及KN-93对正常心肌细胞收缩和钙瞬变的影响Fig 1、2数据表明,单加SMC、单加抑制剂KN-93与正常心肌细胞相比较,静息态肌节长度、收缩幅度、收缩速度、舒张速度差异均无显著性,说明单加SMC、单加KN-93对细胞收缩功能无较大影响。观察心肌细胞钙瞬变相关指标可知,稳态钙静息值、钙瞬变幅度与对照组水平相近,单加SMC后,细胞收缩时[Ca2+]i上升的速率、细胞舒张时[Ca2+]i下降的速率高于正常心肌细胞,单加KN-93细胞收缩时[Ca2+]i上升的速率、细胞舒张时[Ca2+]i下降的速率与正常心肌细胞差异无显著性。
|
| Fig 1 Effect of aralosdie C and KN-93 on contractile function of normal myocardium A: Resting sarcomere length; B: Peak shortening; C:-dL/dtmax; D: +dL/dtmax. #P < 0.05 vs control |
|
| Fig 2 Effect of aralosdie C and KN-93 on Ca2+ transients of normal myocardium A: Resting calcium ratio; B: Amplitude resting calcium; C: +d[Ca2+]/dtmax; D: -d[Ca2+]/dtmax. #P < 0.05 vs control |
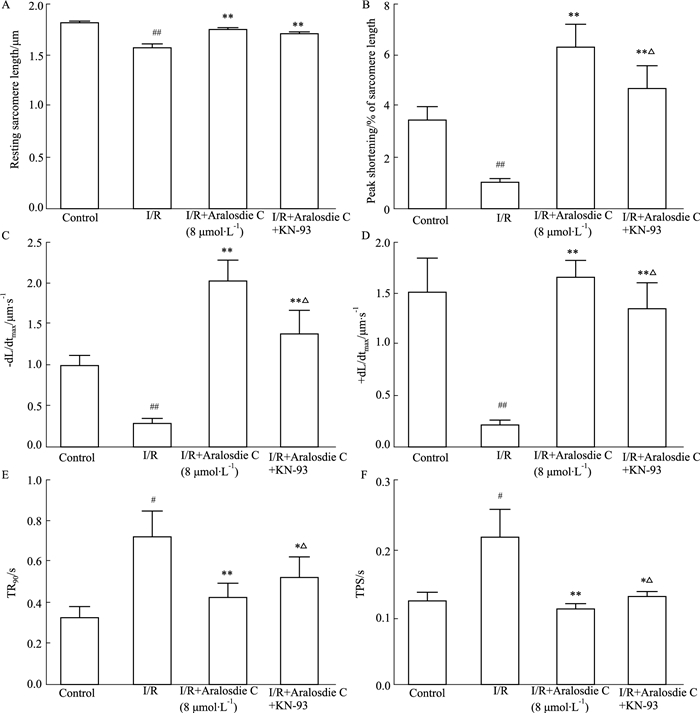
Fig 3、4结果表明,I/R+SMC与I/R组相比,肌节长度、收缩幅度、收缩/舒张速度均明显升高,其中收缩幅度和收缩/舒张速度高于对照组,表现正性肌力作用。细胞达到舒张时最大长度90.0 %的时间与细胞收缩达峰值的时间明显降低,具有恢复至缺氧前水平的趋势。但加入KN-93抑制CaMKⅡ后,除肌节长度无明显变化外,SMC对细胞收缩幅度、速度以及细胞达峰值时间等均比I/R+SMC组降低,说明加入抑制剂后,SMC对细胞收缩功能的作用效果降低。
|
| Fig 3 Effect of aralosdie C on cardiomyocyte contractile function during I/R A: Resting sarcomere length; B: Peak shortening; C:-dL/dtmax; D: +dL/dtmax; E: TR90; F: TPS.#P < 0.05, ##P < 0.01 vs control; *P < 0.05, **P < 0.01 vs I/R; △P < 0.05 vs I/R+Aralosdie C. |
|
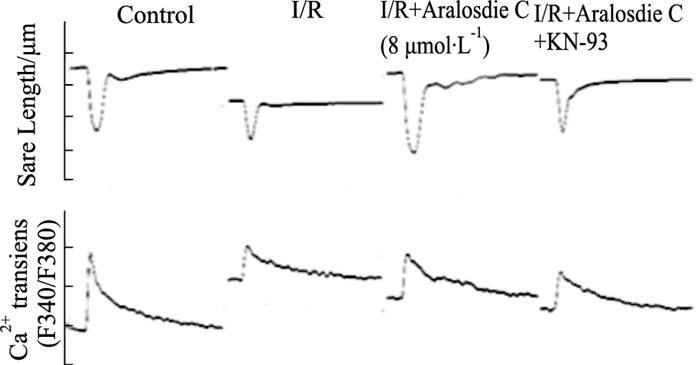
| Fig 4 Sarcomere shortening and Ca2+ transient recorded simultaneously from left ventricular myocytes after aralosdie C perfusion during I/R using SoftEdge MyoCam system |
再灌注后,SMC恢复细胞收缩功能的同时,心肌细胞钙瞬变也恢复。主要检测指标钙瞬变幅度、细胞收缩时[Ca2+]i上升的速率、细胞舒张时[Ca2+]i下降的速率较模型组明显增加,另外,稳态钙静息值、收缩期[Ca2+]i上升到最高50.0 %的时间、胞内钙瞬变衰减率均减少。KN-93抑制CaMKⅡ后,除稳态钙息值无变化外,SMC对钙瞬变的作用效果也相应降低,表明SMC改善I/R诱导心肌细胞钙瞬变紊乱作用机制可能与CaMKⅡ有关(Fig 5)。
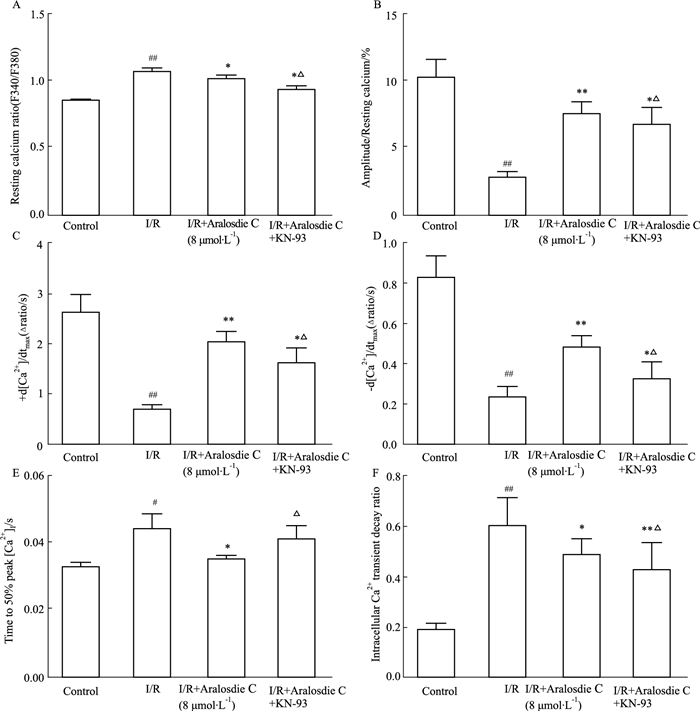
|
| Fig 5 Effect of aralosdie C on Ca2+ transient and cell contraction during I/R A: Resting calcium ratio; B: Amplitude resting calcium; C: +d[Ca2+]/dtmax; D: -d[Ca2+]/dtmax; E: Time to 50% peak [Ca2+]i; F: Intracellular Ca2+ transient decay rate. #P < 0.05, ##P < 0.01 vs control; *P < 0.05, **P < 0.01 vs I/R; △P < 0.05 vs I/R+Aralosdie C. |
中国心血管病报告显示,2016年我国心血管病现患人数达2.9亿,当心肌缺血/再灌注损伤(myocardial ischemia reperfusion injury, MIRI)发生时[12],可导致心绞痛、心肌梗死等多种疾病。血运重建仍然是目前最主要的治疗心肌缺血的方法,目前关于MIRI的机制尚不十分明确,治疗效果一般,尤其是没有非常有效针对MIRI的治疗药物,MIRI已成为世界亟待解决的难题。
为了探讨SMC是否通过调控CaMK Ⅱ对大鼠心肌细胞收缩功能和钙瞬变产生影响,本实验使用胶原酶分解法分离得到成年大鼠心室肌细胞,使用SMC体外干预,减少了多种体内因素对SMC心肌保护作用的影响[13]。使用细胞收缩与离子浓度同步测定系统实时记录SMC对心肌细胞收缩与钙瞬变的影响。该测定系统的特点是在获得细胞肌节收缩/舒张功能相关参数的同时,可以获得心室肌细胞内钙瞬变的同步变化,从而便于对细胞肌小节收缩及钙瞬变的结果进行综合分析。根据前期SMC改善I/R损伤的预实验,浓度筛选范围为0.01~20 μmol·L-1,最终选择了8 μmol·L-1作为最佳剂量;给药时间尝试5、10、15、20 min,发现预给药5 min为最佳给药时间[10]。对加入SMC和未加入SMC的I/R成年大鼠心肌细胞收缩功能进行比较,发现SMC处理可明显促进I/R成年大鼠心肌细胞收缩功能的恢复,SMC改善心肌细胞收缩的同时,其钙瞬变也相应改善,并且SMC使钙瞬变幅度和[Ca2+]i上升/下降的速率明显升高,但加入KN-93抑制CaMKⅡ后,除稳态钙息值无变化外,SMC对钙瞬变的作用效果降低,表明SMC改善I/R损伤可能与CaMKⅡ有关。在I/R原代大鼠心肌细胞中使用特异性抑制剂KN-93阻断CaMKⅡ信号途径,导致SMC对细胞收缩功能及钙瞬变的作用效果降低。
综上所述,SMC可明显改善I/R成年大鼠心肌细胞的收缩功能和钙瞬变,减轻I/R成年大鼠心肌细胞损伤,为寻找安全有效的防治MIRI的药物提供了实验依据,对防治缺血/再灌注所造成的心肌损害具有重要意义和应用前景。
| [1] | 李光, 邢小燕, 张美双, 等. 中药三七对缺血/再灌注损伤的保护作用及应用前景[J]. 中国药理学通报, 2015, 31(10): 1340-4. Li G, Xing X Y, Zhang M S, et al. Panax notoginseng in treatment of myocardial ischemia/reperfusion injury and its application prospect[J]. Chin Pharmacol Bull, 2015, 31(10): 1340-4. doi:10.3969/j.issn.1001-1978.2015.10.003 |
| [2] | 常荣, 格日力. CaMKⅡ在细胞钙稳态维持及心肌保护中作用的研究进展[J]. 生理科学进展, 2011, 42(1): 55-8. Chang R, Ge R L. Research progress in the role of CaMK Ⅱ in maintenance of cellular calcium homeostasis and myocardial protection[J]. Prog Physiol Sci, 2011, 42(1): 55-8. |
| [3] | 孙桂波, 王敏, 高蒙蒙, 等. 龙牙楤木总皂苷对H2O2诱导乳鼠心肌细胞损伤的保护作用[J]. 中国药理学通报, 2013, 29(6): 773-7. Sun G B, Wang M, Gao M M, et al. Protective effects of Aralosides (AS) against H2O2-induced injury in neonatal rat cardiomyocytes[J]. Chin Pharmacol Bull, 2013, 29(6): 773-7. |
| [4] | 孙桂波, 李锐, 周莉玲, 等. 龙牙楤木化学成分与药理作用的研究进展[J]. 中药新药与临床药理, 2003(2): 139-41. Sun G B, Li R, Zhou L L, et al. Research progress of chemical constituents and pharmacological effects of Aralia elata[J]. Tradit Chin Drug Res Clin Pharmacol, 2003(2): 139-41. |
| [5] | 张家鑫, 田瑜, 孙桂波, 等. 龙牙楤木皂苷类成分及药理活性研究进展[J]. 中草药, 2013(6): 770-9. Zhang J X, Tian Y, Sun G B, et al. Research progress in chemcial constituents of saponins from Aralia elataand their pharmacological activities[J]. Chin Herbal Med, 2013(6): 770-9. |
| [6] | 谢英花, 马燕山, 张楠, 等. 硫化氢抑制离体灌流大鼠急性心肌缺血所致心肌细胞凋亡研究[J]. 中国药理学通报, 2014, 30(11): 1543-7. Xie Y H, Ma Y S, Zhang N, et al. Inhibitory effect of hydrogen sulfide on cardiomyocyte apoptosis induced by acute myocardial ischemia in rats[J]. Chin Pharmacol Bull, 2014, 30(11): 1543-7. doi:10.3969/j.issn.1001-1978.2014.11.013 |
| [7] | 张海锋, 张博, 张晓东, 等. 可视化动缘探测系统检测心肌细胞舒缩功能[J]. 中国应用生理学杂志, 2004, 20(4): 99-103. Zhang H F, Zhang B, Zhang X D, et al. Measurement of systolic/diastolic function in isolated ventricular myocytes by video-based motion Edge-Detection system[J]. Chin J Appl Physiol, 2004, 20(4): 99-103. |
| [8] | 张妙笛, 孙桂波, 徐惠波, 等. 龙牙楤木总皂苷对缺血/再灌注心肌细胞收缩功能和钙瞬变的影响[J]. 中国中药杂志, 2015, 40(12): 2403-7. Zhang M D, Sun G B, Xu H B, et al. Effect of aralosides to contraction function and calcium transient of ischemia/reperfusion myocardial cells[J]. China J Chin Mater Med, 2015, 40(12): 2403-7. |
| [9] | Wang M, Xu X, Xu H, et al. Effect of the total saponins of Aralia elata (Miq) Seem on cardiac contractile function and intracellular calcium cycling regulation[J]. J Ethnopharmacol, 2014, 155(1): 240-7. doi:10.1016/j.jep.2014.05.024 |
| [10] | Wang M, Tian Y, Du Y, et al. Protective effects of Araloside C against myocardial ischaemia/reperfusion injury: potential involvement of heat shock protein 90[J]. J Cell Mol Med, 2017, 21(9): 1870-80. doi:10.1111/jcmm.2017.21.issue-9 |
| [11] | Yan W, Zhang F, Zhang R, et al. Adiponectin regulates SR Ca2+ cycling following ischemia/reperfusion via sphingosine 1-phosphate-CaMKⅡ signaling in mice[J]. J Mol Cell Cardiol, 2014, 74: 183-92. doi:10.1016/j.yjmcc.2014.05.010 |
| [12] | 卢宁, 韩吉春, 任博雪, 等. 二氢槲皮素预处理对心肌缺血/再灌注损伤抗氧化作用的影响[J]. 中国药理学通报, 2017, 33(4): 487-92. Lu N, Han J C, Ren B X, et al. Antioxidation effect of dihydroquercetin pretreatment in isolatedrat hearts during myocardial ischemia reperfusion injury[J]. Chin Pharmacol Bull, 2017, 33(4): 487-92. |
| [13] | 石晓路, 柳絮, 郭会彩, 等. 大鼠心肌细胞分离方法的改进[J]. 中国药理学通报, 2010, 26(5): 687-90. Shi X L, Liu X, Guo H C, et al. An improved method of isolation of rat cardiac myocytes[J]. Chin Pharmacol Bull, 2010, 26(5): 687-90. |