


2. 延边大学附属医院 中心实验室,吉林 延吉 133000
2. Central Laboratory, Affiliated Hospital of Yanbian University, Yanji Jilin 133000, China
目前国内外文献提出,多数心血管损伤与氧化应激有密切关联[1-2]。氧自由基参与心血管系统多种生理病理过程,引发多种心血管疾病,尤其在动脉粥样硬化(atherosclerosis,AS)等血管内皮损伤的发生、发展过程中起重要作用[3-4]。AS主要是血管内皮细胞出现应激性损伤,成纤维细胞及平滑肌细胞等增生为关键性病变[5-8]。其主要特点是在大、中动脉内膜下脂质粥样斑块形成[9]。近年研究表明,高脂血症可增加机体细胞脂质过氧化损伤,促进AS的形成和发展[10]。氧化应激学说是AS斑块形成学说中的重要组成部分[11]。氧化应激属于生物体在处于一些应激性损伤环境时,生物体内氧化与抗氧化之间的平衡失调,最终可出现生物体损伤[12]。基于此,本研究拟分析高脂对人脐静脉血管内皮细胞(human umbilical vein endothelial cells,HUVECs)的NADPH氧化酶活性及细胞内活性氧簇(reactive oxygen species,ROS)水平的影响,阐明NADPH氧化应激通路与高脂所致血管内皮细胞的氧化应激损伤之间的关联,为脂毒性内皮损伤的防治提供新的靶点。
1 材料 1.1 细胞系HUVECs购自上海基免实业有限公司。
1.2 试剂p22phox、p47phox、p67phox、gp91phox抗体均购自美国Abcam公司;ROS检测试剂盒、Cell Counting Kit 8(CCK-8) 检测试剂盒,购自碧云天生物技术研究所;DMEM培养基、胎牛血清、胰酶,均购自美国Gibco公司;棕榈酸(palmitic acid,PA)、NADPH氧化酶抑制剂diphenyliodonium(DPI),均购自Sigma公司。
1.3 仪器超净工作台(上海博讯实业有限公司);二氧化碳培养箱(杭州利辉环境检测设备有限公司);荧光显微镜及倒置显微镜(日本奥林巴斯公司);紫外分光光度计(上海凌析仪器有限公司);多功能酶标仪(上海逍鹏生物科技有限公司);高速冷冻离心机(德国Sigma公司);电泳槽、电转膜仪(Bio-Rad公司);化学发光凝胶成像系统(美国ProteinSimple公司)等。
2 方法 2.1 游离脂肪酸的配制用0.1 mol·L-1的NaOH溶液在70℃水浴中溶解一定量的PA,振荡混匀10 min,过滤,配成100 mmol·L-1的PA储存液。在55℃水浴中,用去离子水配50 g·L-1的BSA溶液,过滤。然后,将上述的PA溶液和BSA溶液按1:19的体积比混合,配成PA/BSA复合液,在水浴中振荡10 s,继续水浴10 min,取出后冷却至室温,过滤。然后将上述复合液分别用高糖DMEM培养基稀释。
2.2 细胞培养HUVECs在细胞培养箱(饱和湿度、5% CO2、37℃)中培养至70%~80%融合度,经消化、传代,进行实验。采用的DMEM培养液包含10 mL·L-1双抗、2 mmol·L-1的L-谷氨酰胺、10 mmol·L-1的HEPES、10 mmol·L-1的丙酮酸钠、5 mmol·L-1葡萄糖。
2.3 实验分组① PA浓度梯度分析实验:对照组、PA组(0.1、0.2、0.4、0.8 mmol·L-1)。② PA时间梯度分析实验: PA分别刺激0、12、24、48 h组。③ 抑制剂实验:对照组、0.4 mmol·L-1 PA组、10 μmol·L-1 DPI预处理2 h后给予0.4 mmol·L-1 PA组。
2.4 检测指标 2.4.1 CCK-8检测细胞增殖率HUVECs接种于96孔培养板中(每孔1×106个细胞),培养24 h后给药,进行孵育,每孔中加入10 μL CCK-8溶液反应2 h,酶标仪检测570 nm处吸光度值,计算细胞增殖率。共重复3次,每组设6个复孔。
2.4.2 Western blot法检测NADPH信号通路蛋白表达水平每组血管内皮细胞在细胞培养箱内培养过夜后,用PBS清洗2次,按组别给药后,培养箱内孵育一定时间,4℃用裂解液裂解细胞30 min后,用细胞刮将培养板内细胞反复刮至离心管内,13 000 r·min-1离心15 min,蛋白定量后,取20 μL的蛋白样品加入SDS-PAGE凝胶样品槽内,经电泳、转膜、封闭等过程后,加入NADPH氧化酶亚基p22phox、p47phox、p67phox、gp91phox抗体,4℃孵育24 h,经洗膜、加入二抗室温反应1 h后,用显影液处理,用化学发光凝胶成像仪分析NADPH信号通路蛋白表达水平。
2.4.3 ROS含量的检测6孔细胞培养板接种HUVECs,当细胞贴壁生长至70%~80%融合度,按组别给药后,培养箱内孵育24 h,PBS反复冲洗后,细胞培养板内加入10 μmmol·L-1 DCFH-DA,培养箱内孵育30 min,PBS反复冲洗后,采用荧光显微镜进行拍照,并用ImageJ 1.41软件分析绿色荧光强度。
2.5 统计学方法数据以x±s表示,统计学分析采用GraphPad软件,采用单因素方差分析进行组间比较,两组比较采用成组设计资料t检验。
3 结果 3.1 高脂对HUVECs细胞增殖功能的影响Fig 1A显示,PA(0.1、0.2、0.4、0.8 mmol·L-1)刺激24 h后,0.4、0.8 mmol·L-1 PA组的血管内皮细胞增殖率均明显降低(P<0.05)。Fig 1B显示,0.4 mmol·L-1 PA刺激0、12、24、48 h后,刺激时间在24~48 h时,血管内皮细胞增殖率均明显降低(P<0.05)。
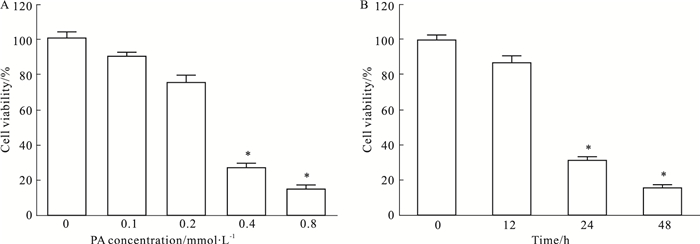
|
| Fig 1 Influence of high fat on cell viability in HUVECs (x±s, n=5) A: Cell viability was significantly suppressed when palmitic acid(PA) concentration increased to 0.4 mmol·L-1; B: Cell viability was significantly suppressed when incubated time exceeded 24 h in 0.4 mmol·L-1 PA. *P < 0.05 vs 0 mmol·L-1 group (A) or 0 h group (B). |
如Fig 2所示,0.4 mmol·L-1 PA刺激0、12、24、48 h后,刺激时间在24~48 h时,NADPH氧化酶亚基p22phox、p47phox、p67phox、gp91phox的蛋白水平出现高表达状态(P<0.05),而24 h PA刺激组与48 h PA刺激组之间的NADPH氧化酶亚基活性差异均无统计学意义(P>0.05)。
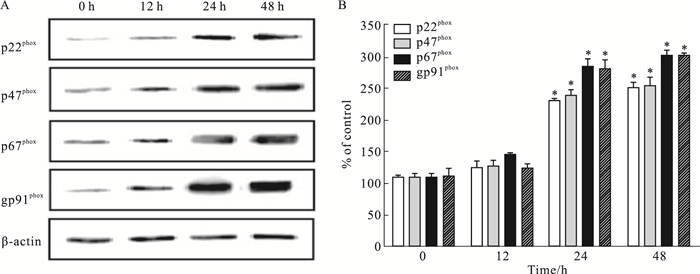
|
| Fig 2 Influence of high fat on expression of NADPH oxidase in HUVECs (x±s, n=3) A: Representative images of p22phox, p47phox, p67phox and gp91phox expression by Western blot; B: Quantitative analysis of p22phox, p47phox, p67phox and gp91phox expression.*P < 0.05 vs 0 h group. |
如Fig 3所示,0.4 mmol·L-1 PA刺激0、12、24、48 h后,刺激时间在24~48 h时,细胞内ROS的水平出现高表达状态(P<0.05),而24 h PA刺激组与48 h PA刺激组之间的ROS水平差异无显著性(P>0.05)。
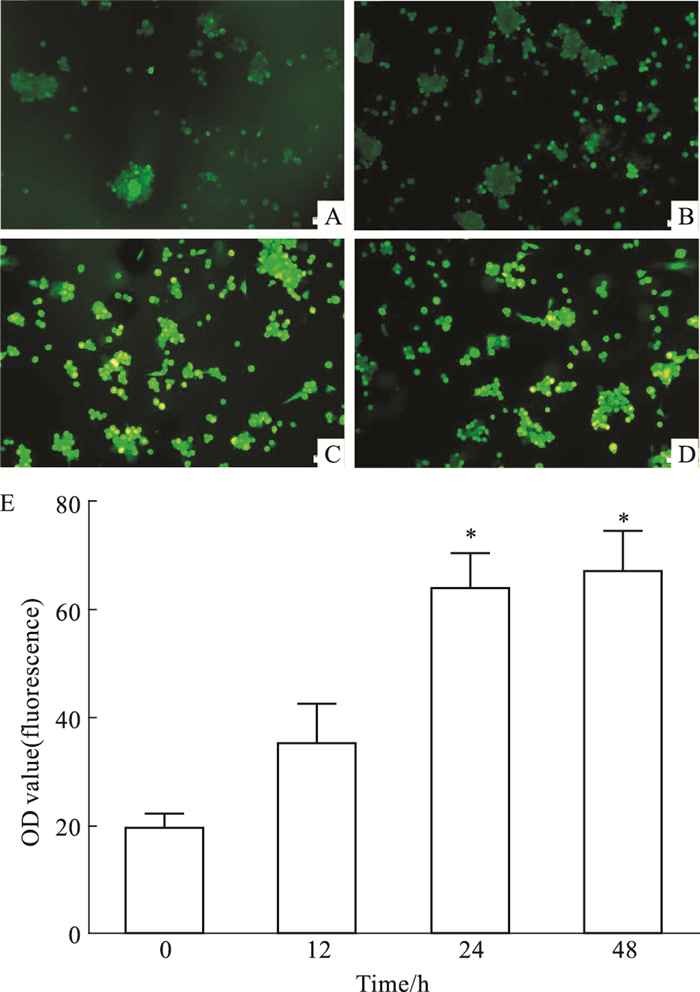
|
| Fig 3 Effects of high fat on ROS of HUVECs The intracellular level of ROS in HUVECs was estimated by DCFH-DA, a fluorescent probe. Fluorescence images of HUVECs stained with DCFH-DA after cells were incubated for 0 h (A), 12 h (B), 24 h (C) and 48 h (D) with 0.4 mmol·L-1 PA. Scale bars: 50 μm. Quantitative analysis for the intensity of green fluorescence (E). *P < 0.05 vs 0 h group |
如Fig 4所示,0.4 mmol·L-1 PA刺激24 h后,细胞内ROS水平出现明显升高(P<0.05);而与单纯PA(0.4 mmol·L-1)组相比,预处理NADPH氧化酶抑制剂DPI组ROS水平明显降低(P<0.05),与对照组之间差异无显著性(P>0.05)。
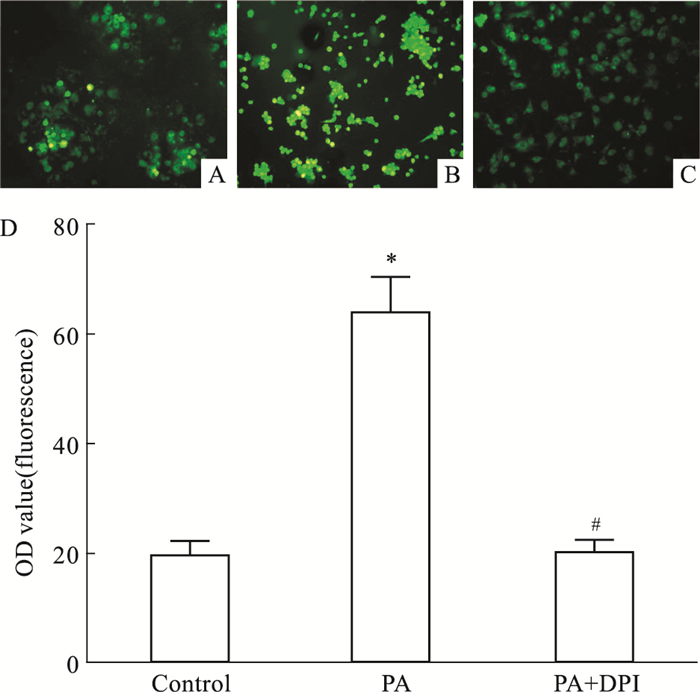
|
| Fig 4 Influence of NADPH oxidase inhibitor DPI(10 μmol·L-1) on ROS of HUVECs exposed to high fat The intracellular level of ROS in HUVECs was estimated by DCFH-DA, a fluorescent probe. Fluorescence images of HUVECs stained with DCFH-DA after cells were incubated for 24 h with control (A), 0.4 mmol·L-1 PA (B) and 0.4 mmol·L-1 PA+10 μmol·L-1 DPI (C). Scale bars: 50 μm. Quantitative analysis for the intensity of green fluorescence (D). *P < 0.05 vs control; #P < 0.05 vs PA |
动脉粥样硬化性疾病属于人类慢性病中最常见且难以得到根治的疾病之一,往往称其为心血管疾病中“头号杀手”,死亡率较高。在全世界范围内,因动脉粥样硬化血栓形成导致死亡的人数占全部疾病死亡人数的52%,远远超过了列第2位死因的肿瘤(24%),可以说动脉粥样硬化性疾病已成为人类健康的第一杀手。目前,我国动脉粥样硬化性疾病的发病率也在呈逐年上升的趋势。动脉粥样硬化的发病过程十分复杂,其确切病因尚未完全阐明,其危险因素有300多个,最早被公认的重要危险因素为高血脂、高血压、吸烟、糖尿病等,其中,高血脂与动脉粥样硬化等血管内皮损伤的相关性居首位,是其独立危险因素[13]。因此,本研究建立了高脂所致血管内皮细胞损伤模型,旨在模拟脂毒性动脉粥样硬化体系。
另一方面,近年来动脉粥样硬化基础理论和动脉粥样硬化性疾病的防治研究也取得突破性进展,出现了许多新理念。例如氧化应激学说,氧化应激属于生物体在处于应激环境时,生物体内ROS积累过多,以至于无法得到有效清除,体内氧化/抗氧化平衡被打乱,最终出现生物体损伤。其中ROS是主要环节,ROS在体内的生成需要有几种酶的参与,其中NADPH氧化酶最为重要[14]。NADPH氧化酶定位于吞噬细胞质膜上,是一种黄素细胞色素,为多系统成分,主要包括黄素蛋白、细胞色素b558和辅酶Q等,它们组成了一个类似于电子传递链样的酶系统,当遇到应激源激活时,NADPH氧化酶能够将NADPH的电子传递给分子氧,生成超氧阴离子。NADPH氧化酶可被高脂激活,NADPH源性ROS的生成过多,氧化应激体系的平衡受到破坏,最终损伤组织或细胞。NADPH氧化酶是由p22phox、p47phox、p67phox、gp91phox、p40phox、Rac1 6种亚单位组成的复合体[15]。本研究提示,高脂刺激血管内皮细胞24 h后,NADPH氧化酶磷酸化亚基p22phox、p47phox、p67phox、gp91phox蛋白的表达明显升高,说明NADPH通路的激活可能与高脂诱导的血管内皮细胞损伤有密切关联。
在氧化应激过程中,其主要作用的物质是ROS。ROS在小剂量时能作为第二信使存在于生物体内,使生物体的正常生命活动得到有效的维持。一旦生物体氧化应激过度时,ROS的产生过量,使生物体无法有效清除过多的ROS,出现ROS在体内的过度蓄积。ROS过度产生不同程度损伤了生物体内脂质、蛋白质、核酸等物质正常的生命活动及功能,直接或间接地对生物体产生程度不一的毒性作用,严重时导致生物体细胞出现坏死或凋亡。本研究提示,高脂刺激24 h时,血管内皮细胞内ROS水平就出现明显升高,而与单纯高脂组相比,高脂+NADPH氧化酶抑制剂DPI组ROS水平出现明显降低,此现象说明血管内皮细胞可在高脂的刺激下出现明显的氧化应激损伤,且此损伤与NADPH氧化酶通路的激活密切相关。
综上所述,高脂刺激可抑制血管内皮细胞的增殖能力,激活NADPH氧化酶通路,使细胞处于氧化应激状态,而此状态成功被NADPH氧化酶抑制剂所阻断。此结果证实,调控NADPH依赖性氧化应激信号通路对血管内皮细胞损伤的防治有指导意义。
( 致谢: 本文实验主要在延边大学基础学院药学分析实验室、药理学实验室,延边大学附属医院中心实验室完成,由湖北科技学院医药研究院省重点实验室协助完成,感谢参与人员廉丽花副教授、李晶副教授,硕士生马伟平、金艳红、权丽娜等对本实验的帮助与指导。)
| [1] | 尹玉洁, 马柳一, 位庚, 等. 桂芍通络对兔动脉粥样硬化早期外膜滋养血管新生及氧化应激水平的干预作用[J]. 中国药理学通报, 2016, 32(3): 416-22. Yin Y J, Ma L Y, Wei G, et al. Influence of guishaotongluo on angiogenesis of adventitial vasa vasorum and oxidative stress in early stage of atherosclerosis[J]. Chin Pharmacol Bull, 2016, 32(3): 416-22. |
| [2] | 董曦, 孙桂波, 罗云, 等. 异鼠李素对H2O2引起的H9c2细胞氧化应激损伤的保护作用研究[J]. 中国药理学通报, 2015, 31(6): 853-60. Dong X, Sun G B, Luo Y, et al. Protective effect of isorhamnetin on H9c2 cell line against oxidative stress[J]. Chin Pharmacol Bull, 2015, 31(6): 853-60. |
| [3] | 丁奇峰, 王珏, 黄晋红, 等. 五福心脑清对实验性早期AS大鼠血脂、氧自由基及组织形态学的影响[J]. 天然产物研究与开发, 2014, 26(4): 504-8. Ding Q F, Wang Y, Huang J H, et al. Efects of Wufu Xinnaoqing on blood lipid, oxygen free radical and histomorphology in rat model with experimental early atherosclerosis[J]. Nat Prod Res Dev, 2014, 26(4): 504-8. |
| [4] | 孙为, 黄霞, 刘惠霞. 中风胶囊对大鼠动脉粥样硬化干预作用的实验研究[J]. 中国中医药科技, 2017, 24(3): 284-90. Sun W, Huang X, Liu H X. Experimental study on intervention effect of Zhongfeng capsule on rats' atherosclerosis[J]. Chin J Tradit Med Sci Technol, 2017, 24(3): 284-90. |
| [5] | Nacif M S, Almeida A L C, Young A A, et al. Three-dimensional volumetric assessment of diastolic function by cardiac magnetic resonance imaging: the multi-ethnic study of atherosclerosis(MESA)[J]. Arq Bras Cardiol, 2017, 108(6): 552-63. |
| [6] | Sahebkar A, Watts G F. Developing role of microRNA-33 in lipid metabolism and atherosclerosis[J]. Curr Opin Lipidol, 2016, 27(2): 197-9. doi:10.1097/MOL.0000000000000286 |
| [7] | Adamson P D, Newby D E, Dweck M R. Translational coronary atherosclerosis imaging with PET[J]. Cardiol Clin, 2016, 34(1): 179-86. doi:10.1016/j.ccl.2015.06.002 |
| [8] | Ali A, Tawakol A. FDG PET/CT imaging of carotid atherosclerosis[J]. Neuroimaging Clin N Am, 2016, 26(1): 45-54. doi:10.1016/j.nic.2015.09.004 |
| [9] | Aoun R J, Sattur M G, Panchanathan R S. The ABSORB Ⅲ trial: potential new concepts for intracranial atherosclerosis in the post-SAMMPRIS era[J]. Neurosurgery, 2016, 78(2): N19-20. doi:10.1227/01.neu.0000479894.02619.6f |
| [10] | Vidé J, Virsolvy A, Romain C. Dietary silicon-enriched spirulina improves early atherosclerosis markers in hamsters on a high-fat diet[J]. Nutrition, 2015, 31(9): 1148-54. doi:10.1016/j.nut.2015.03.014 |
| [11] | Noguchi N. Role of oxidative stress in adaptive responses in special reference to atherogenesis[J]. J Clin Biochem Nutr, 2008, 43(3): 131-8. doi:10.3164/jcbn.2008068 |
| [12] | El-Saeed G S, Fadel F, Elshamaa M F. Advanced glycation end products and soluble receptor as markers of oxidative stress in children on hemodialysis[J]. Ren Fail, 2015, 37(9): 1452-6. doi:10.3109/0886022X.2015.1077317 |
| [13] | Han H, Cui W, Wang L. Lutein prevents high fat diet-induced atherosclerosis in ApoE-deficient mice by inhibiting NADPH oxidase and increasing PPAR expression[J]. Lipids, 2015, 50(3): 261-73. doi:10.1007/s11745-015-3992-1 |
| [14] | Itsumi M, Inoue S, Elia A J. Idh1 protects murine hepatocytes from endotoxin-induced oxidative stress by regulating the intracellular NADP(+)/NADPH ratio[J]. Cell Death Differ, 2015, 22(11): 1837-45. doi:10.1038/cdd.2015.38 |
| [15] | 葛勤敏, 边帆, 苏青. NADPH氧化酶在氧化应激中的作用[J]. 国际内分泌代谢杂志, 2007, 27(6): 395-8. Ge Q M, Bian F, Su Q. Role of NADPH oxidase in oxidative stress[J]. Int J Endocrinol Metab, 2007, 27(6): 395-8. |

