


2. 延边大学医学院临床学院2015级临床2班,吉林 延吉 133002
2. Clinical Class 2 of Grade 2015, Clinical School, Medical Science College, Yanbian University, Yanji Jilin 133002, China
类风湿关节炎(rheumatoid arthritis,RA)是一种以关节病变为主的全身性自身免疫性疾病,严重时会引起全身的关节肿胀疼痛及损坏,甚至造成残障。国外RA发病率约为1%~2%,我国发病率约为0.8%,患者的寿命平均缩短10~15年[1-2]。
目前,用于治疗RA的西药甲氨蝶呤和中药雷公藤多苷都具有一定的毒副作用。因此,研制高效、低毒抗RA新药势在必行,而中药在抗RA方面有着得天独厚的优势。黄芩苷(baicalin,BAI)是从中药黄芩中提取的多酚羟基黄酮类单体化合物,研究发现黄芩苷具有消炎[3-4]、抗氧化[5]、保护细胞免受损伤[6-7]等作用。至今,有关黄芩苷治疗RA的药效及机制研究未见报道。本研究首先成功制备RA大鼠模型,经不同剂量黄芩苷干预治疗后,从膝关节形态变化、病理损伤等方面综合进行药效评价;分离各组大鼠后肢膝关节滑膜,采用实时荧光定量PCR及Western blot技术检测黄芩苷对Toll样受体2(Toll-like receptor 2, TLR2) 介导的核因子κB(NF-κB)传导途径中关键分子的影响,以探寻黄芩苷对RA的治疗作用及其抗炎分子机制,为黄芩苷临床治疗RA提供线索。
1 材料 1.1 实验动物SD大鼠,♂,体质量(180±20) g,大鼠及饲料均购自宁夏医科大学实验动物中心,合格证号:SCXK2015-0001。
1.2 药品与试剂雷公藤多苷片(远大医药黄石飞云制药有限公司,准字号Z42021212);黄芩苷(BAI),纯度98%(南京春秋生物工程有限公司);牛源Ⅱ型胶原(Sigma,货号C7806);完全弗氏佐剂(Sigma,货号F5881);TRIzol试剂盒(Invitrogen);M-MLV反转录试剂盒(TaKaRa);Real-time qPCR扩增试剂盒(北京泽平生物技术有限公司);100 bp DNA Ladder(北京全式金生物技术有限公司);引物由上海生工生物工程公司合成;抗体TLR2(Santa Cruz, 货号sc-10739);MyD88(Abcam, 货号ab2064);NF-κB p65 (CST, 货号4764);蛋白质分子量Marker(Bio-Rad,货号161-0374);HRP标记山羊抗兔IgG二抗(北京中杉金桥生物技术有限公司,货号ZB-2301);GAPDH一抗(Abcam,货号ab8245);Western blot其他试剂、石蜡包埋及HE染色材料由本室配备。
2 方法 2.1 RA模型制备及评价SD大鼠100只,适应性饲养2 d后,从100只大鼠中随机取出16只作为正常对照组,其余84只采用Ⅱ型胶原与完全弗氏佐剂1:1的混合乳剂皮下注射,注射部位分别是尾根部、背部及足跖部,每个部位0.1 mL;正常对照组注射相同体积的0.01 mol·L-1的稀冰醋酸,距初次免疫7 d加强免疫1次[8]。然后,依据足趾肿胀度评价RA进展情况,具体方法是用千分游标卡尺垂直于趾沿爪心测量足厚度(mm)。
2.2 实验分组、给药及样本采集距初次免疫28 d,从84只致炎大鼠中剔除4只足趾红肿较轻的SD大鼠,将80只随机分成模型组、阳性对照组(雷公藤多苷片10 mg·kg-1)、BAI 60、30、15 mg·kg-1治疗组(雷公藤多苷片和BAI用药剂量依据大鼠的剂量是临床剂量的6.3倍确定)。当天灌胃给药,给药组每只大鼠每天按体质量给予相应剂量的药液,正常组与模型组每天给予相应量的生理盐水,共给药20 d。为确保RA模型成功,停药后再饲养20 d。取样当天禁食不禁水8 h,断颈处死后,纵向剪开后肢膝关节外侧皮肤,揭去覆盖关节的白色结缔组织,摘取滑膜,用生理盐水洗净,每组随机取4只大鼠滑膜固定于40 g·L-1的多聚甲醛溶液,其余存于液氮备用。
2.3 滑膜组织病理学观察将固定好的标本行石蜡包埋、切片厚6 μm。经HE染色,中性树胶封固后显微镜观察。
2.4 RT-qPCR检测滑膜组织mRNA表达从液氮中随机取6只大鼠滑膜,TRIzol提取各组滑膜组织总RNA,紫外分光光度计定量。取2 μg为模板,反转录合成cDNA,以1.5 μL cDNA为模板进行PCR扩增。引物序列:GAPDH(128 bp):上游5′-CAACTCCCTCAAGATTGTCAGCAA-3′, 下游5′-GGCATGGACTGTGGTCATGA-3′; TLR2(96 bp):上游5′-GACTCTGGAAGCAGGTGACA-3′, 下游5′-CA GTCAACCAGGACATGGAC-3′; MyD88 (101 bp):上游5′-TGGTGGTTGTTTCTGACGAT-3′, 下游5′-GATCAGTCGCTTCTGTTGGA-3′。PCR反应总体积为20 μL,扩增条件:预变性94℃ 15 min,变性94℃ 15 s、退火60℃ 34 s、延伸72℃ 15 s,共40个循环后72℃延伸10 min,4℃终止反应。RT-qPCR产物行12 g·L-1琼脂糖凝胶电泳,溴化乙锭显色后,用凝胶成像分析系统测定各目的条带与GAPDH的IOD值,比值为目的基因的相对表达量。
2.5 Western blot检测滑膜组织蛋白表达将滑膜组织于液氮中研磨至粉末,加入蛋白裂解液,离心提取总蛋白,BCA法蛋白定量。取总蛋白40 μg,按1:4体积比加入5×样品缓冲液,沸水浴5 min后上样,SDS-PAGE电泳(浓缩胶80 V,分离胶100 V),半干电转膜仪转膜(30 mA,90 min); 封闭后分别加入TLR2、MyD88及NF-κB p65一抗(TLR2一抗稀释度为1:1 000,MyD88为1:2 000,NF-κB p65为1:3 000,GAPDH为1:500),4℃过夜; TBS-T漂洗液洗膜10 min,共3次; 加入HRP标记的二抗(抗TLR2二抗稀释度为1:1 000,抗MyD88二抗为1:2 000,抗NF-κB p65二抗为1:2 000,抗GAPDH二抗为1:10 000),37℃振荡60 min; 加入ECL发光液,X线胶片曝光,经显影、定影、扫描后观察结果。应用Ipp软件对扫描图像的目的条带进行灰度分析,各目的条带与GAPDH的灰度比值为目的蛋白的相对表达量。
2.6 统计学分析采用SPSS17.0软件分析。实验数据以x±s表示,组间显著性比较用方差分析。
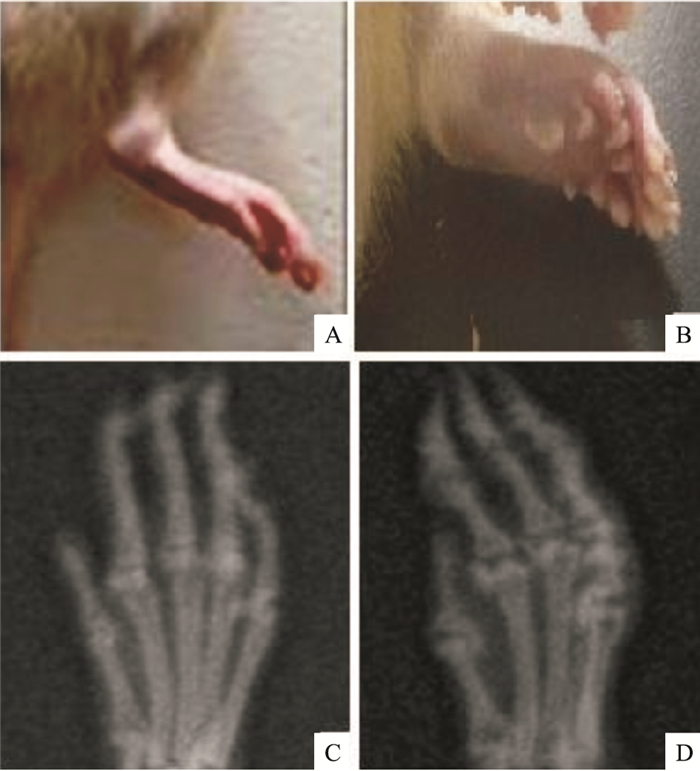
3 结果 3.1 成功制备RA模型在初次免疫后14~28 d,模型组的两后足踝关节以下,包括足趾与足掌出现严重红肿现象,不同时期足趾肿胀度见Tab 1。为进一步验证RA模型制备是否成功,在初次免疫后68 d,对正常组与模型组进行X线拍照。通过比较发现,模型组大鼠的各个关节明显膨大变形(Fig 1),与RA患者有相似的病理学特征,说明RA模型的制备是成功的。
| Group | 7 d | 14 d | 21 d | 28 d |
| Normal | 4.51±0.63 | 4.71±0.71 | 5.14±0.69 | 5.26±0.86 |
| Model | 6.85±1.02 | 10.75±1.63## | 10.24±1.58## | 9.22±1.38# |
| #P < 0.05, ##P < 0.01 vs normal | ||||
|
| Fig 1 The successful preparation of RA model A: Normal group(28 d); B: Model group (28 d); C: Normal group of X ray (68 d); D: Model group of X ray (68 d) |
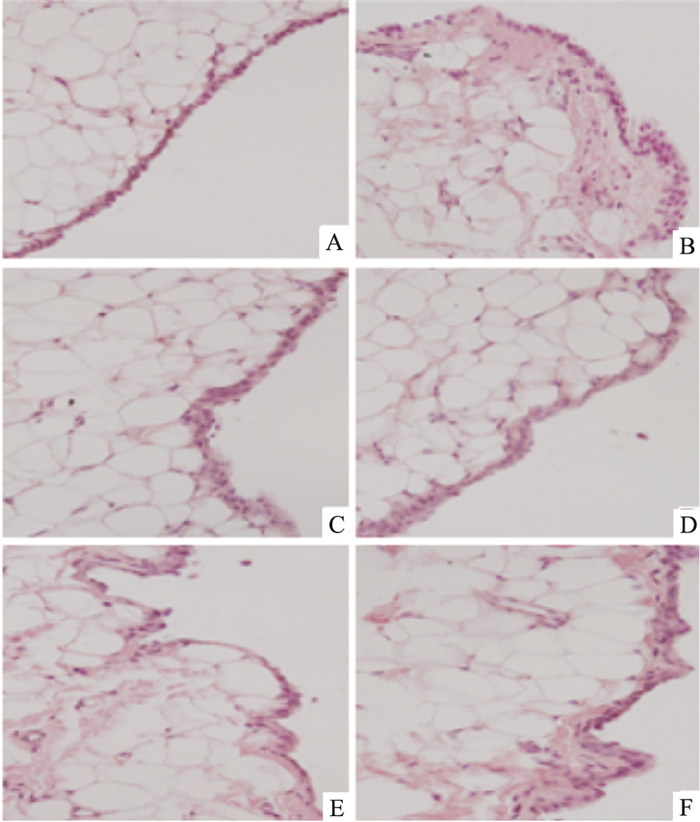
HE染色切片光镜下观察结果如Fig 2所示,正常组膝关节滑膜层很薄,只有1~3层细胞构成;模型组滑膜层明显增厚,滑膜下层有大量滑膜成纤维细胞增生,间质内可见大量炎性细胞浸润;与模型组相比,虽然BAI 60、30 mg·kg-1治疗组的滑膜层变化不明显,但滑膜成纤维细胞的增生及炎性细胞浸润明显减轻;BAI 15 mg·kg-1治疗组滑膜成纤维细胞的增生及炎性细胞浸润有降低趋势。
|
| Fig 2 Effect of BAI on knee joint synovium of RA (HE, ×200) A: Normal group; B: Model group; C: Positive control group (10 mg·kg-1); D: BAI 60 mg·kg-1 group; E: BAI 30 mg·kg-1 group; F: BAI 15 mg·kg-1 group |
本实验参考文献[9],计算mRNA表达量。由Tab 2可见,与正常对照组相比,模型组滑膜组织TLR2、MyD88 mRNA表达量明显升高(P<0.01);与模型组比较,阳性对照组、BAI 60、30 mg·kg-1治疗组TLR2、MyD88 mRNA表达量明显降低(P<0.01),BAI 15 mg·kg-1治疗组的TLR2、MyD88 mRNA表达量降低(P<0.05)。
| Group | Dose/ mg·kg-1 |
2-ΔΔCt | |
| TLR2 | MyD88 | ||
| Normal | - | 1.09±0.12 | 1.06±0.11 |
| Model | - | 3.79±0.49## | 4.24±0.58## |
| Positive control | 10 | 1.72±0.21** | 1.82±0.28** |
| BAI | 60 | 1.60±0.25** | 1.74±0.22** |
| 30 | 1.89±0.28 ** | 2.17±0.31** | |
| 15 | 2.43±0.37* | 2.86±0.34* | |
| ##P < q0.01 vs normal; *P < 0.05, **P < 0.01 vs model | |||
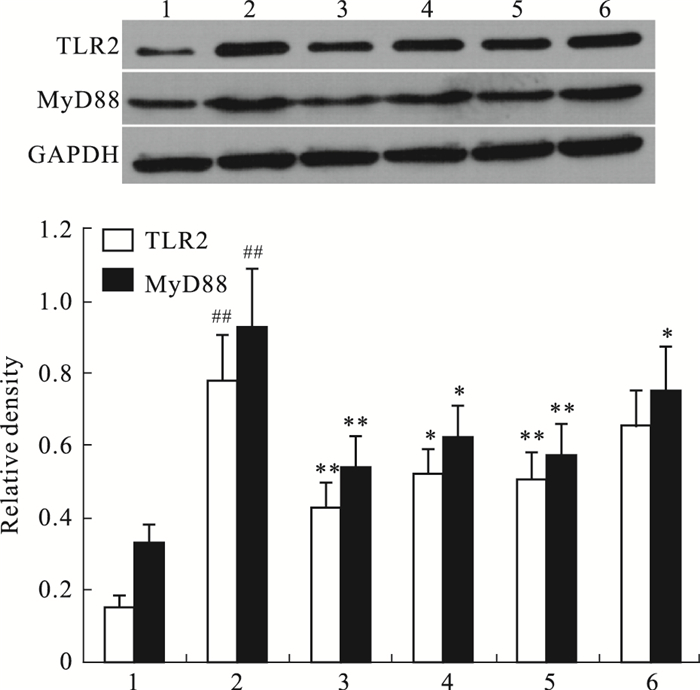
与正常对照组相比,模型组滑膜组织TLR2及MyD88蛋白表达量明显升高(P<0.01);与模型组比较,阳性对照组、BAI 30 mg·kg-1治疗组TLR2及MyD88蛋白表达量明显降低(P<0.01),BAI 60 mg·kg-1治疗组TLR2及MyD88蛋白表达量明显降低(P<0.05),BAI 15 mg·kg-1治疗组的TLR2蛋白表达量有降低趋势、MyD88蛋白表达量明显降低(P<0.05),见Fig 3。
|
| Fig 3 Effect of BAI on expressions of TLR2 and MyD88 protein in knee joint synovium (x±s, n=6) 1: Normal group; 2: Model group; 3: Positive control group (10 mg·kg-1); 4: BAI 60 mg·kg-1 group; 5: BAI 30 mg·kg-1 group; 6: BAI 15 mg·kg-1 group. ##P < 0.01 vs normal group; *P < 0.05, **P < 0.01 vs model group. |
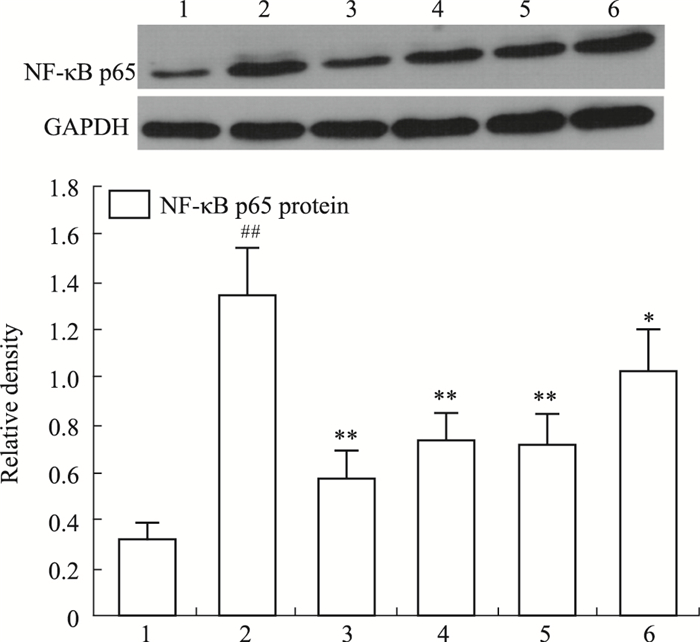
如Fig 4所示,与正常对照组相比,模型组滑膜组织NF-κB p65蛋白表达量明显升高(P<0.01);与模型组比较,BAI 60、30 mg·kg-1治疗组NF-κB p65蛋白表达明显降低(P<0.01),BAI 15 mg·kg-1治疗组NF-κB p65蛋白表达降低(P<0.05)。
|
| Fig 4 Effect of BAI on expression of NF-κB p65 protein in knee joint synovium (x±s, n=6) 1: Normal group; 2: Model group; 3: Positive control group (10 mg·kg-1); 4: BAI 60 mg·kg-1 group; 5: BAI 30 mg·kg-1 group; 6: BAI 15 mg·kg-1 group. ##P < 0.01 vs normal group; *P < 0.05, **P < 0.01 vs model group. |
RA病因及发病机制仍未明晰,其主要病理特点为病变关节滑膜的增殖以及分泌高水平促炎细胞因子。类风湿关节炎滑膜成纤维细胞(rheumatoid arthritis synovial fibroblasts, RASFs)是介导RA关节破坏的主要效应细胞,RASFs异常活化、增殖和分泌炎性介质在RA滑膜炎症损伤中发挥重要作用[10]。RASFs表达Toll样受体(TLRs),有研究认为,TLRs相关的信号通路对RA的发病有重要作用[11]。TLRs识别各自配体后,通过细胞内信号转导介导各种免疫反应,其中髓样分化蛋白分子MyD88起着重要作用,此途径被称为MyD88依赖型信号转导通路。MyD88是重要衔接蛋白,可招募白介素-1受体相关激酶(interleukin-1 receptor-associated kinase,IRAK),后者活化后与肿瘤坏死因子受体相关因子-6(tumor necrosis factor receptor associated factors-6,TRAF6) 相互作用,进而诱导两种不同的信号转导通路。一种是通过激活丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPK),诱导转录激活因子AP-1活化;另一种途径是通过激活NF-κB,使转录因子NF-κB从I-κB/NF-κB的复合物中释放出来,迁移到细胞核内,最终导致相关基因的转录[12]。研究证实,TLR2通过激活NF-κB通路,引发RA患者的关节炎症[13]。
Ⅱ型胶原诱导性关节炎(collagen induced arthritis,CIA)是目前最为常用的关节炎模型[8],该模型具有与人类RA相似的免疫学与病理学特征[14]。本研究首先在确保RA模型制备成功的基础上,进行后续实验。HE染色切片光镜下观察发现,模型组滑膜层明显增厚,滑膜下层有大量滑膜成纤维细胞增生,间质内可见大量炎性细胞浸润;与模型组相比,虽然黄芩苷60、30 mg·kg-1治疗组的滑膜层变化不明显,但滑膜成纤维细胞的增生及炎性细胞浸润水肿明显减轻,可见黄芩苷的确具有良好的消除炎症作用,这一方面跟前期研究结果相吻合[3]。实时荧光定量PCR实验结果表明,与模型组比较,黄芩苷60、30 mg·kg-1治疗组TLR2及MyD88基因表达量明显降低;Western blot实验结果显示,与模型组比较,黄芩苷60、30 mg·kg-1治疗组TLR2、MyD88、NF-κB p65蛋白表达量明显降低,表明黄芩苷良好的消除炎症作用很可能是通过抑制TLR2-NF-κB通路的活化来实现的。
总之,本研究结果提示黄芩苷对SD大鼠RA有良好的消除炎症作用,其作用机制可能是通过抑制TLR2介导的NF-κB通路活化实现的。黄芩苷抑制TLR2介导的NF-κB通路的活化究竟是直接作用还是间接作用,还需要进一步深入探讨。本研究为临床治疗RA提供了理论依据与线索。
( 致谢: 本实验是在宁夏医科大学基础医学院实验室完成,感谢老师和同学的指导与帮助!)
| [1] | Gabriel S E, Michaud K. Epidemiological studies inincidence, prevalence, mortality, and comorbidity of the rheumatic diseases[J]. Arthritis Res Ther, 2009, 11: 229. doi:10.1186/ar2669 |
| [2] | Xiang Y J, Dai S M. Prevalence of rheumatic diseases and disability in China[J]. Rheumatol Int, 2009, 29(5): 481-90. doi:10.1007/s00296-008-0809-z |
| [3] | Wan Q F, Wang H, Han X B, et al. Baicalin inhibits TLR7/MYD88 signaling pathway activation to suppress lung inflammation in mice infected with influenza A virus[J]. Biomed Rep, 2014, 2: 437-41. doi:10.3892/br.2014.253 |
| [4] | Liu J, Wei Y, Luo Q, et al. Baicalin attenuates inflammation in mice with OVA-induced asthma by inhibiting NF-κB and suppressing CCR7/CCL19/CCL21[J]. Int J Mol Med, 2016, 38(5): 1541-8. doi:10.3892/ijmm.2016.2743 |
| [5] | Wang H, ZhangY, Bai R. Baicalin attenuates alcoholic liver injury through modulation of hepatic oxidative stress, inflammation and Sonic Hedgehog pathway in rats[J]. Cell Physiol Biochem, 2016, 39(3): 1129-40. doi:10.1159/000447820 |
| [6] | Zhang Z, Gao X, Guo M, et al. The protective effect of baicalin against lead-induced renal oxidative damage in mice[J]. Biol Trace Elem Res, 2017, 175(1): 129-35. doi:10.1007/s12011-016-0731-2 |
| [7] | 万巧凤, 顾立刚, 殷胜骏, 等. 黄芩苷对FM1肺炎小鼠肺损伤的作用机制研究[J]. 中国药理学通报, 2012, 28(2): 208-12. Wan Q F, Gu L G, Yin S J, et al. Attenuation and mechanism of baicalin on lung tissue injury of mice with FM1 induced pneumonia[J]. Chin Pharmacol Bull, 2012, 28(2): 208-12. |
| [8] | 宋珊珊, 张玲玲, 魏伟. 实验性关节炎动物模型建立及病理机制研究进展[J]. 中国药理学通报, 2011, 27(12): 1648-53. Song S S, Zhang L L, Wei W. Establishment of animal model of experimental arthritis and research progress of pathological mechanism[J]. Chin Pharmacol Bull, 2011, 27(12): 1648-53. doi:10.3969/j.issn.1001-1978.2011.12.006 |
| [9] | Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C (T)) method[J]. Methods, 2001, 25(4): 402-8. doi:10.1006/meth.2001.1262 |
| [10] | Buckland J. Rheumatoid arthritis: Autophagy: a dual role in the life and death of RASFs[J]. Nat Rev Rheumatol, 2013, 19: 637. |
| [11] | Seibl R, Birchler T, Loeliger S. Expression and regulation of Toll-like receptor 2 in rheumatoid arthritis synovium[J]. Am J Pathol, 2003, 162(4): 1221-7. doi:10.1016/S0002-9440(10)63918-1 |
| [12] | Akira S, Takeda K. Toll-like receptor signaling[J]. Nat Rev Immunol, 2004, 4(7): 499-511. doi:10.1038/nri1391 |
| [13] | Jung Y O, Cho M L, Kang C M. Toll-like receptor 2 and 4 combination engagement upregulate IL-15 synergistically in human rheumatoid synovial fibroblasts[J]. Immunol Lett, 2007, 109(1): 21-7. doi:10.1016/j.imlet.2006.12.006 |
| [14] | 栗占国, 张奉春, 鲍春德. 类风湿关节炎[M]. 北京: 人民教育出版社, 2008: 58-65. Li Z G, Zhang F C, Bao C D. Rheumatoid Arthritis[M]. Beijing: People Education Press, 2008: 58-65. |

